分子的立体构型
- 格式:doc
- 大小:273.50 KB
- 文档页数:9



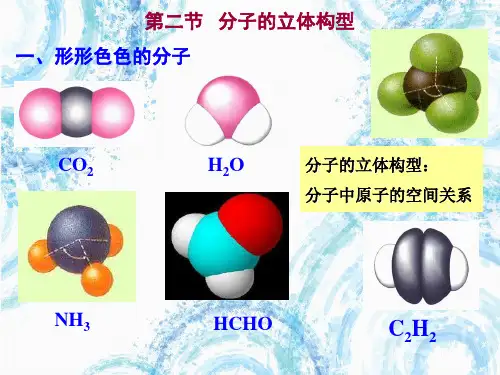

[知识要点]一、常见多原子分子的立体结构:(原子数目相同的分子的立体结构不一定相同)43 22原子数目化学式分子结构 键角中心原子 3CO直线形180° 无孤对电子 HO V 形105° 有孤对电子 4CHO 平面三角形 120° 无孤对电子 NH三角锥形 107° 有孤对电子 5CH正四面体形109° 28'无孤对电子【小结】同为三原子分子或四原子分子,分子的空间构型不同。
所以多原子分子的立体结构不但 与所连原子数目有关,还与其他因素(比如中心原子是否有孤对电子及孤对电子的数目)有关 二、价层电子对互斥模型:(用中心原子是否有孤对电子及孤对电子的数目,预测分子的立体结构)价层电子对互斥模型认为分子的立体结构是由于分子中的价电子对(成键电子对和孤对电子对)相互排斥的结果。
中心原子价层电子对(包括成键电子对和未成键的孤对电子对)的互相排斥作用, 使分子的几何构型总是采取电子对相互排斥最小的那种构型,即分子尽可能采取对称的空间构型这种模型把分子分为两类:1、中心原子上的价电子都用于形成共价键(中心原子无孤对电子)中心原子无孤对电子,分子中存在 成键电子对与成键电子对 间的相互排斥,且作用力相同,分子 的空间构型以中心原子为中心呈对称分布。
如 CO 、CH 2O CH 、HCN 等分子。
它们的立体结构可用中心原子周围的原子数来预测:ABn 立体结构 范例n=2 直线形 CO n=3 平面三角形 CHO n=4正四面体形CH 42、中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
中心原子上有孤对电子,分子中存在成键电子对与成键电子对 间的相互排斥、成键电子对与孤对 电子对间的相互排斥、孤对电子对与孤对电子对 间的相互排斥。
孤对电子要占据中心原子周围的空间, 并参与互相排斥,使分子呈现不同的立体构型如H0和NH ,中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥,中心原 子周围的S 键+孤对电子数=4,所以NH 与H0的VSEPF 理想模型都是四面体形。
[知识要点]一、常见多原子分子的立体结构:(原子数目相同的分子的立体结构不一定相同)CH4 NH3 CH2O CO HbO原子数目化学式分子结构键角中心原子3CO直线形180°无孤对电子fO V形105°有孤对电子4CHO平面三角形120°无孤对电子NH三角锥形107°有孤对电子5CH正四面体形109° 28' 无孤对电子【小结】同为三原子分子或四原子分子,分子的空间构型不同。
所以多原子分子的立体结构不但与所连原子数目有关,还与其他因素(比如中心原子是否有孤对电子及孤对电子的数目)有关二、价层电子对互斥模型:(用中心原子是否有孤对电子及孤对电子的数目,预测分子的立体结构)价层电子对互斥模型认为分子的立体结构是由于分子中的价电子对(成键电子对和孤对电子对)相互排斥的结果。
中心原子价层电子对(包括成键电子对和未成键的孤对电子对)的互相排斥作用,使分子的几何构型总是采取电子对相互排斥最小的那种构型,即分子尽可能采取对称的空间构型这种模型把分子分为两类:1、中心原子上的价电子都用于形成共价键(中心原子无孤对电子)中心原子无孤对电子,分子中存在成键电子对与成键电子对间的相互排斥,且作用力相同,分子的空间构型以中心原子为中心呈对称分布。
如CO、CHO CH、HCN等分子。
它们的立体结构可用中心原子周围的原子数来预测:ABn立体结构范例n=2直线形COn=3平面三角形CHOn=4正四面体形CH42、中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
中心原子上有孤对电子,分子中存在成键电子对与成键电子对间的相互排斥、成键电子对与孤对电子对间的相互排斥、孤对电子对与孤对电子对间的相互排斥。
孤对电子要占据中心原子周围的空间,并参与互相排斥,使分子呈现不同的立体构型如H2O和NH,中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥,中心原子周围的S键+孤对电子数=4,所以NH与H2O的VSEPF理想模型都是四面体形。



化学分子的立体构型与光学异构体化学分子的立体构型是描述分子中原子在空间中的排列方式,涉及到原子之间的化学键角度、距离以及原子与原子的空间环境等因素。
而光学异构体则是指具有相同分子式,但是其立体构型不对称,无法通过旋转或移动来使其重合的分子。
本文将对化学分子的立体构型和光学异构体进行详细探讨。
一、立体构型的概念及意义立体构型指的是分子中原子或原子团的相对排列方式,即空间中的几何结构。
化学分子的立体构型对分子的性质、反应行为以及生物活性等产生了重要影响。
分子的立体构型可以通过分子模型、X射线衍射等手段来确定。
1. 框架构型框架构型是指分子中原子骨架的大致排列方式,不包括具体原子的排列。
框架构型对于分子的性质和反应活性具有重要影响。
2. 手性构型手性构型是一种特殊的立体构型,其特点是具有镜面对称性,无法通过旋转或移动使其与其镜像重合。
手性分子在自然界中广泛存在,对于药物的生物活性以及生物体内的相互作用具有重要的影响。
二、立体构型的描述方法为了描述分子的立体构型,人们发展了不同的表示方法。
1. 空间投影式空间投影式是最直观和常用的描述分子立体构型的方法。
根据不同的原子或原子团在平面上的投影情况,可以将空间投影式进一步分为骨架投影式、棒球棍投影式等。
2. 空间模型空间模型是通过分子模型或者计算机生成的分子图形来表示分子的立体构型。
常见的空间模型有简化球棒模型、线绳模型等。
三、光学异构体的概念及分类光学异构体是指具有相同的分子式,但是其立体构型不对称,无法通过旋转或移动来使其与其镜像重合的分子。
光学异构体可以分为两类:手性异构体和偶极异构体。
1. 手性异构体手性异构体是具有手性构型的分子。
手性分子分为左旋体和右旋体两种,分别表示为左旋异构体和右旋异构体。
手性异构体在化学反应中展现出不同的反应活性和选择性。
2. 偶极异构体偶极异构体是由于分子中极性基团的不同排列而产生的异构体。
偶极异构体在电场中会表现出不同的电性。
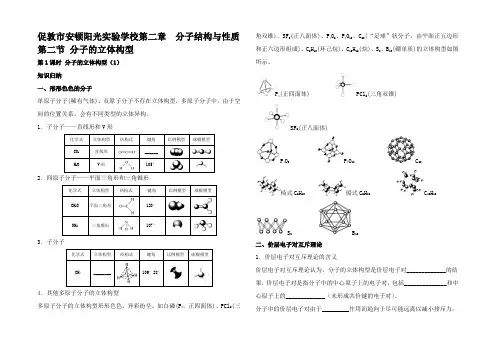
促敦市安顿阳光实验学校第二章分子结构与性质第二节分子的立体构型第1课时分子的立体构型(1)知识归纳一、形形色色的分子单原子分子(稀有气体)、双原子分子不存在立体构型,多原子分子中,由于空间的位置关系,会有不同类型的立体异构。
1.子分子——直线形和V形化学式立体构型结构式键角比例模型球棍模型CO2直线形______H 2O V形105°2.四原子分子——平面三角形和三角锥形化学式立体构型结构式键角比例模型球棍模型CH2O 平面三角形120°NH3三角锥形107°3.子分子化学式立体构型结构式键角比例模型球棍模型CH4________ 109°28'4.其他多原子分子的立体构型多原子分子的立体构型形形色色,异彩纷呈。
如白磷(P4,正四面体)、PCl5(三角双锥)、SF6(正八面体)、P4O6、P4O10、C60(“足球”状分子,由平面正五边形和正六边形组成)、C6H12(环己烷)、C10H16(烷)、S8、B12(硼单质)的立体构型如图所示。
P4(正四面体) PCl5(三角双锥)SF6(正八面体)P4O6P4O10 C60椅式C6H12船式C6H12C10H16S8B12二、价层电子对互斥理论1.价层电子对互斥理论的含义价层电子对互斥理论认为,分子的立体构型是价层电子对_____________的结果,价层电子对是指分子中的中心原子上的电子对,包括______________和中心原子上的_____________(未形成共价键的电子对)。
分子中的价层电子对由于_________作用而趋向于尽可能远离以减小排斥力,分子尽可能采取对称的立体构型。
电子对之间的夹角越大,排斥力_______。
2.价层电子对互斥模型电子对数成键电子对数孤电子对数价层电子对立体构型分子的立体构型典例2 2 0 直线形直线形BeCl23 3 0三角形三角形BF3 2 1 V形SnBr24 4 0四面体___________ CH4 3 1 三角锥形NH3 2 2 V形H2O3.价层电子对互斥模型说明的是价层电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。
第二节 分子的立体构型第1课时一、形形色色的分子大多数分子是由两个以上原子构成的,于是就有了分子中的原子的空间关系问题,这就是所谓“分子的立体结构”。
例如,三原子分子的立体结构有直线形和V 形两种。
如C02分子呈直线形,而H 20分子呈V 形,两个H —O 键的键角为105°。
三原子分子立体结构:有直线形C02 、CS 2等,V 形如H 2O 、S02等。
大多数四原子分子采取平面三角形和三角锥形两种立体结构。
例如,甲醛(CH 20)分子呈平面三角形,键角约120°;氨分子呈三角锥形,键角107°。
四原子分子立体结构:平面三角形:如甲醛(CH 20)分子等,三角锥形:如氨分子等。
五原子分子的可能立体结构更多,最常见的是正四面体形,如甲烷分子的立体结构是正四面体形,键角为109°28。
五原子分子立体结构:正四面体形如甲烷、P 4等。
[讲] 此形形色色的分子世界分子的空间结构我们看不见,那么科学家是怎样测定的呢?科学视野—分子的立体结构是怎样测定的?肉眼不能看到分子,那么,科学家是怎样知道分子的形状的呢?早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。
所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。
当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。
通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息,可分析出分子的立体结构。
分子中原子不是固定不动的,而是不断地振动着的。
所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。
当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。
通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,结合这些信息,可分析出分子的立体结构。
化学选修三第二章第二节分子的立体构型2选修三第二章第2节 分子的立体构型 第2节 分子的立体构型一、常见分子的空间构型1.双原子分子都是直线形,如:HCl 、NO 、O 2、N 2 等。
2.三原子分子有直线形,如CO 2、CS 2等;还有“V ”形,如H 2O 、H 2S 、SO 2等。
3.四原子分子有平面三角形,如BF 3、BCl 3、CH 2O 等; 有三角锥形,如NH 3、PH 3等; 也有正四面体,如P 4。
4.五原子分子有正四面体,如CH 4、CCl 4等,也有不规则四面体,如CH 3Cl 、CH 2Cl 2、CHCl 3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥理论(Valance Shell Electron Pair Repulsion Theory )简称VSEPR 适用AD m 型分子1、理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2、用价层电子对互斥理论推断分子或离子的空间构型的一般步骤: (1)确定中心原子A 价层电子对数目 法1.经验总结中心原子的价层电子对数=21(中心离子价电子数+配对原子提供电子总数)对于AB m 型分子(A 为中心原子,B 为配位原子),计算方法如下: n =中心原子的价电子数+每个配位原子提供的价电子数×m 2注意:①氧族元素的氧做中心时:价电子数为 6, 如 H 2O ,H 2S ;做配体时:提供电子数为 0,如在 CO 2中。
②如果讨论的是离子,则应加上或减去与离子电荷相应的电子数。
如PO -34中P 原子价层电子数5+(0×4)+3 = 8;NH +4 中N 原子的价层电子数5+(1×4)-1 = 8。
③结果为单电子时视作有一个电子对。
例:IF 5 价层电子对数为21[7+(5×1)] = 6对 正八面体(初步判断)N H +4 价层电子对数为21[5+(4×1)-1] = 4对 正四面体 PO -34 价层电子对数为21[5+(0×4)+3] = 4对 正四面体 NO 2 价层电子对数为21[5+0] = 2.5−→−3对 平面三角形 法2. 确定中心原子A 价层电子对数目-----普遍规则中心原子A 价层电子对数目=成键电子对数+孤对电子数 (VP = BP + LP )VP是价层电子对,BP是成键电子对(BOND ),LP是孤对电子对(LONE PAIR)VP = BP + LP =与中心原子成键的原子数+中心原子的孤对电子对数LP=配位原子数+LPLp =21(中心原子价电子数—配位原子未成对电子数之和)IF5Lp =21[7-(5×1)] = 1 构型由八面体−→−四方锥NH+4Lp =21[(5-1)-(4×1)] = 0 正四面体PO-34Lp =21[(5+3)-(4×2)] = 0 正四面体SO-24Lp =21[(6+2)-(4×2)] = 0 正四面体NO2Lp =21[5-(2×2)] =21−→− 1 构型由三角形−→−V形SO-23Lp =21[(6+2)-(3×2)] = 1 构型由四面体−→−三角锥法3:由Lewis结构式或结构式直接写出,双键、三键都是1对电子PClClClClCl PCl Cl ClPClClClCl+ClPClClClClCl-ClClClCl+ClPClClClClCl-VP: 5 4 4 6 4(2)价层电子对数目23456价层电子对构型直线形三角形四面体三角双锥八面体(3)价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。
[知识要点]一、常见多原子分子的立体结构:(原子数目相同的分子的立体结构不一定相同)CH4 NH3 CH2O CO2 H2O【小结】同为三原子分子或四原子分子,分子的空间构型不同。
所以多原子分子的立体结构不但与所连原子数目有关,还与其他因素(比如中心原子是否有孤对电子及孤对电子的数目)有关二、价层电子对互斥模型:(用中心原子是否有孤对电子及孤对电子的数目,预测分子的立体结构)价层电子对互斥模型认为分子的立体结构是由于分子中的价电子对(成键电子对和孤对电子对)相互排斥的结果。
中心原子价层电子对(包括成键电子对和未成键的孤对电子对)的互相排斥作用,使分子的几何构型总是采取电子对相互排斥最小的那种构型,即分子尽可能采取对称的空间构型这种模型把分子分为两类:1、中心原子上的价电子都用于形成共价键(中心原子无孤对电子)中心原子无孤对电子,分子中存在成键电子对与成键电子对间的相互排斥,且作用力相同,分子的空间构型以中心原子为中心呈对称分布。
如CO2、CH2O、CH4、HCN等分子。
它们的立体结构可用中心原子周围的原子数来预测:2、中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
中心原子上有孤对电子,分子中存在成键电子对与成键电子对间的相互排斥、成键电子对与孤对电子对间的相互排斥、孤对电子对与孤对电子对间的相互排斥。
孤对电子要占据中心原子周围的空间,并参与互相排斥,使分子呈现不同的立体构型如H2O和NH3,中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥,中心原子周围的δ键+孤对电子数=4,所以NH3与H2O的VSEPR理想模型都是四面体形。
因而H2O分子呈V 型,NH3分子呈三角锥形。
【小结】电子对的空间构型(VSEPR理想模型)与分子的空间构型存在差异的原因是由于孤对电子没有参与成键,且孤对电子对比成键电子对更靠近原子核,它对相邻成键电子对的排斥作用较大,要使电子对相互排斥最小,那么H2O 、NH3、CH4分子相应的键角必然逐渐变大。
三、杂化轨道理论:(能量相近的原子轨道重新组合)1、杂化的概念:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化,产生的新轨道叫杂化轨道。
特点:杂化前后轨道数目不变。
杂化后轨道伸展方向,形状发生改变。
2、甲烷分子的杂化轨道的形成:(sp3杂化)①甲烷分子的立体构型:空间正四面体,分子中的C—H键是等同的,键角是109°28′②中心原子价电子构型C:2s22p2碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它跟4个氢原子的1s原子轨道重叠,不可能得到四面体构型的甲烷分子。
③鲍林提出杂化轨道理论:形成甲烷分子时,中心原子碳的2s和2p x、2p y、2p z四条原子轨道发生混杂,形成一组新的轨道,即四个相同的sp3杂化轨道,夹角109°28′。
这些sp3杂化轨道不同于s轨道,也不同于p轨道。
当碳原子跟4个氢原子结合时,碳原子以4个sp3杂化轨道分别与4个氢原子的1s轨道重叠,形成4个C—Hδ键,因此呈正四面体的分子构型。
3、其他形式的杂化:根据参与杂化的s轨道与p轨道的数目,除了有sp3杂化轨道外,还有sp2杂化和sp杂化,sp2杂化轨道表示由一个s轨道与两个p轨道杂化形成的,sp杂化轨道表示由一个s轨道与一个p轨道杂化形成的①碳原子的 sp2杂化(以乙烯为例)乙烯的中心原子C在轨道杂化时,有1个p轨道未参与杂化,只是C的2s轨道与2个2p轨道发生杂化,形成3个相同的sp2杂化轨道,sp2杂化轨道分别指向平面三角形的三个顶点,杂化轨道间夹角为120°。
杂化轨道与2个H原子和另外一个C原子形成2个C—Hδ键和1个C—Cδ键,未杂化p轨道垂直于sp2杂化轨道所在平面,与另外的C原子形成C—C p键。
②碳原子的 sp杂化(以乙炔为例)乙炔的中心原子C在轨道杂化时,有2个p轨道未参与杂化,只是C的2s与1个2p轨道发生杂化,形成2个相同的sp杂化轨道,杂化轨道间夹角为180°。
杂化轨道与1个H原子和另外一个C 原子形成1个C—Hδ键和1个C—Cδ键,未杂化2个p轨道垂直于sp杂化轨道所在平面,与另外的C原子形成2个C—C p键。
【小结】杂化轨道在角度分布上比单纯的s或p轨道在某一方向上更集中,从而使它与其它原子的原子轨道重叠的程度更大,形成的共价键更牢固。
四、配合物理论简介1、配位键①概念:由一个原子单方向提供共用电子对给另一原子共用所形成的共价键。
前三种溶液呈天蓝色原因就是Cu在水溶液中与水分子通过配位键结合成四水合铜离子。
其中Cu2+为接受电子对的一方,H2O为提供电子对的一方。
②表示方法A B电子对给予体电子对接受体③形成条件:其中一个原子必须提供孤对电子。
另一原子必须有接受孤对电子的轨道。
④常见的含有配位键的分子或离子的形成过程:H3O+NH4+注意:在NH4+中,虽然有一个N-H键形成过程与其它3个N-H键形成过程不同,但是一旦形成之后,4个共价键就完全相同。
2、配位化合物①概念:金属离子或原子与某些分子或离子以配位键结合而形成的化合物称为配位化合物,简称配合物。
②配合物的组成③常见配合物的生成A 向硫酸铜溶液里逐滴加入氨水,先形成难溶的氢氧化铜沉淀,继续滴加难溶物溶解,得到深蓝色的透明溶液实验中发生的两个反应的离子方程式蓝色沉淀深蓝色溶液氢氧化铜与足量氨水反应后溶解是因为生成[Cu(NH3)4]2+B向盛有氯化铁溶液的试管中滴加1滴硫氰化钾溶液血红色【小结】形成配位化合物时某些性质发生改变,比如颜色、溶解度等。
配位键的强度有大有小,因而有的配位化合物很稳定,有的很不稳定。
[方法指导]一、价层电子对互斥模型小结1、同为三原子分子或四原子分子,其分子空间构型不同,是由于分子中的成键电子对及中心原子上的孤对电子对相互排斥,结果趋向尽可能彼此远离,以减小斥力。
排斥力:孤对电子对与孤对电子对>孤对电子对与成键电子对>成键电子对与成键电子对例如:H2O和NH3中心原子上分别有2对和1对孤对电子,跟中心原子周围的δ键加起来都是4,它们相互排斥形成四面体。
由于分子的中心原子上未成键的孤对电子对对成键电子对之间的排斥力较强,所以使H2O分子中2个O—H键和NH3分子中3个N—H键的空间分布发生一点变化,它们的键角从109°28′分别被压缩到105°和107°。
2、应用VSEPR理论判断分子或离子的构型对于一个AB n型的共价型分子,中心原子A周围电子对排布的几何形状,主要取决于中心原子A 的价电子层中的电子对数(成键电子对数+孤对电子数),这些电子对的位置倾向于分离得尽可能远,使它们之间的斥力最小。
根据中心原子的孤对电子对的数目及中心原子结合的原子的数目确定。
若中心原子周围的原子数与孤对电子对数之和分别为2、3、4,则VSEPR理想模型(注:与分子的立体结构不同)分别是直线形、平面形、四面体形,由于孤对电子对成键电子的斥力影响较大,所以含有孤对电子对的分子中键角比理想模型的键角要小一些。
例如:NH3与H2O的VSEPR理想模型都是四面体形(109°28′),但分子的立体结构分别是三角锥形(107°)、V形(105°)二、杂化轨道与分子的立体结构1、判断杂化轨道的数目和杂化方式中心原子的孤对电子对数与相连的其他原子数之和,就是杂化轨道数。
例如:NH3中心原子N上有一对孤对电子,所以杂化轨道数为1+3=4,即N原子采用sp3杂化;BeCl2中心原子Be上没有孤对电子,所以杂化轨道数为0+2=2,即Be原子采用sp杂化;H2O中心原子O上有2对孤对电子,所以杂化轨道数为2+2=4,即O原子采用sp3杂化2、分子的立体结构三种杂化轨道的轨道形状,sp杂化夹角为180°的直线型杂化轨道,例如BeCl2、C2H2;sp2杂化轨道为120°的平面三角形,例如BF3、C2H4;sp3杂化轨道为109°28′的正四面体构型,例如CH4、CCl4三、微粒的空间构型小结1、直线形:Cl—Be—Cl、O=C=O、CS2、C2H2等,中心原子的电子云以sp杂化成键。
2、V形:H2O、H2S、NH2-是中学比较常见的,中心原子周围有四对电子,电子对的构型必然是四面体形,这样微粒的空间构型就是V形了;SO2、O3这些是中学中不常见的,中心原子均是以sp2杂化的形式成键的。
3、三角锥形:NH3、NF3、H3O+、PCl3等,中心原子都有1对孤对电子,以sp3杂化成键,电子对的构型为四面体形,微粒构型为三角锥形。
4、平面三角形:BF3,CH3+,中心原子以sp2杂化形式成键,中心原子周围的电子对数目为3,所以电子对的空间构型是平面三角形,这样微粒的空间构型就是平面三角形,键角为120°5、四面体形:①、正四面体形:P4(是空心正四面体,有六条化学键,键角为60°)、CH4、CCl4、NH4+、(是顶点原子与中心原子成有中心的正四面体,中心原子一定以sp3杂化成键,键角一定是109°28′)②、四面体:与正四面体CH4相似,只是顶点的原子有不同,但是属于一类,如:CH3Cl、CH2Cl2、CHCl3等。
键角与109°28′相近)四、配位化合物小结[Cu(NH3)4]SO4 硫酸化四氨合铜Cu——中心原子 NH3——配位体 N——配位原子 4——配位数1、中心离子或原子(也称形成体):有空轨道主要是一些过渡金属,如铁、钴、镍、铜、银、金、铂等金属元素的离子;或是具有高氧化数的非金属元素,硼,硅、磷等,如Na[BF4] 中的B、K2[SiF6]中的Si和NH4[PF6]中的P;或是不带电荷的中性原子,如[Ni(CO)4], [Fe(CO)5]中的Ni, Fe都是中性原子2、配位体和配位原子:有孤对电子常见的配位体:含氮配位体NH3;含硫配位体SCN-;含卤素配位体 F-、Cl-、Br-、I-;含碳配位体CN-、CO;含氧配位体H2O、OH-等3、配位数:与中心离子直接以配位键结合的配位原子个数例:[AlF6]3-配位数6 、 [Cu(NH3)4]SO4配位数4中心离子的电荷高,对配位体的吸引力较强,有利于形成配位数较高的配合物。
中心离子半径越大,其周围可容纳配体就越多,配位数越大。
4、配合物的命名:关键在于配合物内界(即配离子)的命名。
命名顺序:自右向左:配位体数(即配位体右下角的数字)——配位体名称——“合”字——中心离子的名称——中心离子的化合价。
ⅰ:配位阴离子配合物--配位阴离子“酸”外界K2[SiF6] 六氟合硅酸钾K[PtCl5(NH3)] 五氯·一氨合铂酸钾Na3[AlF6] 六氟合铝酸三钠ⅱ:配位阳离子配合物——“某化某”或“某酸某”[Co(NH3)6]Br3 三溴化六氨合钴[Cu(NH3)4]Cl2 二氯化四氨合铜ⅲ:中性配合物[PtCl2(NH3)2] 二氯·二氨合铂[Ni(CO)4] 四羰基合镍[经典例题]例题1、用价层电子对互斥模型推测下列分子或离子的空间构型。