分子立体结构
- 格式:ppt
- 大小:1.49 MB
- 文档页数:59






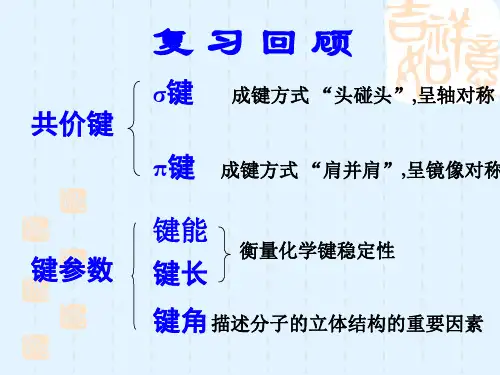

第二节分子的立体结构(学案)【学习目标】1、熟悉共价分子的多样性和复杂性;2、初步熟悉价层电子对互斥模型;3、能用VSEPR模型预测简单分子或离子的立体结构;理解价层电子对互斥模型和分子空间构型间的关系。
4、熟悉杂化轨道理论的要点5、进一步了解有机化合物中碳的成键特征6、能按照杂化轨道理论判断简单分子或离子的构型7、进一步增强分析、归纳、综合的能力和空间想象能力【重点知识】:分子的立体结构;利用价层电子对互斥模型、杂化轨道理论模型预测分子的立体结构。
【回顾思考】1 举例说明什么叫化学式?2 举例说明什么叫结构式?3 举例说明什么是结构简式?4 举例说明什么是电子式?5 举例说明什么价电子?(第一课时)一、形形色色的分子【阅读讲义】认真阅读讲义35到37页“二、价层电子对互斥理论”处。
在阅读进程中勾出你以为重要的句子、词语、规律等,如发现新问题请写在讲义中相应地方。
认真读图2-8、2-9、2-10、2-11、2-12和36页的知识卡片等去熟悉分子的多样性,自己动手制作几种分子的模型体验分子的空间构型。
然后思考下列问题。
【阅读思考1】完成下表1、原子数相同的分子,它们的空间结构相同吗?2、请你利用身旁的易患材料参照讲义35、36页内容制作CO2、H2O、NH3、CH2O、CH4分子的球辊模型(或比例模型);并用书面用语描述它们的分子构型。
3、你如何理解分子的空间结构?4、写出CO2、H2O、NH3、CH2O、CH4的电子式;5、观察上述分子的电子式,分析H、C、N、O原子别离可以形成几个共价键,你知道原因吗?6、如何计算分子中中心原子的价层电子对?(成σ键电子对、未成键电子对)二、价层电子对互斥理论【阅读讲义】认真阅读讲义37到39页“三、杂化轨道理论简介”处。
在阅读进程中勾出你以为重要的句子、词语、规律等,如发现新问题请写在讲义中相应地方。
认真读图2-15、表2-4、2-5,对比价层电子对互斥模型和分子构型。
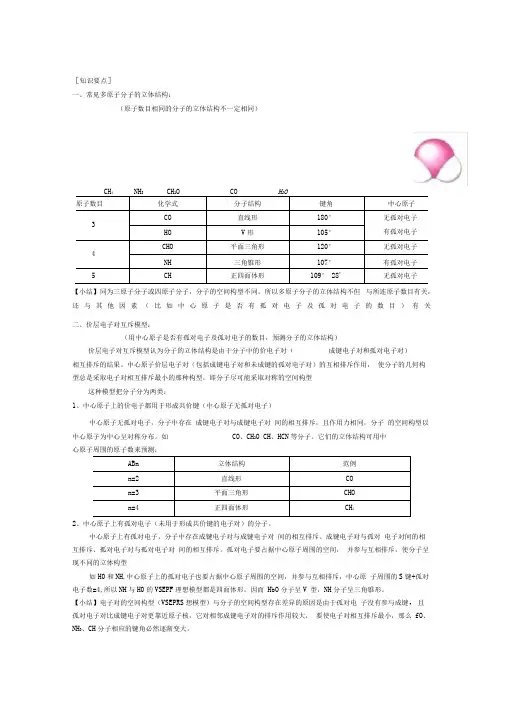
[知识要点]一、常见多原子分子的立体结构:(原子数目相同的分子的立体结构不一定相同)43 22原子数目化学式分子结构 键角中心原子 3CO直线形180° 无孤对电子 HO V 形105° 有孤对电子 4CHO 平面三角形 120° 无孤对电子 NH三角锥形 107° 有孤对电子 5CH正四面体形109° 28'无孤对电子【小结】同为三原子分子或四原子分子,分子的空间构型不同。
所以多原子分子的立体结构不但 与所连原子数目有关,还与其他因素(比如中心原子是否有孤对电子及孤对电子的数目)有关 二、价层电子对互斥模型:(用中心原子是否有孤对电子及孤对电子的数目,预测分子的立体结构)价层电子对互斥模型认为分子的立体结构是由于分子中的价电子对(成键电子对和孤对电子对)相互排斥的结果。
中心原子价层电子对(包括成键电子对和未成键的孤对电子对)的互相排斥作用, 使分子的几何构型总是采取电子对相互排斥最小的那种构型,即分子尽可能采取对称的空间构型这种模型把分子分为两类:1、中心原子上的价电子都用于形成共价键(中心原子无孤对电子)中心原子无孤对电子,分子中存在 成键电子对与成键电子对 间的相互排斥,且作用力相同,分子 的空间构型以中心原子为中心呈对称分布。
如 CO 、CH 2O CH 、HCN 等分子。
它们的立体结构可用中心原子周围的原子数来预测:ABn 立体结构 范例n=2 直线形 CO n=3 平面三角形 CHO n=4正四面体形CH 42、中心原子上有孤对电子(未用于形成共价键的电子对)的分子。
中心原子上有孤对电子,分子中存在成键电子对与成键电子对 间的相互排斥、成键电子对与孤对 电子对间的相互排斥、孤对电子对与孤对电子对 间的相互排斥。
孤对电子要占据中心原子周围的空间, 并参与互相排斥,使分子呈现不同的立体构型如H0和NH ,中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥,中心原 子周围的S 键+孤对电子数=4,所以NH 与H0的VSEPF 理想模型都是四面体形。
煌敦市安放阳光实验学校分子的立体结构复习目标:1.能用键能、键长、键角及杂化轨道理论说明简单分子的空间结构。
2.认识共价分子结构的多样性和复杂性,能根据有关理论判断简单分子或离子的构型,能说明简单配合物的成键情况。
复习、难点:能用键能、键长、键角及杂化轨道理论说明简单分子的空间结构。
课时划分:两课时教学过程:一、形形色色的分子1、子分子立体结构:有直线形__、__,V形如__、__。
2、四原子分子立体结构:平面三角形:如甲醛(CH20)分子,三角锥形:如__分子。
3、子分子立体结构:正四面体形如__、__。
4、测分子体结构:红外光谱仪→吸收峰→分析。
二、价层电子对互斥模型1、中心原子上的价电子都用于形成共价键:分子中的价电子对相互排斥的结果。
如:2、中心原子上有孤对电子:孤对电子也要占据中心原子周围的空间,并参与互相排斥。
如H2O和NH3中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。
因而H2O分子呈V型,NH3分子呈三角锥型。
如:三、杂化轨道理论1、杂化的概念:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重组合,形成一组的轨道,这个过程叫做轨道的杂化,产生的轨道叫杂化轨道。
(1)sp3杂化:1个s轨道和3个p轨道会发生混杂,得到4个相同的轨道,夹角109°28′,称为sp3杂化轨道。
(2)sp杂化:夹角为180°的直线形杂化轨道,sp2杂化:三个夹角为120°的平面三角形杂化轨道。
[练习]完成下表。
四、配位键1、“电子对给予—接受键”被称为配位键。
一方提供孤对电子;一方有空轨道,接受孤对电子。
如:[Cu(H 20)2+]、NH 4+中存在配位键。
表示:A B电子对给予体 电子对接受体条件:其中一个原子必须提供孤对电子。
另一原子必须能接受孤对电子轨道。
2、通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物。

分子结构与物质性质【德智助学】1.分子的立体结构2.分子的性质3.化学键(离子键、共价键),配位键,金属键4.8电子稳定结构【知识梳理】考试要点一、分子的立体结构1.价层电子对互斥模型(1)当A的价电子全部参与成键时,价层电子对间的相互排斥使得键角最大,据此可以直接推测分子的空间构型。
(2)当A上有孤电子对时,孤电子对要占据一定的空间,并参与电子对间的排斥,使得各电子对间的夹角最大,据此可推测出分子的VSEPR模型,去除孤电子对后即得分子的立体结构。
(3)中心原子的杂化及价层电子对互斥模型。
2.杂化轨道理论杂化轨道理论是鲍林为了解释分子的立体结构提出的。
杂化前后轨道总数不变,杂化轨道用来形成σ键或容纳孤对电子,未杂化的轨道与杂化轨道所在的平面垂直,可用来形成π键。
3.中心原子杂化轨道数、孤电子对数及与之相连的原子数间的关系(1)杂化轨道数=中心原子的孤对电子数+中心原子键合原子数。
(2)杂化轨道的形状:2个sp杂化轨道呈直线形,3个sp2杂化轨道呈平面三角形,4个sp3杂化轨道呈正四面体型。
二、分子的性质1.分子的极性(1)分子极性是分子中化学键极性的向量和。
只含非极性键的分子一定是非极性分子(O3除外),只含极性键的分子不一定是极性分子,极性分子中必然含有极性键(O3除外)。
(2)分子中正、负电荷中心重合的是非极性分子,正、负电荷中心不重合的是极性分子。
在极性分子中,某一个部分呈正电性(δ+),另一部分呈负电性(δ-)。
(3)对于AB n型分子,根据VSEPR模型,若中心原子核外最外层没有孤对电子(即化合价的绝对值等于主族序数),该分子一般是非极性分子,否则是极性分子。
2.分子间作用力对物质性质的影响(1)范德华(Van der Waals)力:范德华力是普遍存在于分子间的作用力,其强度比化学键弱,对物质的熔点、沸点和硬度有影响,范德华力越大,熔、沸点越高,硬度越大。
一般来讲,具有相似空间构型的分子,相对分子质量越大,范德华力越大;分子的极性越大,范德华力越大。
高中化学分子立体结构知识点讲解高中化学对于大多数同学来说都是一门难学的功课。
不仅化学方程式需要记忆,还要记忆各种化学物质的性质及化学反应现象,更别说计算了。
一、常见分子的空间构型1.双原子分子都是直线形,如:HCl、NO、O2、N2等。
2.三原子分子有直线形,如CO2、CS2等;还有“V”形,如H2O、H2S、SO2等。
3.四原子分子有平面三角形,如BF3、BCl3、CH2O等;有三角锥形,如NH3、PH3等;也有正四面体,如P4。
4.五原子分子有正四面体,如CH4、CCl4等,也有不规则四面体,如CH3Cl、CH2Cl2、CHCl3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥模型1.理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2.价电子对之间的斥力(1)电子对之间的夹角越小,排斥力越大。
(2)由于成键电子对受两个原子核的吸引,所以电子云比较紧缩,而孤对电子只受到中心原子的吸引,电子云比较“肥大”,对邻近电子对的斥力较大,所以电子对之间斥力大小如下:孤电子对-孤电子对>孤电子对-成键电子>成键电子-成键电子(3)由于三键、双键比单键包含的电子数多,所以其斥力大小次序为三键>双键>单键。
3.价层电子对互斥模型的两种类型价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。
(1)当中心原子无孤对电子时,两者的构型一致;(2)当中心原子有孤对电子时,两者的构型不一致。
4.用价层电子对互斥理论推断分子或离子的空间构型具体步骤:(1)确定中心原子A价层电子对数目中心原子A的价电子数与配体X提供共用的电子数之和的一半,即中心原子A价层电子对数目。
计算时注意:氧族元素原子作为配位原子时,可认为不提供电子,但作中心原子时可认为它提供所有的6个价电子。
第二节 分子的立体构型第1课时一、形形色色的分子大多数分子是由两个以上原子构成的,于是就有了分子中的原子的空间关系问题,这就是所谓“分子的立体结构”。
例如,三原子分子的立体结构有直线形和V 形两种。
如C02分子呈直线形,而H 20分子呈V 形,两个H —O 键的键角为105°。
三原子分子立体结构:有直线形C02 、CS 2等,V 形如H 2O 、S02等。
大多数四原子分子采取平面三角形和三角锥形两种立体结构。
例如,甲醛(CH 20)分子呈平面三角形,键角约120°;氨分子呈三角锥形,键角107°。
四原子分子立体结构:平面三角形:如甲醛(CH 20)分子等,三角锥形:如氨分子等。
五原子分子的可能立体结构更多,最常见的是正四面体形,如甲烷分子的立体结构是正四面体形,键角为109°28。
五原子分子立体结构:正四面体形如甲烷、P 4等。
[讲] 此形形色色的分子世界分子的空间结构我们看不见,那么科学家是怎样测定的呢?科学视野—分子的立体结构是怎样测定的?肉眼不能看到分子,那么,科学家是怎样知道分子的形状的呢?早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。
所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。
当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。
通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息,可分析出分子的立体结构。
分子中原子不是固定不动的,而是不断地振动着的。
所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。
当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。
通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,结合这些信息,可分析出分子的立体结构。