第5章 第1讲 原子结构 核外电子排布剖析
- 格式:ppt
- 大小:502.00 KB
- 文档页数:5





《核外电子排布》讲义一、引言在探索物质的微观世界中,原子的结构是一个关键的研究领域。
而核外电子的排布则是理解原子性质和化学行为的重要基础。
接下来,让我们一同深入了解核外电子排布的奥秘。
二、核外电子排布的基本概念原子是由位于中心的原子核和核外电子组成。
原子核带正电荷,而电子带负电荷。
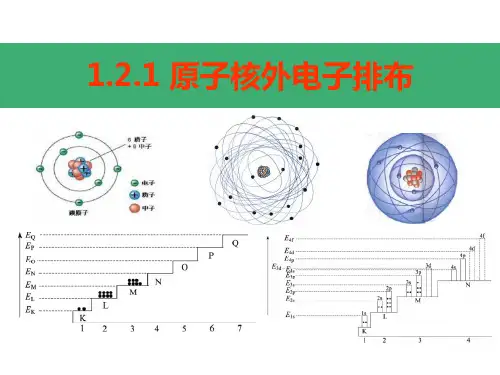
电子在原子核外的特定区域内运动,这些区域被称为电子层。
电子层按照离原子核的距离远近,依次被标记为K、L、M、N、O、P、Q 等。
离原子核越近的电子层,其能量越低;离原子核越远的电子层,其能量越高。
每个电子层所能容纳的电子数量是有限的。
K 层最多容纳 2 个电子,L 层最多容纳 8 个电子,M 层最多容纳 18 个电子,依此类推。
三、核外电子排布的规律1、能量最低原理电子总是优先占据能量最低的电子层,然后再依次进入能量较高的电子层。
这就像是人们在选择座位时,总是先选择离门口近、方便的座位,然后再考虑较远的座位。
2、泡利不相容原理在同一个原子中,不可能有两个电子具有完全相同的四个量子数。
这意味着每个电子都有其独特的“身份标识”,就像每个人都有独一无二的指纹一样。
3、洪特规则电子在等价轨道(能量相同的轨道)上排布时,总是尽可能分占不同的轨道且自旋平行。
这可以理解为如果有几个相同的盒子可以放东西,为了让空间利用更充分,我们会尽量把东西分散地放在不同的盒子里。
四、电子排布式为了更清晰地表示核外电子的排布情况,我们使用电子排布式。
例如,钠原子(Na)的电子排布式为 1s² 2s² 2p⁶ 3s¹。
其中,1s、2s、2p、3s 等表示电子所在的轨道,数字表示该轨道上的电子数。
五、核外电子排布与元素周期表元素周期表是化学中非常重要的工具,而核外电子排布与元素周期表有着密切的关系。
元素周期表的周期数等于原子的电子层数。
同一周期的元素,其原子的电子层数相同,但最外层电子数依次递增。
元素周期表的族数与原子的最外层电子数有关。

原子结构 核外电子排布 考纲定位 核心素养 1.了解元素、核素和同位素的含义。
2.了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数及它们之间的相互关系。
3.了解原子的核外电子排布规律。
掌握原子结构示意图、原子符号、离子符号、元素符号的表示方法。
1.微观探析——从核电荷数、质子数、中子数、核外电子数及其排布掌握原子的微观结构。
2.模型认知——根据核外电子排布规律领会原子结构模型。
3.科学探究——能发现和提出有探究价值的原子结构及核外电子排布规律。
考点一| 原子结构和核素、同位素1.原子结构(1)原子的构成(2)核素(原子)符号表示AZ X 表示质子数为Z 、质量数为A 、中子数为A -Z 的核素,如氘21H 。
(3)微粒中的“各数”间的关系①质量关系:质量数(A )=质子数(Z )+中子数(N )。
②电性关系⎩⎪⎨⎪⎧ 原子AZ X :核外电子数=质子数Z = 核电荷数=原子序数阴离子o\al(A ,Z )X n -:核外电子数=Z +n 阳离子A Z X n +:核外电子数=Z -n提醒:原子结构中的“不一定”(1)原子中不一定都含有中子,如11H 中没有中子;(2)电子排布完全相同的原子不一定是同一种原子,如互为同位素的各原子;(3)易失去1个电子形成+1价阳离子的不一定是金属原子,如氢原子失去1个电子形成H+;(4)形成稳定结构的离子最外层不一定是8个电子,如Li+为2电子稳定结构;(5)阳离子不一定均有电子,如H+。
2.元素、核素、同位素(1)“三素”关系及含义(2)几种重要的核素及其应用11H:用字母H表示,名称为氕,不含中子。
21H:用字母D表示,名称为氘或重氢,含1个中子。
31H:用字母T表示,名称为氚或超重氢,含2个中子。
提醒:(1)现行元素周期表已发现的元素有118种,由于同位素的存在,故核素(或原子)的种数远大于118种。
(2)不同核素可能具有相同的质子数,如21H、31H;也可能具有相同的中子数,如14 6C、16 8 O;也可能具有相同的质量数,如11 6C、11 7N。


第五章 物质结构 元素周期律第一节 原子结构 核外电子排布[基础知识自查]1.原子结构(1)原子的构成(2)核素(原子)符号表示 A Z X 表示质子数为Z 、质量数为A 、中子数为A -Z 的核素原子,如氘21H 。
(3)微粒中的“各数”间的关系①质量关系:质量数(A )=质子数(Z )+中子数(N )②电性关系⎩⎨⎧ 原子(A Z X ):核外电子数=质子数(Z )= 核电荷数=原子序数阴离子(A Z X n -):核外电子数=Z +n 阳离子(A Z X n +):核外电子数=Z -n2.元素、核素、同位素(1)“三素”关系及含义(2)几种重要的核素及其应用(3)1H:名称为氕,不含中子12H:用字母D表示,名称为氘或重氢13H:用字母T表示,名称为氚或超重氢1[应用体验]现有下列9种微粒:11H、21H、136C、146C、147N、5626Fe2+、5626Fe3+、168O2、168O3。
按要求完成以下各题:(1)11H、21H、31H分别是氢元素的一种________,它们互称为________。
(2)互为同素异形体的微粒是____________。
(3)5626Fe2+的中子数为________,核外电子数为________。
(4)11H、21H与16O、18O形成的H2O的种类有________种。
(5)互为同位素的为________________。
(6)对于A Z X n b,按下列要求各举一例(要求:每小题分别写出符合题意的两种粒子,且从以上所给微粒中选择):①Z、n、b相同而A不同:_____________________________________;②A、n、b相同而Z不同:_____________________________________;③A、Z、b相同而n不同:_____________________________________;④Z、n、A相同而b不同:_____________________________________。

电子行业原子核外电子排布1. 介绍电子行业是指以电子技术为核心的产业领域,涵盖了电子器件、通信设备、信息技术等多个领域。
在电子行业中,了解原子结构对于理解材料特性和电子性能非常重要。
原子核外电子排布是指电子在原子核周围的排列方式,影响了原子的化学性质和物理性质。
本文将介绍原子结构和原子核外电子排布的基本知识。
2. 原子结构原子是物质的基本单位,由原子核和围绕在核外的电子组成。
原子核由质子和中子组成,质子带有正电荷,中子不带电荷。
电子带有负电荷,围绕着原子核运动。
原子的总电荷是中性的,即质子数等于电子数。
原子的大小主要由原子核和电子云的分布确定。
原子核非常小,占据了整个原子的很小的空间。
电子云是指电子在原子核周围的运动轨道,占据了大部分的体积,但其中电子的实际位置是不确定的。
3. 原子核外电子排布规律原子核外电子排布遵循一定的规律,主要有以下几个原则:3.1 布居原理布居原理又称为泡利不相容原理,它规定了同一原子中的电子不能完全具有相同的量子数值。
电子的四个量子数分别是主量子数(n)、角量子数(l)、磁量子数(m)和自旋量子数(s)。
根据布居原理,原子中的电子会优先填充能量最低的轨道。
3.2 范德瓦尔斯原子核外电子排布规律根据范德瓦尔斯原子核外电子排布规律,电子首先填满最内层的能级,然后依次填满较高能级的电子。
能级的填充顺序遵循一定的规律:1s、2s、2p、3s、3p、4s、3d、4p、等。
3.3 阿奥斯原子核外电子排布规律阿奥斯原子核外电子排布规律又称为洪特规律,它规定了同一能级上的轨道数目。
根据阿奥斯原子核外电子排布规律,能级为n的主能级上最多可以容纳2n^2个电子。
其中,s轨道最多容纳2个电子,p轨道最多容纳6个电子,d轨道最多容纳10个电子。
4. 典型的电子排布示例4.1 氢原子氢原子只有一个电子,其原子核外电子排布为:1s1。
其中,1s表示主量子数为1的s轨道,1表示该轨道上有一个电子。