五元单杂环化合物芳香性和反应活性讨
- 格式:docx
- 大小:172.47 KB
- 文档页数:4
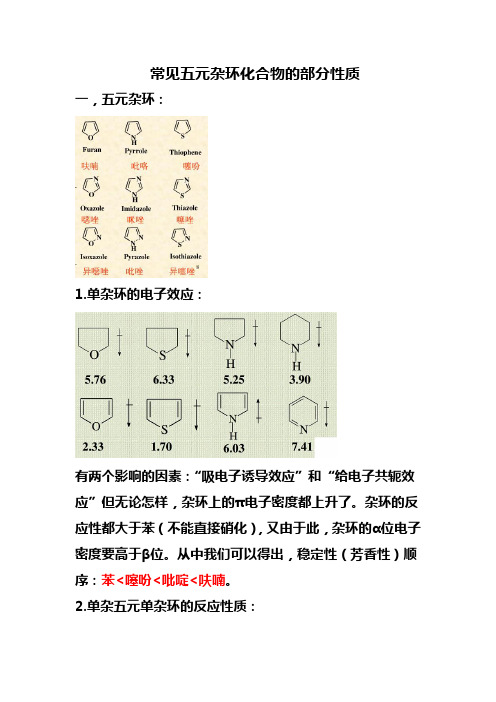
常见五元杂环化合物的部分性质一,五元杂环:1.单杂环的电子效应:有两个影响的因素:“吸电子诱导效应”和“给电子共轭效应”但无论怎样,杂环上的π电子密度都上升了。
杂环的反应性都大于苯(不能直接硝化),又由于此,杂环的α位电子密度要高于β位。
从中我们可以得出,稳定性(芳香性)顺序:苯<噻吩<吡啶<呋喃。
2.单杂五元单杂环的反应性质:加成反应:苯<噻吩<吡啶<呋喃亲电取代:苯<噻吩<呋喃<吡啶(取代考虑的具体因素应该是α位的电子云密度问题,而不是整个环的稳定性。
)·呋喃太容易进行加成,在溴水/甲醇中得到只有用二氧六环溴合物才能得到正常的溴代产物,当然,钝化基团的加入可以使反应变得较为温和。
·与苯炔反应时,呋喃生成D-A产物,而吡咯生成苯炔的加成产物(1-苯基吡咯),噻吩则不能反应。
3.双杂五元单杂环的反应性质:咪唑可以互变,通常4,5位混杂,不过在有基团时并不相等,例如“4(5)-硝基咪唑”绝大多数都为4位。
咪唑分子间有氢键(20个分子左右),沸点异常地高。
相比之下吡唑一般二聚。
唑环的电子云密度比相应的单杂环要低,其亲电取代的顺序为:苯>氮杂>硫杂>氧杂其反应时,取代位通常为三级氮的间位。
机理上先是氮的质子化(噻唑可以在较弱条件下硝化,而噻吩不可以)。
弱的亲电试剂不可以和唑环反应,例如F-C。
虽然唑环硝化和磺化时反应活性比苯环低,但是卤化时却比苯环高。
由于存在三级氮,唑环还可以发生亲核取代(在其邻对位)。
4.单杂五元苯并杂环:5.吲哚吲哚合成法:1>Fischer:苯腙+酮其机理如下:2>Reisset:邻硝基甲苯+草酸二乙酯3>Nenitzescu:对苯醌+β-氨基巴豆酸乙酯And more。
吲哚和苯并噻吩亲电取代在3位,而苯并呋喃在二位。
在酸性下吲哚发生质子化,杂环的密度将小于苯环,取代在苯环上进行(硝化则在5位进行)。

常见五元杂环化合物的部分性质一,五元杂环:1.单杂环的电子效应:有两个影响的因素:“吸电子诱导效应”和“给电子共轭效应”但无论怎样,杂环上的π电子密度都上升了。
杂环的反应性都大于苯(不能直接硝化),又因为此,杂环的α位电子密度要高于β位。
从中我们能够得出,稳定性(芳香性)顺序:苯<噻吩<吡啶<呋喃。
2.单杂五元单杂环的反应性质:加成反应:苯<噻吩<吡啶<呋喃亲电取代:苯<噻吩<呋喃<吡啶(取代考虑的具体因素应该是α位的电子云密度问题,而不是整个环的稳定性。
)·呋喃太容易实行加成,在溴水/甲醇中得到只有用二氧六环溴合物才能得到正常的溴代产物,当然,钝化基团的加入能够使反应变得较为温和。
·与苯炔反应时,呋喃生成D-A产物,而吡咯生成苯炔的加成产物(1-苯基吡咯),噻吩则不能反应。
3.双杂五元单杂环的反应性质:咪唑能够互变,通常4,5位混杂,不过在有基团时并不相等,例如“4(5)-硝基咪唑”绝绝绝大部分都为4位。
咪唑分子间有氢键(20个分子左右),沸点异常地高。
相比之下吡唑一般二聚。
唑环的电子云密度比相对应的单杂环要低,其亲电取代的顺序为:苯>氮杂>硫杂>氧杂其反应时,取代位通常为三级氮的间位。
机理上先是氮的质子化(噻唑能够在较弱条件下硝化,而噻吩不能够)。
弱的亲电试剂不能够和唑环反应,例如F-C。
虽然唑环硝化和磺化时反应活性比苯环低,但是卤化时却比苯环高。
因为存有三级氮,唑环还能够发生亲核取代(在其邻对位)。
4.单杂五元苯并杂环:5.吲哚吲哚合成法:1>Fischer:苯腙+酮其机理如下:2>Reisset:邻硝基甲苯+草酸二乙酯3>Nenitzescu:对苯醌+β-氨基巴豆酸乙酯And more。
吲哚和苯并噻吩亲电取代在3位,而苯并呋喃在二位。
在酸性下吲哚发生质子化,杂环的密度将小于苯环,取代在苯环上实行(硝化则在5位实行)。




单杂环化合物的化学性质一、五元单杂环的化学性质(呋喃,噻吩,吡咯) (一)酸碱性1、吡咯N 的孤e 参与共轭,碱性↓↓,显弱酸性,可与强碱成盐:+ KOH (S)N K -++ H 2ON H2、吡咯的酸性介于醇酚间:醇<吡咯<酚:N HOHK a =×1.3 10-101 10-181 10-15××CH 3CH 2OH3、吡咯与前面所学各类含氮化合物碱性的比较:季铵碱 > 脂肪胺 > 氨 > 苯胺 > 尿素 > 酰胺 > 吡咯 > 酰亚胺例题:NHN HNH 2三者碱性强弱排序?解:吡咯中N 的孤对电子完全参与共轭;苯胺中N 的孤对电子不完全参与共轭(N 是接近于sp2的sp3杂化);四氢吡咯属于环状仲胺,拥有孤对电子。
因此有碱性顺序:N HNH NH 2<<(K b =×3.8 10-10 2 10-4)2.5 10-14××(二)亲电取代N H O(四溴吡咯)N H Br 2BrBr Br Br, 0℃EtOH Br 2OBrS Br 2HOAcSBr, 0℃,1、呋喃、噻吩、吡咯均为富e 体系,亲电活性>苯,且进入α位;2、硝/磺化时:不可用强酸(了解,不要求掌握):因杂原子遇强酸能质子化,破坏大π键显示共轭二烯性质,易聚合、氧化 ;可改用非质子性试剂。
3、亲电取代反应活性:吡咯>呋喃>噻吩>苯: 分析:(1)五元单杂环是富电子体系,电荷密度高于苯,因此苯的反应活性最小;(2)噻吩中S 的轨道匹配性最差,给电子能力在三个单杂环中最弱;(3)O 的电负性比N 大,因此呋喃环的电荷密度小于吡咯,活性比吡咯小。
(三)加成1、呋喃、噻吩、吡咯芳香性<苯,因此较苯易加成;2、产物失去芳香性,性质类似脂杂环。
N S OHH 2N HH 2H 2H 2H 2N HOS SMoS 2(噻吩能使Pd 中毒)二、六元单杂环的化学性质(吡啶) (一)碱性1、吡啶N 孤e 不参与共轭,因此显碱性:NH Cl -N ++ HCl2、N 孤e 处于sp2杂化轨道,因而碱性↓,碱性介于氨和苯胺之间:CH 3NH 2NH 3NNH 2pK b3.384.768.809.423、与各类含氮化合物碱性比较:季铵碱> 脂胺>氨>吡啶>苯胺>尿素>酰胺>吡咯>酰亚胺(二)亲电取代吡啶属于缺电子体系,环上ρe ↓,因此亲电活性↓,<苯,进入β位:NNBrNO 24SO 3H NN20%71%33%(三)加成(还原)吡啶芳香性<苯,因此比苯易加成(还原),产物为环状仲胺,碱性↑。
---------------------------------------------------------------最新资料推荐------------------------------------------------------ 五元单杂环化合物芳香性和反应活性讨五元单杂环化合物芳香性和反应活性讨组员分工:总结和演讲:曹朋成收集资料:尹文,晏杭,冯柏塨,周英杰,卓帅整理资料:龙贤哲,冉天飞 PPT 制作:刘泽宇五元单杂环化合物,呋喃、吡咯、噻吩中各原子在同一平面上,碳原子与杂原子(氧,硫,氮)都是 sp2 杂化。
每个碳原子剩下一个未杂化 P 轨道,其中填充有一个 P 电子。
杂原子的 P 轨道上填充有一对未共用的电子,组成一个五原子,六电子的环状共轭体系,符合休克尔规则,具有杂芳香性,是芳香性的一个扩展,称杂芳香性。
芳香性的标志之一就是其化学行为比较容易进行亲电取代反应,不易进行亲电加成和氧化反应。
呋喃、吡咯、噻吩也容易进行亲电取代,其反应活性:吡咯呋喃噻吩。
按上述,芳香性和亲电取代反应应该有关。
而杂芳香性大小次序和亲电取代反应活性次序之间并无规律性联系。
我们从结构人手,结合实验数据讨论了芳香性和亲电反应活性的关系。
1 / 51.结构和芳香性芳香性五元单杂环化合物呋喃、吡咯、噻吩具有符合休克尔规则的结构,所以具有芳香性。
呋喃、吡咯、噻吩结构与苯结构比较,苯的键长完全平均化,呋喃、吡咯、噻吩的键长是趋于平均化。
另外,从电荷密度分布也是如此。
苯的电荷密度完全平均化,呋喃、吡咯、噻吩的电荷密度分布,并不均一,这和其芳香性有关。
根据上表可得,噻吩中 CS 缩短的最多,吡咯次之,呋喃缩短的最少。
所以芳香性是噻吩吡咯呋喃。
另外从呋喃、吡咯、噻吩的共轭能也证明了这个芳香性大小次序。
共轭能高,说明环共轭体系稳定性高,芳香性大。
共轭能低,环共轭体系稳定性低,芳香性小。
根据上表数据可见,噻吩的共轭能高、芳香性大,呋喃的共轭能低、芳香性小,吡咯介于噻吩、呋喃之间。
五元芳杂环的芳香性和亲电取代活性顺序
五元芳杂环是指包含五个芳烃单元的芳杂环化合物。
这类化合物的芳香性和亲电取代活性取决于它们的结构特征和电子分布。
通常来说,五元芳杂环的芳香性是由以下因素共同作用的结果:共平面性:五元芳杂环的芳香性与它们的共平面性有关。
当五个芳烃单元呈共平面排列时,这类化合物的芳香性较高。
同构体:五元芳杂环可能存在多种同构体,这些同构体可能具有不同的芳香性。
通常来说,五元芳杂环的同构体中,具有更多平面内相邻双键的同构体的芳香性较高。
零价基团:五元芳杂环中存在零价基团(如氧、氮等)可能会抑制它们的芳香性。
五元芳杂环的亲电取代活性取决于它们的电子分布。
通常来说,五元芳杂环中存在较多的可以被亲电取代的位置,这些位置通常是电子富集的,并且具有较小的电子排斥效应。
因此,五元芳杂环的亲电取代活性通常是按照电子富集的位置的顺序排列的。
五元氮杂环的芳香性和稳定性梁艳红【摘要】自然界中许多含有五元环的有机物都具有芳香性,其中这些五元环大部分是由(CH)单元和N原子组成的.(CH)单元和N原子是等电子体,笔者对一些五元杂环及其正负离子的稳定性和芳香性的规律进行了详细的研究.选用从头算和密度泛函理论方法,用cc-pVDZ基组对五元氮杂环及其正负离子的几何结构进行了优化,同时对它们的能量和频率进行了计算,得到了一些具有稳定平面结构的氮杂环和其正负离子.并在相同的计算水平下,对这些稳定结构的核独立化学位移(NICS)和谐振子模型的芳香性(HOMA)进行了计算,利用这两个判断标准对这些结构的芳香性进行了讨论,并得到了有关这些结构的稳定性和芳香性的一些规律.【期刊名称】《河北科技师范学院学报》【年(卷),期】2014(028)004【总页数】6页(P51-55,67)【关键词】氮杂环;芳香性;稳定性;从头计算;密度泛函理论【作者】梁艳红【作者单位】河北科技师范学院物理系,河北秦皇岛,066004【正文语种】中文【中图分类】TQ252氮的五元杂环在生物学上有很重要的地位,研究它们是否具有芳香性,对于探讨其结构的稳定性和在生物学上的应用是非常重要的。
现在化学家提出了很多芳香性的判断标准,这些标准基本上从物质能量,磁性和几何结构这三个方面来判定物质的芳香性,这是由于物质的芳香性对物质这三个方面有很明显的作用[1]。
其中,核独立化学位移(NICS)被化学家认为是一个简单而有效的芳香性判据[2]。
它主要是从磁性的角度来判定芳香性。
它是由Schleyer及其合作者提出的一个判据[3],其定义是在平面环或原子簇的几何中心或中心之上计算的独立磁屏蔽系数的负值。
如果在这些位置计算的NICS值为负,表明分子具有芳香性;若这些位置的NICS值为正,表明分子是反芳香的;接近0,则是非芳香性分子[4]。
它的可靠性已经被一系列对二维和三维芳香化合物的研究所证明。
谐振子模型的芳香性(HOMA)是芳香性的另一个判断标准[5]。
五元单杂环化合物芳香
性和反应活性讨
Company Document number:WTUT-WT88Y-W8BBGB-BWYTT-19998
五元单杂环化合物芳香性和反应活性讨
组员分工:总结和演讲:曹朋成
收集资料:尹文,晏杭,冯柏塨,周英杰,卓帅
整理资料:龙贤哲,冉天飞
PPT制作:刘泽宇
五元单杂环化合物,呋喃、吡咯、噻吩中各原子在同一平面上,碳原子与杂原子(氧,硫,氮)都是sp2杂化。
每个碳原子剩下一个未杂化P轨道,其中填充有一个P电子。
杂原子的P轨道上填充有一对未共用的电子,组成一个五原子,六电子的环状共轭体系,符合休克尔规则,具有杂芳香性,是芳香性的一个扩展,称杂芳香性。
芳香性的标志之一就是其化学行为比较容易进行亲电取代反应,不易进行亲电加成和氧化反应。
呋喃、吡咯、噻吩也容易进行亲电取代,其反应活性:吡咯>呋喃>噻吩。
按上述,芳香性和亲电取代反应应该有关。
而杂芳香性大小次序和亲电取代反应活性次序之间并无规律性联系。
我们从结构人手,结合实验数据讨论了芳香性和亲电反应活性的关系。
1.结构和芳香性
芳香性五元单杂环化合物呋喃、吡咯、噻吩具有符合休克尔规则的结构,所以具有芳香性。
呋喃、吡咯、噻吩结构与苯结构比较,苯的键长完全平均化,呋喃、吡咯、噻吩的键长是趋于平均化。
另外,从电荷密度分布也是如此。
苯的电荷密度完全平均化,呋喃、吡咯、噻吩的电荷密度分布,并不均一,这和其芳香性有关。
根据上表可得,噻吩中C—S缩短的最多,吡咯次之,呋喃缩短的最少。
所以芳香性是噻吩>吡咯>呋喃。
另外从呋喃、吡咯、噻吩的共轭能也证明了这个芳香性大小次序。
共轭能高,说明环共轭体系稳定性高,芳香性大。
共轭能低,环共轭体系稳定性低,芳香性小。
根据上表数据可见,噻吩的共轭能高、芳香性大,呋喃的共轭能低、芳香性小,吡咯介于噻吩、呋喃之间。
2.加成反应与芳香性
加成反应与芳香性的标志之一是不易进行加成反应。
那么,如果容易进行加成反应,则芳香性小,甚至无芳香性。
所以,可以从吡咯、呋喃、噻吩加成反应的难易来分析它们芳香性的大小。
呋喃、吡咯、噻吩有芳香性,也能进行加成反应。
例如,呋喃、吡咯、噻吩都能催化氢化,呋喃较易加氢,并很快生成四氢呋喃。
吡咯、噻吩相对加成较慢,特别是噻吩,加氢时硫可以使催化剂(Pd、Pt、Ni)中毒,加成氢时需大量的催化剂,或需选用特殊催化剂催化。
又如呋喃在-5O℃时可与溴进行1,4或1,2加成。
吡咯和噻吩在该条件下不易与溴加成。
通过上面的分析,对加成反应的活性是,呋喃>吡咯>噻吩。
所以芳香性的大小是噻吩>吡咯>呋喃。
3.亲电取代与反应活性
呋喃、吡咯、噻吩都容易进行亲电取代反应,反应活性是吡咯>呋喃>噻吩,这个活性顺序与它们的芳香性大小有关,更与环上电子几率密度有关。
由于呋喃、吡咯、噻吩都是五原子、六电子共轭体系,环上电子密度较大,容易进行亲电取代反应。
然而,它们环上电子密度大小各不相同,所以亲电取代反应活性不同。
杂原子电负性的影响电负性体现了元素的夺电子能力,也体现了束缚电子的能力。
噻吩环上电荷密度是介于呋喃、吡咯之间的,但硫的电负性又是最小的,其亲电取代活性又是最差的。
这可能硫位于第三周期,有空的3d轨道,这个空3d轨道接受环中兀电子,从而束缚了兀电子,增加了环的稳定性,亲电反应活性减小。
从偶极矩数据比较看(如表三),在饱和化合物中(四氢呋喃、四氢吡咯、四氢噻吩)杂原子是偶极的负端.在芳香杂环化合物中(呋喃、吡咯、噻吩)呋喃
和噻吩的净偶极矩降低了,在吡咯中偶极的负端,与四氢吡咯方向相反。
并且,在三类杂环化合物中吡咯偶极矩最大。
这是氮上电子易于离域所致。
吡咯中偶极矩方向负端在兀环上。
环上电子密度较大容易进行亲电取代反应。
呋喃、噻吩的净偶极矩都降低了,降低的越多,说明环上电子云密度平均化程度高,稳定性大。
显然,噻吩的稳定件大于呋喃,这样噻吩的亲电取代反应活性小于呋喃。
4.结果讨论
五元杂环化合物呋喃、吡咯、噻吩都有芳香性,芳香性大小是,噻吩>吡咯>呋喃。
都易进行亲电取代反应,反应活性次序是吡咯>呋喃>噻吩。
芳香性和亲电反应活性看似没有规律性联系,这是二者考虑问题的角度不同,芳香性考虑是键长、电子密度平均化程度、环的稳定性等。
亲电取代反应活性考虑环上电子密度大小。
电子密度大的易进行亲电取代,电子密度小不易进行亲电取代。
虽然如此,二者还是有联系的。
例如噻吩,芳香性在三个单杂环化合物中是最大的,在亲电取代反应中是最不活泼的。
这是因为,对富电子的芳香杂环化合物,电子云平均化程度越大,芳香性越大,亲电取代反应活性越小,噻吩就是如此。
按上述观点,又不符合呋喃和吡咯规律,这是因为亲电取代反应,不仅考虑芳香性,还要考虑环上电子云密度大小。
环上电子云密度大小与杂原子电负性以及分子偶极矩有关。
在前面的讨论已清楚,氧原子电负性大,在呋喃环中氧原子周围的电子云密度较大,在环上电子云密度较小。
在吡咯中氮的电负性小于氧,而兀偶极矩大于a-偶极矩,偶极矩方向朝向兀环,说明环上电子云密度大,吡咯最容易进行亲电取代反应。