亚铁的测定(重铬酸钾容量法)
- 格式:doc
- 大小:29.50 KB
- 文档页数:2

重铬酸钾法测定铁矿石中铁的含量(无汞法)一、实验目的1. 掌握重铬酸钾法测定亚铁盐中铁含量的原理和方法;2. 了解氧化还原指示剂的作用原理和使用方法。
二.原理:经典的重铬酸钾法测定铁时,每一份试液需加入饱和氯化汞溶液10mL,这样约有480mg 的汞排入下水道,而国家环境部门规定汞的允许排放量是0.05mg·L-1,因此,实验中的排放量是大大超过允许排放量的。
实际上,汞盐沉积在底泥和水质中,造成严重的环境污染,有害于人的健康。
近年来研究了无汞测铁的许多新方法,如新重铬酸钾法,硫酸铈法和EDTA 法等。
本法是新重铬酸钾法。
新重铬酸钾法是在经典的有汞重铬酸钾法的基础上,去掉氯化汞试剂,采用钨酸钠作为指示剂指示Fe3+还原Fe2+的方法。
试样用硫-磷混酸溶剂后,先用氯化亚锡还原大部分Fe3+,继而用三氯化钛定量还原剩余部分的Fe3+,当Fe3+定量还原成Fe2+之后,过量一滴三氯化钛溶液,即可使溶液中作为指示剂的六价钨(无色的磷钨酸)还原为蓝色的五价钨化合物,俗称“钨蓝”,故使溶液呈现蓝色。
滴入重铬酸钾溶液,使钨蓝刚好褪色,以消除少量还原剂的影响。
“钨蓝”的结构式较为复杂定量还原Fe3+时,不能单用氯化亚锡,因为在此酸度下,氯化亚锡不能很好的还原W(Ⅵ)为W(V),故溶液无明显颜色变化。
采用SnCl2-TiCl3联合还原Fe3+为Fe2+,过量一滴TiCl3与Na2WO4作用即显示“钨蓝”而指示。
如果单用TiCl3为还原剂也不好,尤其是试样中铁含量高时,则使溶液中引入较多的钛盐,当加水稀释试液时,易出现大量的四价钛沉淀,影响测定。
在无汞测定铁实验中常用SnCl2-TiCl3联合还原,反应式如下:2Fe3++SnCl42-+2Cl-=2Fe2++SnCl62-Fe3++Ti3++H2O=Fe2++TiO2++2H+试液中Fe3+已经被还原为Fe2+,加入二苯胺磺酸钠指示剂,用K2Cr2O7标准溶液滴定溶液呈现稳定的紫色即为终点。

重铬酸钾滴定法测定金属化球团中氧化亚铁含量1. 实验原理本实验采用重铬酸钾滴定法测定金属化球团中氧化亚铁含量。
氧化亚铁在酸性条件下能够与重铬酸钾发生氧化还原反应,并使重铬酸钾从浅绿色变为蓝色。
根据反应计算出氧化亚铁的含量。
反应方程式:Fe2+ + K2Cr2O7 + H2SO4 → Fe3+ + Cr2(SO4)3 + K2SO4 + H2O由于氧化亚铁比较容易被氧化,因此必须在酸性条件下进行滴定。
反应中的重铬酸钾是一种氧化剂,滴定时需要摇晃溶液使氧气与溶液中的还原剂充分接触。
2. 实验步骤1) 样品制备将金属化球团样品取重量为0.5g,用去离子水将其完全溶解,转移至100ml容量瓶中,加入2ml浓盐酸,加满去离子水至刻度线,摇匀备用。
将取1ml样品溶液加入50ml锥形瓶中,加入3ml浓H2SO4和1g氯化钾,加入50ml去离子水稀释。
2) 滴定将待测溶液与已知浓度的标准溶液进行滴定。
取一定量的标准溶液,称重并加入滴定瓶中。
使用试剂架支撑滴定瓶,并使用滴定管滴加标准溶液到反应瓶中。
添加标准溶液的速度应该适中,保证滴定过程可控且正常。
在加入重铬酸钾之后,应迅速搅拌溶液,以确保氧气与溶液中氧化亚铁的接触。
滴定到溶液变成蓝色时,停止滴定。
此时反应瓶中的氧化亚铁全部被氧化成了氧化铁,重铬酸钾被还原成了铬(III)离子,从而使溶液变成了蓝色。
3) 计算根据滴定过程中使用了多少标准溶液计算出金属化球团中氧化亚铁的含量。
根据已知氧化亚铁的质量以及总溶液的体积可以计算出氧化亚铁的摩尔数。
根据反应方程式可以得出单位摩尔氧化亚铁消耗的重铬酸钾量,从而可以计算出氧化亚铁的质量。
3. 实验注意事项1) 反应瓶和滴定瓶使用前必须清洗干净,并用去离子水洗涤干净。
2) 在滴定过程中要摇动反应瓶,使氧气与还原剂接触,加速反应。
3) 标准溶液的浓度应该精确计算,以保证实验结果的准确。
4) 滴定过程中应该逐滴添加标准溶液,以避免浪费试剂。

重铬酸钾法测定铁矿石中亚铁量周琴;李勇;王玲;廖兵【摘要】介绍了重铬酸钾滴定法测定FeO含量的试验方法,对包括测试过程中的一些滴定条件、试剂及防氧化措施进行了详细讲解,着重分析了其关键影响因素,并对试验条件及装置进行了优化,提高了该方法在实际检测过程中的操作性及准确性.【期刊名称】《玻璃纤维》【年(卷),期】2016(000)005【总页数】3页(P43-45)【关键词】铁矿石;亚铁;测定;影响因素【作者】周琴;李勇;王玲;廖兵【作者单位】南京玻璃纤维研究设计院有限公司,南京210012;南京玻璃纤维研究设计院有限公司,南京210012;南京玻璃纤维研究设计院有限公司,南京210012;南京玻璃纤维研究设计院有限公司,南京210012【正文语种】中文【中图分类】TQ171.77+1.2岩棉及其制品因其良好的隔热阻燃性能被广泛用于石油、电力、建筑、冶金、国防、运输等领域。
其具有不燃、防火、绝热、吸音等特性。
近年来,国家也不断出台政策推动岩棉产品的普及应用。
国内生产岩棉,一般以玄武岩和矿渣作为原料。
同时,辉绿岩也是我国一种储量较大的岩石矿产,拥有不小的岩棉开发潜力。
但是辉绿岩的铁含量差异性大,有些含铁量很高,熔点高,能耗较大,岩棉生产成本高,且较高的铁含量会造成铁渣多、炉膛温度低,进而使得产品纤维粗、硬、渣球过多,使得岩棉质量较差。
因此需要进行必要的铁含量测试,以保证原料的质量,尤其需要了解亚铁含量来控制焦炭的使用量,进而保证生产的顺利进行[1-4]。
在本文中,为了保证变量的稳定性和标准样品的参考性,使用了铁矿石作为研究对象研究了重铬酸钾滴定法测定亚铁含量方法。
现在各实验室大都采用国家标准GB/T 6730.8-1986[5]铁矿石化学分析方法中重铬酸钾滴定法测定亚铁量的方法进行亚铁的分析。
但国标方法仅简要介绍操作步骤,未对试验中关键影响因素进行分析。
本文在大量实验的基础上,对标准的步骤进行了详细讲解,并着重分析了关键影响因素,以期为今后的检测操作起到指导作用。

硫酸亚铁铵中铁含量测定(重铬酸钾法)实验目的:测定硫酸亚铁铵中铁含量。
实验原理:重铬酸钾法是一种常用的测定铁含量的方法。
其基本原理是用重铬酸钾氧化亚铁到三价铁,将未反应的重铬酸钾以三氧化铬析出,在磷酸介质中用铕指示剂滴定铁离子。
实验仪器和药品:仪器:量筒、分析天平。
药品:硫酸亚铁铵样品、重铬酸钾、氯化铀、酒精、磷酸、铵铁硫氰酸、铵铁硫氰酸指示剂实验操作步骤:1. 取重量约为0.1g的硫酸亚铁铵样品,精确称量至0.0001g,置于250mL锥形瓶中。
2. 加入15mL稀磷酸和1.6g重铬酸钾,搅拌均匀,再加3mL 浓氯化铀溶液和50mL蒸馏水。
3. 把瓶放在加热板上,慢慢加热至沸腾,保持沸腾5分钟,放凉。
4. 用试管取5mL上清液,加入50mL蒸馏水中,加若干铵铁硫氰酸指示剂,立即用0.1mol/L铵铁硫氰酸溶液滴定至暗蓝色转为淡粉红色,每滴铵铁硫氰酸溶液相当于0.0056g Fe。
5. 用上述方法测定一组空白试验,作为控制试验。
将重铬酸钾、稀磷酸等试剂照样使用,但在加入硫酸亚铁铵样品前,先放入相等体积的蒸馏水,其他步骤与样品测定完全相同。
6. 根据样品和空白试验用铵铁硫氰酸溶液的用量,计算出样品中Fe含量。
计算公式为:样品中铁含量(%)= (滴定时加入的铵铁硫氰酸溶液体积×0.0056×换算系数/样品称量量)×100%。
实验注意事项:1. 用药品前应认真阅读说明书,掌握使用方法和注意事项。
2. 精密称量,保持良好的实验操作习惯。
3. 操作时需注意安全,如有不适应化学品,请及时与医生联系。
4. 操作规范,测定结果准确。
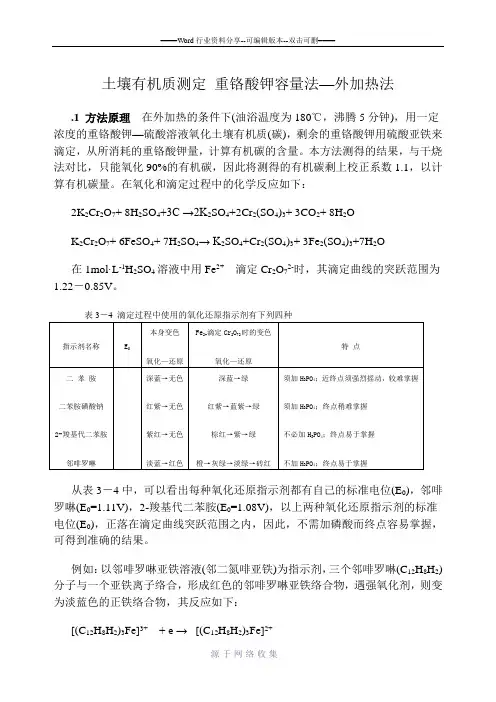
土壤有机质测定重铬酸钾容量法—外加热法.1 方法原理在外加热的条件下(油浴温度为180℃,沸腾5分钟),用一定浓度的重铬酸钾—硫酸溶液氧化土壤有机质(碳),剩余的重铬酸钾用硫酸亚铁来滴定,从所消耗的重铬酸钾量,计算有机碳的含量。
本方法测得的结果,与干烧法对比,只能氧化90%的有机碳,因此将测得的有机碳剩上校正系数1.1,以计算有机碳量。
在氧化和滴定过程中的化学反应如下:2K2Cr2O7+ 8H2SO4+3C →2K2SO4+2Cr2(SO4)3+ 3CO2+ 8H2OK2Cr2O7+ 6FeSO4+ 7H2SO4→ K2SO4+Cr2(SO4)3+ 3Fe2(SO4)3+7H2O在1mol·L-1H2SO4溶液中用Fe2+滴定Cr2O72-时,其滴定曲线的突跃范围为1.22-0.85V。
表3-4 滴定过程中使用的氧化还原指示剂有下列四种指示剂名称E0本身变色氧化—还原Fe2+滴定Cr2O72时的变色氧化—还原特点二苯胺二苯胺磺酸钠2-羧基代二苯胺邻啡罗啉深蓝→无色红紫→无色紫红→无色淡蓝→红色深蓝→绿红紫→蓝紫→绿棕红→紫→绿橙→灰绿→淡绿→砖红须加H3PO4;近终点须强烈摇动,较难掌握须加H3PO4;终点稍难掌握不必加H3PO4;终点易于掌握不加H3PO4;终点易于掌握从表3-4中,可以看出每种氧化还原指示剂都有自己的标准电位(E0),邻啡罗啉(E0=1.11V),2-羧基代二苯胺(E0=1.08V),以上两种氧化还原指示剂的标准电位(E0),正落在滴定曲线突跃范围之内,因此,不需加磷酸而终点容易掌握,可得到准确的结果。
例如:以邻啡罗啉亚铁溶液(邻二氮啡亚铁)为指示剂,三个邻啡罗啉(C12H8H2)分子与一个亚铁离子络合,形成红色的邻啡罗啉亚铁络合物,遇强氧化剂,则变为淡蓝色的正铁络合物,其反应如下:[(C12H8H2)3Fe]3++ e →[(C12H8H2)3Fe]2+淡蓝色←红色滴定开始时以重铬酸钾的橙色为主,滴定过程中渐现Cr3+的绿色,快到终点变为灰绿色,如标准亚铁溶液过量半滴,即变成砖红色,表示终点已到。

高温外热重铬酸钾氧化-容量法测定土壤有机质土壤有机质既是植物矿质营养和有机营养的源泉,又是土壤中异养型微生物的能源物质,同时也是形成土壤结构的重要因素。
测定土壤有机质含量的多少,在一定程度上可说明土壤的肥沃程度。
测定原理:在加热的条件下,用过量的重铬酸钾-硫酸溶液,来氧化土壤中有机质的碳,Cr2O7-2等被还原成Cr+3,剩余的重铬酸钾用硫酸亚铁标准溶液进行滴定,根据消耗的重铬酸钾量计算出有机碳量,乘以常数1.724,即为土壤有机质量。
准备工作:研磨后过100目钢筛的土壤:研磨土壤前需要把过2 mm的风干土壤样品进行进一步剔除植物根系,采用静电吸附(可以使用气球在毛绒衣物上面进行摩擦,制造静电,空气干燥时进行该工作最佳)仔细剔除细小的动植物残体,尤其是草地土壤,并且从风干土壤样品袋里面取出土壤样品前要将其再次均匀混合,确保其均匀,具有代表性。
具体步骤:称取过100目筛的风干土壤0.1 ~ 0.2 g左右(如果是泥炭土或者土壤有机质含量过高可减少土壤重量至0.1 g,实验正事开始前需要进行预实验确定合适土壤重量),精确到0.1 mg,放入干燥的平底消解管中(称量纸倒土壤到平底消解管时要快,并要轻震瓶底,确保壁上的土壤全部到达底部),然后用玻璃移液管准确加入5.00 ml重铬酸钾【105 ℃烘干后的39.2245g K2Cr2O7溶解于1L蒸馏水,c(1/6 K2Cr2O7=0.8000 mol/L】,5.00 ml的浓硫酸【H2SO4,p=1.84 g/cm3】,之后放入电解仪中,190℃持续加热16~20 min,(可以先加热一会,等温度升至190℃后开始计时,如果样品SOC含量较高需要加长消解时间或者减少土壤重量),注意每一批次加热热解时均放置2个空白(只加试剂,不加土样),然后在每个消解管上放置一个弯茎漏斗,起到冷凝作用。
消解完毕后放置于不锈钢管架上,并自然冷却至室温。
将消解后的混合液体全部转移至干净的广口三角锥形瓶中(该过程需要用装有蒸馏水的洗瓶冲洗转移,将平地瓶倾斜直接用水冲底部,可全部冲洗下来),转洗后三角瓶中的总体积在50-60 ml为宜,加2-3 滴邻菲啰啉指示剂【1.485 g邻菲啰啉(C12H8N2H2O)及0.695 g硫酸亚铁(FeSO4·7H2O)溶于100 ml水,无需烘干药品,贮存于棕色瓶中】,用硫酸亚铁溶液滴定消解反应中剩余的K2Cr2O7【硫酸亚铁溶液:56.0 g化学纯的FeSO4·7H2O(无需烘干)和15 ml浓硫酸溶于1 L蒸馏水】。

作者: 王宝荣
作者机构: 宣钢炼铁厂技能科,河北宣化075100
出版物刊名: 科技创新与应用
页码: 28-28页
年卷期: 2012年 第17期
主题词: 重铬酸钾容量法 氧化亚铁 指示剂
摘要:烧结矿中氧化亚铁的含量是烧结生产的一项综合性指标,其含量与原料配比与烧结过程控制有直接关系。
FeO是在熔融状态下高温产生的,FeO产生的越多需要的热量越多,因此烧结矿中FeO越高燃料消耗会升高;同时它与烧结矿的转鼓强度、低温还原粉化率、还原性的相关性很大。
是影响高炉炉况的一个重要参数。
烧结矿FeO的含量的准确测定对指导烧结生产过程控制和提高炉性能具有重要的意义。
本文对用重铬酸钾滴定FEO的实验进行理论研究与验证,用重铬酸钾滴定FEO结果准确,省时,重现性好,适用于工业生产应用。

重铬酸钾容量法(水合热法)
一、适用范围:适用于含有机质<15%的土壤,即使土壤中含有碳酸盐也不影响测定结果,
但若土壤中含有Cl-,Fe2+,Mn2+等还原性物质,则须除去或经校正,否则不适用。
对含有有机质超过15%的土壤,由于称样量过少,难以得到准确分析结果,建议用固体稀释法来克服。
方法为:称磨细土样1份(准确到1mg)和经过高温灼烧并磨细的矿质土壤9份(准确到1mg)使之充分混匀,再从中称样分析,分析结果以称样的1/10计算。
室温需在20摄氏度以上。
二、试制配制
1.1N重铬酸钾溶液准确称取49.04gK2Cr2O7(在105摄氏度烘干),溶于水中,稀释至
1L.
2. 0.5N硫酸亚铁溶液溶解140gFeSO4·7H2O于水中,加入15ml浓H2SO4,冷却稀释至
1L,或称200gFe(NH4)2(SO4)2·6H2O溶于含有200ml浓H2SO4的800ml水中,并稀释至1L。
标定:标准称取105℃烘干的AR级K2Cr2O70.5g,加水约50ml,溶解后加浓H2SO4约3ml 及邻啡啰啉指示剂2—3滴,用FeSO4溶液滴定,计算FeSO4溶液的当量浓度。
FeSO4溶液的浓度易改变,用时必须当天校正。
3.浓硫酸浓度不小于96%。
如土样中有Cl-,在每升中加15gAg2SO
4.
4. 邻啡啰啉指示剂如外加热法中的配法。
三、测定步骤准备称取过0.25mm的土样1—2g(泥炭为0.05g,土壤有机质含量低于1%者称取25g)于500ml三角瓶中,准备加入1 NK2CrO7溶液10ml于土壤样品上,转动。

亚铁的测定方法1.样品前处理在实际应用中,根据岩矿石的特性,分析项目的要求及干扰元素的分离情况碎样碾磨至符合粒度的要求。
结果表明, 样品粒度小于0.125 mm 时对亚铁测定没有影响。
故所以采用100目粒度的样品分析亚铁及全铁。
根据试样氧化亚铁含量:0.5 %一2% F eO称取0.500O g试样;3%- 5%FeO称取0.250O g 试样; 5%一10%FeO称取0.20 0O g试样;大于10%FeO称取0.10 0O g试样,都精确至0.10 0O g。
2.熔样通常选用碱熔融法和酸分解法。
2.1常用的碱熔融法有碳酸盐半熔融分解法---此法操作要仔细,每次只能放2个样进行半熔,稍不注意矿样将全熔,粘在坩埚上,不易提取,不利与矿样分解;2.2常用的酸分解法有硫酸—磷酸分解样品,此法用于不能很快被盐酸所溶解,特别是磁铁矿及赤铁矿等样品,需要与盐酸加热较长时间才能溶解。
因此测定含铁高的试样时,采用硫-磷混合酸分解。
3.滴定分析过程在隔绝空气的条件下用盐酸和氟化钠分解试样,以二苯胺磺酸钠为指示剂,用重铬酸钾标准溶液滴定。
主要试剂:硫-磷混合酸(3+3+14);盐酸(1+1);碳酸氢钠;氟化钠;二苯胺黄酸钠0.5%;硫酸亚铁按溶液:c(FeS04·(NH4)2S04·6H20)=0.00 5O mol/L,重铬酸钾标准溶液:准确称取在105 ℃烘干二小时的重铬酸钾3.5128 g于烧杯中。
以少量水溶解,移入2000 mL容量瓶中,水稀至刻度摇匀。
配制后得到滴定度T(Fe/K2CrO7)=2 mg/mL分析手续:称取试样0.200g 置于300ml干燥的锥形瓶中,加氟化钠0.5g、碳酸氢钠1g、盐酸30ml,迅速盖上瓷坩埚,放在事先预热的低温电炉上溶解。
并保持微沸状态10分钟,取下迅速冷却至室温,待溶解完全(溶液体积8 ~ 10 mL ), 取下, 迅速沿瓶壁加入100 mL水及0. 5 g 碳酸氢钠, 加硫磷混酸20mL, 0. 5% 二苯胺磺酸钠指示剂4 滴, 以重铬酸钾标准溶液滴定至稳定的紫色即为终点。


化学需氧量化学需氧量(COD),是指在一定条件下,用强氧化剂处理水样时所消耗氧化剂的量,以氧的毫克/升来表示。
化学需氧量反映了水中受还原性物质污染的程度。
水中还原性物质包括有机物、亚硝酸盐、亚铁盐、硫化物等。
水被有机物污染是很普遍的,因此化学需氧量也作为有机物相对含量的指标之一。
水样的化学需氧量,可受加入氧化剂的种类及浓度,反应溶液的酸度、反应温度和时间,以及催化剂的有无而获得不同的结果。
因此,化学需氧量也是一个条件性指标,必须严格按操作步骤进行。
重铬酸钾法(5分钟回流)概述1.原理在强酸性溶液中,一定量的重铬酸钾氧化水样中还原性物质,过量的重铬酸钾以试亚铁灵作指示剂、用硫酸亚铁铵溶液回滴。
根据用量算出水样中还原性物质消耗的量。
2.干扰及其消除酸性重铬酸钾氧化性很强,可氧化大部分有机物,加入硫酸银作催化剂时,直链脂肪化合物可完全被氧化,而芳香族有机物却不易被氧化,吡啶不被氧化,挥发性直链脂肪族化合物、苯等有机物存在于蒸气相,不能与氧化剂液体接触,氧化不明显。
氯离子能被重铬酸钾氧化,并且能与硫酸银作用产生沉淀,影响测定结果,故在回流前向水样中加入硫酸汞,使成为络合物以消除干扰。
氯离子含量高于2000mg/L的样品应先作定量稀释、使含量降低至2000mg/L以下,再行测定。
3.方法的适用范围用0.1mol/L浓度的重铬酸钾溶液可测定大于50mg/L的COD值。
仪器1.回流装置:带250ml锥形瓶的全玻璃回流装置。
2.加热装置:可调电炉。
3.25ml酸式滴定管。
试剂(1)重铬酸钾标准溶液(1/6K2Cr2O7=0.1000mol/L):称取预先在120℃烘干2h的基准重铬酸钾4.9030溶于蒸馏水中,移入1000ml容量瓶,稀释至标线,摇匀。
(2)试亚铁灵作指示剂:称取 1.485g邻菲罗啉(C12H8N2·H2O,1,10-phenanthnooline),0.695g硫酸亚铁(FeSO4·7H2O)溶于水中,稀释至100ml,贮于棕色瓶内。
重铬酸钾容量法测定亚铁知识要点一、重铬酸钾法测定亚铁原理将样品隔绝空气使用盐酸分解后,二价铁以二苯胺磺酸钠为指示剂,用重铬酸钾标准溶液滴定至紫红色为终点,计算亚铁的含量。
与全铁测定所不同的是如何使试样分解完全,而在分解过程中又不致使亚铁氧化,是测定亚铁的关键。
试液以三氯化铁溶液浸取后,再加入盐酸使金属铁和亚铁均转入溶液。
以重铬酸钾容量法测得其合量,减去金属铁的量,即得亚铁的量。
二、试样的分解在分解测定亚铁的试样时,一般采用酸溶分解法。
常用的溶剂有盐酸、盐酸-氟化钠、氢氟酸-硫酸等。
为了防止Fe2+ 被空气氧化,需将体系与空气隔绝。
常用的方法是在CO2气氛中分解试样。
在分解试样时,加入碳酸氢钠,使产生二氧化碳气体以防止亚铁氧化。
三、干扰元素消除在亚铁的测定中,硫、锰是主要的干扰元素。
试样中含有硫化物时,被酸分解而产生硫化氢,可将部分三价铁还原为二价铁,使测定结果偏高。
用硫酸、氢氟酸和氯化汞的混合液分解试样,可以消除硫的干扰。
四价锰在试样被酸分解过程中会氧化二价铁,而使结果偏低。
在用酸分解时,加入Na2SO3或H2SO3将试样的高价锰还原为二价锰,然后进行Fe2+的测定。
四、注意事项1、为防止亚铁被氧化,锥形瓶干燥为好,称重后不可久置。
整个操作过程应迅速,分解试样时应保持微沸,不可中断,避免试液接触空气使亚铁离子氧化,导致结果偏低。
2、分解试样时,不得加入硝酸及其它氧化性物质,防止结果偏低。
3、为避免二价铁被空气氧化,试样分解时加入少量碳酸氢钠,它与稀盐酸生成大量的二氧化碳,达到隔绝空气的目的。
4、本法不适用于含硫高的试样,因在溶样过程中生成的硫化氢,能将三价铁还原为二价铁,导致结果偏高。
5、其它还原性态物质和高价锰等氧化态物质对本法存在干扰。
铁矿石中铁的测定及重铬酸钾滴定法铁是地球上分布最广的金属元素之一,在地壳中的平均含量为5%,在元素丰度表中位于氧、硅和铝之后,居第四位。
自然界中已知的铁矿物有300多种,但在当前技术条件下,具有工业利用价值的主要是磁铁矿(Fe3O4含铁72.4%)、赤铁矿(Fe2O3含铁70.0%)、菱铁矿(FeCO3含铁48.2%)、褐铁矿(Fe2O3·nH2O含铁48%~62.9%)等。
铁矿石是钢铁工业的基本原料,可冶炼成生铁、熟铁、铁合金、碳素钢、合金钢、特种钢等。
用于高炉炼铁的铁矿石,要求其全铁TFe(全铁含量)≥50%,S≤0.3%,P≤0.25%,Cu≤0.2%,Pb≤0.1%,Zn≤0.1%,Sn≤0.08%,而开采出来的原矿石中铁的品位一般只有20%~40%.通过选矿富集,可将矿石的品位提高到50%~65%。
我国每年从国外进口大量商品铁矿石。
铁矿石的常规分析是做简项分析,即测定全铁(TFe)、亚铁、可溶铁、硅、硫、磷。
钱分析还要测定:氧化铝、氧化钙、氧化镁、氧化锰、砷、钾、钠、钒、铁、铬、镍、钴,铋、银、钡、锶、锂、稀有分散元素。
吸附水、化合水、灼烧减量及二氧化碳等。
本节着重介绍全铁的测定。
一、铁矿石试样的分解铁矿石属于较难分解的矿物,分解速度很慢,分析试样应通过200目筛,或试样粒度不大于0.074mm。
铁矿石一般能被盐酸在低温电炉上加热分解,如残渣为白色,表明试样分解完全若残渣有黑色或其它颜色,是因为铁的硅酸盐难溶于盐酸,可加入氢氟酸或氟化铵再加热使试样分解完全,磁铁矿的分解速度很慢,可用硫-磷混合酸(1+2)在高温电炉上加热分解,但应注意加热时间不能太长,以防止生成焦磷酸盐。
部分铁矿石试样的酸分解较困难,宜采用碱熔法分解试样,常用的熔剂有碳酸钠、过氧化钠、氢氧化钠和过氧化钠-碳酸钠(1+2)混合熔剂等,在银坩埚、镍坩埚、高铝坩埚或石墨坩埚中进行。
碱熔分解后,再用盐酸溶液浸取。
二、铁矿石中铁的分析方法概述铁矿石中铁的含量较高,一般在20~70%之间,其分析方法有氯化亚锡-氯化汞-重铬酸钾容量法,三氯化钛-重铬酸钾容量法和氯化亚锡-氯化汞-硫酸铈容量法。
立志当早,存高远重铬酸甲容量法测定铁矿石中的亚铁铁矿中的亚铁是指磁铁矿、菱铁矿及一些硅酸盐中的亚铁,不包括硫化物矿物中的亚铁。
所以当分析含有硫铁矿试样中的亚铁时,试样的分解比较复杂,最好能控制一定酸量和时间,以免部分硫铁矿分解而引起误差。
试样置于锥瓶中,在有二氧化碳气体保护下,以盐酸和氟化钠在高温电热板上溶解。
瓶口塞以封闭漏斗(见图),使与空气隔绝。
溶解完全后,加硼酸除去氟的干扰。
加入硫—磷混合酸和指示剂,用重络酸钾标准溶液滴定。
不烘样),置于250 毫升锥瓶中,加入2 克碳酸氢钠,1 克氟化钠,加2∶1盐酸30 毫升,立即盖上盛有碳酸氢钠饱和溶液的封闭漏斗(或特别的变管玻璃),摇动瓶中的试样,勿使粘结瓶底。
在高温电热板上保持微沸15~20 分钟,并摇动2~3 次,取下,在水槽中冷却。
用水洗瓶壁,用新煮沸并已冷却的蒸馏水稀释体积至150 毫升,迅速加入5%硼酸溶液10 毫升,加硫—磷混合酸15 毫升及二笨胺磺酸钠指示剂2 滴,以重络酸钾标准溶液滴定至溶液呈稳定蓝紫色,即为终点。
换算因数:1 毫克铁相当于1.2865 毫克氧化亚铁(FeO)。
二、难溶矿亚铁的测定称取0.2~0.5 克试样(100 筛目,不烘样),置于铂坩埚中,加水润湿。
加已预热至近沸的1∶1 硫酸10 毫升,氢氟酸5 毫升,盖上铂坩埚盖,迅速加热到微沸并保持8~10 分钟。
待试样分解后,将坩埚迅速移入预先盛有200 毫升水的烧杯中(内含有25 毫升饱和硼酸),加硫—磷混合酸15 毫升、二笨胺磺酸钠指标剂2 滴,用重铬酸钾标准溶液滴定。
三、含硫化物铁矿中亚铁的测定试样用溴—甲醇处理,使硫化物氧化为硫酸盐。
本法适用于含少量硫化物(<5%)的试样。
称取0.2 克试样(140 筛目,不烘样),置于50 毫升烧杯中,加入甲醇20 毫升、溴水1 毫升,盖上表皿。
置于电磁搅拌器上搅拌1 小时,然后用铺有精制石棉的玻璃漏斗过。
重铬酸钾法测定亚铁盐中铁含量
重铬酸钾法是一种常用的化学分析方法,用于测定亚铁盐中铁的含量。
该方法基于亚铁离子与重铬酸钾的反应,通过滴定计算出铁的含量。
具体操作步骤如下:
1. 准备试剂:取一定量的重铬酸钾固体,用盐酸溶解并定容至1000mL,即得到 1mol/L 的重铬酸钾溶液。
同时准备体积比为 1:1 的硫酸和氢氧化钠溶液,以备滴定使用。
2. 实验操作:取 10mL 待测样品,加入烧杯中,加入适量盐酸溶解,然后用氢氧化钠溶液调节溶液 pH 至 8-9,用玻棒搅拌。
3. 将玻棒上的样品倒入滴定瓶中,加入 2mL 重铬酸钾溶液,用盐酸溶液润洗滴定瓶和玻棒,然后将滴定瓶插入滴定管中,用氢氧化钠溶液滴定至溶液颜色由橙红色变为无色,并保持 30 秒不褪色。
4. 计算铁含量:根据滴定液的体积和重铬酸钾的浓度,可以计算出待测样品中铁的含量。
具体计算公式为:
铁含量 (mg/L) = (V1 × C1) / M
其中,V1 为滴定液的体积,C1 为重铬酸钾的浓度,M 为摩尔质量。
拓展:
重铬酸钾法测定亚铁盐中铁含量的优点是操作简便,灵敏度高,准确度好。
该方法广泛应用于地质、采矿、化工、医药等领域中的亚铁盐中铁含量的测定。
同时,该方法对样品的前处理要求不高,可以
适用于各种亚铁盐样品的检测。
重铬酸钾法测定亚铁盐中铁的含量课程名称:化学实验Ⅰ⑵课程类型:专业基础课(总54学时)考试时间:2学时实验药品:1、硫酸亚铁铵(S):分装在称量瓶中,存放在干燥器中备用。
2、重铬酸钾(S):分装在称量瓶中,存放在干燥器中备用。
3、二苯胺磺酸钠(0.2%):分装在滴瓶中。
4、硫-磷混合酸:分装在250ml试剂瓶中。
配制方法:将150ml浓硫酸加入700ml水中,冷却后,加入150ml浓磷酸。
实验仪器:分析天平、酸式滴定管、滴定管架、滤纸条、锥形瓶、量杯(50ml) 、洗瓶、实验设计:1.学生依据所学知识,做出实验方案。
2.准却称取重铬酸钾固体1.2-1.3g于烧杯中,加入适量的蒸馏水,溶解,转移至250ml容量瓶中,定容,按下式计算其准却浓度:m(K2Cr2O7)c(1/6K2Cr2O7)=——————————————V(K2Cr2O7)×M(1/6K2Cr2O7)3.在酸式滴定管中加入重铬酸钾溶液。
4.准确称取0.8-1.2g硫酸亚铁铵,置于锥形瓶中,加入50ml蒸馏水溶解,再加入15ml硫-磷混合酸。
5.加入5-6滴二苯胺磺酸钠,滴定至红色,记下所消耗重铬酸钾溶液的体积,平行测定三次。
6.据下式计算硫酸亚铁铵中铁的含量:c(1/6K2Cr2O7) V(K2Cr2O7)M(Fe)w(Fe)=————————————————m计算测定结果的相对偏差,要求相对平均偏差不大于0.2%。
亚铁离子的测定
1 范围
本标准适用于溶液中亚铁离子的测定。
2 方法提要
在硫磷混酸介质中,以二苯胺磺酸钠为指示剂,用重铬酸钾标准滴定溶液滴定到溶液呈紫色为终点。
3 试剂
硫磷混酸(1+1)。
二苯胺磺酸钠(5g/L)(配制时加几滴浓硫酸)。
重铬酸钾标准滴定溶液【c(K2Cr2O7)= L】:称取预先在120℃烘至恒重的基准重铬酸钾2.4516g溶于水,移入1000mL容量瓶中,以水定容,摇匀。
4 分析步骤
取移液管,用洗耳球吸取适量待测溶液,对移液管进行润洗,重复3次;
准确移取试液置于250mL锥形瓶中,加入10mL硫磷混酸,摇匀,加水至约100mL,加4滴二苯胺磺酸钠指示剂;
取滴定管,加入重铬酸钾标准溶液,并准确调整至0刻度;
右手拿锥形瓶,左手掌握滴定管,用重铬酸钾标准滴定溶液滴定至溶液呈紫色为终点。
(注意在滴定时,重铬酸钾标准溶液是一滴一滴的加入);
滴定完成后读数,得出消耗重铬酸钾的体积V。
5分析结果的计算
按下式计算亚铁离子的质量浓度ρ
ρρ2+
,数值以g/L表示:
ρ
ρρ2+=
ρ
ρ2ρρ2ρ7
6
1
×ρ×55.84
2
式中
ρρ2ρρ2ρ76
1 ——1/6重铬酸钾标准滴定溶液的浓度,mol/L ; V ——试液滴定时消耗重铬酸钾标准滴定溶液的体积,mL 。
测定结果表示至两位小数。
6注意事项
取样后尽快测定,免得空气氧化。
亚铁的测定(重铬酸钾容量法)
1、方法提要:
试样在二氧化碳气氛中,经盐酸分解,加入硫-磷混合酸,以二苯胺磺酸钠作指示剂,用重铬酸钾标准溶液滴定至稳定的紫色。
反应如下:
FeO + 2HCl → FeCl 2 + H 2O
6FeCl 2 + K 2Cr 2O 7 + 14HCl → 6FeCl 3 + 2KCl + 2CrCl 3 + H 2O
2、试剂:
1) 盐酸;
2) 碳酸氢钠;
3) 二苯胺磺酸钠指示剂(5g/L);
4) 硫-磷混合酸(3+3+14);
5) 重铬酸钾标准溶液:C(1/6K 2Cr 2O 7)=0.01392mo1/L :称取在150-170℃烘干的基准重铬酸钾1.3650g ,用水溶解后移入2000mL 容量瓶中,用水稀释至刻度,摇匀,备用;
3、分析方法:
称取0.1000-0.2000g 试样于150mL 锥形瓶中,加少许水润湿,加入2-3g 碳酸氢钠,加15mL 盐酸,加盖瓷坩埚盖,在电炉上加热分解,并保持微沸状态10分钟,取下迅速冷却至室温,用水稀释至50-60mL ,加10mL 硫-磷混合酸,加二苯胺磺酸钠指示剂 2滴,用重铬酸钾标准溶液滴定至稳定的紫色出现即为终点。
同批带试剂空白。
计算公式:
ω(FeO)/10-2= ×100
式中:
C :重铬酸钾标准溶液的浓度(mol/L); C × (V-V 0)×M×10-3 m s
M(FeO):氧化亚铁的摩尔质量(g/mol);
V:滴定试样消耗重铬酸钾标准溶液的体积(mL);
V0:滴定试剂空白消耗的重铬酸钾标准溶液的体积(mL);
m s:取样量(g)。
4、注意事项:
1) 试样粒度只要求100目,并不需要烘样;
2) 溶样温度不宜过高,防止亚铁被氧化;
3) 溶样时间、温度均应控制一致,每次分析试样不宜过多;
4) 分解试样应在二氧化碳气氛中进行,若碳酸氢钠已反应完可补加一些;
5) 试样分解后应立即稀释进行滴定,防止亚铁被氧化;
6) 若铁矿中含锰>1.0%,由于高价锰在溶矿中能使亚铁氧化,使结果偏低,可加入亚硫酸,消除干扰。