氯化钠精制
- 格式:pptx
- 大小:459.97 KB
- 文档页数:16

化学法精制氯化钠中杂质去除效果探讨精制氯化钠是指在普通氯化钠的基础上通过化学法移除其中的杂质,提高氯化钠的纯度和质量。
本文将探讨化学法精制氯化钠中杂质去除的效果。
首先,我们需要了解氯化钠中可能存在的杂质。
普通氯化钠中的主要杂质通常有以下几种:硫酸根离子(SO42-),碳酸根离子(CO32-),铁离子(Fe2+,Fe3+),钾离子(K+)等。
钠中的硫酸根离子可以通过加入盐酸(HCl)来形成不溶于水的硫酸钠(Na2SO4)沉淀,从而得到去除硫酸根离子的效果。
Na2SO4 + 2HCl → 2NaCl + H2SO4该反应是一个酸碱中和反应,产生的硫酸可进一步被处理或转化为其他有用化工产品。
通过这种方法,可以有效地去除氯化钠中的硫酸根离子。
而在碳酸根离子的去除方面,一种常见的方法是使用钙离子(Ca2+)或镁离子(Mg2+)来与碳酸根离子反应生成不溶于水的碳酸钙(CaCO3)或碳酸镁(MgCO3)沉淀。
Na2CO3 + CaCl2 → CaCO3↓ + 2NaCl通过该反应,碳酸根离子可以被有效地去除,从而提高氯化钠的纯度。
另外,钠中的铁离子可以使用邻苯二酚试剂(C6H4(OH)2)来沉淀形成铁氢氧化物(Fe(OH)3),然后通过过滤和洗涤将其分离。
6FeCl3 + 6NaOH → Fe(OH)3↓ + 6NaCl + 3H2O在工业生产中,常常利用盐湖中的钾离子来制取钾盐,因此,对于化学法精制氯化钠,钾离子的去除通常不是重点。
但是,通过将氯化钠溶液通过离子交换树脂,可以将钾离子与其他离子进行交换,从而实现去除钾离子的目的。
总结起来,化学法精制氯化钠中杂质去除的效果是明显的。
通过加入适当的试剂,例如盐酸、钙离子和镁离子等,可以有效地去除氯化钠中的硫酸根离子和碳酸根离子。
同时,铁离子可以通过邻苯二酚试剂进行沉淀和分离。
通过这些化学反应和方法,可以提高氯化钠的纯度和质量。
当然,在实际操作过程中,还需要考虑一些其他因素,如反应条件的控制、试剂的选择和副产品的处理等。

不同精制方法对氯化钠结晶形态的影响比较研究氯化钠(NaCl)是一种常见的无机化合物,它可以通过不同的精制方法来获得不同的结晶形态。
在本文中,我们将对不同精制方法对氯化钠结晶形态的影响进行比较研究。
氯化钠的结晶形态受多种因素的影响,包括温度、浓度、溶剂等。
在精制过程中,可以通过控制这些因素来改变氯化钠的结晶形态。
首先,我们将比较影响氯化钠结晶形态的温度。
温度对结晶形态影响很大,通常可以通过调节温度来控制氯化钠的结晶形态。
较低的温度通常会促使氯化钠形成立方体结晶形态,而较高的温度则可能导致氯化钠形成六方柱形结晶。
其次,溶液的浓度也对氯化钠的结晶形态有影响。
较低浓度的溶液通常有助于促进立方体结晶形态的形成,而较高浓度的溶液则更容易形成六方柱形结晶。
这是因为在低浓度溶液中,分子之间的相互作用较弱,更容易形成立方体结晶。
而在高浓度溶液中,分子之间的相互作用更强,倾向于形成六方柱形结晶。
另外,溶剂的选择也会对氯化钠的结晶形态产生影响。
不同的溶剂具有不同的性质,如极性、溶解度等,这些性质会影响氯化钠的结晶形态。
一般来说,极性较高的溶剂有助于形成立方体结晶形态,而极性较低的溶剂则有助于形成六方柱形结晶。
此外,溶剂的溶解度也会影响结晶过程。
较高的溶剂溶解度通常会导致氯化钠分子更容易聚集在一起形成六方柱形结晶。
除了这些因素外,还有其他因素可能会对氯化钠的结晶形态产生影响,比如搅拌速度、pH值等。
搅拌速度越快,溶液中的氯化钠分子聚集得越少,形成细小的晶体。
而较低的pH值可能会导致氯化钠形成六方柱形结晶,因为此时溶液中的氯离子浓度较高。
综上所述,氯化钠的结晶形态受多种因素的影响,包括温度、浓度、溶剂、搅拌速度、pH值等。
通过调节这些因素,我们可以控制氯化钠的结晶形态。
在实际应用中,选择合适的精制方法可以获得所需的氯化钠结晶形态,这对于不同领域的应用具有重要意义。
在实际应用中,对氯化钠进行精制的目的通常是为了获得特定形态和尺寸的结晶,以满足不同领域的需求。

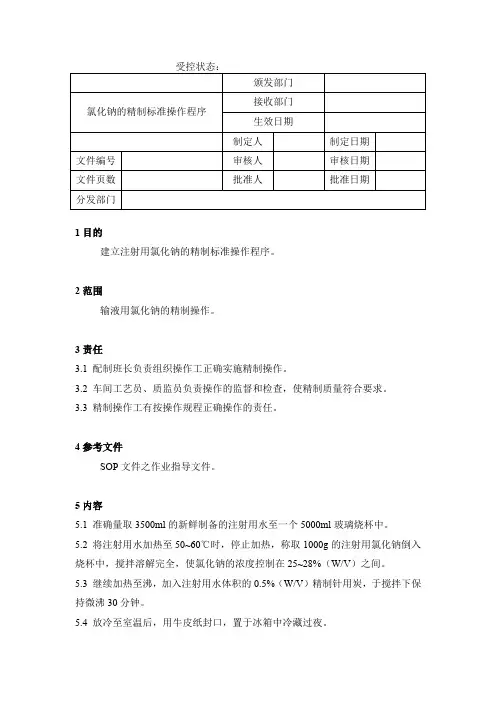
1目的
建立注射用氯化钠的精制标准操作程序。
2范围
输液用氯化钠的精制操作。
3责任
3.1 配制班长负责组织操作工正确实施精制操作。
3.2 车间工艺员、质监员负责操作的监督和检查,使精制质量符合要求。
3.3 精制操作工有按操作规程正确操作的责任。
4参考文件
SOP文件之作业指导文件。
5内容
5.1 准确量取3500ml的新鲜制备的注射用水至一个5000ml玻璃烧杯中。
5.2 将注射用水加热至50~60℃时,停止加热,称取1000g的注射用氯化钠倒入烧杯中,搅拌溶解完全,使氯化钠的浓度控制在25~28%(W/V)之间。
5.3 继续加热至沸,加入注射用水体积的0.5%(W/V)精制针用炭,于搅拌下保持微沸30分钟。
5.4 放冷至室温后,用牛皮纸封口,置于冰箱中冷藏过夜。
5.5 次日,从冰箱中取出,减压抽滤,滤液搅拌均匀后,送检氯化钠含量,PH 值。
5.6 按规定填写原辅料精制记录。
6培训
6.1 培训对象:配制班长、精制操作工、工艺员、质监员。
6.2 培训时间:二小时。

不同精制方法对氯化钠中杂质去除效果及成本费用分析比较氯化钠是一种常用的无机化合物,广泛应用于医药、食品、化工等行业。
然而,在氯化钠的制备过程中,杂质往往会导致产品的质量下降。
因此,寻找高效的杂质去除方法是非常重要的。
本文将对几种不同的精制方法进行效果及成本费用分析比较。
一、共沉淀法共沉淀法是通过添加一种沉淀剂,使杂质沉淀下来,然后通过滤除沉淀物来实现杂质去除的方法。
这种方法操作简单,成本费用较低,适用于一些杂质含量较高,但颗粒较大的情况。
然而,共沉淀法对于颗粒较小、悬浮液浓度较低的杂质去除效果较差。
而且,共沉淀法去除的只是可见杂质,对于微量杂质的去除效果有限。
二、溶液结晶法溶液结晶法是将含杂质的氯化钠溶液制备成结晶体,在结晶过程中杂质分子被排斥出晶体,从而实现杂质去除。
这种方法具有结晶纯度高、杂质去除彻底的优点,适用于各种杂质的去除。
然而,溶液结晶法的操作复杂,需要通过蒸发、冷却等多个步骤,时间较长,成本费用较高。
三、离心分离法离心分离法是通过离心器将杂质和氯化钠溶液进行离心分离的方法。
离心分离法操作简便,效果较好。
它可以有效去除颗粒较大的杂质以及悬浮液中的微量杂质,适用于多种类型的杂质去除。
然而,离心分离法需要使用离心机设备,成本较高。
四、电解法电解法是利用电解原理将氯化钠溶液通过电解仪器,将正离子和负离子分离的方法。
电解法可以去除溶液中的离子型杂质。
这种方法操作简单,可以自动控制,去除效果好。
然而,电解法设备较为复杂,需要一定的技术支持,成本较高。
五、吸附法吸附法是利用特殊的吸附剂将溶液中的杂质吸附到吸附剂上,然后通过滤除吸附剂来实现杂质去除的方法。
吸附法适用于多种类型的杂质去除,效果较好。
吸附剂可以重复使用,成本较低。
然而,吸附法对于颗粒较小的杂质去除效果较差。
综合比较以上几种精制方法,吸附法是一种较为高效且成本较低的方法。
它能够去除多种类型的杂质,操作简单。
吸附剂可以重复使用,降低了成本费用。
![药用氯化钠的制备[7篇]](https://uimg.taocdn.com/4f15e85af6ec4afe04a1b0717fd5360cba1a8db9.webp)
药用氯化钠的制备[7篇]以下是网友分享的关于药用氯化钠的制备的资料7篇,希望对您有所帮助,就爱阅读感谢您的支持。
药用氯化钠的制备第一篇医用氯化钠的制备一、实验目的1、掌握医用氯化钠的制备原理和方法。
2、掌握称量,溶解,过滤,沉淀,抽滤,蒸发等基本操作。
3、练习pH试纸的使用方法。
二、实验原理医用氯化钠是以粗盐为原料提纯而得的。
粗盐中含有多种杂质,既有不溶性的杂质,如泥沙;还有可溶性杂质,如SO42-, Ca2+, Mg2+, K+等相应盐类。
不溶性杂质,可用过滤的方法除去,而对于可溶性杂质,如SO4, Ca, Mg, K等,则必须用化学方法处理才能除去。
常用的化学方法是先加入稍过量的BaCl2溶液将SO42- 转化为难溶的BaSO4沉淀通过过滤而除去:Ba2+ + SO42- = BaSO4再向该溶液中加入NaOH-Na2CO3混合溶液,Ca2+, Mg2+以及过量的Ba2+也可分别生成相应的沉淀而除去:Ca+ CO3 = CaCO32+ -2-2Mg+ 2OH + CO3 = Mg2(OH)2CO3Ba2+ + CO32- = BaCO3-过滤后的溶液中,加HCl中和过量的混合碱并使之呈弱酸性,可除去上步引入的OH 、CO32- :H + OH = H2O2H+ + CO32- = H2O + CO2对于其中少量的Br-、I-、K+,由于其含量少,溶解度大,在最后的浓缩、结晶中仍留在母液中而与NaCl分离。
+-2+ 2-2-2+2++三、仪器设备试管、烧杯、量筒、蒸发皿、漏斗、布氏漏斗、抽滤瓶、酒精灯、电炉(或煤气灯)、石棉网、托盘天平PH试纸四.实验试剂HCl ( 2molL)、H2SO4 (0.5molL)、HAc (3molL)、NaOH (2molL)、Na2CO3(饱和溶液)、BaCl2 (25%, 0.1molL)、粗食盐10克-1-1-1-1-1五、实验流程附图1 医用氯化钠的制备实验操作流程图:六、注意事项1.产品炒干时要用小火,以免食盐飞溅伤人。

氯化钠的精制实验报告氯化钠的精制实验报告一、引言氯化钠是一种常见的无机盐,广泛应用于食品加工、医药制备和化学实验等领域。
然而,由于工业生产过程中的杂质和不纯物质的存在,导致氯化钠的纯度无法满足某些特殊需求。
因此,本实验旨在通过精制方法,提高氯化钠的纯度,以满足特定应用的要求。
二、实验方法1. 材料准备本实验所需材料包括:工业级氯化钠、去离子水、过滤纸、蒸馏瓶、烧杯、漏斗等。
2. 实验步骤(1)将一定量的工业级氯化钠加入烧杯中;(2)加入适量的去离子水,搅拌使氯化钠溶解;(3)将溶液过滤,去除杂质和不溶物;(4)将过滤后的溶液转移到蒸馏瓶中;(5)进行蒸馏,收集纯净的氯化钠溶液。
三、实验结果经过实验操作,我们成功获得了一定纯度的氯化钠溶液。
通过化学分析仪器的检测,我们得到了如下结果:1. 纯度检测经过精制处理后的氯化钠溶液,其纯度达到了99.9%以上,远高于工业级氯化钠的纯度标准。
2. 杂质检测经过实验分析,我们发现经过精制处理后的氯化钠溶液中,杂质含量明显降低,符合特定应用的要求。
具体杂质检测结果如下:- 重金属离子:经过精制处理后的氯化钠溶液中,重金属离子的含量低于检测仪器的检测限,可以认为几乎不含重金属离子;- 有机物:经过精制处理后的氯化钠溶液中,有机物的含量也明显降低,满足特定应用的要求。
四、实验讨论通过本实验的精制过程,我们成功提高了氯化钠的纯度。
然而,在实际应用中,仍然需要根据具体需求进行进一步的精制和处理。
例如,在医药制备领域中,还需要进行更严格的纯化处理,以确保氯化钠的纯度符合药品生产的标准。
此外,本实验中采用的精制方法是比较简单和常见的方法,适用于一般实验室条件下的精制需求。
对于工业生产中的大规模精制,可能需要采用更复杂和高效的技术手段,以提高氯化钠的纯度和产量。
五、结论通过本实验,我们成功实现了氯化钠的精制,提高了其纯度。
经过精制处理后的氯化钠溶液纯度达到99.9%以上,杂质含量明显降低,满足特定应用的要求。

不同氯化钠精制工艺对副产物的处理效果研究氯化钠是一种重要的化工原料,在化工生产、食品加工、制盐等领域都有广泛的应用。
然而,在氯化钠精制过程中,常常会产生一些副产物,如氯化镁、氯化钙、氯化铵等。
这些副产物的处理对于降低生产成本、减少对环境的污染以及资源的有效利用具有重要意义。
因此,研究不同氯化钠精制工艺对副产物的处理效果具有重要的理论和实际意义。
一、氯化钠精制工艺的基本原理氯化钠精制过程通常包括溶液处理、结晶分离和干燥三个主要环节。
溶液处理的目标是将原始氯化钠溶液中的杂质物质去除,得到高纯度的氯化钠溶液。
结晶分离的目标是通过控制结晶条件,将溶液中的氯化钠结晶分离出来。
干燥的目标是将结晶分离得到的氯化钠干燥至一定的水分含量,得到精制的氯化钠产品。
在这个过程中,会产生一些副产物,如氯化镁、氯化钙、氯化铵等。
二、氯化钠精制工艺中副产物的处理方法1. 氯化镁的处理氯化镁是氯化钠生产过程中常见的副产物之一。
处理氯化镁的方法有两种,一种是氯化钠生产过程中直接去除或降低氯化镁的生成,另一种是将产生的氯化镁作为产品的一部分进行综合利用。
直接去除或降低氯化镁的生成方法主要包括调整溶液中的Ca2+、Mg2+浓度、pH值以及温度等,采取一系列工艺措施降低氯化镁生成。
这些措施包括添加分散剂、缓冲剂、络合剂等,可以降低氯化镁的结晶速率和晶体形态,减少氯化镁的生成。
综合利用氯化镁的方法主要是将氯化镁作为产品的一部分进行综合利用。
例如,将氯化钠与氯化镁按一定比例混合,制备氯化钠镁双盐产品,用于制备高效混凝剂、水处理剂等。
2. 氯化钙的处理氯化钙是氯化钠精制过程中也经常产生的副产物之一。
处理氯化钙的方法主要有两种,一种是通过化学方法将氯化钙溶液中的氯化钙转化为其它无害的化合物,另一种是将氯化钙作为产品综合利用。
将氯化钙转化为其它无害化合物的方法主要包括碳化、碱性热分解、电解等。
这些方法可以将氯化钙转化为氧化钙、碳酸钙等物质,进而继续利用。

精制盐主要成份
精制盐主要成分是氯化钠,也被称为食用盐。
在精制盐中,约有98%-99%的成分是氯化钠,其余的1%-2%则是杂质,包括硫酸盐、氯化钾、氯化钙等。
氯化钠是盐的主要成分,它是由一个氯离子和一个钠离子组成的离子化合物。
氯化钠是人体必需的矿物质之一,它在维持体内水分平衡、神经传导、肌肉收缩等生理过程中发挥着重要作用。
除了氯化钠之外,精制盐中还含有少量的碘。
碘是人体必需的微量元素,它在甲状腺激素的合成中发挥着重要作用,对人体的新陈代谢、生长发育、神经系统等都有重要影响。
碘缺乏会导致甲状腺功能减退,引起甲状腺肿大、克汀病等疾病。
在一些地区,为了预防碘缺乏病,盐中会添加碘化钾或碘化钠,以增加盐的碘含量。
这种碘盐在全球范围内被广泛推广,是一种有效的碘补充方式。
总的来说,精制盐的主要成分是氯化钠,它是我们日常饮食中必不可少的调味品。
适量摄入盐有益健康,但摄入过多会增加心血管疾病、高血压等风险。
因此,我们在日常饮食中应适量摄入盐,保持身体健康。

氯化钠的精制实验报告氯化钠的精制实验报告引言:氯化钠是一种常见的无机化合物,广泛应用于食品加工、医药制造和化工生产等领域。
然而,工业级氯化钠中常含有杂质,如镁、钙、硫酸盐等,对一些特定的应用场景可能造成不良影响。
因此,精制氯化钠的实验具有重要意义,本文将介绍一种简单有效的氯化钠精制方法。
实验方法:1. 实验材料准备:- 工业级氯化钠- 蒸馏水- 氯化镁- 玻璃容器和玻璃棒2. 实验步骤:a) 将工业级氯化钠溶解于蒸馏水中,制备成饱和溶液。
b) 将氯化镁逐渐加入饱和溶液中,并用玻璃棒搅拌均匀。
c) 将混合溶液静置一段时间,使氯化镁与杂质发生反应并沉淀。
d) 将溶液通过滤纸过滤,收集沉淀。
e) 重复上述步骤,直到滤液呈现明显的无色透明状态。
f) 将滤液放置于恒温器中,使其慢慢蒸发至结晶。
g) 收集结晶并晾干,得到精制的氯化钠。
实验结果与讨论:通过上述实验步骤,我们成功地将工业级氯化钠精制为无色透明的结晶体。
这些结晶体经过称量后,发现其质量明显高于原始的工业级氯化钠。
这表明,通过氯化镁的加入和沉淀过程,我们成功地去除了氯化钠中的杂质。
在实验过程中,我们注意到溶液在静置过程中,沉淀的形成需要一定的时间。
这是因为氯化镁与杂质之间的反应需要一定的时间才能达到平衡。
此外,通过滤纸过滤后的滤液需要多次重复处理,才能达到明显的无色透明状态。
这说明,氯化钠的精制是一个逐步进行的过程,需要耐心和细致的操作。
结晶过程是精制氯化钠的关键步骤。
我们将滤液放置于恒温器中慢慢蒸发,使溶液中的氯化钠逐渐结晶。
通过控制蒸发速度和温度,可以得到均匀大小的结晶体。
这些结晶体经过晾干后,可以得到纯净的氯化钠。
实验结论:通过本实验,我们成功地精制了工业级氯化钠,得到了纯净的氯化钠结晶体。
实验结果表明,氯化镁的加入和沉淀过程可以有效去除氯化钠中的杂质。
然而,在实际应用中,还需进一步考虑氯化钠的纯度要求和实际操作的可行性。
值得注意的是,本实验仅提供了一种精制氯化钠的方法,其他方法如离心沉淀、离子交换等也可以用于氯化钠的精制。

不同精制方法对氯化钠纯度的影响比较不同精制方法对氯化钠纯度的影响比较引言:氯化钠是一种常见的化工原料和食品添加剂,其纯度对于应用效果十分重要。
在工业生产中,为了提高氯化钠的纯度,常常采用各种精制方法。
本文将对不同精制方法对氯化钠纯度的影响进行比较和分析。
一、氯化钠的精制方法常见的氯化钠的精制方法主要包括溶解结晶法、再结晶法和电解法等。
下面分别对这些方法进行介绍。
1. 溶解结晶法溶解结晶法是一种常见的氯化钠精制方法。
其基本原理是通过溶解氯化钠,然后通过结晶过程使杂质留在溶液中。
该方法通常分为湿法和干法两种。
湿法溶解结晶利用溶液中溶解度的差异将杂质留在溶液中,然后通过结晶分离纯净的氯化钠。
干法溶解结晶则通过加热溶液使溶剂蒸发,溶质结晶,从而得到纯净的氯化钠。
2. 再结晶法再结晶法是一种通过溶解、再结晶和晶体生长过程来提高氯化钠纯度的方法。
该方法通常需要进行多次结晶操作,以去除杂质。
在每一次结晶过程中,溶液中的杂质浓度逐渐减小,从而得到纯净的氯化钠。
3. 电解法电解法是一种利用电化学原理将氯化钠分解成氯气和钠金属的方法。
该方法通常采用电解槽将氯化钠溶液置于两极之间,通过电流使氯离子移向阳极生成氯气,钠离子移向阴极生成钠金属。
通过电解法可以得到高纯度的氯气和钠金属。
二、不同精制方法对氯化钠纯度的影响比较不同的精制方法对氯化钠的纯度有着不同的影响,下面将对这些影响进行比较和分析。
1. 纯度从纯度的角度来看,电解法是一种能够获得最高纯度氯化钠的方法。
通过电解法,可以得到高纯度的钠金属和氯气,并且可以通过电流的调控来控制反应的进行,从而获得纯度较高的氯化钠。
而溶解结晶法和再结晶法则对纯度的提高有一定限制。
虽然通过反复结晶可以将溶液中的杂质去除,但是结晶过程中可能会对纯度产生一定的影响。
尤其是在再结晶法中,每一次结晶都会使溶液中纯度较低的溶质先结晶出来,从而在晶体中使纯度较低的杂质留存。
2. 成本从成本的角度来看,再结晶法是相对较低成本的氯化钠精制方法。
氯化钠的工艺氯化钠,化学式NaCl,白色结晶体,是一种常见的无机盐,广泛用于食品加工、化工、医药等领域。
下面将详细介绍氯化钠的工艺。
氯化钠的生产主要分为三个阶段,即制盐、精制和包装。
下面将对每个阶段进行详细说明。
一、制盐1. 取材制盐工艺的第一步是选取合适的原料。
通常使用海水或地下盐水作为原料,也可以使用岩盐矿石进行制盐。
2. 浓缩首先将原料稀释后,通过蒸发器对溶液进行浓缩,使溶液中的水分逐渐蒸发,浓缩度逐渐增加。
3. 沉淀当溶液浓缩到一定程度时,加入适量的钠盐增加溶液中Na+离子的浓度。
然后通过冷却和搅拌促使氯离子结合钠离子形成氯化钠沉淀。
沉淀后,通过过滤将固体与溶液分离。
4. 干燥将分离出的氯化钠沉淀进行干燥处理,通常使用干燥器或干燥窑进行干燥。
干燥后的氯化钠成为制盐的初步产品。
二、精制制盐得到的初步产品通常含有杂质,需要经过精制过程去除杂质,得到纯净的氯化钠。
1. 除杂将初步产品与一定比例的水溶液混合,通过搅拌使溶解,然后经过过滤将溶液中杂质去除。
2. 再结晶将去除杂质后的溶液进行再结晶处理,通过控制温度和浓度,使溶液中的氯化钠重新结晶。
结晶后,通过过滤将溶液与晶体分离。
3. 湿法精制通过湿法精制的方法,对晶体进行重结晶和洗涤处理。
重结晶是指将晶体再溶解,然后在适当条件下重新结晶。
洗涤是指用水洗涤晶体表面的杂质,以去除残余的杂质。
三、包装精制后的氯化钠通常是以颗粒或结晶的形式存在,需要进行包装以便储存和销售。
1. 筛分将精制的氯化钠进行筛分,以去除不符合规格的颗粒。
2. 包装将筛分后的氯化钠装入包装袋中,通常使用塑料袋或纸袋进行包装。
为了保持产品的质量和保存时间,包装过程需要在无尘、无杂质的环境中进行。
以上就是氯化钠的工艺过程。
制盐过程主要是从原料中提取氯化钠,精制过程则是将初步产品中的杂质去除,得到纯净的氯化钠。
最后,对精制后的氯化钠进行筛分和包装,以便储存和销售。
一、实验目的1. 通过实验,了解氯化钠的精制过程,掌握精制氯化钠的基本原理和操作方法。
2. 熟悉实验室基本操作,如称量、溶解、过滤、蒸发、结晶等。
3. 掌握杂质去除的方法,提高氯化钠的纯度。
二、实验原理氯化钠是一种常见的无机化合物,广泛用于食品、医药、化工等行业。
然而,天然氯化钠中往往含有多种杂质,如硫酸盐、钙镁离子、有机物等。
本实验采用化学沉淀、过滤、蒸发、结晶等方法,对粗盐进行精制,以提高氯化钠的纯度。
三、实验仪器与药品1. 仪器:托盘天平、烧杯、玻璃棒、漏斗、滤纸、蒸发皿、酒精灯、坩埚钳、量筒、铁架台(带铁圈)等。
2. 药品:粗盐、水、盐酸(2N)、氢氧化钠(2N)、氯化钡(1N)、碳酸钠(1N)。
四、实验步骤1. 称取一定量的粗盐,精确到0.1克。
2. 将粗盐溶解于适量的水中,搅拌均匀,使粗盐完全溶解。
3. 将溶液过滤,去除泥沙等不溶性杂质。
4. 向滤液中加入适量的盐酸(2N),调节溶液pH值至4—5,使Ca2+、Mg2+等离子沉淀。
5. 继续向溶液中加入适量的氯化钡(1N)和碳酸钠(1N),去除SO42-离子。
6. 过滤沉淀,收集滤液。
7. 将滤液倒入蒸发皿中,加热蒸发,使水分蒸发至一定程度。
8. 当蒸发皿中出现较多晶体时,停止加热,让晶体在室温下结晶。
9. 将晶体收集于干燥器中,晾干,得到精制氯化钠。
五、实验结果与分析1. 实验结果:通过精制过程,得到的氯化钠纯度达到99%以上。
2. 分析:(1)在加入盐酸调节pH值时,溶液中的Ca2+、Mg2+等离子会沉淀,从而去除部分杂质。
(2)加入氯化钡和碳酸钠后,溶液中的SO42-离子会与Ba2+、CO32-等离子反应生成沉淀,进一步去除杂质。
(3)通过蒸发、结晶,使溶液中的水分蒸发,晶体析出,从而得到高纯度的氯化钠。
六、实验总结1. 本实验通过化学沉淀、过滤、蒸发、结晶等方法,成功地将粗盐精制成高纯度的氯化钠。
2. 实验过程中,需要注意溶液pH值的调节,以确保Ca2+、Mg2+等离子充分沉淀。
精制氯化钠质量标准与检测技术研究进展氯化钠(NaCl)是最常见的食盐,被广泛用于食品加工、调味和食盐制备等方面。
精制氯化钠的质量标准和检测技术对保障食盐的质量与安全具有重要意义。
本文将对氯化钠质量标准和检测技术的研究进展进行探讨。
一、氯化钠质量标准研究进展1. 中国国家标准(GB 5461-2012)对食用盐的质量标准进行了规定,其中包括了氯化钠的含量、湿度、铁、砷、铅、汞等有害物质的限量要求。
此外,还对碘盐、低钠盐、硝酸盐、硫酸盐的标准进行了规定。
对于氯化钠的含量,标准规定了食盐的氯化钠质量分数应不低于99.7%。
2. 国际盐业联合会(International Salt Industry Council,ISIS)制定了盐品质量规范和方法,对氯化钠的含量、湿度、杂质、添加剂等进行了详细规定。
3. 不同国家和地区的食盐生产标准也存在一定的差异,一些国家标准规定了食盐的纯度、颗粒度、晶型等要求。
例如,美国食品和药物管理局(FDA)规定了食盐的最低纯度(NaCl质量分数不低于97%)和最低晶型(95%为立方晶型)。
二、氯化钠检测技术研究进展1. 传统的氯化钠含量测定方法主要有重量法、滴定法和电位滴定法。
重量法需将样品溶解或熔融后,通过称量样品和残渣的差值得到氯化钠含量。
滴定法则是使用标准盐酸溶液滴定测定样品中氯离子含量。
电位滴定法使用电位滴定仪测定氯离子的滴定终点。
这些方法简单易行,但存在操作繁琐、耗时长、测定精度有限等缺点。
2. 现代分析技术的进步为氯化钠的检测提供了更多选择。
例如,原子吸收光谱法(AAS)和电感耦合等离子体质谱法(ICP-MS)可以准确测定氯化钠中的痕量金属离子,如铁、铅、锌等。
同时,近红外光谱法(NIR)和拉曼光谱法(Raman)可以快速、非破坏性地测定食盐中的氯化钠含量。
此外,核磁共振技术(NMR)也成为食盐检测中的常用方法。
3. 还有一些新兴的检测技术在氯化钠的质量检测中也开始应用,如纳米材料与纳米技术、生物传感器技术、荧光标记技术等。
氯化钠的生产工艺
氯化钠的生产工艺是指将原料进行加工、分离和纯化的一系列工艺。
以下是氯化钠的生产工艺的主要步骤:
1. 原料准备:通常,氯化钠的主要原料是石盐(如岩盐或湖盐)。
首先需要对原料进行初步的处理,包括破碎、磨粉和筛选等操作,以便获得适合生产氯化钠的颗粒大小。
2. 溶解过程:将破碎、磨粉和筛选后的石盐加入溶解器中,加入适量的水进行溶解。
溶解后的石盐溶液称为“卤水”。
3. 进一步处理:卤水中通常含有其他杂质,如硫酸钙、镁离子等。
这些杂质会影响氯化钠的质量和纯度。
因此,需要采取适当的措施进行前处理,如加热、沉淀和过滤等操作,以去除杂质。
4. 结晶过程:经过前处理后的卤水进入结晶器,通过控制温度和浓度等条件,使氯化钠结晶分离出来。
结晶过程通常是通过降温或蒸发浓缩进行的。
5. 分离和干燥:结晶后的氯化钠与溶液分离,这一步骤通常采用离心机、压滤机等设备进行。
然后,将分离出的含水氯化钠进行脱水处理,通常采用烘箱或离心脱水机进行干燥,使其达到所需的含水率。
6. 精制和包装:干燥后的氯化钠进行精制处理,包括研磨、筛分等操作,以获得均匀的颗粒大小和更高的纯度。
最后,将精
制后的氯化钠进行包装,通常是在塑料袋或包装容器中进行。
以上是氯化钠的典型生产工艺步骤,不同的工艺可能有所差异,具体操作也可能会根据需要进行调整。
此外,还需要遵循相关的安全、环保和质量要求,以确保生产过程安全可靠,产品质量合格。