氯气的性质及其应用共33页文档
- 格式:ppt
- 大小:3.43 MB
- 文档页数:33
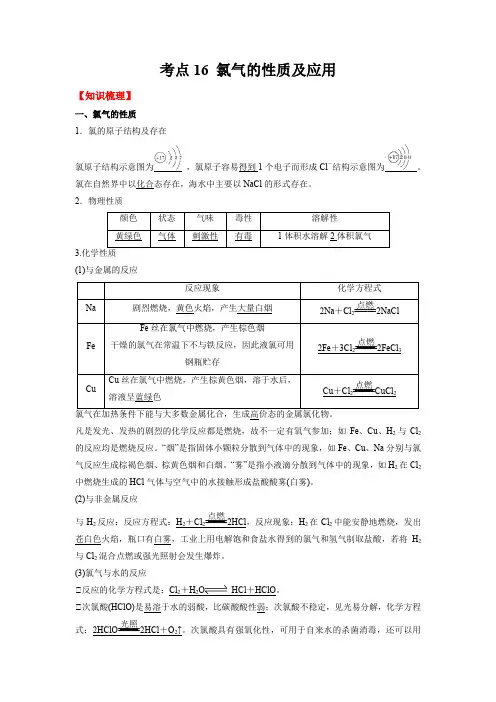
考点16 氯气的性质及应用【知识梳理】一、氯气的性质1.氯的原子结构及存在 氯原子结构示意图为 ,氯原子容易得到1个电子而形成Cl -结构示意图为。
氯在自然界中以化合态存在,海水中主要以NaCl 的形式存在。
2.物理性质颜色状态 气味 毒性 溶解性 黄绿色气体 刺激性 有毒 1体积水溶解2体积氯气 3.化学性质(1)与金属的反应反应现象 化学方程式 Na 剧烈燃烧,黄色火焰,产生大量白烟2Na +Cl 2=====点燃2NaCl Fe Fe 丝在氯气中燃烧,产生棕色烟干燥的氯气在常温下不与铁反应,因此液氯可用钢瓶贮存2Fe +3Cl 2=====点燃2FeCl 3 Cu Cu 丝在氯气中燃烧,产生棕黄色烟,溶于水后,溶液呈蓝绿色 Cu +Cl 2=====点燃CuCl 2 氯气在加热条件下能与大多数金属化合,生成高价态的金属氯化物。
凡是发光、发热的剧烈的化学反应都是燃烧,故不一定有氧气参加;如Fe 、Cu 、H 2与Cl 2的反应均是燃烧反应。
“烟”是指固体小颗粒分散到气体中的现象,如Fe 、Cu 、Na 分别与氯气反应生成棕褐色烟、棕黄色烟和白烟。
“雾”是指小液滴分散到气体中的现象,如H 2在Cl 2中燃烧生成的HCl 气体与空气中的水接触形成盐酸酸雾(白雾)。
(2)与非金属反应与H 2反应:反应方程式:H 2+Cl 2=====点燃2HCl ,反应现象:H 2在Cl 2中能安静地燃烧,发出苍白色火焰,瓶口有白雾,工业上用电解饱和食盐水得到的氯气和氢气制取盐酸,若将H 2与Cl 2混合点燃或强光照射会发生爆炸。
(3)氯气与水的反应①反应的化学方程式是:Cl 2+H 2O HCl +HClO 。
①次氯酸(HClO)是易溶于水的弱酸,比碳酸酸性弱;次氯酸不稳定,见光易分解,化学方程式:2HClO=====光照2HCl +O 2↑。
次氯酸具有强氧化性,可用于自来水的杀菌消毒,还可以用作漂白剂。
③新制氯水的多种成分决定了它具有多重性质,在不同的化学反应中,氯水中参与反应的微粒不同。

第五讲氯与其重要化合物的性质和应用一、知识梳理〔一〕氯气的性质与用途1.物理性质常温下,氯气是黄绿色、有刺激性、能溶于水、比空气重、易液化的有毒气体。
2.化学性质:氯气是化学性质很活泼的非金属单质。
〔1〕与金属反应〔与变价金属反应,均是金属被氧化成高价态〕如:①2Na+Cl2点燃2NaCl〔产生白烟〕②Cu+Cl2点燃CuCl2〔产生棕黄色的烟〕③2Fe+3Cl2点燃2FeCl3〔产生棕色的烟〕注:常温下干燥的氯气或液氯不与铁反应,所以液氯通常储存在钢瓶中。
〔2〕与非金属反应如:①H2+Cl2点燃2HCl〔发出苍白色火焰,有白雾生成〕——可用于工业制盐酸H2+Cl2光照2HCl〔会发生爆炸〕——不可用于工业制盐酸②2P+3Cl2点燃2PCl3〔氯气不足,产生白雾〕2P+5Cl2点燃2PCl5〔氯气充足,产生白烟〕〔3〕与水反应:Cl2+H2O HCl+HClO〔4〕与碱反应:Cl2+2NaOH NaCl+NaClO+H2O〔用于除去多余的氯气〕2Cl2+2Ca(OH)2 Ca(ClO)2+CaCl2+2H2O〔用于制漂粉精〕Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO〔漂粉精的漂白原理〕〔5〕与某些还原性物质反应如:①2FeCl2+Cl2 2FeCl3②2KI+Cl22KCl + I2〔使湿润的淀粉-KI试纸变蓝色,用于氯气的检验〕③SO2+Cl2+2H2O 2HCl + H2SO4〔6〕与某些有机物反应如:①CH4+Cl2光照CH3Cl + HCl〔取代反应〕②CH2=CH2+Cl2→ CH2ClCH2Cl〔加成反应〕3.氯水的成分与性质氯气溶于水得黄绿色的溶液——氯水。
在氯水中有少部分氯分子与水反应,Cl2 + H2O HCl + HClO (次氯酸),大部分是以Cl2分子状态存在于水中。
注意:〔1〕在新制的氯水中存在的微粒有:H2O、Cl2、HClO、H+、Cl-、ClO-、OH-;久置氯水则几乎是盐酸溶液。



氯气的物理性质和化学性质(1)物理性质:黄绿色,有刺激性气味,有毒,密度比空气大,能溶于水(1:2)。
(2)化学性质:氯气(Cl2)是双原子分子,原子的最外层有七个电子,是典型的非金属元素,单质是强氧化剂。
①氯气与金属反应: 2Na+Cl22NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl22FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
②与非金属的反应 H2+Cl22HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl22HCl(发生爆炸) 2P+3Cl22PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。
雾是PCl3,烟是PCl5。
氯气能有很多非金属单质反应,如S、C、Si等。
③与碱反应 Cl2+2NaOH==NaCl+NaClO+H2O2Cl2+2Ca(OH)2==CaCl2+Ca(ClO)2+2H2O④与某些还原性物质反应:Cl2+2FeCl2===2FeCl3Cl2+SO2+2H2O==2HCl+H2SO4⑤有机反应(参与有机反应的取代和加成反应)CH4+Cl2→CH3Cl+HClCH3Cl+Cl2→CH2Cl2+HClCH2Cl2+Cl2→CHCl3+HClCHCl3+Cl2→CCl4+HClCl2+CH2=CH2→CH2Cl-CH2Cl(加成反应)⑥与水反应 Cl2+H2O HCl+HClO氯气制取实验装置图氯气:①化学式:Cl2②氯元素在周期表中的位置:第三周期ⅦA族③氯原子的电子式:④氯的原子结构示意图:⑤氯原子的外围电子排布式:⑥化学键类型:非极性共价键⑦氯分子的电子式:⑧氯分子的结构式:防止氯气泄漏的方法氯气泄漏极易造成人身伤亡和区域性污染,防止氯气泄漏的方法有:不能选用存在缺陷的设备和部件,各设备和部件要定期检测和检验;加强工艺管理,严格控制工艺指标,发现问题必须及时检查和处理;加强事故氯处理装置的管理和检修,相关装置采用多路电源供电,定期清洗事故氯处理装置,机泵定期试车;为了及时发现氯气泄漏,在生产、储存、输送和使用的岗位都要安装氯气报警器,一旦氯气泄漏,可及早发现,防止事故扩大,并在液化岗位安装电视监控和碱液喷淋装置;加强对职工的安全教育和培训。


氯气及其化合物的性质及应用
考点详解
氯气及其化合物的性质及应用知识点包括氯气的物理性质、氯气的化学性质、次氯酸的性质、漂白粉的性质等部分,有关氯气及其化合物的性质及应用的详情如下:
氯气的物理性质
氯气的化学性质
(1)与金属反应
与变价金属反应生成最高价态金属氯化物。
①与铁反应:
②与铜反应:
(2)与非金属反应
与H2反应:
(3)与水反应
(4)与碱反应
与NaOH溶液反应,离子方程式为
(用于制取漂白液或Cl2尾气吸收) (5)与还原性无机化合物反应
次氯酸的性质
(1)不稳定性:(填化学方程式);氯水须现用现配,保存在棕色瓶中,置于冷暗处。
(2)强氧化性
①能将有机物中有颜色物质氧化为无色物质,作漂白剂。
②杀菌、消毒。
(3)弱酸性[电离常数K(H2CO3)>K(HClO)>K(HCO3-)]
NaClO溶液中通入CO2,离子方程式为
漂白粉的性质。



氯气性质说课稿一、引言大家好,今天我将为大家介绍氯气的性质。
氯气是一种常见的化学物质,具有特殊的性质和广泛的应用。
本次说课将从氯气的物理性质、化学性质以及应用领域三个方面进行介绍。
二、主体1. 氯气的物理性质氯气(Cl2)是一种黄绿色的气体,具有刺激性气味。
它是一种非常活泼的元素,密度较大,比空气重约2.5倍。
在常温下,氯气是气态,但在低温下可以被压缩成液态或固态。
氯气的沸点为-34.6℃,熔点为-101.5℃。
此外,氯气具有较高的溶解度,可以溶解于水中,形成氯水。
2. 氯气的化学性质氯气是一种强氧化剂,它能够与许多物质发生剧烈的化学反应。
例如,氯气与金属反应时,会生成相应的金属氯化物。
氯气还可以与非金属元素反应,形成氯化物。
此外,氯气还可以与有机物反应,引发氧化反应,产生有机氯化物。
这些反应都是氯气化学性质的体现。
3. 氯气的应用领域由于氯气具有强氧化性和较高的活性,因此在许多领域有着广泛的应用。
(1)水处理:氯气可以用于水处理过程中的消毒,能有效杀灭水中的细菌和病毒,保持水质的卫生安全。
(2)化工工业:氯气是许多化工反应的重要原料,例如聚氯乙烯(PVC)的制备过程中,氯气是必不可少的原料之一。
(3)制药工业:氯气在制药工业中也有广泛的应用,可以用于合成药物、消毒和灭菌等过程。
(4)纺织工业:氯气可以用于漂白纺织品,去除纤维上的色素和杂质,使得纺织品更加洁白。
(5)污水处理:氯气可以用于污水处理过程中的消毒,有效杀灭污水中的细菌和病毒,保护环境和人类健康。
三、结论综上所述,氯气是一种具有特殊性质和广泛应用的化学物质。
它具有刺激性气味,是一种非常活泼的元素。
氯气在化学反应中表现出强氧化性,能够与许多物质发生剧烈的反应。
在水处理、化工工业、制药工业、纺织工业以及污水处理等领域都有着重要的应用价值。
通过深入了解氯气的性质,我们可以更好地应用它,为社会的发展和人类的生活带来更多的益处。
四、课堂导入在课堂上,我将通过实验演示、图片展示等形式,让学生亲身感受氯气的性质。
