朱骥-局部进展期直肠癌综合治疗的策略与布局
- 格式:doc
- 大小:1.19 MB
- 文档页数:4

局部晚期直肠癌治疗(完整版)局部晚期直肠癌包括T3,T4 和/或淋巴结阳性的直肠癌。
随着大型临床研究结果不断出炉,自2004 年以来,局部晚期直肠癌的治疗格局逐步发生改变。
今年8 月份,美国临床肿瘤学会(ASCO)指南汇总2013~2023 年发表的Ⅱ期和Ⅲ期随机对照研究(RCT)和观察性研究,进行全面分析和推荐,旨在回答6 大热点临床问题,为局部晚期直肠癌的治疗提供循证依据[1]。
笔者现将该指南的推荐意见和证据进行总结,旨在与读者一同学习交流。
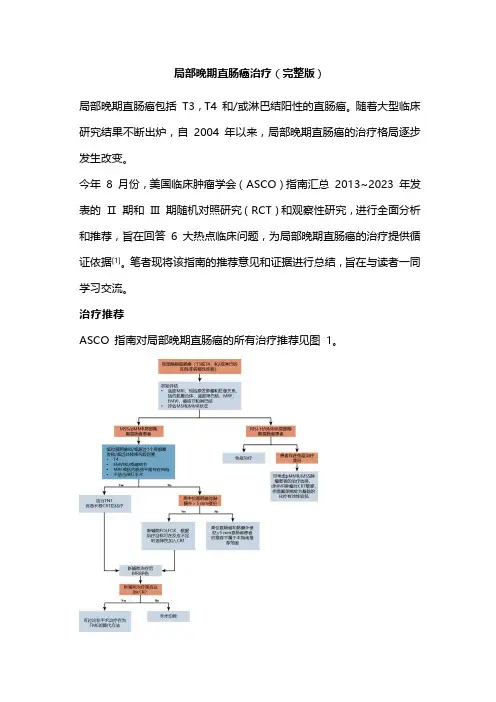
治疗推荐ASCO 指南对局部晚期直肠癌的所有治疗推荐见图1。
图1. 局部晚期直肠癌治疗推荐一览推荐要点:1. 局部晚期直肠癌需行MRI 评估;2. 对于微卫星稳定/错配修复完整(MSS/pMMR)患者,全程新辅助治疗(TNT)应作为低位直肠癌和/或高危患者的初始治疗;3. 无高危因素的患者可根据反应程度考虑化疗伴选择性化放疗(CRT),TNT,新辅助长程CRT 或短程放疗(RT);4. 对于适合于TNT 的患者,优选化疗时间是在放疗后;5. 新辅助长程CRT 优于短程RT,但是短程RT 也可作为治疗选择;6. 非手术治疗(NOM)可作为新辅助治疗后临床完全缓解(cCR)患者的全直肠系膜切除术(TME)替代方法;7. 对于高度微卫星不稳定/错配修复缺陷(MSI-H/dMMR)患者,推荐免疫治疗。
初始评估推荐使用直肠MRI 进行分期。
前瞻性数据显示高分辨MRI 评估黏膜外播散范围和预测TME 平面有助于准确选择适合新辅助治疗的患者。
可被高分辨MRI 准确评估的预后因素包括壁外血管侵犯(EMVI),癌结节(目前TNM 分期分为N1c)和黏膜外肿瘤侵犯深度。
治疗决策应基于术前MRI 结果进行多学科讨论。
新辅助治疗Q1联合TNT(新辅助化疗和CRT)对比标准新辅助CRT 是否改善结局?RAPIDO,POLISH Ⅱ,PRODIGE-23 和STELLAR 等4 项RCTs 对比了TNT 和标准新辅助CRT[2-5]。



临床医学研究与实践2020年12月第5卷第36期临床医学DOI :10.19347/ki.2096-1413.202036017作者简介:容谦(1982-),男,汉族,广西壮族自治区南宁人,主治医师,硕士。
研究方向:消化系肿瘤,鼻咽癌。
直肠癌是临床上较常见的消化系恶性肿瘤,近年来发病率呈上升趋势,其早期症状不明显,以排便习惯改变、便血、腹泻、局部腹痛症状为主,晚期则会出现贫血、体重减轻等全身症状,病死率较高,严重威胁患者的生命安全[1]。
临床上以根治性手术为主要治疗手段,但对于局部晚期患者,单纯行手术治疗较难彻底清除病灶,术后易出现复发。
而近年来多项相关研究显示,局部晚期直肠癌患者术前同步放化疗能在一定程度上控制肿瘤进展,且有降期、提高手术效果、降低复发率的作用,对提高患者的生存质量有重要意义,已成为局部晚期直肠癌的标准治疗模式[2]。
但目前相关研究指标选择较为局限,多从近期疗效、放化疗副反应、及术后保肛率分析。
基于此,本研究分析术前调强放疗联合同步替吉奥化疗治疗局部晚期直肠癌的效果。
1资料与方法1.1一般资料将2017年5月至2019年5月我院收治的120例局部晚期直肠癌患者根据治疗方案分为对照组与试验组,各60例。
对照组男33例,女27例;年龄29~68岁,平均(51.96±6.68)岁;病理分型:低分化癌17例,中分化癌29例,高分化癌14例。
试验组男35例,女25例;年龄33~67岁,平均(52.75±6.53)岁;病理分型:低分化癌19例,中分化癌27例,高分化癌14例。
两组的一般资料无显著差异(P >0.05)。
本研究已经医院伦理委员会批准,所有患者及其家属签署知情同意书。
纳入标准:符合局部直肠癌的诊断标准[3],患者处于晚期,经临床病理及辅助检查证实;无远处转移;未合并其他恶性肿瘤;KPS 评分>70分;无盆腔放化疗病史。
排除标准:有放化疗禁忌证者;合并严重感染者;严重脏器损害者;预计生存期<6个月者。



局部进展期直肠癌患者的非手术治疗
王靖雯;朱骥
【期刊名称】《肿瘤综合治疗电子杂志》
【年(卷),期】2018(004)004
【摘要】接受新辅助治疗的局部进展期直肠癌患者达到病理完全缓解(pathological complate response,pCR)的比例为10%~30%,其生存明显优于未能达到pCR的患者.在临床完全缓解(clinical complete response,cCR)的患者中实施观察等待(watch&wait)策略,可以避免根治性手术,极大地提高了患者的生活质量.本文对观察等待治疗模式的现状与发展及尚待解决的问题进行综述.
【总页数】7页(P31-37)
【作者】王靖雯;朱骥
【作者单位】复旦大学附属肿瘤医院放疗科,上海200032;复旦大学附属肿瘤医院放疗科,上海200032
【正文语种】中文
【相关文献】
1.局部进展期直肠癌患者的非手术治疗 [J], 王靖雯;朱骥;
2.局部进展期中低位直肠癌患者术前同期加量调强放疗联合化疗的疗效观察 [J], 曾铭玥;冯林春;贾宝庆;杨咏强;刘其腾;陈静;王运来
3.新辅助治疗在局部进展期直肠癌患者中的应用效果分析 [J], 冯金龙;安当华
4.新辅助免疫治疗:dMMR/MSI-H局部进展期结直肠癌患者的"黎明之光" [J], 张旋;武涛;李进莎;李国钰;李权;董超;李婷;杨仁芳;李云峰
5.术前放疗不足以控制局部进展期直肠癌患者的侧方复发:一项随机对照研究的事后分析 [J], 李来元;杨熊飞
因版权原因,仅展示原文概要,查看原文内容请购买。

直肠癌局部复发后怎么办?有数据表明,2018年,全球结直肠癌确诊人数超过180万例,死亡人数超过80万例。
发病率在全部肿瘤中居第3位,死亡率居第2位。
局部复发性直肠癌(locally recurrent rectal cancer,LRRC)定义为直肠癌术后原发肿瘤部位或手术野范围局部再出现的和原发癌病理性质相同的肿瘤。
未经治疗的LRRC中位生存期仅10个月,直肠癌初次根治后复发几率为2.4%~10%。
Park等报道高达95%的复发转移在术后3年内出现,患者有局部压迫症状,会阴区、下肢疼痛,排尿困难,严重影响其生存质量。
Yamada等根据手术预后分型,将复发部位分为3种:局限型:肿瘤局限于临近盆腔器官和结缔组织;骶前型:肿瘤侵犯低位骶骨(S3、S4、S5),尾骨或骨膜;侧壁型:肿瘤侵犯坐骨神经、坐骨大孔、盆侧壁或上位骶骨(S1、S2)。
另有研究报道根据症状分型:S0为无症状,S1为有症状但无疼痛,S2为有症状伴疼痛。
目前LRRC的治疗仍以手术和外放疗为主,但许多患者因既往外放疗史或复发部位等因素难以行手术或外放疗。
目前,大量新兴技术涌现,均证实对LRRC有较好的疗效。
手术大量研究证实,肿瘤完全切除(R0切除)是影响预后的独立因素。
Dresen等报道,R0切除、不完全切除(R1切除)和残留切除(R2切除)术后3年生存率分别为58.7%、26.5%和24.1%,3 年局部控制率分别为74.9%、29.2%和28.5%,组间比较存在显著性差异,而术前新辅助放化疗可提高R0切除的几率。
但有研究表明仅20%~30%的患者可行R0 手术,手术禁忌包括伴有盆腔外难以切除的转移灶,主动脉旁淋巴结累及,两侧坐骨神经累及,L5/S1以上腰椎累及等。
Iversen等报道侧盆壁复发的患者预后更差,原因是R0切除的几率更低。
50% LRRC在诊断时已经伴有远处转移,不适宜手术切除。
因此诊断LRRC时应完善全身检查,避免过度治疗。

2019年华医网继续教育答案-536-直肠癌术前放疗新
进展与病例探讨
备注:红色选项或后方标记“[正确答案]”为正确选项
(一)局部进展期直肠癌术前放化疗进展
1、局部进展期直肠癌,mFOLFOX6结合同期放疗的新辅助方案与5-FU单药结合放疗相比()
A、更高的pCR率[正确答案]
B、更小的毒性
C、更低的降期率
D、明显改变的依从性
E、以上都是
2、有研究表明,体积小≤()的T2T3直肠癌可以考虑器官保留
A、2cm
B、4cm[正确答案]
C、3cm
D、1cm
E、6cm
3、研究表明,对于局部进展期直肠癌患者同步放化疗后延长至()再行手术可显著提高MRI上T分期降期率
A、16周
B、12周[正确答案]
C、10周
D、7周
E、4周
4、局部进展期直肠癌CRT后手术间隔,GRECCAR-6建议为()
A、6~8周[正确答案]
B、4~6周
C、5~12周。

"开坦尼®作为免疫双靶点药物,我个人认为其今后在胃肠道肿瘤综合治疗方面,会有很好的应用前景。
"2022年6月29日,全球首个肿瘤双免疫检查点抑制剂卡度尼利单抗——开坦尼® 获NMPA批准上市,8月13日由康方生物主办的开坦尼®全国上市会上海站顺利召开,多位著名专家学者及领军人物出席会议,分享开坦尼®的杰出成果。
上海交通大学附属瑞金医院朱正纲教授就开坦尼® 胃肠道肿瘤领域应用前景进行展望。
各位医学同道,大家好!非常高兴,康方药业开坦尼®问世,给我们临床医生,特别是从事肿瘤治疗的临床医生,带来一个非常利好的消息。
同时,开坦尼®的获批也提振了广大肿瘤患者的信心,这是一个双重利好消息。
据已发表的临床研究报道,开坦尼®作为肿瘤双免疫检查点抑制剂药物问世,首先在宫颈癌治疗方面取得非常充分的临床治疗证据,证明开坦尼®较其他免疫药物更好地使患者获益,提高病人的PFS和OS。
基于宫颈癌领域优异的临床结果,现开坦尼®已在中国获批上市,成为国内首个上市双抗免疫药物,这是一个振奋人心的消息。
最近十多年来,免疫检查点抑制剂药物研究在临床应用深入开展,例如PD-1/PD-L1药物种类繁多。
就我个人观点,开坦尼®针对免疫双靶点抑制剂,作为一个双抗药物是将传统靶向PD-1和CTLA-4的两种药物结合到一起。
作为一个长期从事胃肠道肿瘤临床诊疗的专家,我认为未来为提高胃肠道肿瘤患者疗效方面带来极大帮助。
众所周知,胃肠道肿瘤是我国非常高发的恶性肿瘤,初步估计,我国每年约有100万新增的胃肠肿瘤患者,面对这样一个庞大的肿瘤人群,绝大多数患者就医时即为中晚期,因此这类患者的治疗面临很大挑战。
胃肠肿瘤的传统治疗方案是以外科手术为主,兼有综合疗法包括化疗、靶向治疗以及免疫治疗,逐渐形成一个以外科手术治疗为主的综合诊疗规范化体系。
晚期结直肠癌的全身治疗进展
岳亚丽;郑坚;朱莹杰;顾缨
【期刊名称】《现代中西医结合杂志》
【年(卷),期】2012(021)015
【摘要】@@ 在全世界范围内,结直肠癌的发病率男女均处于常见恶性肿瘤的第3位,其发病率呈逐渐上升的趋势[1].由于结直肠癌的早期症状不明显,一旦确诊大部分已属中、晚期,甚至失去手术的机会,不能手术的晚期转移性结直肠癌的预期寿命仅为8个月[2],对于晚期结直肠癌患者主要的全身治疗方式包括:化疗、分子靶向治疗及中药治疗.现将晚期结直肠癌全身治疗的最新进展综述如下.
【总页数】5页(P1701-1705)
【作者】岳亚丽;郑坚;朱莹杰;顾缨
【作者单位】上海中医药大学附属龙华医院,上海,200032;上海中医药大学附属龙华医院,上海,200032;上海中医药大学附属龙华医院,上海,200032;上海中医药大学附属龙华医院,上海,200032
【正文语种】中文
【中图分类】R735.3
【相关文献】
1.DC-CIK细胞联合全身静脉化疗治疗晚期结直肠癌伴弥漫性肝转移的研究
2.极限全身热疗联合奥沙利铂治疗晚期结直肠癌疗效观察
3.晚期结直肠癌全身化疗进展
4.
全身热疗联合奥沙利铂方案治疗晚期结直肠癌5.DC-CIK细胞联合全身静脉化疗治疗晚期结直肠癌伴弥漫性肝转移临床疗效分析
因版权原因,仅展示原文概要,查看原文内容请购买。
每周化疗合并局部放疗治疗晚期肺癌的临床研究
张洁;黄迪泽;徐瑛;朱韧
【期刊名称】《临床肺科杂志》
【年(卷),期】2004(009)002
【摘要】目的对比每周化疗加局部放疗与单纯化疗对晚期非小细胞肺癌的疗效.方法对初次化疗失败的非小细胞肺癌患者行每周化疗合并局部放疗,对初次化疗有效的病例继续行同一方案化疗.结果放化疗组有效率为66.6%,单纯化疗组有效率为70.2%,二者之间无显著性差异(P>0.05).二者副作用Ⅲ-Ⅳ级白细胞减少的发生率,放化疗组较单纯化疗组明显下降(P<0.05).结论每周化疗结合局部放疗是改善晚期肺癌初次化疗失败的一种有效方法.
【总页数】2页(P118-119)
【作者】张洁;黄迪泽;徐瑛;朱韧
【作者单位】200433,上海市肺科医院肿瘤科;200433,上海市肺科医院肿瘤
科;200433,上海市肺科医院肿瘤科;200433,上海市肺科医院肿瘤科
【正文语种】中文
【中图分类】R453.9;R454.1;R734.2
【相关文献】
1.支气管动脉灌注化疗联合局部放疗治疗中晚期肺癌72例观察研究 [J], 方珊珊;毛小刚;毛爱华
2.奈达铂每周方案同期适形放疗治疗局部晚期鼻咽癌的临床研究 [J], 潘素明;陈志
仁;丘全胜;郭明江;司徒慧晶
3.每周TP方案化疗联合放疗治疗宫颈癌临床研究 [J], 林柏翰;李东升;李冬英;伍方才;陈志坚;林灿峰
4.奈达铂每周方案化疗联合同期放疗治疗局部晚期食管癌的临床疗效分析 [J], 陈德东
5.食管癌放疗后局部复发再程三维适形放疗联合每周铂类化疗的疗效及安全性临床研究 [J], 方海城; 陈树群; 陈钢群; 潘旭彬; 陈耿春; 杨少武; 黄春霖
因版权原因,仅展示原文概要,查看原文内容请购买。
局部进展期直肠癌综合治疗的策略与布局复旦大学肿瘤医院放射治疗科/临床统计中心朱骥目前,国内局部进展期直肠癌推荐治疗模式为新辅助的长程放化疗,它选择的人群是T3/T4,伴或不伴淋巴结转移,先给予5周或5周半的以氟尿嘧啶为基础的长程放化疗,然后在疗程结束之后,再接受TME手术。
手术完之后再根据术后病理等情况给予新辅助化疗,这是一个目前国内应用最广泛的一个模式。
但是它的局限性也是非常明显的,首先表现在同步放化疗后完全缓解率低,根据文献报道,pCR约为10%-25%;其次约有30-35%出现远处转移,成为治疗失败的主要原因;最后约50%的患者不能够按计划完成6个月围手术期辅助治疗,主要原因为毒性及患者依从性。
那么,怎样对这样一个并不理想的模式进行优化呢?我们从统计学的角度,把它从两个方面进行区分,第一,从优效性的方向来考虑,提高新辅助治疗阶段剂量强度,以期获得肿瘤的降期。
第二,从非劣效方向考虑,在手术治疗的前提下,下调剂量强度,以期达到毒性下降且不影响临床疗效。
从优效性的方向,首先讨论是否增加放疗剂量。
丹麦学者[1]报道了一个的小样本的临床II期研究,一共纳入55例的患者,其实有4例因为错误入组被剔除,只有51例的患者接受了一个长程的放化疗,具体方案:放疗剂量对于可见病灶给予60Gy/30Fx,对于淋巴引流区给予50Gy/30Fx,同期给予UET 300/m2/day以化疗增敏,在放疗结束的最后一周,还会给予一次5Gy的后装照射。
在51例评价的患者中可看到有非常好的肿瘤降期,有40例患者因为完全性缓解而没有立即接受手术,而接受一个Watch&Wait的一个治疗策略,那么又有9例患者因为局部复发,而接受一个挽救性的手术切除。
但值得我们注意,该研究或许从基线特征获得高cCR,从纳入人群可看出,约50%病人是T2的患者,所以入组的患者局限的肿瘤负荷较低,以更高的几率获得CCR。
同时研究者也提出不足之处:首先,T2患者录入比较多,再者,所采用的同期化疗的方案不是我们目前所常规使用的氟尿嘧啶静脉给药或是卡培他滨口服给药,而是采用丹麦标准的口服优福定,并且所有患者在治疗结束后6周未进行间隔期化疗,故该研究只给予长程的同期放化疗治疗。
从优效性的方向,其次讨论是否增加同期化疗强度。
在氟尿嘧啶的基础上,我们可选择加奥沙利铂、伊立替康,甚至加靶向治疗。
那我们到底应该采取氟尿嘧啶单药还是联合其他有效的药物呢?关于奥沙利铂的选择,在欧美早已有5个临床III期研究,分别为STAR研究、ACCORD研究以及德国的CAO/ARO/AIO-04研究、NSABP R-04研究、PETACC-6研究,探讨术前放化疗是否加奥沙利铂。
最近报道的以中山六院邓艳红领衔的FOWARC研究,为国内多中心、前瞻性临床研究,纳入距肛缘<12cm、T3/4和/或N+、预计可切除的495例直肠腺癌,随机分成三组,一组是放疗联合氟尿嘧啶(放疗46-50,4Gy联合De Gramont×5),一组是放疗联合FOLFOX6(放疗46-50,4Gy联合mFOLFOX6×5),一组是单纯的FOLFOX6×4-6,选择主要终点是3年的DFS。
三组中毒性反应最低的是单纯的化疗,而毒性反应最大的是放疗联合FOLFOX6。
三组的RO切除率均在90%左右,在吻合口瘘方面,最低的是单纯化疗组,另外两组的毒性反应类似。
在pCR方面,最高的是放疗联合FOLFOX6,达68%,而单纯的FOLFOX6组仅有6.1%,具有统计学意义。
综合以上六个III期临床研究,在近期疗效pCR方面,除了德国的CAO/ARO/AIO-04研究和FOWARC研究显示出在长程放化疗的基础上,加上奥沙利铂,pCR有提高的趋势之外,其他四个研究均没有显著提高PCR,而且从毒性放映来看,只有德国的CAO/ARO/AIO-04研究认为加上奥沙利铂的毒性增加不明显,其余五个研究均认为加上奥沙利铂导致毒性反应明显增加。
长期的随访中,联合奥沙利铂后3年的DFS 和3年的OS并没有显著的提高。
所以总体来看,奥沙利铂在新辅助治疗中充当的角色主流认为增毒但不增效的结果。
我们再来看伊立替康在新辅助治疗中的价值,在CinClare研究中,纳入距肛缘小于12cm、T3/4期和/或淋巴结阳性的360个直肠腺癌病例,随机分为单药组(放疗+卡培他滨)及双药组(放疗+卡培他滨+伊立替康),主要研究终点为pCR。
在英国Aristotle 研究中,已纳入600例患者,随机分为放疗+卡培他滨及放疗+卡培他滨+伊立替康(60mg/m2 每周共四次)。
我们期待这两个研究的结果,或许将影响未来的指南。
无论如何,目前主流观点认为奥沙利铂并没有显著地提高疗效,而对于伊立替康及靶向没有高质量的临床III 期研究报道,故NCCN指南仍只推荐以氟尿嘧啶单药的基础上联合长程放化疗,而不支持两药联合的方案。
从优效性的方向,最后讨论是否把化疗从辅助化疗阶段向前挪到新辅助化疗阶段。
一个是把它放到放化疗之前,我们称之为诱导化疗,或者是把它放到放化疗之后,称之为间隔期化疗。
对于诱导化疗阶段,目前临床研究证据并不多,主要为西班牙的108例的GCR2的临床II期研究[2],随机分为辅助的放化疗,四个疗程的CAP,或者将这4个疗程的CAP前移诱导化疗阶段来给予,结果提示高肿瘤的退缩率及pCR率没有统计学意义。
把4个疗程的CAP 前移诱导化疗阶段来给予降低的化疗毒性,提高治疗依从性,患者完成全程化疗的比例较高,基于此项研究,NCCN指南推荐诱导化疗也可作为局部进展期直肠癌的化疗方案之一。
当然,个人认为这个推荐的证据级别比较低,有一定指导意义。
间隔期化疗,我们医院(复旦肿瘤医院)在第一阶段没加加入间隔期化疗,第二阶段在间隔期加上一个疗程的单药希罗达口服,第三阶段在间隔期加上一个疗程的Xelox方案给药,同时调整放疗剂量,我们看到pCR率从第一阶段的10%逐步增加至第第三阶段的23%,因此我们觉得间隔化疗剂量增加可改善肿瘤退缩的情况。
2015 发表在Thonas CR发表在ASTRO的非随机对照临床II期研究同样支持此观点,患者被分为四组,第一组患者为放化疗之后等6周直接接受手术,后面的三组分别在间隔期给予两个、四个或者六个疗程的FOLFOX6方案的化疗,结果显示pCR率从第一组的18%逐渐递增至第四组(加入六个疗程间隔化疗)的38%,具有统计学意义。
同时显示增加间隔期化疗虽然延长了手术时间,但手术相关的并发症并没有显著地增高。
Lyon 90-01研究[3]、Tulchinsky[4]、Kalady[5]、Garcia-AguilarJ[6]均提示延长间隔期并给予化疗,提高了pCR 率。
我们优化新辅助放化疗方案,增加治疗强度以增加临床缓解率,主要针对低位直肠癌未能获取保肛的患者是否具备观察及等待的机会,以显著提高生活质量。
Sao Paulo,Brazil最早提出了Watch&Wait的治疗策略,在她的研究显示cCR患者采用Watch&Wait有一个比较不错的长期随访的结果。
而在MSKCC回顾性研究中同样支持这样的结论,在这个医院中选出符合cCR并接受Watch&Wait的73例患者作为研究组,而在另外的直接接受了TME手术之后,病理显示为pCR的患者作为对照组,结果发现Watch&Wait失败的患者大约均在在13个月左右出现,这就提示我们若采用观察等待的方案应密切监测患者13个月以上。
这两组的EFS及OS均无明显差别。
2006年以来接受Watch&Wait的患者逐年增加,说明Watch&Wait 接受度逐渐提高。
对于不可保肛门的患者,通过观察等待的治疗策略可显著提高生活质量,从前面研究提到观察等待的患者初始分期越早,获得CR的机会越大。
目前多中心临床研究中符合并接受观察等待患者数量并不多,所以建立全球Watch&Wait协作数据库,以评估这种治疗策略是否真的可行,我们期待最终的结果。
MSKCC目前正开展一项诱导化疗与间隔期化疗对比的临床II期研究,我们期待它的结果,个人感觉间隔期化疗可能有更好的结果。
关于非劣效的方向改变,我们考虑是否可以去除放疗或者化疗。
首先我们讨论能否去除化疗,早在已有URTC229221和FSE19203研究对比长程放化疗与长程的放疗,显示长程放疗效果更差,所以我们在此不再讨论单纯去除化疗。
我们主要讨论经典短程放疗对比长程的放化疗,头对头的比较为波兰研究(316例T3-4,1999-2004)及澳洲研究(326例T3),短程放疗方案为25Gy/5Fx,化疗后1周内手术;长程放化疗方案为45-50.4Gy/25-28Fx,同期给予氟尿嘧啶,化放疗后6-8周手术。
结果提示无论局部复发率、EFS或者OS,短程放疗对比长程化放疗并无统计学差别,所以从患者长期利益考虑两种方案并无差别。
当短程放疗要求患者在放疗后1周以内接受手术,若手术中发现肿瘤不属于T3,而属于T2NO时,术后就可不必再给予治疗,同时可节约医疗资源,可提高局控、避免过度治疗。
但肿瘤退缩并不明显,为了弥补不足,对短程放疗方案进行了优化:延期手术或者延期手术+化疗,前者pCR 率可提高10%,后者可提高20%,在中间加入化疗的效果类似于长程放化疗方案,同时可节约医疗资源,若有更多数据报道,短程放疗+延期手术也许将是更被推荐的方案之一。
所以短程放疗之后接受手术也进入了今年NCCN指南,成为局部进展期直肠癌的治疗模式之一。
再来看我们能否去除放疗,MSKCC对此最早做了一项小样本的临床研究,纳入32例T2-3的患者,再有PROSPECT研究,将II/III期直肠癌随机分为对照组(5-Fu联合放疗)及研究组(先予FOLFOX ×6,评价若肿瘤退缩>=20%,就直接进入手术;若肿瘤退缩<20%,则给予5FUXRT长程放化疗后再手术)。
看似一个理想的设计,但是我们发现这两个研究均不能代表进展期结直肠癌的,我们发现MSKCC排除合并T4、MRF+、肿瘤固定不可切、4枚以上LN>2cm高危因素及PROSPECT排除合并T4、距肛<5cm和外侵>3mm高危因素。
2014年曾有研究报道[7]将76例患者按照是否符合PROSPECT标准分为两组,结果发现符合PROSPECT 标准的pCR率达到42%,另外一组的pCR率仅有13%。
这说明这个新辅助化疗的研究是有意识筛选早期的局部进展期直肠癌,所以即使结果达到预期效果,我们也不能简单地把这个结论外推到所有局部进展期直肠癌患者。
再回到FOWARC研究,其中第三组为单纯的化疗组,单用mFOLFOX6的新辅助方案与5-FU单药结合放疗相比,具有相似的RO切除率及降期率,且有更少的手术并发症。