三元相图的绘制(氯仿、盐酸、水)
- 格式:doc
- 大小:85.00 KB
- 文档页数:4


实验六三液系(三氯甲烷—醋酸—水)相图的绘制实验目的1、熟悉相律和三角形坐标表示三组分相图的方法。
2、用溶解法绘制具有一对共轭溶液的三组分相图。
实验原理在萃取时,具有一对共轭溶液的三组分相图对确定合理的萃取条件极为重要。
在定温定压下,三组分体系的状态和组成之间的关系通常可用等边三角形坐标表示,如图1所示。
图1.三角形坐标表示法图2. 具有一对共轭溶液的三组分相图等边三角形三顶点分别表示三个纯物A、B、C。
AB、BC、CA三边分别表示A和B、B和C、C和A所组成的二组分体系的组成。
三角形内任一点则表示三组分体系的组成。
如O点的组成为A%=Cc′、B%=Aa′、C%=Bb′。
具有一对共轭溶液的三组分体系的相图如图2所示。
该三液系中,A和B及A和C完全互溶,而B和C部分互溶。
曲线abd是溶解度曲线。
曲线外是单相区,曲线内是两相区。
物系点落在两相区内,即分成两相,如O点分成组成为E 和F的两相,EF称为连接线。
绘制溶解度曲线的方法较多。
本实验先在完全互溶的两组分以一定的比例混合所成是均相溶液(如图2中的N点)中加入组分B,物系点则沿着NB线移动,直至溶液变浑,即为L点。
然后加入A,物系点沿着LA上升至N′点变清。
如再加入B,物系点又沿N′B由N′点移至L′点而再次变浑。
再滴加A使变清……。
如此重复,最后连接L,L′,L″……,即可绘出其溶解度曲线。
仪器和药品1.仪器滴定管(50ml,碱式)2支移液管(5ml,刻度)1支移液管(10ml,刻度)2支锥形瓶(100ml)2个洗耳球2个2.药品氯仿(分析纯)密度1.48g/ml,冰醋酸(分析纯)密度1.08g/ml,水密度 1.00g/ml实验步骤1、在洁净的碱式滴定管内装入水。
2、移取6ml氯仿及1ml醋酸于干燥的100ml磨口锥形瓶中,然后慢慢滴入水,且不停地震荡,至溶液由清变浑,即为终点,记下水的体积。
再向瓶中加入2ml醋酸,体系又成均相,继续用水滴定至终点。

Ⅰ、目的要求1.掌握用三角坐标表示三组分相图的方法;2.能正确利用溶解度方法绘制KCl-HCl-H2O三组分系统的相图;3.了解湿固相法的原理,学会确定溶液中纯固相组成点的方法。
Ⅱ、基本原理为了绘制相图就需要通过实验获得平衡时各相间的组成及二相的连接线,即先使体系达到平衡,然后把各相分离,再用化学分析法或物理方法测定达成平衡时各相的组成。
但体系达到平衡的时间,可以相差很大。
对于互溶的液体,一般平衡达到的时间很快;对于溶解度较大,但不生成化合物的水盐体系,也容易达到平衡。
对于一些难溶的盐,则需要相当长的时间,如几个昼夜。
由于结晶过程往往要比溶解过程快得多,所以通常把样品置于较高的温度下,使其较多溶解,然后将其移至温度较低的恒温槽中,使之结晶,加速达到平衡。
另外,摇动、搅拌、加大相界面也能加快各相间的扩散速度,加速达到平衡。
由于在不同温度时的溶解度不同,所以系统所处的温度应该保持不变。
湿固相法的基本原理:在等边三角形相图中凡带有饱和溶液的固相组成点,必定处于饱和溶液组成点和纯固相点的连结线上,测定一组饱和溶液和湿固相(饱和溶液所对应的固相)的组成,它们的连结延长线将交于一点,即纯固相组成点。
本实验是测定在一定温度和压力下,KCl-HCl-H2O三组分体系中各组分的质量百分组成,从而绘制出三组分相图(体系中KCl处于饱和状态,溶解的KCl与KCl固体处于平衡状态)。
由KCl、HCl、H2O组成的三组分体系,在HCl的含量不太高时,HCl完全溶于水而成盐酸溶液,与KCl有共同的负离子Cl-。
所以当饱和的KCl水溶液中加入盐酸时,由于同离子效应使KCl的溶解度降低。
本实验即是研究在不同浓度的盐酸溶液中KCl的溶解度,通过此实验熟悉盐水体系相图的构筑方法和一般性质。
为了分析平衡体系各相的成分,可以采取各相分离方法。
如对于液体可以用分液漏斗来分离。
但是对于固相,分离起来比较困难。
因为固体上总会带有一些母液,很难分离干净,而且有些固相极易风化潮解,不能离开母液而稳定存在。

Ⅰ、目的要求1.掌握用三角坐标表示三组分相图的方法;2.能正确利用溶解度方法绘制KCl-HCl-H2O三组分系统的相图;3.了解湿固相法的原理,学会确定溶液中纯固相组成点的方法。
Ⅱ、基本原理为了绘制相图就需要通过实验获得平衡时各相间的组成及二相的连接线,即先使体系达到平衡,然后把各相分离,再用化学分析法或物理方法测定达成平衡时各相的组成。
但体系达到平衡的时间,可以相差很大。
对于互溶的液体,一般平衡达到的时间很快;对于溶解度较大,但不生成化合物的水盐体系,也容易达到平衡。
对于一些难溶的盐,则需要相当长的时间,如几个昼夜。
由于结晶过程往往要比溶解过程快得多,所以通常把样品置于较高的温度下,使其较多溶解,然后将其移至温度较低的恒温槽中,使之结晶,加速达到平衡。
另外,摇动、搅拌、加大相界面也能加快各相间的扩散速度,加速达到平衡。
由于在不同温度时的溶解度不同,所以系统所处的温度应该保持不变。
湿固相法的基本原理:在等边三角形相图中凡带有饱和溶液的固相组成点,必定处于饱和溶液组成点和纯固相点的连结线上,测定一组饱和溶液和湿固相(饱和溶液所对应的固相)的组成,它们的连结延长线将交于一点,即纯固相组成点。
本实验是测定在一定温度和压力下,KCl-HCl-H2O三组分体系中各组分的质量百分组成,从而绘制出三组分相图(体系中KCl处于饱和状态,溶解的KCl与KCl固体处于平衡状态)。
由KCl、HCl、H2O组成的三组分体系,在HCl的含量不太高时,HCl完全溶于水而成盐酸溶液,与KCl有共同的负离子Cl-。
所以当饱和的KCl水溶液中加入盐酸时,由于同离子效应使KCl的溶解度降低。
本实验即是研究在不同浓度的盐酸溶液中KCl的溶解度,通过此实验熟悉盐水体系相图的构筑方法和一般性质。
为了分析平衡体系各相的成分,可以采取各相分离方法。
如对于液体可以用分液漏斗来分离。
但是对于固相,分离起来比较困难。
因为固体上总会带有一些母液,很难分离干净,而且有些固相极易风化潮解,不能离开母液而稳定存在。

三液系(三氯甲烷~醋酸~水)相图的绘制薛念华一.实验目的:1.熟悉相律和用三角形坐标表示三组分相图的方法。
2.用溶解度法绘制具有一对共轭溶液的三组分相图。
二.实验原理:在定温定压下,三组分体系的状态和组成之间的关系通常可用等边三角形坐标,如下图所示。
等边三角形三顶点分别表示三个纯物A、B、C。
AB、BC、CA三边分别表示A和B、B和C、C和A所组成的二组分体系的组成。
三角形内任一点则表示三组分体系的组成。
如O点的组成为A%=Cc’,B%=Aa’,C%=Bb’。
具有一对共轭溶液的三组分体系相图,在该三液系中,A和B、A和C完全互溶,而B和C只能有限度的互溶,B和C的浓度在Ba和Cd之间可以完全互溶,介于ad 之间体系分为两层,一层是B在C中的饱和溶液(d点),另一层是C在B中的饱和溶液(a点),这对溶液称为共轭溶液。
曲线abd为溶解度曲线。
曲线外是单相区,曲线内是二相区。
物系点落在两相区内即分成二相,如O点分成组成为E和F的二相,EF 线称为连结线。
绘制溶解度曲线的方法较多。
本实验是先在完全互溶的两个组分(如A和C)以一定的比例混合所成的均相溶液(如图II上的N点)中滴加入组分B,物系点则沿NB 线移动,直至溶液变浑,即为L点,然后加入A,物系点沿LA上升至N’点而变清。
如再滴加B,则物系点又沿N’B移动,当移至L’点时溶液再次变浑。
再滴加A使之变清……。
如此重复,最后连接L,L’,L’’……,即可绘出溶解度曲线。
三.仪器与药品:滴定管(50mL,酸式)×1,滴定管(50mL,碱式)×1,有塞锥形瓶(100mL)×2,有塞锥形瓶(25mL)×4,锥形瓶(100mL)×2,移液管(2mL,胖肚)×4,移液管(5mL,刻度)×2,移液管(10mL,刻度)×1,分液漏斗(60mL)×2,漏斗架×1,氯仿(分析纯),冰醋酸(分析纯),0.5mol/L标准NaOH溶液。
实验五三元体系(H2O-HAC-CHCl3)相图的绘制一.实验目的:1.熟悉相律和利用等边三角形坐标表示三组分相图的方法。
2.用溶解度法绘制具有一对共轭溶液的三组分相图,并绘制连接线。
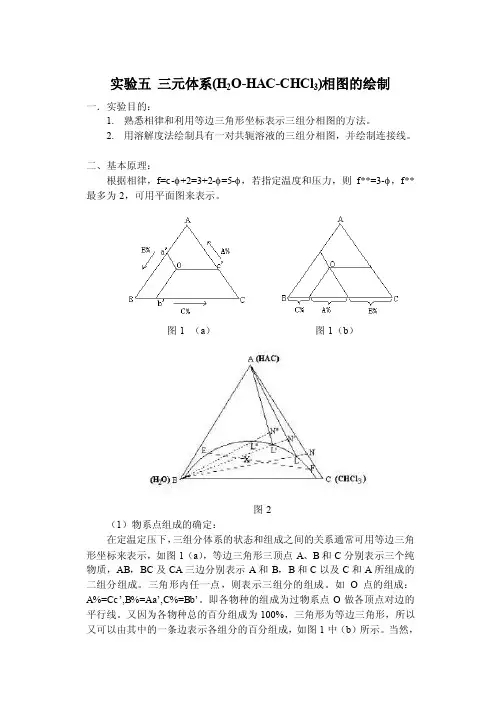
二、基本原理:根据相律,f=c-φ+2=3+2-φ=5-φ,若指定温度和压力,则f**=3-φ,f**最多为2,可用平面图来表示。
图1 (a)图1(b)图2(1)物系点组成的确定:在定温定压下,三组分体系的状态和组成之间的关系通常可用等边三角形坐标来表示,如图1(a),等边三角形三顶点A、B和C分别表示三个纯物质,AB,BC及CA三边分别表示A和B,B和C以及C和A所组成的二组分组成。
三角形内任一点,则表示三组分的组成。
如O点的组成:A%=Cc’,B%=Aa’,C%=Bb’。
即各物种的组成为过物系点O做各顶点对边的平行线。
又因为各物种总的百分组成为100%,三角形为等边三角形,所以又可以由其中的一条边表示各组分的百分组成,如图1中(b)所示。
当然,给出一定组成的溶液百分比,按照上述表示方法,也应该能找出对应的物系点。
(2)溶解度曲线的绘制对于具有一对共轭溶液的三液系相图,如图2,该三液系相图中A和B,A和C为完全互溶而B和C为部分互溶,曲线abc为溶解度曲线。
曲线上方为单相区,曲线下方为二相区,物系点落在二相区内,即分为二相,如X 点则分成组成为E和F的二相,而EF线称为连接线。
对于溶解度曲线的绘制,本实验是先以完全互溶的两个组分(如A和C),以一定的比例混合所组成的均相溶液,如图2上的N点,滴加入组分B,根据平衡相图的直线规则,物系点则沿着NB移动,直至溶液变混,即为L点。
再加入A,物系点由LA上升至N’点而变清。
再加入B,此时物系点又沿着N’B由N’移动至L’而再次变混,再滴加A使变清……,如此反复,最后连接L,L’,L’’……即可画出溶解度曲线。
(3)连接线的绘制由于连接线是表示在两相区内呈平衡两相的组成(或A在两相中的分配),所以可以在两相区内配制溶液,待平衡后分析每相中的任何一种组成的含量,连接在溶解度曲线上该两含量的组成点而得出。

实验三氯甲烷—醋酸—水三液系相图的绘制一.实验目的1.掌握用三角坐标表示三组分相图的方法;2.用溶解度法绘制具有一对共轭溶液的三组分相图。
二.实验原理为了绘制相图就需要通过实验获得平衡时各相间的组成及二相的连接线,即先使体系达到平衡,然后把各相分离,再用化学分析法或者物理方法确定达成平衡时各相的组成。
但体系达到平衡的时间,可以相差很大。
对于互溶的液体,一般平衡达到的时间很快;对于溶解度较大但不生成化合物的水盐体系,也容易达到平衡。
对于一些难溶的盐,则需要相当长的时间,如几个昼夜。
由于结晶过程往往要比溶解过程快得多,所以通常把样品置于较高的温度下,使其溶解较多,然后将其移至温度较低的恒温槽中,使之结晶,加速达到平衡,另外,摇动、搅拌、加大相界面也能加快各相间的扩散速度,加速达到平衡。
水和氯仿的相互溶解度很小,而醋酸却与水、氯仿互溶。
在水和氯仿组成的两相混合物中加入醋酸,能增大水和氯仿间的互溶度,醋酸增多,互溶度越大,当加入醋酸到某一数量时,水和氯仿能完全互溶,原来由两相组成的混合体系由混变清。
在温度恒定的情况下,使两相体系变成均匀的混合物所需要的醋酸量,取决于原来混合物中水和氯仿的比例。
同样,把水加到醋酸和氯仿的均相混合物中时,当水达到一定数量,原来的均相体系变成水相和氯仿相的两相混合体系,体系由清变混。
使体系变成两相所需要的水量,取决于醋酸和氯仿的起始成分。
因此利用体系在相变化时的浑浊和清亮现象的出现。
可以判断体系中各组分间互溶度的大小。
一般由清到浊,肉眼比较容易分辨。
所以实验由均相样品中加入第三物质使变成二相的方法,测定两相间的相互溶解度。
当二相共存并达到平衡时,将二相分离,测得二相的成分,然后用直线连接这二点,即得连接线。
用等边三角形的方法表示三元相图。
等边三角形的三个定点各代表纯组分,三角形三条边AB、BC和CA分别代表A和B,B和C,C和A所组成的二组分的组成,而三角形内任意一点表示三组分的组成。


三元相图的绘制本实验是综合性实验。
其综合性体现在以下几个方面:1.实验内容以及相关知识的综合本实验涉及到多个基本概念,例如相律、相图、溶解度曲线、连接线、等边三角形坐标等,尤其是在一般的实验中(比如分析化学实验、无机化学实验等)作图都是用的直角坐标体系,几乎没有用过三角坐标体系,因此该实验中的等边三角形作图法就具有独特的作用。
这类相图的绘制不仅在相平衡的理论课中有重要意义,而且对化学实验室和化工厂中经常用到的萃取分离中具有重要的指导作用。
2.运用实验方法和操作的综合本实验中涉及到多种基本实验操作和实验仪器(如电子天平、滴定管等)的使用。
本实验中滴定终点的判断,不同于分析化学中的大多数滴定。
本实验的滴定终点,是在本来可以互溶的澄清透明的单相液体体系中逐渐滴加试剂,使其互溶度逐渐减小而变成两相,即“由清变浑”来判断终点。
准确地掌握滴定的终点,有助于学生掌握多种操作,例如取样的准确、滴定的准确、终点的判断准确等。
一.实验目的1. 掌握相律,掌握用三角形坐标表示三组分体系相图。
2. 掌握用溶解度法绘制三组分相图的基本原理和实验方法。
二.实验原理三组分体系K = 3,根据相律:f = K–φ+2 = 5–ф式中ф为相数。
恒定温度和压力时:f = 3–φ当φ= 1,则f = 2因此,恒温恒压下可以用平面图形来表示体系的状态与组成之间的关系,称为三元相图。
一般用等边三角形的方法表示三元相图。
在萃取时,具有一对共轭溶液的三组分相图对确定合理的萃取条件极为重要。
在定温定压下,三组分体系的状态和组分之间的关系通常可用等边三角形坐标表示,如图1所示:图1 图2等边三角形三顶点分别表示三个纯物质A,B,C。
AB,BC,CA,三边表示A和B,B和C,C和A所组成的二组分体系的组成。
三角形内任一点则表示三组分体系的组成。
如点P 的组成为:A%=Cb B%=Ac C%=Ba具有一对共轭溶液的三组分体系的相图如图2所示。
该三液系中,A和B,及A和C 完全互溶,而B和C部分互溶。


三液系(三氯甲烷-醋酸-水)相图的绘制班级:11级化二姓名:丁楠学号20115051262 成绩:一:实验目的1、熟悉相律和用三角坐标表示三组分相图的方法2、用溶解法绘制具有一对共轭溶液的三组分相图二:实验原理在萃取时,具有一对共轭溶液的三组分相图对确定合理的萃取条件极为重要。
在一定温度下,三组分体系的状态和组成之间的关系通常可用等边三角形坐标表示,如图6-1所示C%图6-1 三角形坐标表示法X Axis Title图6-2具有一对共轭溶液的三组分体系相图等边三角形三顶点分别表示三个纯物A、B、C。
AB、BC、CA三边分别表示A和B、B和C、C和A所组成的二组分体系的组成。
三角形内任一点则表示三组分体系的组成。
如O点的组成为A%=Cc’、B%=Aa’、C%=Bb’。
具有一对共轭溶液的三组分体系的相图如图6-2所示。
该三液系中,A和B 及A和C完全互溶,而B和C部分互溶。
曲线abc为溶解度曲线。
曲线外是单相区,曲线内是两相区。
物系点落在两相区内,即分成两相,如O点分成组成为E和F的两相,EF线成为连接线。
绘制溶解度曲线方法较多。
本实验是先在完全互溶的两个组分(如A和C)以一定的比例混合所成的均相溶液(如图6-2上的N点)中滴加入组分B,物系点则沿NB线移动。
直至溶液变浑,即为L点。
然后加入A,物系点沿LA上升至N’点而变清。
如再加入B,则物系点又沿N’B由N’移到L’可再次变馄。
再滴加A使变浑……。
如此重复,最后连接L、L、’L’’……,即可绘出其溶解度曲线。
四:实验步骤1、在洁净的碱式滴定管内装水移取6mL氯仿及1mL醋酸于干燥洁净的100mL磨口锥形瓶中,然后慢慢加入水,且不停地摇动,至溶液由清变浑,即为终点,记下水的体积。
再向此瓶中加入2mL醋酸,体系又成均相,继续用水滴至终点。
同法再依次加入3.5mL、6.5mL醋酸,并分别再用水滴定,记录各次各组分的用量。
另取一干燥洁净的100mL磨口锥形瓶,用移液管移入1mL氯仿和3mL醋酸。
三元相图的绘制本实验是综合性实验。
其综合性体现在以下几个方面:1.实验内容以及相关知识的综合本实验涉及到多个基本概念,例如相律、相图、溶解度曲线、连接线、等边三角形坐标等,尤其是在一般的实验中(比如分析化学实验、无机化学实验等)作图都是用的直角坐标体系,几乎没有用过三角坐标体系,因此该实验中的等边三角形作图法就具有独特的作用。
这类相图的绘制不仅在相平衡的理论课中有重要意义,而且对化学实验室和化工厂中经常用到的萃取分离中具有重要的指导作用。
2.运用实验方法和操作的综合本实验中涉及到多种基本实验操作和实验仪器(如电子天平、滴定管等)的使用。
本实验中滴定终点的判断,不同于分析化学中的大多数滴定。
本实验的滴定终点,是在本来可以互溶的澄清透明的单相液体体系中逐渐滴加试剂,使其互溶度逐渐减小而变成两相,即“由清变浑”来判断终点。
准确地掌握滴定的终点,有助于学生掌握多种操作,例如取样的准确、滴定的准确、终点的判断准确等。
一.实验目的1.掌握相律,掌握用三角形坐标表示三组分体系相图。
2.掌握用溶解度法绘制三组分相图的基本原理和实验方法。
二.实验原理三组分体系K=3,根据相律:f=K–φ+2=5–ф式中ф为相数。
恒定温度和压力时:f=3–φ当φ=1,则f=2因此,恒温恒压下可以用平面图形来表示体系的状态与组成之间的关系,称为三元相图。
一般用等边三角形的方法表示三元相图。
在萃取时,具有一对共轭溶液的三组分相图对确定合理的萃取条件极为重要。
在定温定压下,三组分体系的状态和组分之间的关系通常可用等边三角形坐标表示,如图1所示:图1图2等边三角形三顶点分别表示三个纯物质A,B,C。
AB,BC,CA,三边表示A和B,B和C,C和A所组成的二组分体系的组成。
三角形内任一点则表示三组分体系的组成。
如点P的组成为:A%=CbB%=AcC%=Ba具有一对共轭溶液的三组分体系的相图如图2所示。
该三液系中,A和B,及A和C完全互溶,而B和C部分互溶。
实验五三元体系(H2O-HAC-CHCl3)相图的绘制一.实验目的:1.熟悉相律和利用等边三角形坐标表示三组分相图的方法。
2.用溶解度法绘制具有一对共轭溶液的三组分相图,并绘制连接线。
二、基本原理:根据相律,f=c-φ+2=3+2-φ=5-φ,若指定温度和压力,则f**=3-φ,f**最多为2,可用平面图来表示。
图1 (a)图1(b)图2(1)物系点组成的确定:在定温定压下,三组分体系的状态和组成之间的关系通常可用等边三角形坐标来表示,如图1(a),等边三角形三顶点A、B和C分别表示三个纯物质,AB,BC及CA三边分别表示A和B,B和C以及C和A所组成的二组分组成。
三角形内任一点,则表示三组分的组成。
如O点的组成:A%=Cc’,B%=Aa’,C%=Bb’。
即各物种的组成为过物系点O做各顶点对边的平行线。
又因为各物种总的百分组成为100%,三角形为等边三角形,所以又可以由其中的一条边表示各组分的百分组成,如图1中(b)所示。
当然,给出一定组成的溶液百分比,按照上述表示方法,也应该能找出对应的物系点。
(2)溶解度曲线的绘制对于具有一对共轭溶液的三液系相图,如图2,该三液系相图中A和B,A和C为完全互溶而B和C为部分互溶,曲线abc为溶解度曲线。
曲线上方为单相区,曲线下方为二相区,物系点落在二相区内,即分为二相,如X 点则分成组成为E和F的二相,而EF线称为连接线。
对于溶解度曲线的绘制,本实验是先以完全互溶的两个组分(如A和C),以一定的比例混合所组成的均相溶液,如图2上的N点,滴加入组分B,根据平衡相图的直线规则,物系点则沿着NB移动,直至溶液变混,即为L点。
再加入A,物系点由LA上升至N’点而变清。
再加入B,此时物系点又沿着N’B由N’移动至L’而再次变混,再滴加A使变清……,如此反复,最后连接L,L’,L’’……即可画出溶解度曲线。
(3)连接线的绘制由于连接线是表示在两相区内呈平衡两相的组成(或A在两相中的分配),所以可以在两相区内配制溶液,待平衡后分析每相中的任何一种组成的含量,连接在溶解度曲线上该两含量的组成点而得出。
三液系(三氯甲烷~醋酸~水)相图的绘制薛念华一.实验目的:1.熟悉相律和用三角形坐标表示三组分相图的方法。
2.用溶解度法绘制具有一对共轭溶液的三组分相图。
二.实验原理:在定温定压下,三组分体系的状态和组成之间的关系通常可用等边三角形坐标,如下图所示。
等边三角形三顶点分别表示三个纯物A、B、C。
AB、BC、CA三边分别表示A和B、B和C、C和A所组成的二组分体系的组成。
三角形内任一点则表示三组分体系的组成。
如O点的组成为A%=Cc’,B%=Aa’,C%=Bb’。
具有一对共轭溶液的三组分体系相图,在该三液系中,A和B、A和C完全互溶,而B和C只能有限度的互溶,B和C的浓度在Ba和Cd之间可以完全互溶,介于ad 之间体系分为两层,一层是B在C中的饱和溶液(d点),另一层是C在B中的饱和溶液(a点),这对溶液称为共轭溶液。
曲线abd为溶解度曲线。
曲线外是单相区,曲线内是二相区。
物系点落在两相区内即分成二相,如O点分成组成为E和F的二相,EF 线称为连结线。
绘制溶解度曲线的方法较多。
本实验是先在完全互溶的两个组分(如A和C)以一定的比例混合所成的均相溶液(如图II上的N点)中滴加入组分B,物系点则沿NB 线移动,直至溶液变浑,即为L点,然后加入A,物系点沿LA上升至N’点而变清。
如再滴加B,则物系点又沿N’B移动,当移至L’点时溶液再次变浑。
再滴加A使之变清……。
如此重复,最后连接L,L’,L’’……,即可绘出溶解度曲线。
三.仪器与药品:滴定管(50mL,酸式)×1,滴定管(50mL,碱式)×1,有塞锥形瓶(100mL)×2,有塞锥形瓶(25mL)×4,锥形瓶(100mL)×2,移液管(2mL,胖肚)×4,移液管(5mL,刻度)×2,移液管(10mL,刻度)×1,分液漏斗(60mL)×2,漏斗架×1,氯仿(分析纯),冰醋酸(分析纯),0.5mol/L标准NaOH溶液。
基
础
化
学
实
验
实验 三相图的绘制——O
H HCl CHCl 23--体系
三元相图的绘制
本实验是综合性实验。
其综合性体现在以下几个方面:
1.实验内容以及相关知识的综合
本实验涉及到多个基本概念,例如相律、相图、溶解度曲线、连接线、等边三角形坐标等,尤其是在一般的实验中(比如分析化学实验、无机化学实验等)作图都是用的直角坐标体系,几乎没有用过三角坐标体系,因此该实验中的等边三角形作图法就具有独特的作用。
这类相图的绘制不仅在相平衡的理论课中有重要意义,而且对化学实验室和化工厂中经常用到的萃取分离中具有重要的指导作用。
2.运用实验方法和操作的综合
本实验中涉及到多种基本实验操作和实验仪器(如电子天平、滴定管等)的使用。
本实验中滴定终点的判断,不同于分析化学中的大多数滴定。
本实验的滴定终点,是在本来可以互溶的澄清透明的单相液体体系中逐渐滴加试剂,使其互溶度逐渐减小而变成两相,即“由清变浑”来判断终点。
准确地掌握滴定的终点,有助于学生掌握多种操作,例如取样的准确、滴定的准确、终点的判断准确等。
一.实验目的
1. 掌握相律,掌握用三角形坐标表示三组分体系相图。
2. 掌握用溶解度法绘制三组分相图的基本原理和实验方法。
二.实验原理
三组分体系K = 3,根据相律:
f = K–φ+2 = 5–ф
式中ф为相数。
恒定温度和压力时:
f = 3–φ
当:φ= 1
则: f = 2
因此,恒温恒压下可以用平面图形来表示体系的状态与组成之间的关系,称为三元相图。
一般用等边三角形的方法表示三元相图。
对共轭溶液的三组分体系,即三组分中二对液体AB及AC完全互溶,而另一对BC则不溶或部分互溶的相图,如图5-1所示。
图中EK1K2K3DL3L2L1F是互溶度曲线;K1L1,K2L2是连结线。
互溶度曲线下面是两相区,上面是一相区。
共轭溶液的三元相图(A:醋酸;B:水;C:氯仿)
三.实验准备
1. 仪 器:具塞磨口锥形瓶,酸式滴定管,碱式滴定管,移液管,分析天平。
2. 药 品:冰醋酸,氯仿,NaOH 溶液(0.2mol·mol –3),酚酞指示剂。
四.操作要点(各实验步骤中的操作关键点)
1. 因所测的中含有水的成分,所以玻璃器皿均需干燥。
2. 在实验过程中要注意防止或尽可能减少氯仿和乙酸的挥发,测定连接线时取样要迅速。
3. 当体系中乙酸含量少时,滴加水要逐滴加入,注意判断终点。
1. 在洁净的酸式滴定管内装水,移取6ml 氯仿及1ml 醋酸于干燥洁净的100ml 磨口锥形瓶中,然后慢慢滴入水,且不停地振摇,至溶液由清变浊,即为终点,记下水的体积。
再向此瓶中加入2ml 醋酸。
体系又成均相,继续用水滴至终点。
同法再依次加入3.5ml ,6.5ml 醋酸,并分别再用水滴定,记录各次各组分的用量。
最后加入40ml 的水,盖紧瓶塞,每隔5min 振摇一次,约30min 后将此溶液作测量连接线使用(溶液1)。
2. 另取一干燥洁净的100ml 磨口锥形瓶,用移液管移入1ml 氯仿和3ml 醋酸。
用水滴定至终点,以后依次再添加2ml ,5ml ,6ml 醋酸。
分别用水滴定至终点。
记录各次各组分的用量。
最后加入9ml 氯仿和5ml 醋酸,混合均匀,每隔5min 振摇一次,约30min 后作为测量另一根连接线使用(溶液2)。
3.将2只25ml 磨口锥形瓶称重,待用。
将溶液1和溶液2静置,待溶液分层后,用干燥洁净的移液管吸取溶液1上层2ml ,下层2ml ,分别放入已经称重的25ml 磨口锥形瓶中,再称其重量。
然后以酚酞为指示剂,用0.5M 的NaOH 溶液滴定至终点。
4.同步骤3,移取溶液2上层液2ml 和下层液2ml ,称重并滴定。
五.本实验的成败关键
1. 酸式滴定管和碱式滴定管的操作正确和规范。
2. 测定溶解度曲线时滴定终点“由清变浑”的准确判断。
六、数据处理
序列 CH 3COOH CHCl 3 H 2O M/(g) ω/(%) V/(mL) m/(g) V/(mL) m/(g) V/(mL) m/(g) CH 3COOH CHCl 3 H 2O
1 1 1.07
2 6 9.1584 0.1 0.1 10.3304 10.38 88.65 0.97
3 3.216 6 9.158
4 0.4
5 0.45 12.8244 25.08 71.41 3.51 6.5 6.968
6 9.1584 2.25 2.25 18.3764 37.92 49.84 12.24 13 13.936 6 9.1584 7.2
7 7.27 30.3644 45.9 30.16 23.94 2 3 3.216 2 3.052
8 1.35 1.35 7.6188 42.21 40.07 17.72 5 5.36 2 3.0528 2.85 2.85 11.2628 47.6 27.11 25.2
9 10 10.72 2 3.0528 8.41 8.41 22.1828 48.33 13.76 37.91 16 17.152 2 3.0528 18.73 18.73 38.9348 44.05 7.84 48.11
七、问题讨论
1.若滴定过程中不小心超过终点,是否需要重做?
答:滴定过程中若不小心超过终点,可以再滴加几滴醋酸(记录加入量),至刚由浑变清作为终点,记录实际各组分的用量。
无需返工。
2.不同温度时各物质的密度:
9362310)(10)(10)(---⨯-+⨯-+⨯-+=S S s s T T T T T T T d d γβ
α
K T S 5.273。