各种酸的酸性值
- 格式:doc
- 大小:24.50 KB
- 文档页数:1

食品中各种酸的测定方法附公式酸度的测定概述食品中的酸味物质,主要是溶于水的一些有机酸和无机酸。
在果蔬及其制品中,以苹果酸,柠檬酸,酒石酸,琥珀酸和醋酸为主;在肉,鱼类食品中则以乳酸为例。
此外,还有一些无机酸,像盐酸,磷酸等。
这些酸味物质,有的是食品中的天然成分,像葡萄中的酒石酸,苹果中的苹果酸;有的是人为的加进去的,像配制型饮料中加入的柠檬酸;还有的是在发酵中产生的,像酸牛奶中的乳酸。
酸在食品中主要有以下三个方面的作用。
1、显味剂不论是哪种途径得到的酸味物质,都是食品重要的显味剂,对食品的风味有很大的影响。
其中大多数的有机酸具有很浓的水果香味,能刺激食欲,促进消化,有机酸在维持人体体液酸碱平衡方面起着重要的作用。
2、保持颜色稳定食品中的酸味物质的存在,即pH值的高低,对保持食品的颜色的稳定性,也起着一定的作用。
在水果加工过程中,如果加酸降低介质的pH值,可抑制水果的酶促褐度;选用pH6.5-7.2的沸水热烫蔬菜,能很好地保持绿色蔬菜特有的鲜绿色。
3、防腐作用酸味物质在食品中还能起到一定的防腐作用。
当食品的pH小于2.5时,一般除霉菌外,大部分微生物的生长都受到了抑制;若将醋酸的浓度控制在6%时,可有效地抑制腐败菌的生长食品中酸度测定的意义1.测定酸度可判断果蔬的成熟程度例如:如果测定出葡萄所含的有机酸中苹果酸高于酒石酸时,说明葡萄还未成熟,因为成熟的葡萄含大量的酒石酸。
不同种类的水果和蔬菜,酸的含量因成熟度、生长条件而异,一般成熟度越高,酸的含量越低。
如番茄在成熟过程中,总酸度从绿熟期的0.94%下降到完熟期的0.64%,同时糖的含量增加,糖酸比增大,具有良好的口感,故通过对酸度的测定可判断原料的成熟度。
2.可判断食品的新鲜程度例如:新鲜牛奶中的乳酸含量过高,说明牛奶已腐败变质;水果制品中有游离的半乳糖醛酸,说明受到霉烂水果的污染。
3.酸度反映了食品的质量指标食品中有机酸含量的多少,直接影响食品的风味、色泽、稳定性和品质的高低。

浅谈有机物的酸碱性作者:(总汇)张宏琛201610518226 王含宇 201610518219(要点总结)有机物的列举:肖欢欢 201610518221影响酸碱性的因素:杜文倩 201610518207有机物酸碱性在实际中的应用:屈婷敏 201610518218摘要:本文探讨的有机物酸碱性仅限于汪小兰编《有机化学(第四版)》.本篇论文从有机物酸碱性的影响因素、有机物酸碱性的实际应用等方面进行了简要的阐述。
罗列出了一部分具有代表性的酸碱性有机物。
参考文献:《有机化学(第四版)》汪小兰编一、具有酸碱性的有机物列举在有机化合物的世界中,具有酸碱性的有机物包括了以下种类:炔类物质(具有末端氢)、醇、酚、醚、酮类、醛类、羧酸、取代酸、酰胺类、碳酸的衍生物类、脂肪族硝基化合物、吡咯、吡啶、生物碱等。
以下是代表性物质举例。
酸性有机物质:丙炔、乙醇(弱酸性、极弱碱性)、苯酚、丙酮、乙醛、乙酸、三氯乙酸(强酸性)、EDTA、乙酰胺(中性)、邻苯二甲酰亚胺、乳酸、水杨酸、丙酮酸、乙酰乙酸乙酯、硝基乙烷、吡咯碱性有机物:甲醚(能够接受质子)、尿素、胍(强碱性)、二甲胺、吡啶、烟碱二、代表性酸碱性有机物结构分析①具有末端氢的炔类物质由于sp杂化碳原子的电负性比sp2或sp3杂化碳原子的电负性强,所以与sp杂化碳原子相连的氢原子显弱酸性,能被某些金属离子取代。
②醇的似水性醇与水都含有一个与氧原子结合的氢,这个氢表现了一定程度的酸性,但由于烷基的给电子效应,醇中氧原子上电子密度比水中的高,所以醇的酸性比水还弱(但比炔氢强)。
醇不能与碱的水溶液作用,而只能与碱金属或碱土金属作用放出氢气.由于醇的酸性比水弱,所以RO-(烷氧基)的碱性比HO-强,因此醇化物遇水则分解成醇和金属氧化物。
醇与水的另一相似之处则是,醇也可作为质子的接受体,通过氧原子上的未共用电子对与酸中的质子结合形成钅羊离子(RO+H2)。
它们碱性极弱,只能由强酸中接受质子。



无机含氧酸的酸性及氧化性的比较1无机含氧酸的酸性无机含氧酸可以的分于式为HmROn,其通式可以写成Hl-Rm-〔()-H〕n,:其中1小可以为0, n>0],也可写成其中R称为成酸元素,•无机含氧酸在水溶液中的酸强度取决于酸分于中短基OH的电商程度,也可以用Pka值来衡長,酸分于老基中的质于在电离过程中脱离氧原于,转移到水分子中的孤对电于对上,其捷移的难易程度取决于成酸元素R 吸引羟基氧原于电于的能力。
如果成酸无素R的电负性越大,R周围的非轻基氧原于数目越多,则其酸性越强。
原因是成酸元素R 的电负性越大,贝IJ其偏移()的电于越少,从而减小了()原于周围的电于密度增大的趋势,使得其对质于的吸引减弱,有利于质于的转移;非軽基氧原于越多,则分于周围越易形成离域兀键,这种键将成酸R原于及()原于包裏在其中,一方面增强丁短基-O-H键的极性,有利于质于的粳移,其次使得整个酸基团周围的空间减小,阻碍了质于与()原于上孤对电于的结台,从而使得酸性增强。
含氧酸的酸性一般存在如下规律[1]:⑴同一成酸元素若能形成几种不同氧化态的含氧酸,其酸性依氧化数递增而递增;如HC1O4 >HC1()3>HC1()2>HCK)〔原因:从HCK)到HC1O4非短基氧原于逐渐增多,包基-O-H键的极性増强,质于转移程度增强,故酸性增强〕⑵在同一主族中,处于相同氧化态的成酸元素,其含氧酸的酸性随原于序教递增,自上而下减弱。
SO H ClO>HBrO>HIO, HC1O2>HBrO2>HIO2HCiO3>HBrO3>键HI()3、HCK)4>HBr()4>Hl()4〔原因:同主族元素自上而下,成酸元素的电负性逐渐减小,原于半径增大,吸引轻基囊原于的能力依次减小,轻基-()-H键的极性依次减小,所以酸性依次减弱。
〕(3)在同一周期中,处于晟高氧化态的成酸元素,其含氧酸的酸性随原于序数递増,自左至右增强。
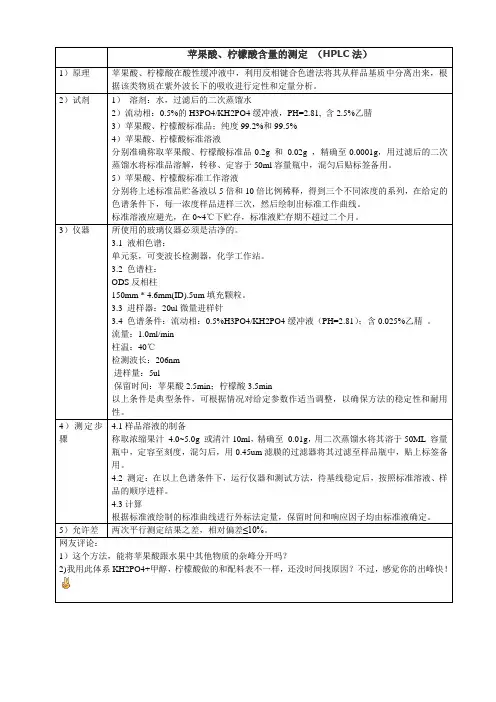
苹果酸、柠檬酸含量的测定(HPLC法)1)原理苹果酸、柠檬酸在酸性缓冲液中,利用反相键合色谱法将其从样品基质中分离出来,根据该类物质在紫外波长下的吸收进行定性和定量分析。
2)试剂1)溶剂:水,过滤后的二次蒸馏水2)流动相:0.5%的H3PO4/KH2PO4缓冲液,PH=2.81, 含2.5%乙腈3)苹果酸、柠檬酸标准品;纯度99.2%和99.5%4)苹果酸、柠檬酸标准溶液分别准确称取苹果酸、柠檬酸标准品0.2g 和0.02g ,精确至0.0001g,用过滤后的二次蒸馏水将标准品溶解,转移、定容于50ml容量瓶中,混匀后贴标签备用。
5)苹果酸、柠檬酸标准工作溶液分别将上述标准品贮备液以5倍和10倍比例稀释,得到三个不同浓度的系列,在给定的色谱条件下,每一浓度样品进样三次,然后绘制出标准工作曲线。
标准溶液应避光,在0~4℃下贮存,标准液贮存期不超过二个月。
3)仪器所使用的玻璃仪器必须是洁净的。
3.1 液相色谱:单元泵,可变波长检测器,化学工作站。
3.2 色谱柱:ODS反相柱150mm * 4.6mm(ID).5um填充颗粒。
3.3 进样器:20ul微量进样针3.4 色谱条件:流动相:0.5%H3PO4/KH2PO4缓冲液(PH=2.81);含0.025%乙腈。
流量:1.0ml/min柱温:40℃检测波长:206nm进样量:5ul保留时间:苹果酸2.5min;柠檬酸3.5min以上条件是典型条件,可根据情况对给定参数作适当调整,以确保方法的稳定性和耐用性。
4)测定步骤4.1样品溶液的制备称取浓缩果汁 4.0~5.0g 或清汁10ml,精确至0.01g,用二次蒸馏水将其溶于50ML 容量瓶中,定容至刻度,混匀后,用0.45um滤膜的过滤器将其过滤至样品瓶中,贴上标签备用。
4.2 测定:在以上色谱条件下,运行仪器和测试方法,待基线稳定后,按照标准溶液、样品的顺序进样。
4.3计算根据标准液绘制的标准曲线进行外标法定量,保留时间和响应因子均由标准液确定。

日化洗涤品的酸碱性ph值比较及解说洗涤剂是通过洗净过程用于清洗而专门配制的产品。
主要组分通常由表面活性剂、助洗剂和添加剂等组成。
洗涤剂的种类很多,按照去除污垢的类型,可分为重垢型洗涤剂和轻垢型洗涤剂;按照产品的外形可分为粉状、块状、膏状、浆状和液体等多种形态。
酸性洗涤剂和碱性洗涤剂的区别?
酸性洗涤剂和碱性洗涤剂的区别
1、主要区别:酸性清洁剂具有杀菌除臭的功能,除去碱性顽渍斑垢;碱性清洁剂清除一些油脂类脏垢和酸性污垢。
2、成分不同:碱性清洗剂,其主要是以表面活性剂和其它原料复配而成的;酸性清洗剂是以胺类、添加剂为原料,经混合溶解而制成的一种洗涤剂。
3、酸碱度不同:碱性清洗剂的PH值,碱性值比较高,一般PH 值大于7。
酸性清洗剂的PH值,酸性值比较高,一般ph值小于7,对人体皮肤都有一定伤害。
金属表面油脂中的动植物油(主要成分是硬脂酸),与碱性清洗剂中的碱生成硬脂酸钠(即肥皂)和甘油溶解进入碱性溶液,俗称皂化反应,以除去金属表面油脂。
酸性清洗剂除油脂是一种使用十分广泛的办法。
它使用表面活性剂的乳化、潮湿、渗透原理,并借助于酸腐蚀金属发生氢气的机械剥离作用,到达除油脂的意图。

酸性碱性ph值范围
酸性碱性ph值范围是指物质在水溶液中的酸碱度,从而决定了溶液中物质的性质。
PH值介于0~14之间,7为中性,大于7为碱性,小于7为酸性。
可以通过使用PH试纸来测量溶液的PH值。
PH值主要包括:
1. 酸性范围:PH值低于7,呈酸性的溶液,常见的酸性物质有柠檬酸、硫酸、盐酸、磷酸等。
柠檬酸的PH值约为
2.0-2.5,硫酸的PH值约为1.3-2.0,盐酸的PH值约为
1.0-1.5,磷酸的PH值约为
2.4-
3.0。
2. 碱性范围:PH值高于7,呈碱性的溶液,常见的碱性物质有烧碱、氢氧化钠、氢氧化钙等。
烧碱的PH值约为11.0-12.5,氢氧化钠的PH值约为10.5-11.5,氢氧化钙的PH值约为10.3-11.3。
3. 中性:PH值为7的溶液为中性,常见的中性物质有水、乙醇等。
水的PH值为7.0,乙醇的PH值约为6.5-7.5。
4. 混合性:PH值处于7以上或7以下的混合液,其PH值可以通过添加碱性物质或酸性物质而变化。
碱性和酸性溶液中的物质彼此之间存在平衡作用。
混合性溶液中,如果添加酸性物质,PH值会变低;如果添加碱性物质,PH值会变高。
酸性碱性PH值范围对生物体的生活有着重要的意义,人体内的PH值一般为7.4,偏离此值会影响正常的新陈代谢等生理活动。
如果碱性PH值过高,会引起胃部痉挛疼痛;如果酸性PH值过低,会引起皮肤出现瘙痒等症状。
因此,要保持健康,最好的方法就是保持正常的酸性碱性PH 值范围。


浅谈有机物的酸碱性作者:(总汇)张宏琛201610518226 王含宇 201610518219(要点总结)有机物的列举:肖欢欢 201610518221影响酸碱性的因素:杜文倩 201610518207有机物酸碱性在实际中的应用:屈婷敏 201610518218摘要:本文探讨的有机物酸碱性仅限于汪小兰编《有机化学(第四版)》。
本篇论文从有机物酸碱性的影响因素、有机物酸碱性的实际应用等方面进行了简要的阐述。
罗列出了一部分具有代表性的酸碱性有机物。
参考文献:《有机化学(第四版)》汪小兰编一、具有酸碱性的有机物列举在有机化合物的世界中,具有酸碱性的有机物包括了以下种类:炔类物质(具有末端氢)、醇、酚、醚、酮类、醛类、羧酸、取代酸、酰胺类、碳酸的衍生物类、脂肪族硝基化合物、吡咯、吡啶、生物碱等。
以下是代表性物质举例。
酸性有机物质:丙炔、乙醇(弱酸性、极弱碱性)、苯酚、丙酮、乙醛、乙酸、三氯乙酸(强酸性)、EDTA、乙酰胺(中性)、邻苯二甲酰亚胺、乳酸、水杨酸、丙酮酸、乙酰乙酸乙酯、硝基乙烷、吡咯碱性有机物:甲醚(能够接受质子)、尿素、胍(强碱性)、二甲胺、吡啶、烟碱二、代表性酸碱性有机物结构分析①具有末端氢的炔类物质由于sp杂化碳原子的电负性比sp2或sp3杂化碳原子的电负性强,所以与sp杂化碳原子相连的氢原子显弱酸性,能被某些金属离子取代。
②醇的似水性醇与水都含有一个与氧原子结合的氢,这个氢表现了一定程度的酸性,但由于烷基的给电子效应,醇中氧原子上电子密度比水中的高,所以醇的酸性比水还弱(但比炔氢强)。
醇不能与碱的水溶液作用,而只能与碱金属或碱土金属作用放出氢气。
由于醇的酸性比水弱,所以RO-(烷氧基)的碱性比HO-强,因此醇化物遇水则分解成醇和金属氧化物。
醇与水的另一相似之处则是,醇也可作为质子的接受体,通过氧原子上的未共用电子对与酸中的质子结合形成钅羊离子(RO+H2)。
它们碱性极弱,只能由强酸中接受质子。

浅谈有机物的酸碱性作者:王含宇(要点总结)有机物的列举:肖欢欢影响酸碱性的因素:杜文倩有机物酸碱性在实际中的应用:屈婷敏摘要:本文探讨的有机物酸碱性仅限于汪小兰编《有机化学(第四版)》。
本篇论文从有机物酸碱性的影响因素、有机物酸碱性的实际应用等方面进行了简要的阐述。
罗列出了一部分具有代表性的酸碱性有机物。
参考文献:《有机化学(第四版)》汪小兰编一、具有酸碱性的有机物列举在有机化合物的世界中,具有酸碱性的有机物包括了以下种类:炔类物质(具有末端氢)、醇、酚、醚、酮类、醛类、羧酸、取代酸、酰胺类、碳酸的衍生物类、脂肪族硝基化合物、吡咯、吡啶、生物碱等。
以下是代表性物质举例。
酸性有机物质:丙炔、乙醇(弱酸性、极弱碱性)、苯酚、丙酮、乙醛、乙酸、三氯乙酸(强酸性)、EDTA、乙酰胺(中性)、邻苯二甲酰亚胺、乳酸、水杨酸、丙酮酸、乙酰乙酸乙酯、硝基乙烷、吡咯碱性有机物:甲醚(能够接受质子)、尿素、胍(强碱性)、二甲胺、吡啶、烟碱二、代表性酸碱性有机物结构分析①具有末端氢的炔类物质由于sp杂化碳原子的电负性比sp2或sp3杂化碳原子的电负性强,所以与sp杂化碳原子相连的氢原子显弱酸性,能被某些金属离子取代。
②醇的似水性醇与水都含有一个与氧原子结合的氢,这个氢表现了一定程度的酸性,但由于烷基的给电子效应,醇中氧原子上电子密度比水中的高,所以醇的酸性比水还弱(但比炔氢强)。
醇不能与碱的水溶液作用,而只能与碱金属或碱土金属作用放出氢气。
由于醇的酸性比水弱,所以RO-(烷氧基)的碱性比HO-强,因此醇化物遇水则分解成醇和金属氧化物。
醇与水的另一相似之处则是,醇也可作为质子的接受体,通过氧原子上的未共用电子对与酸中的质子结合形成钅羊离子(R O+H2)。
它们碱性极弱,只能由强酸中接受质子。
因此醇可溶于浓强酸中。
③酚的酸性由于酚羟基中氧原子的p轨道与苯环形成p-π共轭体系,氧上未共用电子对向苯环转移。
因而,H-O之间电子密度比醇中的低,也就是H-O之间的结合较醇中的弱,所以酚羟基中的氢较醇羟基的氢更容易以H+形式解离。
二、清洗中常用的有机酸用于酸洗的有机酸很多,常用的有氨基磺酸、羟基乙酸、柠檬酸、乙二胺四乙酸等,用有机酸酸洗与元机酸相比,成本比较高,需要在较高温度下操作,清洗消耗时间较长,这是它的缺点。
但有机酸往往腐蚀性较小,有的有机酸有螯合能力,可以用在设备不停车清洗上,所以有其特点和使用价值。
1.氨基磺酸氨基磺酸分子式为NH2S03H,一元强酸。
市售商品为固体,是由尿素和发烟硫酸反应得到的产品,25℃时密度为2.126g/cm3,熔点为205℃,在209℃开始分解。
常温下只要保持干燥不与水接触,它不吸潮是比较稳定的,因而便于运输。
氨基磺酸的水溶液酸性与盐酸、硫酸相似,因此又称固体硫酸。
它具有不挥发,无臭味,对人毒性极小的特点。
但长时间与皮肤接触,或进入眼睛也是有害的,应注意防止。
但当相对湿度大于70%时,氨基磺酸开始潮解,在高温下会水解生成硫酸铵和硫酸氢铵:NH2SO3H+H2O===NH4HSO42NH4HSO4===(NH4)2SO4+H2504清洗温度一般要控制在60℃以下,以减少其水解。
当温度超过130℃时,浓的氨基磺酸水溶液在密闭容器中快速分解,并产生大量蒸气会引起爆炸,在使用中要引起注意。
氨基磺酸的碱土金属盐有很好的溶解性,氨基磺酸与钙镁垢反应剧烈。
通常2E_qk上使用7%~10%浓度的氨基磺酸水溶液作清洗剂,在60℃以下温度除垢,一般在1h内可将90%的钙镁垢转变成可溶性氨基磺酸盐而去除。
反应式为:CaCO3十2NH2S03H==Ca(NH2S03)2+H2O+C02↑MgCO3+2NH2S03H==Mg(NH2SO3)2+H2O+CO2↑Mg(OH)2+2NH2S03H==Mg(NH2SO3)2+2H2O氨基磺酸水溶液对铁锈作用较慢,可添加一些氯化物如NaCl等,使之缓慢产生盐酸,从而朋效地溶解铁锈。
由于氨基磺酸盐的多数金属盐在水中溶解度较高,不会在清洗液中产生沉淀。
而氨硼酸对金属腐蚀性小,所以常被用来清洗钢铁、铜、不锈钢、铝以及陶瓷等材料制造的设备外表上的铁锈和水垢。
酸度ag的值域-概述说明以及解释1.引言1.1 概述概述部分的内容可以是对整篇文章的简要介绍,包括酸度ag值域的定义和意义。
可以按照以下方式撰写概述部分的内容:在这篇文章中,我们将探讨酸度ag的值域及其在化学分析和环境监测等领域中的重要意义。
酸度ag是用来描述溶液酸性强弱的一个指标,它可以通过测量溶液中的氢离子浓度来确定。
酸度ag值域的分析对于理解和评估溶液的酸碱性质至关重要。
本文将首先介绍酸度ag的定义和相关背景知识,包括其在化学领域中的应用和意义。
我们将进一步讨论酸度ag的测量方法,包括常用的酸度计和pH计的原理和使用。
酸度ag的值域分析将在接下来的章节中进行,我们将探讨不同酸度ag值对应的溶液酸性等级,并详细解释不同值域的特点和应用范围。
通过本文的研究,我们将总结出酸度ag的值域,为溶液酸碱性的测量和评价提供参考。
此外,我们将展望酸度ag的未来应用,包括其在环境监测和生物医学领域中的潜在价值。
最后,我们将得出结论,并提出进一步研究的建议,以促进酸度ag值域在更广泛领域的应用和发展。
通过本文的研究,我们希望能够加深对酸度ag值域的理解,为相关领域的科学研究和实践工作提供有益的参考和指导。
1.2 文章结构文章结构:本文主要分为以下几个部分:引言、正文和结论。
引言部分首先对整篇文章进行了概述,简要介绍了酸度ag的定义和意义,同时提出了本文的目的。
正文部分将详细讨论酸度ag的定义和意义。
首先解释了酸度ag的概念,并探讨了其在化学和环境领域中的重要性。
然后介绍了酸度ag的测量方法,包括常见的实验方法和仪器设备的应用。
接下来,对酸度ag的值域进行了分析,阐明了其取值范围及相关理论原理。
在这一部分,我们将探讨酸度ag与其他化学参数之间的关系,并分析其变化规律。
结论部分对整篇文章进行总结,并对酸度ag的值域进行了概述。
同时,对酸度ag的意义和应用进行了展望,指出了其在环境保护、工业生产和科学研究等方面的重要性。
- 31.30:氟锑酸
- 19.20:魔酸
- 18.00:碳硼烷酸- 15.10:氟磺酸
- 10.00:高氯酸
–9.48:氢碘酸
- 9.00:氢溴酸
- 8.00:盐酸
- 3.00、+1.99:硫酸- 2.00:硝酸
- 1.76:水合氢离子- 1:氨基磺酸2.12:磷酸
3.15:氢氟酸
3.75:甲酸
4.04:抗坏血酸(维生素C)
4.19:琥珀酸
4.20:苯甲酸
4.63:苯胺*
4.74:乙酸(醋酸)
4.76:柠檬酸二氢根离子
5.21:吡啶*
6.35:碳酸**
6.40:柠檬酸一氢根离子
6.99:乙二胺*
7.00:硫化氢、咪唑*(作为酸)
7.21:磷酸二氢根离子(磷酸二氢盐)7.50:次氯酸
9.25:氨*
9.30:氢氰酸
9.33:苯甲胺*
9.81:三甲胺*
9.99:酚
10.08:乙二胺*
10.66:甲胺*
10.73:二甲胺*
10.81:乙胺*
11.01:三乙胺*
11.09:二乙胺*
11.65:过氧化氢
12.50:胍*
12.67:磷酸一氢根离子(磷酸一氢盐)
14.58:咪唑(作为碱)
15.74:水
- 19.00(pKb):氨基化钠
26.00:六甲基二硅基胺基钾(KHMDS) 34:液氨*
37.00 四甲基哌啶锂(LiTMP)
37.00:二异丙基胺基锂(LDA)
45.00:丙烷
50.00:乙烷。
判断酸性强弱方法
以《判断酸性强弱方法》为标题,写一篇3000字的中文文章
酸性是一种重要的物理性质,它正在日常生活中起着重要作用。
酸性是确定酸性强弱的主要因素。
因此,研究判断酸性强弱的方法对于解决各种实际问题和安全措施有重要作用,也是广大科研工作者研究的重点。
首先,要判断酸性的强弱,应该采用pH值的方法。
pH值是一种衡量液体的酸碱性的系统,它表明溶液的强度,介于0~14之间,碱性溶液的pH值大于7,酸性溶液的pH值小于7。
此外,也可以采用量子化学的方法来判断酸性的强弱,例如量子计算、分子动力学模拟和振动性能等技术。
其次,要判断酸性的强弱,还可以采用分析化学的方法。
如元素分析法,根据样品中某种元素的含量,比如硫和氮元素,来推测样品的性质,如酸性和强度。
还可以通过离子分析法,来确定样品中离子种类和含量,从而进一步界定样品的性质,例如酸性和强度。
最后,可采用显微镜技术,例如巴斯德实验法和荧光技术,来判断样品的酸性和强度。
巴斯德实验是将酸性液体滴入硬脂酸和双氧水中,观察溶液变色情况,以此来比较酸性强弱。
荧光技术通过紫外线照射样品,研究样品的荧光发射及其强度,也可以用于判断样品的酸性强弱。
综上所述,判断酸性强弱的方法有很多种,根据实际应用的需要,可以采用pH值测量、量子化学分析、分析化学分析以及显微镜分析
等技术,找出结果的最佳组合,来快速准确地判断酸性强弱。
未来,为了改善酸性判断的准确性,可以将传统的实验方法与现代技术结合起来,以开发更为准确、灵敏、有效的酸性判断方法,保证样品评估的准确性和周全性,对于满足日常生活、工业生产和科学研究中的实际应用,都具有重要的意义。
- 31.30:氟锑酸
- 19.20:魔酸
- 18.00:碳硼烷酸- 15.10:氟磺酸
- 10.00:高氯酸
–9.48:氢碘酸
- 9.00:氢溴酸
- 8.00:盐酸
- 3.00、+1.99:硫酸- 2.00:硝酸
- 1.76:水合氢离子- 1:氨基磺酸2.12:磷酸
3.15:氢氟酸
3.75:甲酸
4.04:抗坏血酸(维生素C)
4.19:琥珀酸
4.20:苯甲酸
4.63:苯胺*
4.74:乙酸(醋酸)
4.76:柠檬酸二氢根离子
5.21:吡啶*
6.35:碳酸**
6.40:柠檬酸一氢根离子
6.99:乙二胺*
7.00:硫化氢、咪唑*(作为酸)
7.21:磷酸二氢根离子(磷酸二氢盐)7.50:次氯酸
9.25:氨*
9.30:氢氰酸
9.33:苯甲胺*
9.81:三甲胺*
9.99:酚
10.08:乙二胺*
10.66:甲胺*
10.73:二甲胺*
10.81:乙胺*
11.01:三乙胺*
11.09:二乙胺*
11.65:过氧化氢
12.50:胍*
12.67:磷酸一氢根离子(磷酸一氢盐)
14.58:咪唑(作为碱)
15.74:水
- 19.00(pKb):氨基化钠
26.00:六甲基二硅基胺基钾(KHMDS) 34:液氨*
37.00 四甲基哌啶锂(LiTMP)
37.00:二异丙基胺基锂(LDA)
45.00:丙烷
50.00:乙烷。