工艺风险评估与验证案例
- 格式:pdf
- 大小:1.47 MB
- 文档页数:126

乌鸡白凤丸(水蜜丸)工艺验证
风险评估
评估工艺参数关键性评估报告
基本定义和方法
2
2、评估流程
2.1 工艺流程图:
三步法评估关键工艺参数
1)列出产品生产工艺过程相关的质量风险。
2)筛选影响与工艺相关的关键质量属性的工艺步骤 3)筛选影响质量的工艺参数确定工艺参数最终关键性 3、
风险的评估标准表格。
4
4.评估报告所需的相关文件
评估工艺关键性参数分析表
5.参考文件
5
6
剂
9
由上表可以明确反映出存在质量风险比较大的因素有:1、各投料环节的复核2、干燥、灭菌人为错误或设备故障3、混合均匀度4、泛丸的质量检查
5、空调系统和纯化水系统的人为错误或设备故障
6、内包装质量
7、外盒、标签、纸箱的批号打印的复核。
但是其中能用参数表现的有3、4条,其它条都是QA与工艺员日常重点巡查的项目。
第3、4条可以根据检测出得数据间接判断产品质量并且有些参数直接影响成品质量。
10。
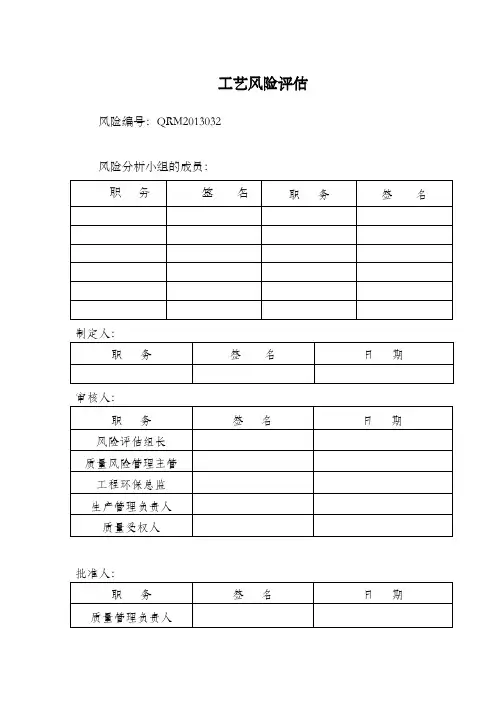
工艺风险评估风险编号:QRM2013032风险分析小组的成员:审核人:一、概述二、风险管理小组人员及职责三、风险评估启动四、执行正式风险评估一、概述一、背景简述我公司新改建成**生产线,按照《药品生产质量管理规范(2010年修订)》及公司相关管理制度的要求,为了确保依照现行的**注射液生产工艺规程能持续稳固地生产出适用于预定用途,符合注册批准和质量标准的药品,并最大限度减少药品生产进程中污染、交叉污染和混淆、过失的风险,故在工艺验证生产前申请对丙泊酚注射液生产工艺进行风险评估。
**注射液*,批准文号别离为国药准字H、H,处方原辅料包括:**。
我公司自2003年起生产**注射液*,在此期间,该产品生产工艺稳固,质量均符合标准规定。
、适用于本公司**生产线**注射液*工艺参数的质量风险评估,包括人流、物流、称量配制、洗瓶、灌封、上车、灭菌检漏、下车、灯签、包装等生产全进程。
、按照公司《质量风险标准管理规程》对“**注射液*”启动质量风险评估。
二、风险评估概述:通过对**注射液**工艺及参数进行分析,找出各参数在生产中影响产品质量属性的因素,再通过FMEA风险管理进行风险评估和风险控制,明确风险点,并制定相应的风险控制办法,确保风险取得有效控制。
二、风险管理小组人员及职责1、按照公司质量风险标准管理规程,成立**注射液*工艺风险评估小组。
三、风险评估启动。
一、风险项目名称:**注射液*工艺风险评估。
二、概念:质量风险管理:用于评估,控制,沟通和评审药物产品贯穿整个产品生命周期质量风险的一个系统化进程。
风险评估:在一个风险管理进程顶用于支持所做的风险决策的组织信息的系统进程。
其包括对危险因素辨识,对暴露在这些危险因素相关风险的分析、评价。
质量属性:一个直接或间接影响物料质量的物理化学或微生物特性(产品指标是生产者提出和证明、由法规机构批准的质量特性)。
工艺参数:在某个工艺下概念单个条件的单个参数。
比如工艺参数有温度、压力、时刻、搅拌、pH、数量等。

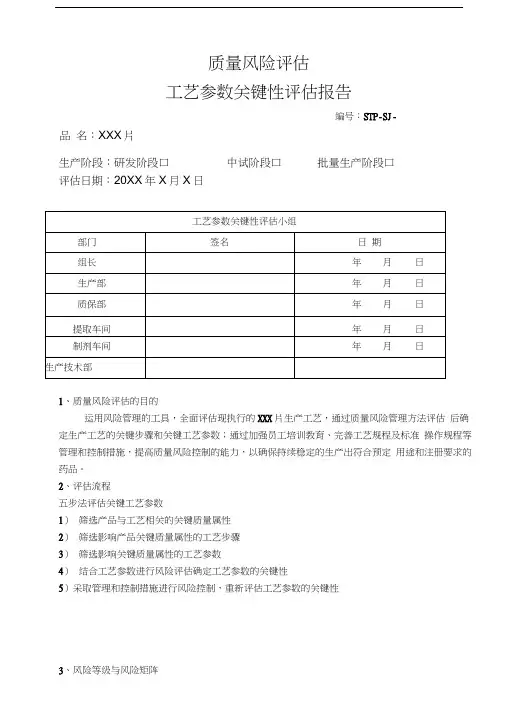
质量风险评估工艺参数关键性评估报告编号:STP-SJ-品名:XXX片生产阶段:研发阶段口中试阶段口批量生产阶段口评估日期:20XX年X月X日1、质量风险评估的目的运用风险管理的工具,全面评估现执行的XXX片生产工艺,通过质量风险管理方法评估后确定生产工艺的关键步骤和关键工艺参数;通过加强员工培训教育、完善工艺规程及标准操作规程等管理和控制措施,提高质量风险控制的能力,以确保持续稳定的生产出符合预定用途和注册要求的药品。
2、评估流程五步法评估关键工艺参数1)筛选产品与工艺相关的关键质量属性2)筛选影响产品关键质量属性的工艺步骤3)筛选影响关键质量属性的工艺参数4)结合工艺参数进行风险评估确定工艺参数的关键性5)采取管理和控制措施进行风险控制,重新评估工艺参数的关键性3、风险等级与风险矩阵3.1风险等级3.2严重性和可能性矩阵(风险等级、内在关键性)风险等级内在关键性低中高 可能性3.3可检测性和内在关键性矩阵(最终关键性) 最终关键性内在关键性4、评估报告相关文件可 检 测 性重 性高 中 低非关键潜在关键关键产品质量属性评估表1—影响工艺步骤评估产品质量属性评估表2—影响工艺参数评估产品风险评估表3—工艺参数关键性评估产品风险评估表4—工艺参数关键性评估(采取管理或控制措施后)说明:1、产品质量属性:根据产品质量指标填写,如:外观、溶解度、鉴别、含量、杂质、水分等。
2、工艺步骤:该栏填写工艺步骤编号和相应的工艺步骤名称。
3、对质量属性有无影响填写“有”或“无” ;人机物法环任何一项或以上对质量属性有影响,结论栏中填写“有” ;均无影响,结论栏中填写“无” 。
4、质量指标(关键质量属性):该栏填写对应的工艺参数发生偏差时可能产生的影响,分高、中、低、无四个等级。
高:影响啊很大,主要决定因素;中:异常时有影响,影响一般;低:有影响但很小;无:无影响。
5、影响:按照该参数对各个关键质量属性各项中最严重程度来确定该参数的最终影响产品质量的程度。

生产工艺验证风险评估报告制药有限公司GMP管理文件生产工艺验证风险评估报告一、目的:建立一个生产工艺验证的质量风险管理报告,为生产工艺验证的风险管理提供指导和参考,并为生产工艺验证质量风险管理提供通用性的文件范例。
二、适用范围:适用于生产工艺验证的风险管理。
三、职责:质管部负责组织和实施质量风险管理,质量管理体系相关部门负责本规程的具体实施。
四、正文:1.风险评估计划:1.1风险评估名称:生产工艺验证的质量风险评估;1.2风险评估范围:本次风险管理计划主要是对本公司生产工艺验证进行风险评估活动的策划,包括参与人员和职责,风险分析、风险评价、风险控制,风险改进措施与支持活动,风险管理评审等;1.3参与人员和职责:1.3.1生产工艺验证质量风险评估小组包括质管部负责人,生产部负责人,检验室主管,工程部,QA,设备操作人员;1.3.2生产工艺验证质量风险评估小组负责组织实施质量风险评估;1.3.3质管部负责人负责制定质量风险评估计划,风险评估组织,风险评估后改进措施监督落实等;1.3.4质管部负责整理质量风险管理文档。
1.4风险评估小组人员2.风险分析:本次采用失败模式效果分析(FMEA),识别潜在的失败模式,按照风险评估操作规程,对生产工艺验证的严重程度、发生的几率、发现的可能性评分,其评分结果见表1-1、表1-2 、表1-3表1-1 生产工艺验证中的关键控制点失败影响的严重程度表1-2 生产工艺验证中的关键控制点失败影响的发生慨率表1-3 生产工艺验证中的关键控制点失败影响的可检测性3.风险评价3.1按照风险评估操作规程,对生产工艺验证质量风险进行评价,见表2。
3.2风险评价标准按照风险等级确定,可接受的风险不需要改进措施即可接受;合理可降低的风险与不经过风险/收益分析即判定为不可接受的风险,需制定相关的改进措施并有效执行以减少其质量风险后才能予以接受,(表3)。
表 2 生产工艺验证风险评价第5 页表3 生产工艺验证风险评价第6 页注:风险值(RPN):RPN≦8时风险程度低,不需要通过改进措施就能接受;56≧RPN﹥8时风险程度中,需要通过制定改进措施,实施后RPN≦8时,才能接受;RPN﹥56时风险程度高,制定相应的改进措施,并有效执行,确认无质量风险时,才能接受;4.风险控制:4.1按照风险评估操作规程对生产工艺验证质量风险中、高程度,制定详细的改进措施,并监督实施。

工艺流程的项目风险评估项目概述:本文旨在对工艺流程项目进行风险评估,以确保项目在实施过程中能够及时发现和应对潜在的风险,以保障项目的顺利进行和成功完成。
一、背景分析:工艺流程项目是指通过对原始物料进行一系列操作加工和转化,最终得到符合特定要求的产品。
该类项目在各行各业都广泛存在,但由于涉及到复杂的操作步骤和多方面的因素,其风险较高。
因此,对工艺流程项目的风险评估尤为重要。
二、风险评估目的:1. 确定潜在的风险:对工艺流程项目的每个阶段进行细致分析,确定可能会出现的风险和隐患。
2. 评估风险的影响程度:确定每种风险的潜在影响,包括对项目进度、成本、质量和安全等方面的可能影响。
3. 制定风险应对策略:根据风险评估结果,制定相应的应对措施,包括避免、减轻、转移和接受等策略。
三、风险评估步骤:1. 识别风险:对工艺流程项目的每个步骤进行全面分析,确定可能出现的风险和潜在隐患。
这包括人力资源、设备、原材料、工艺流程和环境等方面的风险。
2. 评估风险的概率和影响:对每个风险进行概率和影响的评估,以确定其发生的可能性和对项目的影响程度。
常用的评估方法包括风险矩阵、风险指数和风险值排序等。
3. 制定应对措施:针对每个风险,制定相应的应对措施,包括避免、减轻、转移和接受等策略。
对于高风险的项目,应注重制定预案和应急措施,以应对突发情况。
4. 监控和控制风险:在项目实施过程中,进行风险监控和控制,及时发现和应对新出现的风险,确保项目能够按计划进行。
四、风险评估工具:1. 专家访谈:通过与相关专家进行访谈,了解其领域内的经验和观点,获取风险分析的信息和建议。
2. 数据分析:通过对历史数据和统计数据进行分析,找出可能的风险因素和规律。
这包括设备故障率、原材料质量、人员培训情况等方面的数据。
3. SWOT分析:结合项目的优势、劣势、机会和威胁,对项目的内外环境进行综合分析,找出可能的风险因素。
4. 逻辑树和鱼骨图:通过构建逻辑树和鱼骨图,对项目的关键因素进行分类和分析,找出可能的风险源。
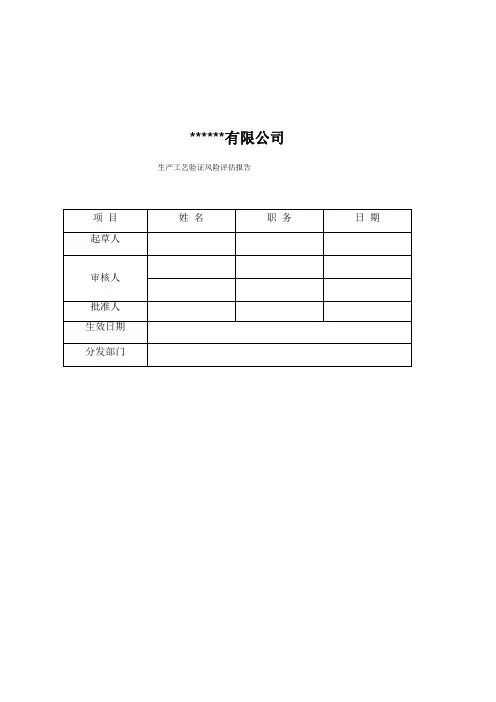
******有限公司生产工艺验证风险评估报告目录1概述2目的3适用范围4依据文件5质量风险管理小组职责6风险评估6.1风险评估过程6.2风险评估(失败模式影响分析)6.3安全性特征问题清单及可能危害分析6.4危害判断及风险控制措施6.5实施结论1、概述工艺验证应当证明一个生产工艺按照规定的工艺参数能够持续生产出符合预定用途和质量要求的产品。
验证的范围和程度应当经过风险评估来确定。
本报告拟对中药饮片工艺流程进行风险评估,以期对其工艺操作过程和关键参数的控制能正确认识并采取降低安全风险预见的控制措施,使生产质量的风险降低到可以接受的水平。
2、目的本文是对公司产品的净制、切制、炒制、炙制、煅制、蒸制等工序的操作和关键参数的控制风险评估。
对于每种风险可能产生损害的严重度(S)和危害的发生概率(P)进行估计。
在某一风险水平不可接受时,提出降低风险预见的控制措施,以期将剩余风险降低到可以接受的水平。
3、适用范围本报告适用于普通饮片生产车间、毒性饮片生产车间、直接口服饮片车间的产品生产的净制、切制、炒制、炙制、煅制、蒸制、煮制、发芽、发酵等工序。
4、依据文件药品生产质量管理规范(2010年修订)质量风险管理规程(SMP-QA-00-005)各岗位的操作规程相关产品的工艺规程5、质量风险管理小组职责6、风险评估6.1风险评估过程:项目质量风险管理提出——风险识别一一风险评估一一风险控制一一风险交流和通报一一风险评估一一风险管理活动评价6.2风险评估(失败模式影响分析)6.2.1严重性、可能性、检测性的定性•严重性(失败的结果)极高:预示对质量造成严重影响(产品不符合质量标准、没有可能的专家声明)高:预示对质量有显著影响(不符合质量标准、没有稳定性数据、可能的专家声明)中等:预示对质量有较小影响(没有满足质量标准、可得到稳定性数据)低:预示对产品质量没有/较小影响(质量在标准内)•可能性经常的失败:预料经常发生重复的失败:预料以一个低频次发生偶尔的失败:预料不经常发生不太可能的失败:不太可能发生•检测性一般不被检测到:很可能不被注意到的失败,因此未被检测到(没有技术上的解决,没有人工控制)可能不被检测到:可能被省略的失败(人工控制、现场检查)经常被检出:一般将被检出(人工控制、有统计控制的日常工作)总被检出:在任何情况下失败都能且将被检出(监控、可用的技术解决方式)6.2.2严重性、可能性、检测性的定量将不同水平以数值区间区分开,并将不同水平等级数值化。

工艺验证工艺风险评估在咱们的生活里,工艺无处不在。
从咱们每天用的手机,到出行坐的汽车,再到吃的各种美食,背后都有着一套又一套的工艺。
今天咱们就来聊聊工艺验证和工艺风险评估这两个听起来有点专业,实际上跟咱们生活密切相关的话题。
就拿我前段时间的一个经历来说吧。
我去一家面包店买面包,发现他们新推出了一款巧克力蛋糕。
那卖相,真是诱人得很!我就好奇地问了问老板,这蛋糕是怎么做出来的。
老板一脸自豪地跟我讲,他们为了做出这款蛋糕,可是下了大功夫。
从选料到制作工艺,都经过了反复的验证和风险评估。
比如说,选巧克力的时候,他们要考虑不同品牌、不同产地的巧克力的品质和口感,还要考虑价格和供应的稳定性。
这就像是一场“巧克力选美大赛”,得选出那个最合适的“佳丽”。
在确定了巧克力之后,制作工艺也不能马虎。
烤箱的温度、烘焙的时间、搅拌的力度,每一个环节都像是一个小小的战场,稍有不慎,就可能导致蛋糕的口感不佳或者形状不完美。
这其实就是一个简单的工艺验证和工艺风险评估的过程。
老板要确保每一个步骤都能达到预期的效果,同时还要预见到可能出现的问题,并提前想好解决办法。
再比如说,咱们穿的衣服。
一件衣服从布料变成咱们身上漂亮的时装,这中间也经历了无数的工艺环节。
服装厂要验证裁剪的方式是否合理,缝纫的线是否结实,染色是否均匀,而且还要评估在生产过程中会不会出现布料浪费、工人操作失误等风险。
工艺验证,简单来说,就是检查咱们的工艺是不是真的能做出咱们想要的东西,而且每次做出来的质量都差不多。
就像做数学题,咱们得保证用同样的方法,每次都能算出正确的答案。
这可不是一件容易的事儿!得有严格的标准,得有精确的测量,还得有认真负责的态度。
比如说,一家生产玩具的工厂,他们要生产一款会说话的娃娃。
那在生产之前,就得先验证一下,设计的电路能不能让娃娃清晰地说话,外壳的材质够不够结实,颜色够不够鲜艳。
这每一个环节都得仔仔细细地检查,不能有一点儿马虎。
工艺风险评估呢,则是在工艺验证之前,先想想可能会出现哪些问题。

生产工艺验证风险评估报告
一、目的
1.1本文的目的是对[XX公司]的生产工艺进行风险评估,以确保[XX
公司]生产工艺的有效性。
1.2该评估将帮助[XX公司]识别存在的原始、管理和工艺风险,以及
可能产生的结果。
二、综述
2.1[XX公司]工艺验证的目的是控制和调整生产工艺,以保证最终产
品的可靠性和质量。
2.2本次风险评估报告将会评估[XX公司]的生产工艺,以确定可能存
在的风险和影响,以及与本公司的管理标准和行业标准的匹配程度。
三、受影响的公司部门
3.1[XX公司]的生产工艺影响本公司各部门的运作,具体如下:
(1)生产车间,其工艺将影响产品质量、工作效率、工作安全等情况;
(2)技术研发部门,其工艺将影响产品研发周期,及时把握市场趋势;
(3)销售部门,其工艺将影响公司销售能力,准确定位目标市场;
(4)质量控制部门,其工艺将影响产品质量,确保公司产品质量符合
国家相关标准;
(5)其他部门,其工艺将影响公司其他行政办公工作。
四、评估方法
4.1本次评估主要采用FMEA(失效模式影响分析),结合实际运行情况,分别从原始、管理和工艺风险等三方面,进行评估。

生产工艺的风险评估与控制生产工艺的风险评估与控制在现代企业管理中占据着重要的地位。
随着制造业的快速发展和全球化的背景下,企业面临的风险也越来越多样化和复杂化。
因此,对生产工艺进行全面的风险评估和有效的控制成为企业持续发展的关键之一。
一、背景与意义随着科技的不断进步和市场需求的变化,企业为了在激烈的市场竞争中立于不败之地,不断进行生产工艺的创新和优化。
然而,随之而来的是各种各样的风险和挑战。
生产工艺的风险一旦发生,将对企业的生产进度、产品质量甚至员工健康造成严重影响,进而影响企业的经济效益和声誉。
因此,对生产工艺的风险进行评估和有效控制显得尤为重要。
二、生产工艺的风险评估1. 定义生产工艺的风险生产工艺的风险指的是在生产过程中可能发生的各种意外事件,包括但不限于原材料供应中断、设备故障、人为失误、环境变化等,这些风险可能导致生产线停工、产品质量下降、安全事故等不良后果。
2. 生产工艺的风险评估方法为了有效评估生产工艺的风险,企业可以采用多种方法,如故障模式与效应分析(FMEA)、安全生产检查、事故树分析等。
通过对生产流程、设备设施、操作人员等方面进行全面分析,确定潜在的风险点和可能的危害,以及其发生的概率和后果,为进一步制定风险控制措施提供依据。
三、生产工艺的风险控制1. 预防性控制预防性控制是指通过规范管理制度、加强培训教育、优化设备维护等手段,在事故发生之前预先排除可能存在的风险因素。
企业可以制定相应的操作规程和标准化操作流程,建立完善的质量管理体系,加强对设备和工装的定期维护保养,提高员工的安全意识和操作技能,以降低生产工艺的风险发生概率。
2. 应急响应控制即使进行了充分的风险评估和预防性控制,生产工艺中的意外风险仍然无法完全避免。
因此,企业需要建立健全的应急预案和响应机制,一旦发生风险事件,能够及时做出反应并采取有效措施进行处理。
应急响应控制包括事故应急演练、安全教育培训、设备备品备件的储备等,以保障生产工艺的连续性和稳定性。

1.概述:根据《药品生产质量管理规范》2010年修订第二章第十四条规定:应当根据科学知识及经验对质量风险进行评估,以保证产品质量。
本报告是对公司工艺验证方案中质量风险评估。
2.目的:通过对生产部门质量风险评估,确认目前采取的各项生产管理控制措施可以将产品在生产过程中产生的质量风险控制在可以接受的范围内。
3.范围工艺验证方案中质量风险评估4.风险识别评估--工艺验证中涉及到导致验证失败的风险因素( 表1)5、采取避免风险的措施后再评估针对以上可能产生的情况,我们采取以下措施:(表2)6.评估结论:根据以上分析评估,对存在风险经采取相应措施后,我公司生产工艺验证方案中质量风险基本可控,确保工艺验证的有效性。
工艺验证工作中还应加强以下几点:6.1.认真做好操作人员和验证人员培训工作。
将工艺验证过程中可能发生的质量风险贯彻到每个操作人员思想意识中、落实到每个验证环节中去。
6.2. 操作人员和验证人员严格执行各项管理规程和生产操作规程,所有验证应该复核的工作必须坚持做到。
表1工艺验证风险要素和级别列表风险序号可能的风险风险级别1 文件不完整或内容有错误,或者包含有让人误解的信息。
高2 操作人员没有经过相关培训,导致未按规定的要求进行操作中3 生产设备不匹配、操作不当或没有校验中4 车间洁净区尘埃粒子、沉降菌超标,房间之间压差不符合要求中5 纯化水不符合要求高6设备及场地清洁不彻底,导致成品微生物限度超标高评估意见根据以上分析评估,对工艺验证存在风险点采取相应的消减措施评估人员:年月日表2 采取避免风险的措施后评估表。
工艺风险评估报告
《工艺风险评估报告》
嘿呀,咱今天就来说说工艺风险这档子事儿哈。
就拿我上次去参观一个手工艺品作坊来说吧。
那天我溜达着就进了那个作坊,一进去就瞧见各种工具啊、材料啊摆得满满当当的。
他们正在做那种精美的木雕,我就凑过去看。
哇塞,那师傅拿着刻刀,小心翼翼地在木头上雕琢着,那专注的神情,就跟在对待一件绝世珍宝似的。
我就站在旁边看着,看着那师傅每一刀下去,木头就一点点地呈现出形状来。
这时候我就开始琢磨了,这工艺可不简单呐!要是这师傅一个不小心,手一抖,刻坏了一点,那整个作品不就完蛋啦?这就是工艺风险呀!比如说吧,万一他那天没睡好,迷迷糊糊的,或者突然被旁边什么动静给打扰了一下,这刀没准就偏了。
还有啊,要是那刻刀质量不行,突然断了呢?或者是那木头本身有啥瑕疵,雕到一半才发现,哎呀,这可咋整。
我越想越觉得这工艺风险真是无处不在啊。
就像我们平时做事情一样,看似简单,其实背后都藏着各种可能出现问题的地方。
咱得时刻保持警醒,注意着各种细节,才能把风险降到最低呀。
所以啊,不管是做手工艺品还是其他的啥,都得好好地去评估一下工艺风险,可不能马虎大意哟!这样才能做出好东西来,大家说是不是呀!嘿嘿。
以上内容仅供参考,你可以根据实际情况进行调整和修改。
5工艺验证风险评估报告一、概述工艺验证是指通过实际操作过程验证产品设计和制造工艺的可行性和表现的过程。
工艺验证的目的是为了确认产品能够符合设计的要求,并且在批量生产中能够达到稳定的质量水平。
在进行工艺验证时,需要对工艺过程中可能存在的风险进行评估,以确保制定适当的控制措施,降低风险发生的可能性。
二、风险评估方法1.确定评估范围:确定需要评估的风险范围,包括可能影响产品设计和制造工艺的因素。
2.收集信息:收集与工艺验证相关的信息,包括设计文件、工艺流程、设备参数等。
3.风险识别:通过分析已收集的信息,识别可能存在的风险,包括质量风险、安全风险、成本风险等。
4.评估风险等级:对识别出的风险进行评估,确定其严重性和可能性等级,以确定优先处理的风险。
5.制定控制措施:根据评估结果,制定相应的控制措施,以减轻或消除风险。
6.监控和追踪:建立监控和追踪机制,对控制措施的实施情况进行监测,并及时跟踪风险的演变情况。
1.风险概述:对评估的范围、目标进行概述,清楚地说明评估的目的和意义。
2.风险识别:列举已识别的可能存在的风险因素,包括质量风险、安全风险、成本风险等,对每个风险因素进行详细描述。
3.风险评估:对每个风险因素进行评估,确定其严重性和可能性等级,以确定优先处理的风险。
4.控制措施:根据评估结果,制定相应的控制措施,包括工艺调整、设备改进、操作规程制定等,确保风险得到有效控制。
5.监控和追踪计划:制定监控和追踪计划,对控制措施的实施情况进行监测,并及时跟踪风险的演变情况。
6.结论和建议:根据评估结果,对工艺验证的风险进行总结,提出必要的建议,以指导后续的工艺验证过程。
四、风险评估实施案例以型号电子产品的工艺验证为例进行风险评估。
1.风险识别:通过分析设计文件、工艺流程等资料,识别出可能存在的质量风险、安全风险、成本风险等因素,如材料供应不稳定、操作工人技术不熟练等。
2.风险评估:对风险因素进行评估,确定其严重性和可能性等级。
胶囊剂工艺验证风险评估报告文件编码:STP/ZL/FX/007/00胶囊剂工艺验证风险评估1 概述根据《药品生产质量管理规范》(2010年修订)第一百三十八条的要求:“企业应当确定需要进行的确认或验证工作,以证明有关操作的关键要素能够得到有效控制。
确认或验证的范围和程度应当经过风险评估来确定”,而工艺验证的风险评估方法最常用的是国际制药工业协会(ISPE)发布的ISPE基准指南:《基于风险评估的药品生产》。
1.1 工艺验证风险评估目的1.1.1 通过风险评估以确定出关键的质量属性和关键的工艺参数,因为它们将作为对需要被验证系统的评价基础。
1.1.2 验证结束后,评估风险确定后续行动方案,以控制风险,减少风险。
1.1.3 通过验证后的培训分享已知的风险。
1.2 评估小组成员与职责表1 评估小组成员与职责表1.3 评估依据1.3.1《药品生产质量管理规范》(2010年修订)及附录(原料药);1.3.2《基于风险评估的药品生产》(国际制药工业协会(ISPE)发布);1.3.3《确认与验证风险评估管理规程》。
2 工艺验证风险评估方法2.1.1 中药提取与浓缩等生产工艺流程图2.1.2 胶囊剂生产工艺流程图2.2 确认关键质量属性(CQA)2.2.1 工艺验证的目的,在于证明一个具体的工艺在以连续耐用的方式运转时仍然是有效的,并且生产的物料满足预定的规格和质量属性。
2.2.2 即使某一属性与患者的安全性或产品的有效性之间尚未最终建立一种直接的科学的关系,但是基于对药学的普遍认识,该属性应被认为是关键质量属性。
2.2.3 关键质量属性的判定关键质量属性的判定结果见下表所示。
表2 关键质量属性评估表表2 关键质量属性评估表(续前表)2.3 确认关键工艺参数2.3.1 在对“关键工艺参数”进行鉴别之前,有必要将整个工艺分解成不同的多个定义的工艺步骤。
这样做的目的是,可以通过检测每个工艺步骤的结果,分别评估每个关键参数对产品质量和收率的影响。
工艺变更风险评估表摘要:一、引言二、工艺变更风险评估表的定义与作用三、工艺变更风险评估表的具体内容与填写要求四、工艺变更风险评估的实际应用案例五、总结正文:一、引言在我国的制造业中,工艺变更是一种常见的现象。
工艺变更可能会带来一些不确定因素,如质量问题、生产效率降低等。
为了降低这些风险,工艺变更风险评估表应运而生。
二、工艺变更风险评估表的定义与作用工艺变更风险评估表是一种用于评估工艺变更可能带来的风险的工具。
通过对工艺变更的各个方面进行分析,评估表可以帮助企业预测潜在的风险,并采取相应的措施进行预防和应对。
这样一来,企业可以在工艺变更的过程中更好地控制风险,保证生产稳定进行。
三、工艺变更风险评估表的具体内容与填写要求工艺变更风险评估表通常包括以下几个部分:1.基本信息:包括变更申请单号、申请人、申请部门等;2.变更内容:详细描述工艺变更的具体内容,如原材料、设备、工艺参数等;3.变更原因:分析工艺变更的原因,如降低成本、提高质量等;4.风险评估:从质量、生产效率、设备、人员等方面评估工艺变更可能带来的风险;5.风险应对措施:针对评估出的风险,提出相应的应对措施;6.评估结论:总结评估结果,给出是否批准工艺变更的建议。
在填写评估表时,要求申请人详细、准确地填写各项内容,以便于评估人员对工艺变更进行全面、深入的了解。
四、工艺变更风险评估的实际应用案例某家汽车零部件制造企业,在生产过程中发现原有的焊接工艺存在焊点不牢固的问题。
为了解决这个问题,生产部门提出了变更焊接工艺的申请。
在对新的焊接工艺进行风险评估时,评估人员从焊接质量、设备要求、人员培训等方面进行了分析。
最终,评估人员提出了新的焊接工艺,并对生产部门进行了培训,确保了新工艺的顺利实施。
五、总结工艺变更风险评估表是一种有效的工具,可以帮助企业在工艺变更过程中识别并控制风险。
冻干工序质量风险评估实际应用案例一、概述2011年3月1日2010版《药品生产质量管理规范》颁布实施,其中第一百三十八条规定:企业应当确定需要进行的确认或验证工作,以证明有关操作的关键要素能够得到有效控制,确认或验证的范围和程度应当经过风险评估来确定。
第十条规定:应当根据科学知识及经验对质量风险进行评估,以保证产品质量。
二、实施计划1.概述及目的注射剂车间新购置了XX型冻干机,用于冻干产品的生产。
对冻干程序进行风险分析,以用来评估现行操作规程及管理方式的可行性,找出风险点,并采取相应措施降低风险至可接受水平。
2.风险评估范围识别新原料药厂房(厂房,设备,分析仪器,设施,以及计算机化系统等)相关的潜在风险,评估,以及为了使风险水平最小化应用的控制措施。
根据风险评估结果,规定随后验证活动的范围和深度。
控制措施得到执行和验证之后,确定残余风险水平,从而确定GMP的符合性,为整个项目阶段的风险管理活动提供完整的可追溯性。
本文件将对风险分析的每项功能,通过控制措施确认的确认方案进行交叉检查。
3.风险管理实施步骤(具体见第一章)4. 质量风险管理项目组成员及职责(根据企业实际情况编写)5. 风险评估工具潜在失效模式及后果分析-FMEA(评估标准见第一章)。
6. 风险沟通风险管理项目实施结束后,形成风险项目评估报告,并提交质量管理部门存档备查。
7. 风险管理实施计划风险评估项目的审核、批准以及项目启动应有明确日期规定。
例如:从年月日至年月日。
三、风险回顾要求本次风险评估项目中为降低风险所采取的控制措施实施完毕后一个月内,将对冻干工序开展风险回顾,对本项目中识别的风险进行闭环,确认是否通过采取有效措施将所有风险控制在可接受范围内。
四、项目开展活动中涉及的变更历史如在风险项目实施过程中,因需要改变原有风险降低措施,应在风险回顾时详细记载项目开展活动中涉及的变更历史。
五、附件附件:冻干工序风险评估附件:冻干工序风险评估。
2011年11月 12011年11月 2Figure 28. Process map for Example MR Tablets, 10 mg图28 实例10 mgMR片剂的工艺图2011年11月 3Example QbD MR Tablet Module 3 Quality 3.2.P.2 Pharmaceutical Development实例QbD MR片剂模块3质量3.2.P.2药物开发2.3.1 Initial Risk Assessment of the Drug Product Manufacturing Process药品生产工艺的初始风险评估A risk assessment of the overall drug product manufacturing process was performed to identify the high risk steps that could affect the final drug product CQAs. Subsequently, the drug product intermediate CQAs that are directly linked to the identified final drug product CQAs were identified. The process variables that could impact the identified drug product intermediate CQAs became the focus of the risk assessment to determine which variables have the highest potential to cause a CQA failure. These variables then needed to be investigated in order to optimize the drug product manufacturing process and reduce the risk of failure. For example, the overall risk assessment of the manufacturing process found assay of the tablets to be at high risk of failure due to the drug layering step.Subsequently, assay of the layered beads is directly linked to final tablet assay and was identified as the CQA of the drug-layered beads. Process variables that could directly impact the assay of the drug-layered beads were assessed to identify which of the variables could have the highest potential to cause a bead assay failure. This method of identifying process variables for further study was also illustrated previously in Figure 19.进行整体药品生产工艺的风险评估以确定可能影响最终药品CQAs的高风险步骤。
随后,确定直接与已确定的最终药品CQAs相关的药品中间体CQAs。
可能影响已确定的药品中间体CQAs的工艺变量成为风险评估的焦点,以确定哪些变量最可能引起CQA不合格。
然后需要研究这些变量以便优化药品生产工艺并降低不合格的风险。
例如,整体生产工艺的风险评估发现片剂的含量是不合格的高风险由于层积上药步骤。
随后,层积微丸的含量直接与最终片剂含量相关,曾被确定为层积上药微丸的CQA。
评估可直接影响层积上药微丸含量的工艺变量以确定哪些变量最有可能引发微丸含量不合格。
这种确定用于进一步研究的工艺变量的方法之前也在图19中进行了说明。
In the initial risk assessment of the overall manufacturing process shown in Table 51, drug layering, ER polymer coating, blending and lubrication, and compression were identified as high risk steps that could affect the quality of the final product. Justification for each risk assignment is presented in Table 52.表51所示的整体生产工艺的初始风险评估中,确定层积上药,ER聚合物包衣,混合和润滑,及压缩为可影响最终药品质量的高风险步骤。
每个风险分配的依据见表52。
Table 51. Initial risk assessment of the manufacturing process for Example MR Tablets, 10 mg表51 实例10 mg MR片剂生产工艺的初始风险评估Process Steps 工艺步骤Drug Product CQAs药品CQAs IRgranulationIR制粒ER beads: druglayeringER微丸:层积上药Sieving I过筛IER beads: polymercoatingER微丸:聚合物包衣Sieving II过筛IIBlending andLubrication混合和润滑Compression压缩Physical Attributes (size and splitability)物理属性(大小和分割性)Low低Low低Low低Low低Low低Low低High高Assay 含量Low 低High 高Low 低Low 低Low 低Medium 中High 高Content Uniformity 含量均匀度Low低Medium中Low低Low低Low低High高High高Drug Release – whole tablets 药物释放--整片Low低Low低Low低High高Medium中Medium中High高Drug Release – split tablets 药物释放—分割片Low低Medium中Low低High高Medium中High高High高Drug Release –alcohol-induced dose dumping 药物释放—酒精引发的剂量倾卸N/A N/A N/A Low低Low低Low低Low低Table 52. Justification for the initial risk assessment of the manufacturing process for Example MR Tablets, 10 mg 表52 实例10 mg MR片剂生产工艺的初始风险评估的依据Process Steps 工艺步骤Drug Product CQAs药品CQAsJustification依据IR granulation IR制粒Physical Attributes (size andsplitability)The IR granules in Example MR Tablets are prepared the same as the IR granules in Example IR Tablets(ANDA aaaaaa(Appendix I)). The manufacturing process has been optimized previously and low2011年11月 5物理属性(大小和分割性)variability of granule PSD and bulk density between commercial batches were observed. The risk of theIR granulation process variables to impact the tablet size and splitability is low.制备与实例IR片剂(ANDA aaaaaa(附件I))中的IR颗粒相同的实例MR片剂中的IR颗粒。
之前已经优化了生产工艺,并观察到市售批之间的颗粒PSD和松密度的变异性低。
影响片剂大小和分割性的IR制粒工艺变量的风险为低。
Assay 含量The approved commercial IR granulation routinely delivers granules with an assay of 95 – 105%. Therisk is low. 已批准的市售IR制粒定期提供的含量为95 – 105%。
风险为低。
Content Uniformity 含量均匀度On the commercial scale, the IR granules routinely demonstrate good blend uniformity and Example IR Tablets show acceptable CU. The risk of the IR granulation process variables to impact Example MR Tablet CU is low. 在工业规模中,IR颗粒定期显示了良好的混合均匀度,实例IR片剂显示了可接受的CU。
影响实例MR片剂CU的IR制粒工艺变量的风险为低。
Drug Release – whole tablets 药物释放--整片Example IR Tablets manufactured using the approved IR granulation process consistently demonstrate rapid drug release. During formulation development, the drug release from IR granules compressed with placebo beads was unaffected. Therefore, the risk of the IR granulation process variables to impact drug release from the IR portion of Example MR Tablets is low. 用已批准的IR制粒工艺生产的实例IR片剂一贯表现出快速药物释放。