855《无机化学》考试大纲
- 格式:doc
- 大小:75.50 KB
- 文档页数:3

硕士研究生(有机化学专业初试)入学考试大纲第一篇:硕士研究生(有机化学专业初试)入学考试大纲硕士研究生(有机化学专业初试)入学考试大纲课程名称:化学基础一、考试的总体要求1、掌握无机化学的基本概念和基本原理;掌握对一般无机化学问题进行理论分析和计算。
2、掌握分析化学中各类分析方法的特点、应用范围及局限性,正确处理分析数据与信息,并具有选择分析化学方法、正确判断和表达分析结果的能力。
3、掌握物理化学课程中重要的基本概念与基本原理并掌握其含义及适用范围。
掌握物理化学的公式应用及应用条件,概念要明确,计算题要求思路正确,步骤简明。
二、考试内容及复习范围无机、分析化学部分1.物质结构简介1)了解微观粒子运动的特殊性:能量的量子化、波粒二象性。
2)了解原子轨道、波函数、概率、概率密度、电子云的概念,了解原子轨道和电子云的角度分布特征。
重点掌握描述电子运动状态的四个量子数(n、l、m、ms)的物理意义、取值规律和合理组合。
3)根据电子排布的三个原则和能级组概念,掌握多电子原子核外电子排布规律,并根据电子排布的价电子构型,判断元素在周期表中的位置(周期、族、区)及有关性质。
4)了解电离能、电子亲和能和电负性等概念及其一般递变规律。
5)了解离子键、共价键的理论要点。
重点掌握杂化轨道理论与分子空间构型及分子极性的关系。
6)了解分子间力和氢键的性质。
7)熟悉和掌握晶体的内部结构和基本类型,以及离子键和离子晶体,金属键和金属晶体。
2.滴定分析概述1)了解有关误差的几个基本概念:系统误差、随机误差、准确度、精密度等。
2)了解误差的来源、特点、消除及减免、提高测定准确度的措施和方法,掌握各种误差的计算(绝对误差、相对误差、绝对偏差、相对偏差、平均偏差、相对平均偏差、标准偏差、变动系数)。
3)掌握有效数字及运算规则,了解置信区间与置信度的概念及计算。
4)掌握可疑值的取舍方法(Q检验法、G检验法)。
了解显著性检验方法(F检验法、t检验法)。

2021年全国硕士研究生招生考试大纲科目代码:855科目名称:无机化学适用专业:化学制订单位:沈阳师范大学修订日期:2020年9月《无机化学》考试大纲一、考察目标及要求要求学生全面系统地掌握无机化学的基本概念、基本知识和基本原理,并能对基本知识和原理进行灵活运用,具备较强的分析问题与解决问题的能力。
二、考试内容1.气体与溶液●理想气体状态方程式●分压定律●稀溶液依数性2.热化学●热力学基本概念●热力学能、焓、标准摩尔生成焓、反应的标准摩尔焓变●热力学第一定律、盖斯定律3.化学动力学基础●浓度对反应速率的影响●温度对反应速率的影响●活化分子、活化能的基本概念,活化能与反应的焓变的关系4.化学平衡、熵和吉布斯函数●平衡状态,标准平衡常数的表示及应用●化学平衡的移动及影响因素●自发变化的基本特征,熵、热力学第三定律●吉布斯函数、吉布斯函数变判据,反应商判据●平衡组成计算、热力学相关计算5.酸碱平衡●酸碱质子理论●一元弱酸、弱减的解离平衡及其计算●同离子效应及缓冲溶液,缓冲溶液pH值的计算,缓冲范围●酸碱电子理论及配合物的组成和命名●配合物的解离常数和稳定常数及相关计算6.沉淀——溶解平衡●溶解度和溶度积及其关系●溶度积规则并熟练应用,●同离子效应及盐效应●pH对溶解度的影响,配合物的生成对溶解度的影响●分步沉淀及沉淀的转化●相关计算7.氧化还原反应电化学基础●氧化还原反应的基本概念●原电池的构造,电池符号●原电池电动势及电动势与吉布斯函数的关系●电极电势的相关内容,能斯特方程式及电极电势的应用●元素电势图的表示及其应用●相关计算8.原子、分子、晶体及配合物结构●量子数及其关系,原子轨道与波函数●多电子原子轨道能极,多电子原子的核外电子排布●原子的电子层结构和元素周期系,元素性质的周期性●共价键的本质和特点,共价键的键型●杂化轨道理论及VSEPR理论及分子的空间构型,分子轨道理论●晶体结构的类型,晶格能与离子晶体,分子的偶极矩、分子的相互作用、氢键●配合物的空间构型和磁性,配合物价键理论。


《无机化学》理论教学大纲英文名称:Inorganic Chemistry 课程编号:090201学时数: 54 学分:3.5课程类型:必修课适用专业:药学、医学检验先修课程:无考核方式:闭卷考试一、课程的性质、地位和作用无机化学是药学、医学检验专业的重要基础课,也是第一门化学课。
它是培养专业技术人才的整体知识结构和能力结构的重要组成部分,同时也是后继化学课程打下牢固的基础。
通过本课程的学习,使学生获得物质结构的基础理论、化学反应的基本原理、元素化学的基本知识和实验的基本技能。
培养学生具有分析处理一般无机化学问题的初步能力,独立进行无机化学试验和自学一般无机化学书刊,以获取新知识的能力。
本课程的教学应该运用辩论唯物主义观点和科学方法,阐明化学的基本原理和元素及化合物性质的变化规律,以促进学生辩证唯物主义世界观的形成。
根据我院教学中实际特制订本大纲,供药学、医学检验专业使用。
二、教学基本内容及基本要求一绪论1课时【教学内容】无机化学与药学、无机化学与医学检验关系。
无机化学课程的性质、地位和作用。
无机化学的主要内容和学习方法。
【基本要求】明确什么是无机化学。
了解无机化学与药学、无机化学与医学检验的关系。
了解无机化学课程主要内容和学习方法。
二溶液3课时【教学内容】溶液的浓度:质量分数、摩尔分数、质量摩尔浓度、质量浓度、物质的量浓度。
稀溶液的依数性:溶液的蒸汽压下降、溶液的沸点上升、溶液的凝固点降低、溶液的渗透压。
电解质在水溶液中的存在状况。
活度、活度系数、离子强度。
【基本要求】掌握溶液浓度的含义。
掌握质量分数、摩尔分数、质量摩尔浓度、质量浓度、物质的量浓度的含义及有关计算。
理解稀溶液的依数性。
熟悉渗透压及在医学上的应用。
了解强电解质在水溶液中的状况。
了解活度、活度系数、离子强度的概念。
三化学反应速率4课时【教学内容】化学反应速率和反应机理,化学反应速率表示方法,反应速率理论,浓度对化学反应速率的影响——质量作用定律。

化学系化学(师范教育)专业《无机化学实验》考试大纲第一篇:化学系化学(师范教育)专业《无机化学实验》考试大纲化学系化学(师范教育)专业《无机化学实验》考试大纲课程名称:无机化学实验课程编号:1004002适用专业:08级化学(师范教育)专业学时数: 112学分数:4执笔人:鲜华编写日期: 2008.09审批人:柳闽生一、课程性质和目的促进学生复习、巩固实验课的教学内容,检验学生对本学科基本原理和基础知识的理解和掌握的程度;检查学生的实验技能;检查学生观察实验现象、数据处理、查阅资料手册、自行设计实验和独立思考的能力;培养学生严谨的科学态度与良好的实验工作习惯。
二、课程教学内容绪言实验室基本知识实验数据处理常用仪器及基本操作实验基本操作物理化学量及常数的测定化学反应原理与物质结构基础元素化合物的性质无机化合物的提纯与制备综合性设计性和研究性实验三、考试主要内容及考试要求本考试大纲以四年制本科人才培养规格为目标,按照无机化学实验教学内容的知识体系,提出了考核的知识点和考核的目标。
考核内容:预习报告,实验报告,实验现象解释,仪器组装和使用,实验技能技巧,实验态度以及遵守实验室规章制度等。
(一)实验基本操作技能1、熟练掌握玻璃仪器的洗涤与干燥,托盘天平的使用,试剂的取用(正确的取量及估量)与溶液配制,试管操作,气体发生器的使用,仪器装置气密性的检查,气体的收集和净化,搅拌和振荡,加热(水浴加热)、烘干、灼烧与冷却,蒸发、浓缩与稀释,溶解和重结晶,过滤方法的选择和使用(常压过滤、减压过滤),倾泻分离,酒精灯、酒精喷灯的使用,离心分离、减压分离、重结晶分离,分析天平的使用,温度计的使用,其它常见的一般无机化学实验仪器(或器具)的使用,实验现象的观察与记录、分析与推理,实验报告书写与实验装置图绘制。
2、一般掌握一般仪器的连接、安装与拆卸,冷冻剂,干燥剂的选择,移液管、容量瓶、滴定管的使用与滴定操作,气压计的使用,pH计的使用,分光光度计的使用,秒表的使用。

《无机化学》考试大纲《无机化学》是化学、应用化学等专业的专业基础课。
它既是化学专业知识结构中重要的一环,又要为后继化学相关课程准备必需的无机化学基础理论和知识。
要求考生通过本课程的学习,掌握无机化学的基本理论和原理,熟悉常见元素及其化合物的性质。
掌握化学平衡理论、化学热力学和物质结构初步知识等在元素化学部分的应用,初步从微观和宏观相结合来阐述元素及其化合物的性质,并能灵活运用所学知识解决综合问题。
一、考试方法闭卷、笔试试卷满分:100分考试时间:3小时。
二、考试内容及要求以下按无机化学原理、元素化学和综合共三部分列出考试内容及要求。
基本要求按深入程度分为了解、理解(或明了)和掌握或熟悉(或会用)三个层次。
(一)无机化学原理部分1、化学基础知识了解理想气体和实际气体的基本性质;熟悉理想气体状态方程、分压定律及应用。
掌握溶液浓度的表示方法;了解非电解质稀溶液的依数性及应用。
2、化学热力学基础熟悉、理解热力学的基本概念。
掌握热力学能U、焓H、熵S和吉布斯自由能G等热力学函数的概念和物理意义,熟悉状态函数的特点;掌握盖斯定律和热力学第一定律、第二定律和第三定律。
能够熟练计算过程或反应的焓变、熵变和吉布斯自由能变,运用吉布斯自由能变判断化学反应的方向和限度;理解范特霍夫等温式并学会计算非标准态下的吉布斯自由能变;掌握利用吉布斯-赫姆霍兹公式的计算、理解△G 、△H 、△S之间的关系;学会估算热力学分解温度和反应温度等。
3、化学反应速率和化学平衡了解化学反应速率的基本概念及反应速率的实验测定;了解质量作用定律和反应级数的概念。
掌握浓度、温度及催化剂对反应速度的影响;掌握化学平衡的基本概念和平衡常数表达式;熟练掌化学平衡的有关计算;掌握化学平衡移动原理和应用。
4、原子结构与元素周期律了解原子能级、原于轨道(波函数)和电子云等概念。
熟悉四个量子数的物理意义和取值及对核外电子运动状态的描述。
了解屏蔽效应和钻穿效应的概念,熟练掌握鲍林原子轨道能级图、原子核外电子排布和元素在周期表中的位置。

《无机化学》考试大纲一考试要求1、初步掌握元素周期律,化学动力学,化学热力学,近代物质结构,化学平衡以及基础电化学等基本原理。
2、利用无机化学原理去掌握有关无机化学中元素和化合物的基本知识,并具有对一般无机化学问题进行理论分析和计算的能力。
二考试内容第一章气体(1)掌握理想气体状态方程式及其应用。
(2)掌握道尔顿分压定律。
第二章热化学(1)热力学第一定律及相关概念(2)化学反应热效应,等容化学反应热和等压反应热的概念及关系。
(3)热化学方程式;反应热、反应焓变的计算;盖斯定律及有关计算;第三章化学动力学基础(1)化学反应速率、催化剂、反应机理等相关概念。
(2)各种动力学方程:速率方程和Arrhenius方程。
第四章化学平衡熵和Gibbs函数(1)化学反应的可逆性,掌握化学平衡和平衡常数的概念。
(2)标准平衡常数和吉布斯自由能变,反应商、标准平衡常数及其有关计算;利用反应商和标准平衡常数判断反应进行的方向。
(3)浓度、压力、温度对化学平衡移动的影响;(4)吉布斯自由能和化学反应的方向,吉布斯-姆霍兹公式:ΔG=ΔH-TΔS公式。
了解从热力学和动力学等方面来选择合理的生产条件。
第五章酸碱平衡(1)酸碱质子理论。
(2)掌握一元弱酸、弱碱在水溶液中的质子转移平衡和近似计算;熟悉多元酸、多元碱、两性物质的质子转移平衡和近似计算。
(3)掌握同离子效应的概念。
(4)掌握缓冲溶液的作用和组成、缓冲作用机制、能熟悉地计算缓冲溶液pH值。
(5)掌握配位化合物的基本概念,组成,命名,分类。
(6)掌握配位平衡,配合物的稳定常数和不稳定常数的概念以及配合物的有关计算。
第六章沉淀溶解平衡(1)熟悉难溶电解质溶液的沉淀溶解平衡、掌握溶度积原理与溶解度的关系。
(2)掌握溶度积规则,能用溶度积规则判断沉淀的生成和沉淀的溶解,了解两种沉淀间的转化、分步沉淀。
(3)熟悉pH值对难溶金属氢氧化物和金属硫化物沉淀溶解平衡的影响及有关计算。

无机化学考研资料一、无机及分析化学考查目标该门学科在考查要求考生比较系统地理解和掌握无机化学、分析化学的基础知识、基本理论、基本方法和基本技能,能够分析、判断和解决有关理论和实际问题。
二、无机及分析化学考点解析大纲中明确的考试内容主要包括化学反应的一般原理、近代物质的结构理论、溶液化学平衡、电化学等的基础知识;分析误差和数据处理的基本概念,滴定分析、分光光度分析和电势分析等常用的分析方法。
要求考生掌握无机及分析化学的基础知识和基础理论,具有独立分析和解决有关化学问题的能力。
本学科知识体系分为十一个章节,对大纲中各章节内容考点的总结归纳为七项,解析如下:1、溶液和胶体考试内容:溶液浓度的表示方法、稀溶液的通性、胶体溶液。
考点解析及复习建议:该部分内容属于基础概念,要求掌握物质的量浓度等基本内容,考查多以概念性描述的选择题为主,要求准确理解和描述。
2、化学热力学基础考试内容:热力学基本概念、热化学及化学反应热的计算、化学反应方向的判断。
考试考点解析及复习建议:对热化学及化学反应热的计算,反应方向判断等是每年必考内容,也是重点,是化学平衡分析的基础。
该部分要求了解热力学能等名词概念,学会根据热力学定律分析化学反应过程中的热变化,及根据热变化分析化学反应方向等。
3、化学反应速率和化学平衡考试内容:化学反应速率基本概念及速率方程式、反应速率理论、化学平衡及移动。
考试考点解析及复习建议:在名词概念理解的基础上,强调掌握计算、分析和判断。
分析计算题中要求正确书写化学反应速率方程式和化学平衡常数,判断浓度、温度等对化学平衡的影响,侧重分析,在单选、填空、计算题中均会出现。
4、物质结构考试内容:核外电子运动状态、多电子原子核外电子排布、元素周期律及元素性质的周期性变化、离子键和共价键理论、杂化轨道理论、分子间力。
考试考点解析及复习建议:该部分内容概念性较强,较多,易混淆。
多以了解、理解为主,考查时以单选和填空为主,对此部分内容要求对名词概念的内容正确了解、理解物质组合结构规律,并根据规律学会分析判断杂化轨道、分子极性。

《无机化学》研究生入学考试大纲科目代码:836一、考查总目标《无机化学》主要考察学生对无机化学基础理论和元素化学基本知识掌握情况。
基础理论包括物质结构基础(原子结构和元素周期律、分子结构、晶体结构和配合物结构)、化学热力学与化学动力学基础(化学热力学、化学平衡、化学动力学)和水溶液化学原理(酸碱平衡、沉淀平衡、氧化还原平衡和配位平衡)。
元素化学包括主族元素、过渡元素及其化合物的存在、制备、性质和应用。
要求考生系统掌握无机化学的基本知识、基础理论和基本方法,并能运用相关理论和方法分析、解决实际问题。
二、考试形式与试卷结构(一)试卷成绩及考试时间本试卷满分150分,考试时间为180分钟。
(二)答题方式答题方式为闭卷、笔试。
(三)试卷内容结构物质结构基础:约35分化学热力学与化学动力学基础:约25分水溶液化学原理:约35分主族元素:约30分过渡元素:约25分(四)试卷题型结构选择题:每小题2 分,共50分填空题:每空2 分,约35分简答题:约35分完成并配平反应方程式:10分计算题:20 分三、考查范围(一)考查目标1、掌握元素周期律,化学热力学,近代物质结构,化学平衡以及基础电化学等基本原理;并具有对一般无机化学问题进行理论分析和计算的能力,2、熟悉常见元素及其化合物的性质。
培养学生运用无机化学原理去掌握有关无机化学中元素和化合物的基本知识,并能从微观和宏观相结合来阐述元素及其化合物的性质,熟悉离子的分离和鉴定。
(二)考核要求第一章原子结构和元素周期系1.掌握原子、分子、元素、核素、同位素、原子质量、平均原子质量、分子量、式量等基本概念。
2.了解电子等微观粒子运动的特殊性;掌握波函数、电子云、原子轨道、电子层的概念,会看波函数与电子云图形,重点掌握描述电子运动状态的四个量子数的物理意义、取值规律和合理组合。
3.根据电子排布三原则和鲍林原子轨道近似能级图,掌握原子核外电子排布规律(特殊情况除外),能书写一般元素的原子核外电子排布式和价电子构型,并根据电子排布式判断元素在周期表中的位置及有关性质。
855《无机化学》考试大纲
一、基本要求
1.掌握化学热力学、化学平衡及化学动力学的基本概念和原理,并作简单计算。
2.掌握溶液中酸碱平衡、沉淀溶解平衡、氧化还原平衡和配位平衡等四大平衡的基本规律和相关计算。
3.了解原子结构和分子结构的基本知识和基本理论,理解并掌握相关概念。
4.掌握主要元素单质和化合物的化学性质,并能运用相关知识说明元素及其化合物的某些应用;了解常见离子的鉴定方法。
5.了解化合物性质与结构的相互关系。
二、课程复习大纲
1.化学基础知识
掌握理想气体状态方程、混合气体分压定律,了解真实气体与理想气体的区别。
理解液体蒸气压的概念和性质。
掌握非电解质稀溶液的依数性及其应用。
2.化学热力学基础
掌握热力学的基本概念,了解热力学能、焓、熵、Gibbs自由能的意义,掌握热力学第一定律、第二定律的基本内容。
重点掌握反应热及∆r S mθ、∆r G mθ的有关计算,熟练掌握Gibbs-Helmholtz 方程及其应用。
3.化学平衡
掌握平衡常数的意义和正确表达,掌握有关化学平衡的计算。
掌握标准平衡常数与自由能变化的关系、化学反应等温式及其应用,理解浓度、压力、温度对化学平衡的影响。
4.化学反应速率
理解反应速率方程、速率常数、反应级数、反应分子数、活化能、反应机理等基本概念,了解浓度、温度、催化剂对反应速率的影响,掌握质量作用定律和Arrhenius公式的意义及应用,了解反应速率理论基本内容。
5.原子结构与元素周期律
了解微观粒子的运动特征及波函数与原子轨道、概率密度与电子云、原子轨道和电子云角度分布图等基本概念及表示方法。
掌握四个量子数的物理意义、相互关系及合理组合。
理解单电子原子、多电子原子的轨道能级,掌握核外电子排布规律,能熟练写出一般元素原子核外电子排布式。
掌握原子结构与元素周期系的关系,了解元素基本性质(原子半径、电离能、电子亲合能、电负性)的变化规律。
6.化学键理论
掌握离子键、共价键的特征。
掌握离子键理论要点,了解离子化合物性质与离子晶体的晶格能之间的关系。
理解价键理论、价层电子对互斥理论、杂化轨道理论和分子轨道理论的
要点及各自的优势,能解释简单分子的形成、键的特点及分子的空间构型等,掌握分子间作用力和氢键的形成、特点及对物质性质的影响,了解离子极化对化合物结构和性质的影响。
了解各类晶体的特点。
7.酸碱解离平衡
掌握酸(碱)解离平衡的特点、解离常数的意义,熟悉缓冲溶液的性质,了解同离子效应、盐效应对平衡的影响,掌握弱酸(碱)水溶液中有关离子浓度的计算。
掌握盐类水解平衡的有关计算。
了解酸碱理论的发展,重点掌握酸碱质子理论的基本内容。
8.沉淀-溶解平衡
掌握难溶电解质的溶度积规则,掌握溶液酸度、配合物生成、氧化还原反应对沉淀溶解平衡的影响,并作相应计算。
掌握分步沉淀的原理,了解如何控制溶液酸度来分离某些金属离子。
9.氧化还原反应
掌握原电池的组成、电极反应、电池符号等基本概念,掌握电池电动势与电池反应的Δr G mθ、Kθ的关系。
理解电极电势的概念及浓度、压力、酸度、沉淀反应、配位反应等对电极电势的影响,熟练掌握Nernst 方程及其应用。
了解电极电势的图解方法,掌握元素电势图及其应用。
10.配位化合物
掌握配合物的组成和命名。
理解价键理论的要点,能解释简单配合物的类型和空间构型,初步掌握晶体场理论的基本内容及对配合物磁性、颜色的解释。
了解配离子稳定性的影响因素。
掌握溶液酸度、沉淀溶解平衡、氧化还原平衡对配位平衡的影响及有关计算。
11.氢、稀有气体
掌握氢的制备及其主要化学性质、离子型氢化物的主要性质,了解稀有气体的性质及用途、稀有气体化合物的结构。
12.碱金属与碱土金属
掌握碱金属和碱土金属单质及化合物(氧化物、氢氧化物、重要盐类)的主要性质,了解单质及化合物的化学性质与结构之间的关系。
13.硼族元素
掌握硼的主要含氧化合物的性质,了解硼族化合物的缺电子结构,掌握铝的氧化物及水合物的主要性质。
14.碳族元素
了解碳、二氧化硅、硅酸盐的基本结构,掌握碳、硅的氧化物及含氧酸的重要性质,掌握锡、铅的主要化合物的氧化还原性质。
15.氮族元素
了解氮的成键特征、氮和磷含氧酸的结构,掌握氮、磷含氧酸及其盐的重要性质,初步掌握砷、锑、铋的氧化物及主要含氧酸(氢氧化物)的主要性质。
16.氧族元素
掌握氧族元素单质及重要化合物(过氧化氢、硫的含氧酸及其盐)的化学性质,了解硫的各含氧酸根的结构。
17.卤族元素
掌握卤素单质、氢化物、含氧酸及其盐的主要性质,了解卤素含氧酸及其盐的性质变化规律、含氧酸根的结构与含氧酸性质的关系。
18.铜副族与锌副族
掌握Cu(I)、Cu(II)和Zn(II)、Hg(I)、Hg(II)化合物及配合物的性质。
了解铜族金属与碱金属的结构及性质差异、铜族与锌族金属的性质差异。
19.钛副族和钒副族
了解钛、钒重要化合物(钛的氧化物和氯化物、钒的氧化物和含氧酸盐)的主要性质及用途。
20.铬副族和锰副族
掌握Cr(III)、Cr(VI)的主要化学性质,Mn(II)、Mn(IV)、Mn(VII)的氧化还原稳定性。
了解铬、钼、钨多酸的结构和性质。
21.铁系元素和铂系元素
掌握Fe(II)、Fe(III)、Co(II)、Co(III)、Ni(II) 的主要化学性质,了解铁、钴、镍的氧化物和氢氧化物的性质差异,Co(II)、Co(III)的不同配离子的氧化还原活性,能根据特征反应进行相关离子的鉴定。
了解铂的重要化合物的性质。
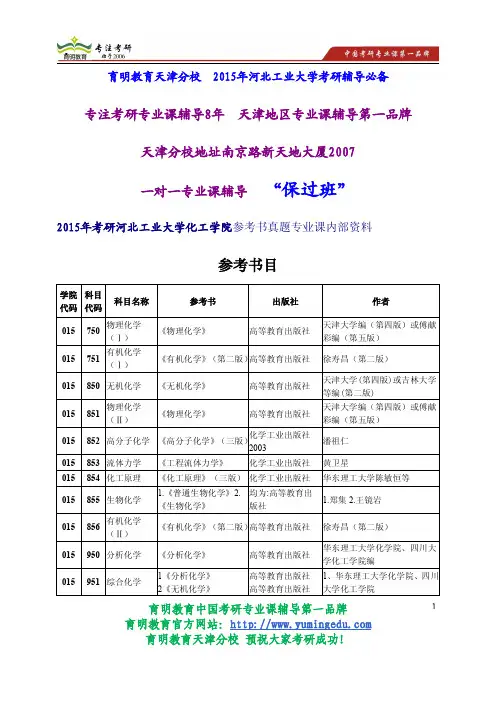
三、主要参考书
[1] 宋天佑等.无机化学(第2版).高等教育出版社,2009.
[2] 邵学俊等.无机化学(第2版).武汉:武汉大学出版社,2002.
[3] 大连理工大学无机室.无机化学.第5版.北京:高等教育出版社,2006.
[4] 北京师范大学等.无机化学.第4版.北京:高等教育出版社,2002.
[5] 武汉大学、吉林大学等.无机化学.第3版.北京:高等教育出版社,1994.。