产品安全特征问题清单
- 格式:docx
- 大小:8.10 KB
- 文档页数:5



一次性使用输注器具产品注册技术审查指导原则一、前言本指导原则旨在帮助和指导申请者/生产企业对一次性输注器具产品注册申报资料进行准备,以满足技术审评的基本要求。
同时有助于审评机构对该类产品进行科学规范的审评,提高审评工作的质量和效率。
本指导原则是对一次性使用输注器具产品注册申报资料的一般要求,申请者/生产企业应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用。
本指导原则是对生产企业和审查人员的指导性文件, 但不包括注册审批所涉及的行政事项,亦不作为法规强制执行, 如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
二、适用范围临床治疗与诊断时一次性使用,用于将容器内的液体通过插入静脉的针头或导管输入患者血管的器械及用于将液体注入人体和抽取人体体液的器具及其组件统称为一次性使用输注器具。
一次性使用输注器具包括:一次性使用输液器、一次性使用输血器、一次性使用滴定管式输液器、一次性使用静脉输液针、一次性使用精密过滤输液器、一次性使用袋式输液器、一次性使用输液连接管路、一次性使用输注泵、一次性使用无菌注射器、一次性使用无菌注射针、一次性使用无菌胰岛素注射器、一次性使用固定剂量疫苗注射器、一次性使用高压造影注射器、一次性使用自毁式注射器等产品,也包括基本结构和预期用途与上述产品相似的产品及其组件,如一次性使用无菌注射器用活塞、一次性使用肝素帽、无针输注装置、三通阀、药液过滤器等器具。
三、基本要求(一)产品的技术资料产品的技术资料应当从技术层面论述申报产品的用途、设计、技术特征、与已上市产品的比较、原材料控制、生产工艺、产品包装验证、产品灭菌验证、产品有效期验证、产品性能要求及依据。

一次性使用输注器具产品注册技术审查指导原则一、前言本指导原则旨在帮助和指导申请者/生产企业对一次性输注器具产品注册申报资料进行准备,以满足技术审评的基本要求。
同时有助于审评机构对该类产品进行科学规范的审评,提高审评工作的质量和效率。
本指导原则是对一次性使用输注器具产品注册申报资料的一般要求,申请者/生产企业应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用。
本指导原则是对生产企业和审查人员的指导性文件, 但不包括注册审批所涉及的行政事项,亦不作为法规强制执行, 如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
二、适用范围临床治疗与诊断时一次性使用,用于将容器内的液体通过插入静脉的针头或导管输入患者血管的器械及用于将液体注入人体和抽取人体体液的器具及其组件统称为一次性使用输注器具。
一次性使用输注器具包括:一次性使用输液器、一次性使用输血器、一次性使用滴定管式输液器、一次性使用静脉输液针、一次性使用精密过滤输液器、一次性使用袋式输液器、一次性使用输液连接管路、一次性使用输注泵、一次性使用无菌注射器、一次性使用无菌注射针、一次性使用无菌胰岛素注射器、一次性使用固定剂量疫苗注射器、一次性使用高压造影注射器、一次性使用自毁式注射器等产品,也包括基本结构和预期用途与上述产品相似的产品及其组件,如一次性使用无菌注射器用活塞、一次性使用肝素帽、无针输注装置、三通阀、药液过滤器等器具。
三、基本要求(一)产品的技术资料产品的技术资料应当从技术层面论述申报产品的用途、设计、技术特征、与已上市产品的比较、原材料控制、生产工艺、产品包装验证、产品灭菌验证、产品有效期验证、产品性能要求及依据。


食品加工企业安全风险辨识分级管控清单1. 引言本文档旨在帮助食品加工企业识别和管理安全风险,确保产品的安全性和符合相关法规要求。
通过分级管控清单的使用,食品加工企业可以有针对性地采取措施,减少潜在的安全风险。
2. 安全风险辨识2.1 食品原料安全性辨识- 对每个食品原料进行评估,确认其安全性,并记录评估结果。
- 根据评估结果,将食品原料分为高风险、中风险和低风险等级。
2.2 生产工艺安全风险辨识- 分析生产工艺中可能存在的安全风险,如物理、化学和微生物污染等。
- 根据风险级别,对生产工艺进行分级,确定各级别相应的管控措施。
3. 安全风险分级管控3.1 高风险管控- 针对高风险食品原料和生产工艺,采取必要的管控措施,确保安全性。
- 确保高风险食品原料供应商符合相关安全质量标准,建立供应商评估和合格供应商名录。
3.2 中风险管控- 针对中风险食品原料和生产工艺,采取适当的管控措施,减小风险。
- 定期检查中风险食品原料的质量和安全性,确保其合规。
3.3 低风险管控- 针对低风险食品原料和生产工艺,建立基本的管控措施,确保安全性。
- 对低风险食品原料进行抽检,确保其合规和安全性。
4. 风险管控评估4.1 监控和评估风险管控措施的有效性,随时做出必要的调整和改进。
4.2 定期进行风险管控评估,确保管控措施的持续有效性。
5. 风险管控清单更新5.1 根据食品原料和生产工艺的变化,及时更新风险管控清单。
5.2 引入新的技术或工艺时,重新评估相关的风险并更新清单。
6. 总结通过使用食品加工企业安全风险辨识分级管控清单,企业可以做到风险有序管控,确保产品安全和合规性。
同时,定期评估和更新管控措施,提高管理效能和企业竞争力。


***产品风险管理报告编写: (技术部经理)风险管理参加人员:日期: 2018年 10月 20 日评审: (管代)日期: 2018年 10 月 25 日批准: (总经理)日期: 20178年 10月 30 日********医疗科技有限公司目录第一章概述第二章风险管理人员及其职责分工第三章风险可接受准则第四章预期用途和与安全性有关的特征的判定第五章判定可预见的危害、危害分析及初始风险控制方案第六章风险评价、风险控制和风险控制措施验证第七章综合剩余风险评价第八章生产和生产后信息第九章风险管理评审结论第一章概述1.编制依据1.1相关标准1)YY0316-2016医疗器械风险管理对医疗器械的应用2)注册产品技术要求3)其他标准1.2产品的有关资料1)使用说明书2)医院使用情况、维修记录、顾客投诉、意外事故记录等3)专业文献中的文章和其他信息2.目的和适用范围本文是对***产品进行风险管理的报告,报告中对医疗冷敷眼罩产品在上市后风险管理情况进行总体评价,所有的可能危害以及每一个危害产生的原因进行了判定。
对于每种危害可能产生损害的严重度和危害的发生概率进行了估计。
在某一风险水平不可接受时,采取了降低风险的控制措施,同时,对采取风险措施后的剩余风险进行了可接受性评价,证实对产品的风险已进行了管理,并且控制在可接受范围内。
本报告适用于医用冷敷眼罩产品。
3.产品描述本风险管理的对象是医用冷敷眼罩产品。
该产品由医用冷敷眼罩几部分组成,该产品的性能特点是*******。
适应症:***********产品的结构和组成如下图:产品结构图*******4.风险管理计划及实施情况简述***产品产品于****年开始策划立项。
立项同时,我们就针对该产品进行了风险管理活动的策划,指定了风险管理计划。
该风险管理计划确定了风险管理活动范围、参加人员及职责和权限的分配、基于制造商决定可接受风险方针的风险可接受性准则,包括在损害发生概率不能估计时的可接受风险的准则、风险管理活动计划等内容。

物品安全隐患排查清单一、背景随着社会的发展和物品生产的不断增加,人们的生活质量得到了提高,但同时也带来了一些物品安全隐患。
为了保障人们的生命财产安全,减少物品安全事故的发生,对物品安全隐患进行全面排查是十分必要的。
二、排查范围物品安全隐患排查范围主要包括以下几个方面:1. 生产环节:排查生产过程中可能存在的安全隐患,包括原材料的选用、工艺流程、生产设备、操作人员等。
2. 产品质量:排查产品质量相关的隐患,包括产品设计、材料选择、生产加工等环节。
3. 使用环节:排查产品在使用过程中可能存在的隐患,包括产品的使用方法、使用场景、使用人群等。
4. 储存运输环节:排查产品在储存和运输过程中可能存在的隐患,包括储存条件、运输工具、物流环节等。
5. 废弃处理环节:排查废弃产品可能带来的环境安全隐患,包括产品的废弃处理方式、对环境的影响等。
三、隐患排查内容1.原材料选用(1)排查原材料的质量问题,是否符合国家标准,是否存在质量问题。
(2)排查原材料的来源和生产厂家信誉,是否存在不合格或假冒产品。
(3)排查原材料的存储条件,是否符合要求,是否存在受潮、霉变等情况。
(4)排查原材料的检验记录,是否存在问题。
2.生产工艺(1)排查生产工艺过程中的操作规范,是否存在疏忽大意、操作失误等现象。
(2)排查生产设备的安全性能,是否存在设备老化、损坏等情况。
(3)排查工人操作技术熟练程度,是否存在操作不规范、操作失误等问题。
(4)排查生产过程中的排放废气、废水等环保问题。
3.产品设计(1)排查产品设计的合理性,是否符合国家标准和行业标准。
(2)排查产品安全性能,是否存在易燃、易爆、易腐蚀等安全隐患。
(3)排查产品的功能性能,是否存在性能不稳定、寿命较短等问题。
(4)排查产品标识和说明书,是否存在虚假宣传、误导消费者等情况。
4.生产加工(1)排查产品生产加工过程中的质量控制和检验,是否存在疏漏和盲目自检等情况。
(2)排查产品加工工艺,是否存在产品表面缺陷、内部质量问题等。
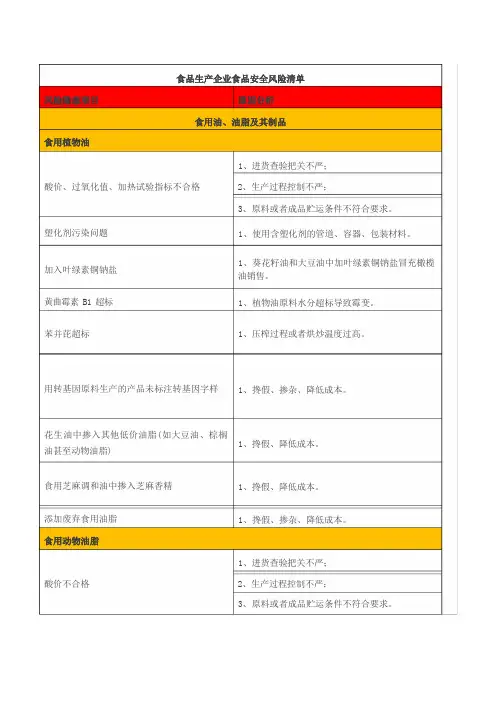
酸价、过氧化值、加热试验指标不合格塑化剂污染问题加入叶绿素铜钠盐黄曲霉素 B1 超标苯并芘超标1、进货查验把关不严;2、生产过程控制不严;3、原料或者成品贮运条件不符合要求。
1、使用含塑化剂的管道、容器、包装材料。
1、葵花籽油和大豆油中加叶绿素铜钠盐冒充橄榄油销售。
1、植物油原料水分超标导致霉变。
1、压榨过程或者烘炒温度过高。
用转基因原料生产的产品未标注转基因字样花生油中掺入其他低价油脂(如大豆油、棕榈油甚至动物油脂)食用芝麻调和油中掺入芝麻香精添加废弃食用油脂酸价不合格1、搀假、掺杂、降低成本。
1、搀假、降低成本。
1、搀假、降低成本。
1、搀假、掺杂、降低成本。
1、进货查验把关不严;2、生产过程控制不严;3、原料或者成品贮运条件不符合要求。
添加废弃食用油脂掺入其他低价油脂(如牛油中掺入起酥油)或者来源不明油脂1、搀假、掺杂、降低成本。
1、搀假、掺杂、降低成本。
火炼猪油中丙二醛超标 1、生产过程控制不严。
用工业用油(工业鱼油、工业猪油等)等非食1、搀假、掺杂、降低成本。
品原料加工1、进货查验把关不严;过氧化值不合格 2、生产过程控制不严;3、原料或者成品贮运条件不符合要求。
1、购进变质原料;微生物超标,主要涉及菌落总数和大肠菌群两个指标。
2、生产环境卫生条件差;3、原料或者成品贮运条件不符合要求。
兽药残留(如β-兴奋剂莱克多巴胺)不合格铅等重金属超标用福尔马林处理鸡爪卤肉加工使用罂粟壳泡椒肉制品山梨酸等防腐剂超标,或者多种防腐剂比例之和大于 1.1、进货查验把关不严。
1、进货查验把关不严;2、生产过程控制不严。
1、延长保质期;2、增强卖相。
1、增加口味。
1、防腐。
在牛羊肉中人为掺杂猪肉、鸡肉、鸭肉等价格1、降低成本。
低廉肉类使用胭脂红、诱惑红、苋菜红等着色剂创造假1、改善色泽、让鸭肉等似像羊肉。
羊肉使用磷酸氢二钠、焦磷酸钠、三聚磷酸钠等水分保持剂创造假羊肉篡改生产日期和保质期超范围使用日落黄等着色剂亚硝酸盐超标违法使用硝基呋喃类药物、玉米赤霉醇、万古霉素、氯丙嗪等兽药以病害肉冒充合格肉猪肉染色制成牛肉违法添加酸性橙等非食用物质二恶英类污染1、注水,增加肉品的分量,改变色泽,让鸭肉等似像羊肉。
.XXXX 产品风险管理报告文件编号:LX-RM-项目编号 版本:V1.0风险管理编写参与人员: 编制时间: 审核人员: 审核时间 批准人员: 批准时间:..第一章概述1.1 目的识别 XXX 产品可能对病人、操作者、服务人员、仪器附近人员及环境造成的危 害,并找出消除风险或控制风险的解决方法。
1.2 依据1.2.1 相关标准(按企业所生产产品的类型列举相关标准,以下标准为举例) 1)YY0316-2008 医疗器械——风险管理对医疗器械的应用 2)注册产品技术要求 3)其他标准1.3 范围1.3.1 此风险管理报告包含研发初期可以识别的所有风险及按照预期目的使用 时可能发生的风险,建议使用的附件也包括在本风险分析范围之内。
而关于使用 到产品之后外延部分的风险将在具体的产品中进行分析,此报告不予进行分析。
1.3.2 风险管理适用产品:产品名称 产品型号型号:xxxxxxx 1.3.3 本报告适用于 xxxxx 产品,该产品处于试产\批量生产阶段。
1.4 产品信息1.4.1 产品描述产品预期用途。
产品应用范围、功能、性能描述。
1.5 产品研发背景描述产品研究历程,..1.6 产品使用描述产品使用说明书,描述产品安装服务,作用对象。
1.7 产品标准配置部件数量 1台1台 1台 1套 1份1份 1份 1份1.8 产品可选配置部件数量 1台1台 1台 1套 1份1份 1份 1份1.9 风险管理计划及实施情况简述XXXX 产品于 20XX 年开始策划立项。
立项同时,我们就针对该产品进行了风 险管理活动的策划,指定了风险管理计划(文件编号:XXXX,版本号 XX)。
该风险管理计划确定了风险管理活动范围、参加人员及职责和权限的分配、基于 制造商决定可接受风险方针的风险可接受性准则,包括在损害发生概率不能估计 时的可接受风险的准则、风险管理活动计划等内容。
..XXXX 产品于 20XX 年开始试产\批量生产,未发生设计、材料、工艺等方面的 变更(或者发生了 XXXX 方面的变更,公司已针对变更情况制订了风险管理计 划并实施了风险评估及纠正)。
(完整 word 版)风险管理报告模板XXXX 产品风险管理报告文件编号:LX-RM-项目编号 版本:V1。
0风险管理编写参与人员: 编制时间: 审核人员: 审核时间 批准人员: 批准时间:第一章 概述1.1 目的识别 XXX 产品可能对病人、操作者、服务人员、仪器附近人员及环境造成的危害,并找出消 除风险或控制风险的解决方法。
1.2 依据1.2。
1 相关标准(按企业所生产产品的类型列举相关标准,以下标准为举例) 1)YY0316-2008 医疗器械—-风险管理对医疗器械的应用 2)注册产品技术要求 3)其他标准1.3 范围1。
3.1 此风险管理报告包含研发初期可以识别的所有风险及按照预期目的使用时可能发生的风 险,建议使用的附件也包括在本风险分析范围之内。
而关于使用到产品之后外延部分的风险将 在具体的产品中进行分析,此报告不予进行分析。
1。
3.2 风险管理适用产品:产品名称(完整 word 版)风险管理报告模板产品型号型号:xxxxxxx1。
3。
3 本报告适用于 xxxxx 产品,该产品处于试产\批量生产阶段。
1.4 产品信息1.4.1 产品描述产品预期用途.。
产品应用范围、功能、性能描述。
.。
1.5 产品研发背景描述产品研究历程,1.6 产品使用描述产品使用说明书,描述产品安装服务,作用对象。
1.7 产品标准配置部件数量 1台 1台 1台 1套 1份1份 1份 1份1.8 产品可选配置部件数量 1台 1台 1台 1套 1份1.9 风险管理计划及实施情况简述(完整 word 版)风险管理报告模板 1份 1份 1份XXXX 产品于 20XX 年开始策划立项。
立项同时,我们就针对该产品进行了风险管理活动的策划, 指定了风险管理计划(文件编号:XXXX,版本号 XX)。
该风险管理计划确定了风险管理活动范围、参加人员及职责和权限的分配、基于 制造商决定可接受风险方针的风险可接受性准则,包括在损害发生概率不能估计时的可接受风 险的准则、风险管理活动计划等内容。
安全风险分析报告产品名称:一次性使用病毒采样管1.医疗器械预期用途用于样本的收集、运输和储存等。
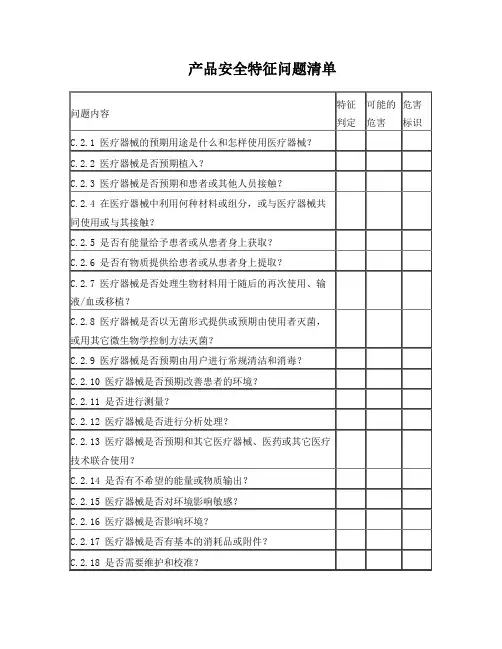
2. 与安全性有关的特征与安全性有关的特征见附表1:产品安全特征问题清单。
3. 危害的判定危害的判定见附表2:一次性使用病毒采样管的初始危害分析(PHA),包括可预见的事件序列、危害处境和可发生的损害及初始风险控制方案分析。
4.估计每个危害处境的风险产品的风险可接受准则如下:4.1损害的严重度水平4.2损害发生的概率等级4.3风险评价准则说明:A:可接受的风险;R:合理可降低(ALARP)的风险;U:不经过风险/受益分析即判定为不可接受的风险。
4.4 对每个危害处境的风险估计见附表3:一次性使用病毒采样管的风险评价、风险控制措施评价表。
5.对每个已判定的危害处境,评价和决定是否需要降低风险对每个已判定的危害处境,评价和决定见附表3:一次性使用病毒采样管的风险评价、风险控制措施评价表。
6. 风险控制措施的实施和验证结果风险控制措施的实施和验证结果见附表3:一次性使用病毒采样管的风险评价、风险控制措施评价表。
在所有的风险控制措施实施并验证后,并经相关责任人和专家评审后,认为全部剩余风险是可以接受的。
7. 任何一个或多个剩余风险的可接受性评定任何一个或多个剩余风险的可接受性评定见附表3:一次性使用病毒采样管的风险评价、风险控制措施评价表。
附表1:产品安全特征问题清单一次性使用病毒采样管的初始危害分析(PHA),包括可预见的事件序列、危害处境和可发生的损害及初始风险控制方案分析一次性使用病毒采样管的风险评价、风险控制措施评价表本公司承诺:按如下要求编写了 (一次性使用病毒采样管 ) 的安全风险分析报告。
1、国家食品药品监督管理总局《关于第一类医疗器械备案有关事项的公告》(2014年第26号公告)中,关于“安全风险分析报告”的相关要求。
2、YY 0316《医疗器械风险管理对医疗器械的应用》的相关要求。
****有限公司2020年11月02日。
一次性使用输注器具产品注册技术审查指导原则一、前言本指导原则旨在帮助和指导申请者/生产企业对一次性输注器具产品注册申报资料进行准备,以满足技术审评的基本要求。
同时有助于审评机构对该类产品进行科学规范的审评,提高审评工作的质量和效率。
本指导原则是对一次性使用输注器具产品注册申报资料的一般要求,申请者/生产企业应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据具体产品的特性确定其中的具体内容是否适用。
本指导原则是对生产企业和审查人员的指导性文件, 但不包括注册审批所涉及的行政事项,亦不作为法规强制执行, 如果有能够满足相关法规要求的其他方法,也可以采用,但是需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本指导原则。
本指导原则是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本指导原则相关内容也将进行适时的调整。
二、适用范围临床治疗与诊断时一次性使用,用于将容器内的液体通过插入静脉的针头或导管输入患者血管的器械及用于将液体注入人体和抽取人体体液的器具及其组件统称为一次性使用输注器具。
一次性使用输注器具包括:一次性使用输液器、一次性使用输血器、一次性使用滴定管式输液器、一次性使用静脉输液针、一次性使用精密过滤输液器、一次性使用袋式输液器、一次性使用输液连接管路、一次性使用输注泵、一次性使用无菌注射器、一次性使用无菌注射针、一次性使用无菌胰岛素注射器、一次性使用固定剂量疫苗注射器、一次性使用高压造影注射器、一次性使用自毁式注射器等产品,也包括基本结构和预期用途与上述产品相似的产品及其组件,如一次性使用无菌注射器用活塞、一次性使用肝素帽、无针输注装置、三通阀、药液过滤器等器具。
三、基本要求(一)产品的技术资料产品的技术资料应当从技术层面论述申报产品的用途、设计、技术特征、与已上市产品的比较、原材料控制、生产工艺、产品包装验证、产品灭菌验证、产品有效期验证、产品性能要求及依据。