氨基酸等电点计算步骤
- 格式:docx
- 大小:165.47 KB
- 文档页数:1


等电点:某一氨基酸处于净电荷为零的兼性离子状态时的介质pH,用pl表示中性氨基酸的羧基解离程度大于氨基,故其pI偏酸,pI值略小于7.0,等电点一般在5~6.3之间;酸性氨基酸的羧基解离程度更大,pI明显小于7.0,等电点一般在2.8~3.2之间。
;碱性氨基酸的氨基解离程度明显大于羧基等,故其pI大于7.0,等电点一般在7.6~10.8之间;在一定的pH条件下,氨基与羧基的解离程度相等,静电荷为零,此时溶液的pH 即为其等电点。
各种氨基酸在其等电点时,溶解度最小,因而用调节等电点的方法,可以分离氨基酸的混合物。
氨基酸形成内盐:氨基酸的晶体是以偶极离子的形式存在。
这种偶极离子是分子内的氨基与羧基成盐的结果,故又叫内盐。
核酸的等电点比较低。
如DNA的等电点为4~4.5,RNA的等电点为2~2.5。
在氨基酸溶液中存在如下平衡,在一定的pH值溶液中,正离子和负离子数量相等且浓度都很低,而偶极浓度最高,此时电解以偶极离子形式存在,氨基酸不移动。
这时溶液的pH值便是该氨基酸的等电点。
蛋白氨酸、缬氨酸、异亮氨酸、赖氨酸、苏氨酸、色氨酸、苯丙氨酸,丙氨酸、谷氨酸、天门冬氨酸、甘氨酸、胱氨酸、脯氨酸、酷氨酸、丝氨酸、脯氨酸20种蛋白质氨基酸在结构上的差别取决于侧链基团R的不同。
通常根据R基团的化学结构或性质将20种氨基酸进行分类根据侧链基团的极性1、非极性氨基酸(疏水氨基酸):8种 丙氨酸(Ala)缬氨酸(Val)亮氨酸(Leu)异亮氨酸(Ile)脯氨酸(Pro)苯丙氨酸(Phe) 色氨酸(Trp)蛋氨酸(Met)2、极性氨基酸(亲水氨基酸):1)极性不带电荷:7种 甘氨酸(Gly)丝氨酸(Ser)苏氨酸(Thr)半胱氨酸(Cys)酪氨酸(Tyr)天冬酰胺(Asn)谷氨酰胺(Gln)2)极性带正电荷的氨基酸(碱性氨基酸): 3种 赖氨酸(Lys)精氨酸(Arg)组氨酸(His)3)极性带负电荷的氨基酸(酸性氨基酸): 2种 天冬氨酸(Asp)谷氨酸(Glu)根据氨基酸分子的化学结构1、 脂肪族氨基酸: 丙、缬、亮、异亮、蛋、天冬、谷、赖、精、甘、丝、苏、半胱、天冬酰胺、谷氨酰胺2、 芳香族氨基酸:苯丙氨酸、酪氨酸3、 杂环族氨基酸:组氨酸、色氨酸4、 杂环亚氨基酸:脯氨酸等电点的计算1)侧链不含离解基团的中性氨基酸,其等电点是它的p K1和p K2的算术平均值:p I= (p K1 + p K2 )/2;(K1:-COOH电离常数;K2:-NH3+电离常数)以Gly为例:2)侧链含有可解离基团的氨基酸,其p I值也决定于两性离子两边的p K 值的算术平均值。

当氨基酸完全质子化时(即处于酸性溶液时),再用碱滴定结论:氨基酸的等电点相当于该氨基酸的两性离子状态两侧基团pK值之和的一半。
即pI =1/2(pKa1+pKa2)侧链上有解离基团的氨基酸的pI如何计算?1)首先氨基酸完全质子化;2)写出其解离方程式:①先解离α-COOH, 再解离侧链基团上的COOH;②再解离α-NH3+, 最后解离侧链基团上的NH3+。
3)标出各解离步骤的pK值,最后以两性离子状态两侧基团pK值之和的一半计算其等电点。
例如:1)Glu的pK1(α-COOH)=2.19, pK2(γ- COOH)=4.25,pK3(α- NH3+)=9.67,计算其pI 值。
2)Lys的pK1(α-COOH)=2.18, pK2(α-NH3+)=8.95,pK3(ε- NH3+)=10.53,计算其pI值。
⏹名词解释:1.兼性离子(zwitterion);2.等电点(isoelectric point,pI);两性离子所带电荷因溶液的pH值不同而改变,当两性离子正负电荷数值相等时,溶液的pH值即其等电点。
3.构象(conformation);指一个分子中,不改变共价键结构,仅单键周围的原子放置所产生的空间排布。
一种构象改变为另一种构象时,不要求共价键的断裂和重新形成。
构象改变不会改变分子的光学活性。
⏹填空1.氨基酸在等电点时,主要以__________离子形式存在,在pH>pI的溶液中,大部分以________离子形式存在,在pH<pI的溶液中,大部分以________离子形式存在。
2.组氨酸的pK1(α-COOH)值是1.82,pK2 (咪唑基)值是6.00, pK3(α-NH3+)值是9.17,它的等电点是__________。
3.Asp的pK1=2.09,pK2= 3.86,pK3=9,82,其pI等于________。
4.在近紫外区能吸收紫外光的氨基酸有________、________和_________。

氨基酸等电点与pH关系1. 引言氨基酸是构成蛋白质的基本组成单位,也是生命体系中重要的小分子。
氨基酸分子中含有一个或多个氨基(NH2)和一个羧基(COOH),以及一个侧链(R)。
在溶液中,氨基酸会解离成带正电荷的氨离子(NH3+)和带负电荷的羧酸离子(COO-)。
当溶液中存在H+离子时,氨基酸分子还可以接受或释放H+离子。
pH值是用来衡量溶液酸碱性强弱的指标。
在水溶液中,pH值定义为负对数函数-log[H+]。
当[H+]浓度较高时,溶液呈酸性;当[H+]浓度较低时,溶液呈碱性。
本文将探讨氨基酸等电点与pH值之间的关系,并介绍等电点的定义、计算方法以及影响因素。
2. 等电点的定义和计算方法2.1 等电点的定义等电点是指溶液中氨基酸带净电荷的平衡状态,即氨基酸分子带正电荷和负电荷数量相等的pH值。
在等电点时,氨基酸不带净电荷,呈现中性状态。
2.2 等电点的计算方法氨基酸的等电点可以通过两种方法计算:理论计算和实验测定。
2.2.1 理论计算理论计算等电点是基于氨基酸分子的化学性质和离子解离平衡的原理。
根据氨基酸的pKa值(指解离常数pKa=-logKa),可以推导出氨基酸在不同pH值下带正负电荷的比例,并找到正负电荷数量相等时对应的pH值作为等电点。
2.2.2 实验测定实验测定等电点是通过测量溶液中氨基酸带净电荷状态转变的pH值来确定。
常用的实验方法包括等电聚焦法、色谱法和电泳法等。
3. 氨基酸等电点与pH关系3.1 酸性氨基酸当溶液中pH低于氨基酸的pKa值时,羧基失去一个质子,形成带负电荷的羧酸离子,而氨基仍保持带正电荷的状态。
随着pH值的升高,氨基酸分子逐渐失去正电荷,直到pH等于pKa值时,氨基酸带正负电荷数量相等,达到等电点。
当溶液中pH继续升高时,羧酸离子将接受更多的质子,使氨基酸带负电荷。
3.2 碱性氨基酸当溶液中pH高于氨基酸的pKa值时,氨基失去一个质子,形成带正电荷的氨离子,而羧基仍保持带负电荷的状态。

谷氨酸等电点的计算引言:谷氨酸是一种重要的氨基酸,广泛存在于生物体中。
了解谷氨酸的等电点对于研究其性质和功能具有重要意义。
本文将介绍谷氨酸等电点的计算方法及其意义。
一、什么是等电点?等电点是指溶液中某一物质带有的净电荷为零的pH值。
在等电点附近,物质的电荷转移达到平衡,净电荷为零。
对于氨基酸等带有离子性的化合物来说,等电点是其溶液中带有的净电荷为零的pH 值。
二、谷氨酸的结构和性质谷氨酸是一种二元氨基酸,由谷氨酸酸和谷氨酸碱两种离子形式构成。
谷氨酸具有两个离子化的官能团,即羧基(COOH)和氨基(NH2)。
在酸性条件下,谷氨酸以酸离子形式存在;在碱性条件下,谷氨酸以碱离子形式存在。
三、计算谷氨酸的等电点1. 等电点的计算方法谷氨酸的等电点可以通过数学方法计算得出。
等电点是指谷氨酸带有的净电荷为零的pH值,也就是谷氨酸酸离子和谷氨酸碱离子的浓度相等的pH值。
可以通过求解酸离子和碱离子的浓度相等的方程来计算等电点。
2. 酸离子和碱离子浓度的计算谷氨酸酸离子的浓度可以通过酸性条件下的酸离子解离常数Ka计算得出。
而谷氨酸碱离子的浓度可以通过碱性条件下的碱离子解离常数Kb计算得出。
根据电离常数的定义,可以得到以下等式:Ka = [谷氨酸酸离子]/[谷氨酸酸],Kb = [谷氨酸碱离子]/[谷氨酸碱]。
3. 方程的求解将酸离子和碱离子的浓度相等代入酸离子解离常数和碱离子解离常数的等式中,即Ka = [谷氨酸酸离子]/[谷氨酸酸] = [谷氨酸碱离子]/[谷氨酸碱] = Kb。
然后解方程,求解出等电点的pH值。
四、谷氨酸等电点的意义谷氨酸等电点的计算可以帮助我们了解谷氨酸的电离特性和溶液中的电荷分布。
谷氨酸在不同pH条件下具有不同的电荷状态,这对于其在生物体内的功能和相互作用具有重要影响。
例如,在酸性条件下,谷氨酸酸离子会与其他离子或分子发生静电吸引作用,影响其在代谢途径中的活性。
谷氨酸等电点的计算还对于生物工程和药物研发等领域具有重要意义。

氨基酸等电点的相关问题一、定义等电点(pI,isoelectric point):在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,所带净电荷为零,呈电中性,此时溶液的pH称为该氨基酸的等电点。
两性离子所带电荷因溶液的pH值不同而改变,当两性离子正负电荷数值相等时,溶液的pH值即其等电点。
当外界溶液的pH大于两性离子的pl值,两性离子释放质子带负电。
当外界溶液的pH小于两性离子的pl值,两性离子质子化带正电。
二、两性与等电点的关系氨基酸具有氨基和羧基的典型反应,例如氨基可以羟基化、酰基化可与亚硝酸作用;羧基以成酯或酰氯或酰胺等。
此外,由于分子中同时具有氨基与羧基,还有氨基酸所特有的性质。
氨基酸分子中既含有氨基,又含有羧基,所以氨基酸与强酸强碱都能成盐,氨基酸是两性物质,本身能形成内盐。
氨基酸的高熔点(实际为分解点)、难溶于非极性有机溶剂等性质说明氨基酸在结晶状态是以两性离子存在的。
在水溶液中,氨基酸二偶极离子即可以与一个结合成为正离子,又可以失去一个成为负离子。
这三种离子在水溶液中通过得到或失去互相转换同时存在,在pH值达到等电点时溶液处于平衡。
等电点不是中性点,不同氨基酸由于结构不同,等电点也不同。
酸性氨基酸水溶液的pH值必然小于7,所以必须加入较多的酸才能使正负离子量相等。
反之,碱性氨基酸水溶液中正离子较多,则必须加入碱,才能使负离子量增加。
所以碱性氨基酸的等电点必然大于7。
各种氨基酸在其等电点时,溶解度最小,因而用调节等电点的方法,可以分离氨基酸的混合物。
核酸的等电点比较低。
如DNA的等电点为4~4.5,RNA的等电点为2~2.5。
在氨基酸溶液中存在如下平衡,在一定的pH值溶液中,正离子和负离子数量相等且浓度都很低,而偶极浓度最高,此时电解以偶极离子形式存在,氨基酸不移动。
这时溶液的pH值便是该氨基酸的等电点。
某一氨基酸处于净电荷为零的兼性离子状态时的介质pH,用pl表示。
中性氨基酸的羧基解离程度大于氨基,故其pI偏酸,pI值略小于7.0;酸性氨基酸的羧基解离程度更大,pI明显小于7.0;碱性氨基酸的氨基解离程度明显大于羧基等,故其pI大于7.0;在一定的pH条件下,氨基与羧基的解离程度相等,静电荷为零,此时溶液的pH即为其等电点。

计算氨基酸的等电点氨基酸的带电状况与溶液的ph值有关,改变ph值可以使氨基酸带上正电荷或负电荷,也可以使他处于正负电荷数相等即净电荷为零的兼性离子状态,此时的ph值为氨基酸的等电点。
氨基酸是同时带氨基和羧基的物种,在水溶液中羧基失去氢离子带负电,而氨基得到氢离子带正电,由于羧基酸性和氨基的碱性不相同,所以氨基酸往往整体上是带电的。
调节溶液的pH值,可以改变二者的电离状况,到某一点时羧基所带的负电荷与氨基所带的正电荷相同,氨基酸表现为整体不带电,这点的pH值就是氨基酸的等电点。
记-COOH的电离常数为Ka1 ,-NH3+的电离常数为Ka2,则等电点的pH值为pH=(Ka1+Ka2)/2解释氨基酸的等电点氨基酸是两性分子,能结合H(+)的-NH2,形成正电荷离子,也带有能够电离出H(+)的-COOH,形成负离子。
因此,氨基酸分子的整体与溶液的pH有关,改变溶液pH可以使氨基酸带上正电荷,负电荷或者正好处于净电荷为零的兼性离子状态,这个pH就是该氨基酸的等电点。
解离常数(pK)是水溶液中具有一定离解度的溶质的的极性参数。
离解常数给予分子的酸性或碱性以定量的量度,pKa减小,对于质子给予体来说,其酸性增加;对于质子接受体来说,其碱性增加。
pK=PH+log电子受体/电子供体氨基酸中,-COOH的电离常数为Ka1 ,-NH(3+)的电离常数为Ka2,该氨基酸的等电点的pH就是(Ka1+Ka2)/2去哪找等电点计算方法的资料?建议你去买本生化的教辅书等电点:如果调节溶液的PH值使得其中的氨基酸呈电中性,我们把这个PH值称为氨基酸的等电点:PI。
PI是氨基酸的重要常数之一,它的意义在于,物质在PI处的溶解度最小,是分离纯化物质的重要手段。
等电点的计算:对于所有的R基团不解离的氨基酸而言(即解离只发生在α-羧基和α-氨基上),计算起来非常简单:PI=(PK1’+PK2’)/2若是碰到R基团也解离的,氨基酸就有了多级解离,这个公式就不好用了,比如Lys、Glu、Cys等。

等电点的计算公式在化学和生物化学的领域里,等电点可是个相当重要的概念。
它就像是一把神奇的钥匙,能帮助我们打开理解蛋白质和氨基酸性质的大门。
那啥是等电点呢?简单来说,等电点就是氨基酸或者蛋白质在溶液中净电荷为零时的 pH 值。
要计算等电点,就得先了解一下氨基酸的结构。
氨基酸就像是一个小巧的“零件”,它有一个氨基(-NH₂)和一个羧基(-COOH),还有一个侧链(R 基团)。
在不同的 pH 条件下,氨基和羧基会发生质子化或者去质子化,从而让氨基酸带上不同的电荷。
咱们先来说说氨基酸等电点的计算。
对于像甘氨酸这种只有一个氨基和一个羧基的氨基酸,它的等电点计算公式就相对简单,是 pH = (pK₁ + pK₂)/ 2 。
这里的 pK₁和 pK₂分别是羧基和氨基的解离常数的负对数。
比如说,甘氨酸的羧基的 pK₁约为 2.34,氨基的 pK₂约为 9.60,那它的等电点 pH 就约等于(2.34 + 9.60)/ 2 = 5.97 。
那对于有酸性或者碱性侧链的氨基酸,计算等电点就稍微复杂一点啦。
咱拿赖氨酸来举个例子,它除了氨基和羧基,还有一个碱性的侧链氨基。
这时候,等电点的计算就得考虑三步解离。
我记得有一次在实验室里,我和几个同学一起做实验,就是要测定一种蛋白质的等电点。
我们按照步骤一步一步来,小心翼翼地调节溶液的 pH 值,然后观察蛋白质的沉淀情况。
那时候可紧张啦,就怕哪个步骤出错,影响了实验结果。
最后,经过一番努力,我们成功地测得了那个蛋白质的等电点,那种成就感,真的没法形容!再来说说蛋白质的等电点计算。
蛋白质可是由好多氨基酸组成的大分子,所以计算它的等电点就更复杂一些。
一般来说,需要综合考虑组成蛋白质的各种氨基酸的含量和它们的解离常数。
不过,在实际应用中,我们常常会通过实验方法来测定蛋白质的等电点,比如等电聚焦电泳。
这种方法就是利用电场让蛋白质在 pH 梯度中移动,直到它们到达自己的等电点位置不再移动,从而确定等电点。

氨基酸、多肽链和蛋白质的等电点及其相关计算(解题示例)已有5人参与★★★★★氨基酸、多肽链和蛋白质的等电点及其相关计算(解题示例)我在今年年初回答别人的提问以及以前的资料汇编,因为我也有教学工作。
本帖部分例题内容摘自:网上的发的王镜岩主编,生物化学(上),高教出版社,2002,第三版的课后习题解答。
谢谢解答者!我大致看了一下,把有错的地方给改过来了,连同楼上我摘录的张来群等,生物化学习题集,科学出版社,2002,第一章的Lys-L ys-Lys的等电点计算,还有我自己写的“酒石酸缓冲溶液的配置(附录缓冲溶液的配制方法小结)”应对生物化学考研试题应该足够了。
(一)氨基酸解离的pH计算的解题方法:基本方法是用Henderson-H asselbalch方程,pH=pKa+lg[共轭碱]/[共轭酸],[共轭碱]表示共轭碱的摩尔浓度,pKa 表示解离常数,大致知道:pKa(coo-)=3.2-3.6,pKa(NH+)=8.0-10.6, 记个大致数字即可,Lg是以10为底的对数。
具体就两点:1.题设中是哪个基团解离就用那个基团的pK,其他深的东西这里不讲,讲多了反而乱。
2.如果分不清共轭酸碱,那么更简单的规则:[共轭碱]/[共轭酸]=[质子受体]/[质子供体]=[氢离子离去后剩下的离子或者分子]/[带有氢离子的离子或为失去质子的分子],请看例1的说明,注意分子和分母的对象(质子受体与质子供体)必须是一对共轭酸碱,也就是说两者除了相差1个或多个氢离子外其余部分没有两样!最简单的规则:缺质子的在分子,或者缺质子的在上面。
例1。
计算赖氨酸的ε-NH3+20%被解离时的溶液PH。
[9.9](pKb = 10.53)(原题录入有错,我根据课本原题修正了,这题的解答也有错,我重写了解答)解:ε-NH+20%被解离,NH3+解离为NH2 + H+,NH3+和NH2+两者中谁的正电荷少,也就是丢掉的H+谁就在分子位置,ε-NH3+20%就是说有20%的ε-NH3+成为了ε-NH2,还剩下80%的ε-NH3+。

氨基酸和蛋白质等电点氨基酸和蛋白质等电点(isoelectric point, pI)是化学性质中一个重要的参数,对于理解生物化学和蛋白质功能至关重要。
本文将从氨基酸和蛋白质等电点的定义、计算方法和意义等方面进行全面解析,希望能够给读者带来一定的指导和启发。
首先,我们来了解一下氨基酸和蛋白质。
氨基酸是构成生物体内蛋白质的基本组成单元,它们由氨基(-NH2)、羧基(-COOH)和侧链基团(-R)组成。
目前已知的氨基酸有20种,它们的侧链基团的性质各异,决定了氨基酸的不同化学性质。
蛋白质是生命体内复杂而重要的分子,它们通过氨基酸之间的肽键连接而成。
蛋白质作为生物体内的工程师,承担着各种生物功能,如结构支持、酶催化、运输传递等。
了解蛋白质的化学性质,尤其是等电点,有助于揭示其在生物过程中的作用和调控机制。
那么,什么是等电点呢?等电点是指具有正电荷和负电荷的氨基酸或蛋白质,在特定条件下其总电荷为零的 pH 值。
也就是说,当氨基酸或蛋白质处于等电点状态时,它们不带电。
这是因为在酸性条件下,氨基酸的阳离子化,而在碱性条件下则阴离子化。
当 pH 值等于等电点时,氨基酸或蛋白质的阳离子和阴离子的数量相等,故总电荷为零。
那么如何计算氨基酸和蛋白质的等电点呢?这涉及到氨基酸和蛋白质的酸碱性质以及 Henderson-Hasselbalch 方程的应用。
对于氨基酸而言,它的等电点可以通过考察氨基酸的两个离子化过程:氨基质(-NH3+)和羧基质(-COO-)。
通过计算这两个离子化状态所占的比例,并找到它们相等的 pH 值,即可得到氨基酸的等电点。
对于蛋白质,由于它们是由多个氨基酸残基连接而成,所以计算等电点时需要考虑每个氨基酸残基的酸碱性质和比例,计算方法与氨基酸类似。
等电点对于理解氨基酸和蛋白质的生理功能具有重要的指导意义。
首先,等电点可以用于预测蛋白质在不同环境下的电荷状态,从而预测其溶解度和电动性。
其次,等电点还可以用于蛋白质的分离纯化。
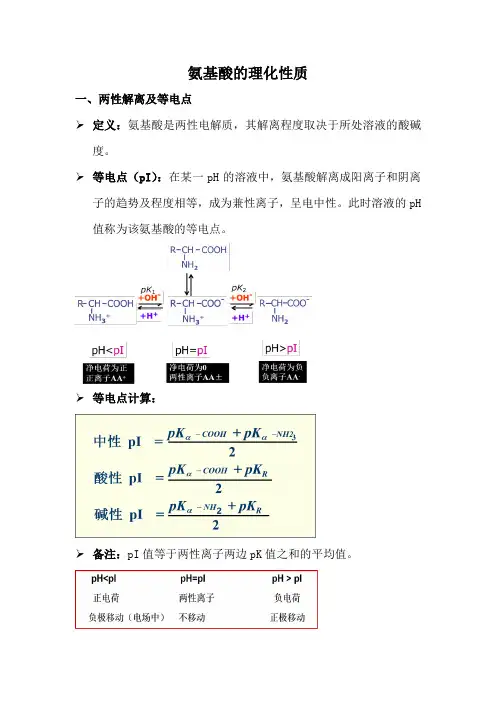
氨基酸的理化性质
一、两性解离及等电点
➢定义:氨基酸是两性电解质,其解离程度取决于所处溶液的酸碱度。
➢等电点(pI):在某一pH的溶液中,氨基酸解离成阳离子和阴离子的趋势及程度相等,成为兼性离子,呈电中性。
此时溶液的pH 值称为该氨基酸的等电点。
➢等电点计算:
➢备注:pI值等于两性离子两边pK值之和的平均值。
➢溶液的pH偏离pI越远,氨基酸带净电荷越多,在电场中越容易分离。
➢pI时氨基酸溶解度最小,容易聚集沉淀。
二、光学性质
1.旋光性:除甘氨酸外,其他氨基酸有不对称C原子,可以用旋光仪测定其旋光性。
➢左旋:Ser、Leu、Pro、Trp、Phe等。
➢右旋:Ala、Ile、Glu、Asp、Val、Lys、Arg等。
2.光吸收:R基团含有芳香环共轭双键系统的色氨酸、酪氨酸、苯丙氨酸,在近紫外区(220—300nm)有光吸收,其最大光吸收(λmax)分别为279nm,278nm和259nm。
蛋白质由于含有这些氨基酸,一般最大光吸收在280nm波长处,因此能利用紫外分光光度法很方便的测定蛋白质含量。
三、重要化学反应
1.茚三酮反应:在ph5-7和80—100°条件下,氨基酸与茚三酮可生成蓝紫色化合物,其最大吸收峰在570nm处。
常作为氨基酸定量分析方法。
脯氨酸或羟脯氨酸与茚三酮生成黄色化合物。
此反应经常用于氨基酸的定性和定量分析。
等电点:某一氨基酸处于净电荷为零的兼性离子状态时的介质pH,用pl表示中性氨基酸的羧基解离程度大于氨基,故其pI偏酸,pI值略小于7.0,等电点一般在5~6.3之间;酸性氨基酸的羧基解离程度更大,pI明显小于7.0,等电点一般在2.8~3.2之间。
;碱性氨基酸的氨基解离程度明显大于羧基等,故其pI大于7.0,等电点一般在7.6~10.8之间;在一定的pH条件下,氨基与羧基的解离程度相等,静电荷为零,此时溶液的pH 即为其等电点。
各种氨基酸在其等电点时,溶解度最小,因而用调节等电点的方法,可以分离氨基酸的混合物。
氨基酸形成内盐:氨基酸的晶体是以偶极离子的形式存在。
这种偶极离子是分子内的氨基与羧基成盐的结果,故又叫内盐。
核酸的等电点比较低。
如DNA的等电点为4~4.5,RNA的等电点为2~2.5。
在氨基酸溶液中存在如下平衡,在一定的pH值溶液中,正离子和负离子数量相等且浓度都很低,而偶极浓度最高,此时电解以偶极离子形式存在,氨基酸不移动。
这时溶液的pH值便是该氨基酸的等电点。
蛋白氨酸、缬氨酸、异亮氨酸、赖氨酸、苏氨酸、色氨酸、苯丙氨酸,丙氨酸、谷氨酸、天门冬氨酸、甘氨酸、胱氨酸、脯氨酸、酷氨酸、丝氨酸、脯氨酸20种蛋白质氨基酸在结构上的差别取决于侧链基团R的不同。
通常根据R基团的化学结构或性质将20种氨基酸进行分类根据侧链基团的极性1、非极性氨基酸(疏水氨基酸):8种丙氨酸(Ala)缬氨酸(Val)亮氨酸(Leu)异亮氨酸(Ile)脯氨酸(Pro)苯丙氨酸(Phe)色氨酸(Trp)蛋氨酸(Met)2、极性氨基酸(亲水氨基酸):1)极性不带电荷:7种甘氨酸(Gly)丝氨酸(Ser)苏氨酸(Thr)半胱氨酸(Cys)酪氨酸(Tyr)天冬酰胺(Asn)谷氨酰胺(Gln)2)极性带正电荷的氨基酸(碱性氨基酸): 3种赖氨酸(Lys)精氨酸(Arg)组氨酸(His)3)极性带负电荷的氨基酸(酸性氨基酸): 2种天冬氨酸(Asp)谷氨酸(Glu)根据氨基酸分子的化学结构1、脂肪族氨基酸:丙、缬、亮、异亮、蛋、天冬、谷、赖、精、甘、丝、苏、半胱、天冬酰胺、谷氨酰胺2、芳香族氨基酸:苯丙氨酸、酪氨酸3、杂环族氨基酸:组氨酸、色氨酸4、杂环亚氨基酸:脯氨酸等电点的计算1)侧链不含离解基团的中性氨基酸,其等电点是它的p K1和p K2的算术平均值:p I= (p K1 + p K2 )/2;(K1:-COOH电离常数;K2:-NH3+电离常数)以Gly为例:2)侧链含有可解离基团的氨基酸,其p I值也决定于两性离子两边的p K 值的算术平均值。
多肽等电点与疏水性一、氨基酸的等电点,该如何进行计算?1、氨基酸是两性电解质,在碱性溶液中表现出带负电荷,在酸性溶液中表现出带正电荷,在某一定pH 溶液中,氨基酸所带的正电荷和负电荷相等时的pH,称为该氨基酸的等电点。
2、氨基酸等电点的计算公式:pH=(pKn+pKn+1)/2n:氨基酸(或多肽)完全质子化时带正电荷基团数pK:解离基团的解离常数等电点的计算步骤先将氨基酸/多肽可解离基团的pK值自小到大按顺序排列判断n值判断氨基酸的分类酸性氨基酸和中性氨基酸的完全质子化数n=1碱性氨基酸的完全质子化数n=23、氨基酸等电点表甘氨酸5.97丙氨酸6.00缬氨酸5.96亮氨酸5.98异亮氨酸6.02苯丙氨酸5.48丝氨酸5.68苏氨酸6.16酪氨酸5.68半胱氨酸5.05蛋氨酸5.74脯氨酸6.30色氨酸5.89赖氨酸9.74精氨酸10.76组氨酸7.59门冬氨酸2.77谷氨酸3.22门冬酰胺5.41谷氨酰胺5.65二、20种氨基酸的疏水参数见下表(高正值的氨基酸具有更大的疏水性,而低负值的氨基酸则更加亲水):Arg(R)-4.5Lys(K)-3.9Asn(N)-3.5Asp(D)-3.5Gln(Q)-3.5Glu(E)-3.5His(H)-3.2Pro(P)-1.6Tyr(Y)-1.3Trp(W)-0.9Ser(S)-0.8Thr(T)-0.7Gly(G)-0.4Ala(A)1.8Met(M)1.9Cys(C)2.5Phe(F)2.8Leu(L)3.8Val(V)4.2Ile(I)4.5多肽保存多肽一般长期保存需要避光保存,并应保存在-20度以下,短期可以保存在4℃。
可以短时间以室温运输。
多肽在-20℃很稳定,特别是冷冻干燥并保存在干燥器中时,在将它们暴露于空气之前,冷冻干燥多肽可以放于室温自然升温,这将使湿度影响减少,当无法冷冻干燥时,最好的方法是以小的工作样量存放。
对于含Cys, Met or Trp的多肽,脱氧缓冲剂对其溶解必不可少,因为这种多肽容易空气氧化,在封瓶前,氮气或氩气保护会降低氧化作用。
三个pk等电点的计算方法
等电点(pI)是指分子或表面不带电荷时的pH值,是针对带电荷的物质而言,不只限于两性电解质如氨基酸和蛋白质。
对于具有三个pk等电点的物质,可以使用以下方法计算:方法一:PI=(PKa+PKb)/2。
方法二:先写出物质电性由最正到最负的过程,然后计算等电点。
例如,对于谷氨酸,其过程为NH3+(aCOOH,R-COOH)到NH3+(aCOO-,R-COOH)到NH3+(aCOO-,R-COO-)最后到NH3 (aCOO-,R-C。
方法三:若三个PK值中有两个是碱性,一个是酸性,则等电点是两个碱性值的平均数,即PI=(PK1+PK2)/2。
需要注意的是,等电点的计算可能会因物质的性质和环境条件而有所不同,在实际应用中,需要根据具体情况选择合适的计算方法。