20种氨基酸等电点
- 格式:xls
- 大小:15.00 KB
- 文档页数:1

氨基酸等电点氨基酸等电点是目前生物化学、分子生物学领域中应用最为广泛的一个理论,它是一个衡量氨基酸内部化学活性以及生物活性的度量标准,它涉及到生物体内各种细胞器官的形成和功能等等。
一般而言,氨基酸的等电点由其化学结构所决定,比如它的偶氮性、酸性和碱性程度,它们会影响氨基酸在不同环境下受紫外线、热、酸和碱等刺激性介质的反应。
等电点可以帮助科学家们更好地理解和掌握氨基酸的性质,从而有效地改善生物系统的功能和性能。
氨基酸等电点有两个主要指标,即等电点值(pI)和等电点活性(pK)。
等电点值表示氨基酸在特定pH值下,其吸电子数量和放电子数量最接近的pH值,而等电活性(pK)则表示氨基酸在绝对静态环境下的hydronium ion(H+)转化率。
由于氨基酸等电点涉及到许多不同种类的氨基酸,因此,这些氨基酸的等电点值也是不同的。
对于酸性氨基酸,例如丙氨酸,等电点值可以高达9.78,而碱性氨基酸,例如色氨酸,则可以高达10.20。
此外,中性氨基酸,例如苯丙氨酸,则可以高达5.90。
针对不同氨基酸的等电点,可以采用多种不同的测定方法。
其中,最常见的测定方法是离子对比,它利用离子对比反应来确定氨基酸的等电点。
另外,也可以采用电位计法来测定氨基酸的等电点,这种方法也称为量程法,它可以通过电位计测量氨基酸的等电点。
此外,还可以采用其他的技术,如静电表法、滴定法,甚至利用超声波提取技术等,测定氨基酸的等电点,但这些方法相对较复杂,不太容易进行,因此一般情况下不常用。
由于氨基酸等电点十分重要,因此,目前科学家们正在努力研究和开发更加准确的测定氨基酸的等电点的方法,从而提高氨基酸等电点的测量精度,为后续的生物化学和分子生物学研究提供可靠的研究基础。
总而言之,氨基酸等电点是生物化学和分子生物学领域中重要的一种理论,它可以帮助科学家们更好地理解和掌握氨基酸的性质,从而有效地改善生物系统的功能和性能。
而研究等电点的方法也在不断发展成熟,可以更加精准地测定氨基酸的等电点。


氨基酸等电点
氨基酸等电点(Isoelectric Point,pI)是非离子型的氨基酸在特定溶液条件下所表现出的中性电荷。
当特定溶液中的氨基酸浓度增加时,溶液中的带正荷的离子浓度将减少,并且溶液中的带负荷的离子浓度也会随之减少,从而使溶液中的pH值逐渐变成中性,这就是氨基酸等电点。
氨基酸的等电点是由其羧基或氨基的质子损失和氢离子的捕获所决定的。
由于氨基酸的烷基和醇基组成,可以同时捕获和损失一个质子,因此根据其在等电点处发生的分子反应,氨基酸可以分为两类:非离子型氨基酸和离子型氨基酸。
非离子型氨基酸在低pH溶液中能够损失质子,得到阴离子状态,这些氨基酸的等电点的pI值一般小于7。
离子型氨基酸中,可以得到多种酸性和碱性氨基酸,它们的等电点pI值则可以大于7。
氨基酸的等电点是相当重要的,因为它们正是蛋白质结构中重要元素的存在,而且它们的等电点也可以用来描述特定溶液中氨基酸的整体电性。
其实,氨基酸的等电点还可以用来帮助科学家预测蛋白质分子在特定溶液中的溶解率和酶作用对应的酶-反应物体系。

等电点:某一氨基酸处于净电荷为零的兼性离子状态时的介质pH,用pl表示中性氨基酸的羧基解离程度大于氨基,故其pI偏酸,pI值略小于7.0,等电点一般在5~6.3之间;酸性氨基酸的羧基解离程度更大,pI明显小于7.0,等电点一般在2.8~3.2之间。
;碱性氨基酸的氨基解离程度明显大于羧基等,故其pI大于7.0,等电点一般在7.6~10.8之间;在一定的pH条件下,氨基与羧基的解离程度相等,静电荷为零,此时溶液的pH 即为其等电点。
各种氨基酸在其等电点时,溶解度最小,因而用调节等电点的方法,可以分离氨基酸的混合物。
氨基酸形成内盐:氨基酸的晶体是以偶极离子的形式存在。
这种偶极离子是分子内的氨基与羧基成盐的结果,故又叫内盐。
核酸的等电点比较低。
如DNA的等电点为4~4.5,RNA的等电点为2~2.5。
在氨基酸溶液中存在如下平衡,在一定的pH值溶液中,正离子和负离子数量相等且浓度都很低,而偶极浓度最高,此时电解以偶极离子形式存在,氨基酸不移动。
这时溶液的pH值便是该氨基酸的等电点。
蛋白氨酸、缬氨酸、异亮氨酸、赖氨酸、苏氨酸、色氨酸、苯丙氨酸,丙氨酸、谷氨酸、天门冬氨酸、甘氨酸、胱氨酸、脯氨酸、酷氨酸、丝氨酸、脯氨酸20种蛋白质氨基酸在结构上的差别取决于侧链基团R的不同。
通常根据R基团的化学结构或性质将20种氨基酸进行分类根据侧链基团的极性1、非极性氨基酸(疏水氨基酸):8种 丙氨酸(Ala)缬氨酸(Val)亮氨酸(Leu)异亮氨酸(Ile)脯氨酸(Pro)苯丙氨酸(Phe) 色氨酸(Trp)蛋氨酸(Met)2、极性氨基酸(亲水氨基酸):1)极性不带电荷:7种 甘氨酸(Gly)丝氨酸(Ser)苏氨酸(Thr)半胱氨酸(Cys)酪氨酸(Tyr)天冬酰胺(Asn)谷氨酰胺(Gln)2)极性带正电荷的氨基酸(碱性氨基酸): 3种 赖氨酸(Lys)精氨酸(Arg)组氨酸(His)3)极性带负电荷的氨基酸(酸性氨基酸): 2种 天冬氨酸(Asp)谷氨酸(Glu)根据氨基酸分子的化学结构1、 脂肪族氨基酸: 丙、缬、亮、异亮、蛋、天冬、谷、赖、精、甘、丝、苏、半胱、天冬酰胺、谷氨酰胺2、 芳香族氨基酸:苯丙氨酸、酪氨酸3、 杂环族氨基酸:组氨酸、色氨酸4、 杂环亚氨基酸:脯氨酸等电点的计算1)侧链不含离解基团的中性氨基酸,其等电点是它的p K1和p K2的算术平均值:p I= (p K1 + p K2 )/2;(K1:-COOH电离常数;K2:-NH3+电离常数)以Gly为例:2)侧链含有可解离基团的氨基酸,其p I值也决定于两性离子两边的p K 值的算术平均值。

常见氨基酸的等电点《探索常见氨基酸的等电点》嘿,你知道氨基酸吗?这可是个特别有趣的东西呢!在我们的身体里呀,它们就像一个个小小的建筑砖块,组成了各种各样重要的东西,像蛋白质啦。
今天我想和你好好聊聊常见氨基酸的等电点。
我先给你说说什么是氨基酸吧。
你可以把氨基酸想象成一个小怪兽,它有一个头,这个头就是氨基(-NH₂),还有一个尾巴,那就是羧基(-COOH),中间呢还有个身体,这个身体是各种各样不同的结构,这就使得氨基酸有好多不同的种类。
那等电点又是啥呢?这可有点像小氨基酸的一个特殊状态。
你看啊,在溶液里的时候,氨基酸有时候会带电。
就像我们有时候高兴就很积极向上,有时候难过就有点消极低沉一样。
氨基酸在不同的环境下也会有不同的电荷状态。
等电点呢,就是这个氨基酸在溶液里,它的净电荷为零的时候的pH值。
这时候的氨基酸啊,就像一个安静的小娃娃,既不特别“活泼”(带正电),也不特别“沉闷”(带负电)。
咱们先来说说甘氨酸吧。
甘氨酸可算是氨基酸里比较简单的一个啦。
它的等电点大概是6.06呢。
你想啊,如果溶液的pH值比6.06低,那就好像周围的环境变得有点“酸溜溜”的,甘氨酸这个小怪兽就会带上正电荷,就像它穿上了一层带正电的小铠甲。
可是呢,如果pH值比6.06高,环境变得“碱乎乎”的,那甘氨酸就会带上负电荷啦,就像给自己披上了一件带负电的披风。
再说说谷氨酸。
谷氨酸这个氨基酸啊,可厉害了呢。
它的等电点是3.22。
这可比甘氨酸的等电点低多了。
你要是把谷氨酸放在pH值为7的溶液里,就像是把一个在自己舒适小窝(等电点)的小动物放到了一个有点陌生而且不太适合它的大环境里。
这时候的谷氨酸就会带上负电荷,而且负电还挺多的呢。
就好像它被这个环境影响得有点“沮丧”,然后表现出很明显的带负电的状态。
还有赖氨酸呢,赖氨酸的等电点是9.74。
这就比较高啦。
要是溶液的pH值在7左右,对于赖氨酸来说,就像是把一个喜欢温暖的小动物放到了一个有点冷的地方。

二十种基本氨基酸简写符号丙氨酸Ala 精氨酸Arg 天冬氨酸Asp 半胱氨酸Cys 谷氨酰胺Gln 谷氨酸Glu 组氨酸His 异亮氨酸Ile 甘氨酸Gly 天冬酰胺Asn 亮氨酸Leu 赖氨酸Lys 甲硫氨酸Met 苯丙氨酸Phe 脯氨酸Pro 丝氨酸Ser 苏氨酸Thr 色氨酸Trp 酪氨酸Tyr 缬氨酸Val1.等电点:在某一特定pH值溶液时,氨基酸主要以两性离子形式存在,净电荷为零,在电场中不向电场的正极或负极移动,这时的溶液pH值称为该氨基酸的等电点。
2.杂多糖:水解时产生一种以上的单糖或和单糖衍生物,例如果胶物质、半纤维素、肽聚糖和糖胺聚糖等3.复合糖:糖类的还原端和蛋白质或脂质结合的产物。
4.蛋白多糖:又称黏多糖,为基质的主要成分,是多糖分子与蛋白质结合而成的复合。
5.糖蛋白:糖蛋白是一类复合糖或一类缀合蛋白质,糖链作为缀合蛋白质的辅基,一般少于是15个单糖单位,也称寡糖链或聚糖链。
6.糖胺聚糖:曾称粘多糖,氨基多糖和酸性多糖。
糖胺聚糖是一类由重复的二糖单位构成的杂多糖,其通式为:【己糖醛酸-己糖胺】n,n随种类而异,一般在20到60之间。
7.复合脂:除含脂肪酸和醇外,尚有所谓非脂分子成分(磷酸、糖和含氮碱等),如甘油磷脂、鞘磷脂、甘油糖脂和鞘糖脂,其中鞘磷脂和鞘糖脂又合称为鞘脂。
8.必需脂肪酸:体内不能合成或合成速度不能满足机体需要,必须通过食物供给。
9.脂蛋白:是由脂质和蛋白质以非共价键结合的复合体。
10.活化能:指在一定温度下,1mol底物全部进入活化态所需要的自由能11.过渡态:在酶催化反应中,酶与底物或底物类似物间瞬时生成的复合物,是具有高自由能的不稳定状态。
12.全酶:(1)由蛋白质组分(即酶蛋白)和非蛋白质组分(一般为辅酶或激活物)组成的一种结合酶。
(2)含有表达全部酶活性和调节活性所需的所有亚基的一种全寡聚酶。
13.反馈抑制:是指最终产物抑制作用,即在合成过程中有生物合成途径的终点产物对该途径的酶的活性调节,所引起的抑制作用。

二十种基本氨基酸简写符号丙氨酸Ala 精氨酸Arg 天冬氨酸Asp 半胱氨酸Cys 谷氨酰胺Gln 谷氨酸Glu 组氨酸His 异亮氨酸Ile 甘氨酸Gly 天冬酰胺Asn 亮氨酸Leu 赖氨酸Lys 甲硫氨酸Met 苯丙氨酸Phe 脯氨酸Pro 丝氨酸Ser 苏氨酸Thr 色氨酸Trp 酪氨酸Tyr 缬氨酸Val1.等电点:在某一特定pH值溶液时,氨基酸主要以两性离子形式存在,净电荷为零,在电场中不向电场的正极或负极移动,这时的溶液pH值称为该氨基酸的等电点。
2.杂多糖:水解时产生一种以上的单糖或和单糖衍生物,例如果胶物质、半纤维素、肽聚糖和糖胺聚糖等3.复合糖:糖类的还原端和蛋白质或脂质结合的产物。
4.蛋白多糖:又称黏多糖,为基质的主要成分,是多糖分子与蛋白质结合而成的复合。
5.糖蛋白:糖蛋白是一类复合糖或一类缀合蛋白质,糖链作为缀合蛋白质的辅基,一般少于是15个单糖单位,也称寡糖链或聚糖链。
6.糖胺聚糖:曾称粘多糖,氨基多糖和酸性多糖。
糖胺聚糖是一类由重复的二糖单位构成的杂多糖,其通式为:【己糖醛酸-己糖胺】n,n随种类而异,一般在20到60之间。
7.复合脂:除含脂肪酸和醇外,尚有所谓非脂分子成分(磷酸、糖和含氮碱等),如甘油磷脂、鞘磷脂、甘油糖脂和鞘糖脂,其中鞘磷脂和鞘糖脂又合称为鞘脂。
8.必需脂肪酸:体内不能合成或合成速度不能满足机体需要,必须通过食物供给。
9.脂蛋白:是由脂质和蛋白质以非共价键结合的复合体。
10.活化能:指在一定温度下,1mol底物全部进入活化态所需要的自由能11.过渡态:在酶催化反应中,酶与底物或底物类似物间瞬时生成的复合物,是具有高自由能的不稳定状态。
12.全酶:(1)由蛋白质组分(即酶蛋白)和非蛋白质组分(一般为辅酶或激活物)组成的一种结合酶。
(2)含有表达全部酶活性和调节活性所需的所有亚基的一种全寡聚酶。
13.反馈抑制:是指最终产物抑制作用,即在合成过程中有生物合成途径的终点产物对该途径的酶的活性调节,所引起的抑制作用。

二十种基本氨基酸简写符号丙氨酸Ala 精氨酸Arg 天冬氨酸Asp 半胱氨酸Cys 谷氨酰胺Gln 谷氨酸Glu 组氨酸His 异亮氨酸 Ile 甘氨酸 Gly 天冬酰胺 Asn 亮氨酸 Leu 赖氨酸 Lys 甲硫氨酸 Met 苯丙氨酸Phe 脯氨酸Pro 丝氨酸Ser 苏氨酸Thr 色氨酸Trp 酪氨酸Tyr 缬氨酸Val1.等电点:在某一特定pH值溶液时,氨基酸主要以两性离子形式存在,净电荷为零,在电场中不向电场的正极或负极移动,这时的溶液pH值称为该氨基酸的等电点。
2.杂多糖:水解时产生一种以上的单糖或和单糖衍生物,例如果胶物质、半纤维素、肽聚糖和糖胺聚糖等3.复合糖:糖类的还原端和蛋白质或脂质结合的产物。
4.蛋白多糖:又称黏多糖,为基质的主要成分,是多糖分子与蛋白质结合而成的复合。
5.糖蛋白:糖蛋白是一类复合糖或一类缀合蛋白质,糖链作为缀合蛋白质的辅基,一般少于是15个单糖单位,也称寡糖链或聚糖链。
6.糖胺聚糖:曾称粘多糖,氨基多糖和酸性多糖。
糖胺聚糖是一类由重复的二糖单位构成的杂多糖,其通式为:【己糖醛酸-己糖胺】n,n随种类而异,一般在20到60之间。
7.复合脂:除含脂肪酸和醇外,尚有所谓非脂分子成分(磷酸、糖和含氮碱等),如甘油磷脂、鞘磷脂、甘油糖脂和鞘糖脂,其中鞘磷脂和鞘糖脂又合称为鞘脂。
8.必需脂肪酸:体内不能合成或合成速度不能满足机体需要,必须通过食物供给。
9.脂蛋白:是由脂质和蛋白质以非共价键结合的复合体。
10.活化能:指在一定温度下,1mol底物全部进入活化态所需要的自由能11.过渡态:在酶催化反应中,酶与底物或底物类似物间瞬时生成的复合物,是具有高自由能的不稳定状态。
12.全酶:(1)由蛋白质组分(即酶蛋白)和非蛋白质组分(一般为辅酶或激活物)组成的一种结合酶。
(2)含有表达全部酶活性和调节活性所需的所有亚基的一种全寡聚酶。
13.反馈抑制:是指最终产物抑制作用,即在合成过程中有生物合成途径的终点产物对该途径的酶的活性调节,所引起的抑制作用。

氨基酸的等电点氨基酸的等电点:指氨基酸的正离子浓度和负离子浓度相等时的pH值,用符号pI表示。
必需氨基酸:指人或其它动物生长所需但自身不能合成,需要从食物中获得的氨基酸。
蛋白质一级结构:指蛋白质中共价连接的氨基酸残基的排列顺序。
蛋白质二级结构:在蛋白质分子中的局布区域内氨基酸残基的有规则的排列。
蛋白质三级结构:蛋白质分子处于它的天然折叠状态的三维构象。
蛋白质变性:生物大分子的天然构象遭到破坏导致其生物活性丧失的现象。
复性:在一定的条件下,变性的生物大分子恢复成具有生物活性的天然构象的现象。
别构效应:又称为变构效应,是寡聚蛋白与配基结合改变蛋白质的构象,导致蛋白质生物活性丧失的现象。
分子病:某种蛋白质的氨基酸排序异常导致的遗传病。
氨基酸残基:氨基酸残基就是指不完整的氨基酸。
核酸的变性与复性:对呈双螺旋结构的DNA溶液缓慢加热时,其中的氢键断开,双链DNA脱解为单链的现象叫做核酸的变性。
熔解温度(Tm):紫外吸收增量达到最大变化值半数时所对应的温度增色效应:核酸水解时,紫外吸收值通常增加30%-40%的现象。
退火:变形核酸复性时需缓慢冷却叫做退火。
核酸的一级结构:核苷酸残基沿多核苷酸链排列的序列。
酶:通过降低活化加快反应速率的生物催化剂,除少数RNA 外几乎都是蛋白质。
全酶:具有催化活性的酶,包括所有必需的亚基,辅基和其它辅助因子。
单体酶:只有一条多肽链的酶称为单体酶寡聚酶:有几个或多个亚基以非共价键结合组成的酶称为寡聚酶。
多酶体系:由几个酶彼此嵌合形成的复合体称为多酶体系。
活性部位:酶中含有底物结合部位和参与催化底物转化为产物的氨基酸残基部分。
酶活力单位(U):指在特定条件下,单位时间内能转化一定量底物的酶量。
比活:每分钟每毫克酶蛋白在25oC下转化的底物的微摩尔数。
比活是酶纯度的测量米氏方程:表示一个酶促反应的速率(υ)与底物浓度([s])关系的速度方程。
维生素:是一类动物本身不能合成,但对动物生长和健康又是必需的有机物。
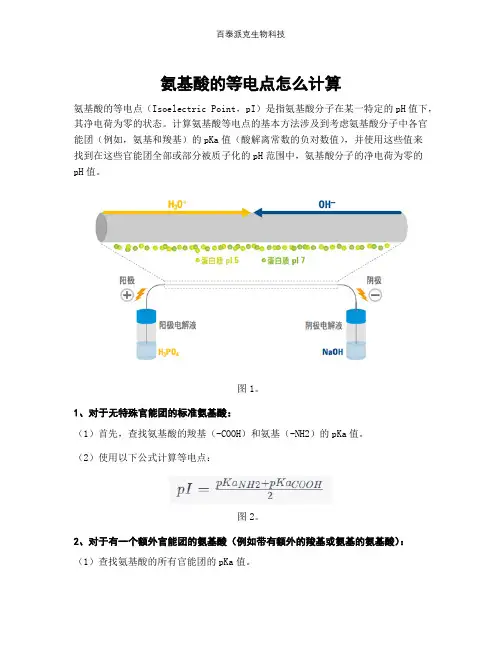
氨基酸的等电点怎么计算
氨基酸的等电点(Isoelectric Point,pI)是指氨基酸分子在某一特定的pH值下,其净电荷为零的状态。
计算氨基酸等电点的基本方法涉及到考虑氨基酸分子中各官能团(例如,氨基和羧基)的pKa值(酸解离常数的负对数值),并使用这些值来
找到在这些官能团全部或部分被质子化的pH范围中,氨基酸分子的净电荷为零的pH值。
图1。
1、对于无特殊官能团的标准氨基酸:
(1)首先,查找氨基酸的羧基(-COOH)和氨基(-NH2)的pKa值。
(2)使用以下公式计算等电点:
图2。
2、对于有一个额外官能团的氨基酸(例如带有额外的羧基或氨基的氨基酸):
(1)查找氨基酸的所有官能团的pKa值。
(2)将pKa值从低到高排序。
(3)使用中间两个pKa值来计算等电点:
图3。
3、对于有两个或更多额外官能团的氨基酸:
(1)与上面类似,首先确定所有官能团的pKa值。
(2)将pKa值从低到高排序。
(3)根据氨基酸在中性pH下的总净电荷,选择适当的中间pKa值来计算等电点。
特别注意,氨基酸的pKa值可能因文献或来源而异,因此使用准确的pKa值是很重要的。
实际上,最好的方法是直接查找文献中给出的特定氨基酸的pI值。
如果需
要进行精确的计算或有特定应用,可能还需要考虑溶液条件(如离子强度、温度等)对pKa值的影响。