硝酸银
- 格式:docx
- 大小:25.55 KB
- 文档页数:2

硝酸银白色沉淀硝酸银是一种重要的化学试剂,常用于化学实验和分析测试中。
其中,硝酸银与氯化钠反应生成白色沉淀是化学实验中常见的现象。
本文将介绍硝酸银白色沉淀的形成过程、性质及其在化学实验和分析测试中的应用。
一、硝酸银白色沉淀的形成过程硝酸银与氯化钠发生化学反应生成白色沉淀的过程如下所示:AgNO3 + NaCl → AgCl↓ + NaNO3硝酸银与氯化钠在水溶液中反应,生成氯化银沉淀和氯化钠溶液。
氯化银沉淀是白色的固体,称为白色沉淀。
二、硝酸银白色沉淀的性质1. 外观:硝酸银白色沉淀呈现出白色固体的形态。
2. 溶解性:硝酸银在水中是可溶的,但是硝酸银白色沉淀不溶于水,因此可以通过此性质进行分离和鉴定。
3. 光敏性:硝酸银白色沉淀对光敏感,在阳光下会变暗甚至变黑,这一性质可用于相纸摄影中的感光过程。
4. 稳定性:硝酸银白色沉淀对光、热和化学性质不稳定,在供暗条件下可以稳定存在。
三、硝酸银白色沉淀的应用1. 化学实验中的应用:硝酸银白色沉淀可用于检测氯离子、溴离子和碘离子等卤素离子的存在。
在氯化钠溶液中,加入硝酸银后可以观察到白色沉淀生成,从而推断出溶液中是否存在卤素离子。
2. 分析测试中的应用:硝酸银白色沉淀可以用于定量分析中,如通过沉淀重量确定样品中卤素的含量。
此外,硝酸银白色沉淀也可用于鉴定金和铜等金属离子的存在。
3. 化学反应中的应用:硝酸银白色沉淀可以用作还原剂,例如与硝酸铁反应生成铁银沉淀。
此外,硝酸银白色沉淀还可与氰化钠反应生成氰化银溶液,用于银盐摄影的显影过程。
四、结语硝酸银白色沉淀是化学实验和分析测试中常见的产物,具有重要的应用价值。
了解硝酸银白色沉淀的形成过程、性质和应用,有助于深入理解化学反应的本质和原理。
希望本文对您有所帮助,欢迎阅读更多有关化学知识的文章。


标准硝酸银溶液浓度硝酸银溶液是化学实验室中常用的一种试剂,用于检测氯离子和溴离子等化合物。
在实验中,我们经常需要制备不同浓度的硝酸银溶液,以满足不同实验要求。
本文将介绍标准硝酸银溶液的浓度计算方法和制备步骤,希望能对实验人员有所帮助。
首先,我们需要明确标准硝酸银溶液的浓度是多少。
根据化学实验室常用的标准浓度,标准硝酸银溶液的浓度通常为0.1mol/L。
这个浓度是根据实验需要和化学反应的特性确定的,可以满足大多数实验的要求。
接下来,我们来介绍标准硝酸银溶液浓度的计算方法。
在实际制备过程中,我们通常会使用硝酸银的化学计量法来计算其浓度。
硝酸银的化学计量法是指根据化学方程式中的化学计量关系,通过称量物质的质量或体积来确定其浓度的方法。
具体的计算步骤如下:1. 硝酸银的化学计量方程式为AgNO3 + NaCl = AgCl + NaNO3。
2. 根据化学计量关系,1mol的硝酸银可以与1mol的氯化钠发生化学反应。
3. 根据实验需要,确定所需制备硝酸银溶液的体积V(单位为升)。
4. 根据化学计量关系,计算出所需的硝酸银的摩尔数n。
5. 根据所需的硝酸银的摩尔数n和所需制备硝酸银溶液的体积V,计算出硝酸银的质量m(单位为克)。
6. 根据硝酸银的质量m和所需制备硝酸银溶液的体积V,计算出硝酸银的浓度C(单位为mol/L)。
在进行硝酸银溶液的制备时,需要严格按照计算出的质量和体积进行称量和溶解,以确保制备出的硝酸银溶液浓度准确无误。
最后,我们来总结一下标准硝酸银溶液的制备步骤。
具体步骤如下:1. 根据实验需要确定所需制备硝酸银溶液的体积V。
2. 计算出所需的硝酸银的摩尔数n。
3. 根据所需的硝酸银的摩尔数n和所需制备硝酸银溶液的体积V,计算出硝酸银的质量m。
4. 按照计算出的质量m进行称量和溶解,制备标准硝酸银溶液。
通过以上的介绍,相信大家对标准硝酸银溶液的浓度计算方法和制备步骤有了更深入的了解。
在实际实验中,我们需要严格按照计算出的数据进行操作,以确保制备出的硝酸银溶液浓度准确无误。

硝酸银标准溶液的滴定
硝酸银是一种常见的银盐,它在分析化学中被广泛使用。
特别是在滴定分析中,硝酸银标准溶液被用于测定氯离子、溴离子、碘离子等。
下面将详细介绍硝酸银标准溶液的滴定过程。
一、准备工作
1. 硝酸银标准溶液的配制:按照一定的质量比将硝酸银固体溶解在水中,配制成浓度精确的硝酸银标准溶液。
具体的配制方法可以参考相关的分析化学书籍或实验教程。
2. 实验仪器:准备滴定管、三角瓶、电子天平等实验仪器,确保仪器的清洁和准确度。
3. 实验试剂:准备待测溶液、硝酸银标准溶液、铬酸钾指示剂、酚酞指示剂等实验试剂。
二、滴定过程
1. 将待测溶液放入三角瓶中,加入适量的铬酸钾指示剂。
铬酸钾指示剂会与氯离子等发生反应,生成砖红色沉淀。
2. 用滴定管滴加硝酸银标准溶液至三角瓶中,同时搅拌待测溶液。
当待测溶液中的氯离子等完全反应后,滴定管的读数即为硝酸银标准溶液消耗的体积。
3. 根据硝酸银标准溶液的浓度和消耗的体积,可以计算待测溶液中的氯离子等含量。
三、注意事项
1. 实验过程中要保持环境的清洁和干燥,避免外界因素对实验结果的影响。
2. 在滴定过程中要保证搅拌充分,确保待测溶液中的氯离子等与硝酸银标准溶液充分反应。
3. 在使用酚酞指示剂时,要特别注意指示剂的变色范围,避免滴定过量或不足的情况发生。
4. 在实验过程中要保证实验仪器的清洁和准确度,避免误差的产生。
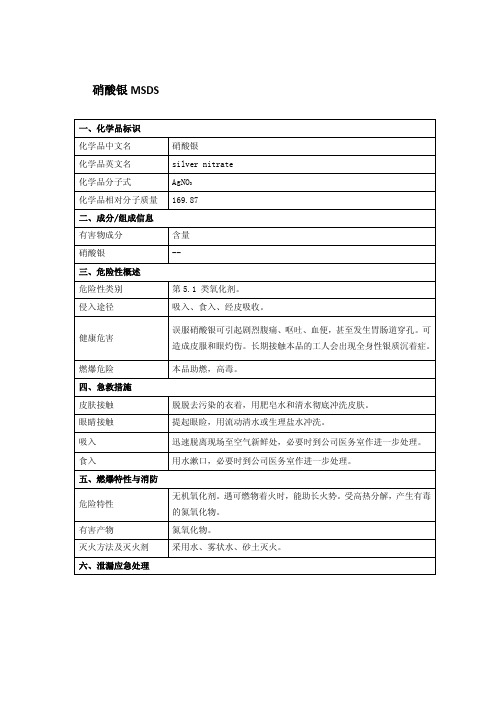

硝酸银的理化性质及危险特性(表-)硝酸银是一种常见的无机化合物,具有一系列的理化性质和危险特性。
以下是对其主要性质的介绍。
理化性质- 化学式: AgNO3化学式: AgNO3- 分子量: 169.87 g/mol分子量: 169.87 g/mol- 外观:纯净的硝酸银呈白色结晶状固体。
外观:纯净的硝酸银呈白色结晶状固体。
- 溶解性:在水中可以完全溶解,溶液呈无色。
溶解性:在水中可以完全溶解,溶液呈无色。
- 熔点:硝酸银的熔点约为 209 °C。
熔点:硝酸银的熔点约为209 °C。
- 沸点:硝酸银分解后才会显著升华,所以没有明确的沸点。
沸点:硝酸银分解后才会显著升华,所以没有明确的沸点。
- 密度:硝酸银的密度约为 4.35 g/cm³。
密度:硝酸银的密度约为 4.35 g/cm³。
危险特性- 腐蚀性:硝酸银具有一定的腐蚀性,可对皮肤、眼睛和呼吸道造成刺激和腐蚀。
腐蚀性:硝酸银具有一定的腐蚀性,可对皮肤、眼睛和呼吸道造成刺激和腐蚀。
- 毒性:硝酸银对生物具有一定的毒性,可能对环境造成影响。
毒性:硝酸银对生物具有一定的毒性,可能对环境造成影响。
- 易燃性:硝酸银本身不易燃,但可引起可燃物的燃烧。
易燃性:硝酸银本身不易燃,但可引起可燃物的燃烧。
- 放射性:硝酸银并不是放射性物质。
放射性:硝酸银并不是放射性物质。
以上是对硝酸银的主要理化性质和危险特性的介绍。
对于使用硝酸银的过程中,必须严格遵守安全操作规程,注意防护措施,以确保人身安全和环境安全。
> 注意:本文档所提供的信息基于目前能够确认的内容,但不代表全部信息。
使用时请按照正规渠道获取并确认信息。
*以上为回答,请查收。
*。
本文摘自再生资源回收-变宝网()硝酸银的性质及用途变宝网9月28日讯硝酸银是一种化学物品,主要用于镀银、制镜、印刷、医药等行业,硝酸银具有易溶于水的特性,它没有颜色,纯度较高的硝酸银对于光的反应比较稳定。
一、硝酸银的化学反应若遇到氯离子,溴离子,碘离子等会发生反应生成不溶于水,不溶于硝酸的氯化银(白色沉淀),溴化银(淡黄色沉淀),碘化银(黄色沉淀)等。
因此常被用于检验氯离子的存在;氯化银受光照射生成灰色溶液。
氯化银可与氨水反应再度溶解,生成无色的二氨银(I)溶液。
二、硝酸银的性质物理性质无色透明斜方晶系片状晶体,易溶于水和氨水,溶于乙醚和甘油,微溶于无水乙醇,几乎不溶于浓硝酸。
其水溶液呈弱酸性。
硝酸银溶液由于含有大量银离子,故氧化性较强,并有一定腐蚀性,医学上用于腐蚀增生的肉芽组织,稀溶液用于眼部感染的杀菌剂。
熔化后为浅黄色液体,固化后仍为白色。
化学性质硝酸银遇有机物变灰黑色,分解出银。
纯硝酸银对光稳定,但由于一般的产品纯度不够,其水溶液和固体常被保存在棕色试剂瓶中。
硝酸银加热至440℃时分解成银、氮气、氧气和二氧化氮。
水溶液和乙醇溶液对石蕊呈中性反应,pH 约为6。
沸点444℃(分解)。
有氧化性。
在有机物存在下,见光变灰色或灰黑色。
硝酸银能与一系列试剂发生沉淀反应或配位反应(见配位化合物)。
例如,与硫化氢反应,形成黑色的硫化银Ag2S沉淀;与铬酸钾反应,形成红棕色的铬酸银Ag2CrO4沉淀;与磷酸氢二钠反应,形成黄色磷酸银Ag3PO4沉淀;与卤素离子反应,形成卤化银AgX沉淀。
还能与碱作用,形成棕黑色氧化银Ag2O沉淀;与草酸根离子作用形成白色草酸银Ag2C2O4沉淀等。
硝酸银能与NH3、CN-、SCN-等反应,形成各种配位离子。
三、硝酸银的用途分析化学用于沉淀氯离子,工作基准的硝酸银用于标定氯化钠溶液。
无机工业用于制造其他银盐。
电子工业用于制造导电粘合剂、新型气体净化剂、A8x分子筛、镀银均压服和带电作业的手套等。
硝酸银硝酸银是一种无色晶体,易溶于水。
纯硝酸银对光稳定,但由于一般的产品纯度不够,其水溶液和固体常被保存在棕色试剂瓶中。
用于照相乳剂、镀银、制镜、印刷、医药、染毛发、检验氯离子,溴离子和碘离子等,也用于电子工业。
中文名硝酸银英文名silver nitrate化学式AgNO3 分子量169.8731CAS登录号7761-88-8 EINECS登录号231-853-9熔点212℃沸点444℃水溶性易溶密度 4.35外观无色透明晶体应用镀银危险性描述氧化剂,易爆炸硝酸银物理性质无色透明斜方晶系片状晶体,易溶于水和氨水,溶于乙醚和甘油,微溶于无水乙醇,几乎不溶于浓硝酸。
其水溶液呈弱酸性。
硝酸银溶液由于含有大量银离子,故氧化性较强,并有一定腐蚀性,医学上用于腐蚀增生的肉芽组织,稀溶液用于眼部感染的杀菌剂。
熔化后为浅黄色液体,固化后仍为白色。
硝酸银化学性质硝酸银遇有机物变灰黑色,分解出银。
纯硝酸银对光稳定,但由于一般的产品纯度不够,其水溶液和固体常被保存在棕色试剂瓶中。
硝酸银加热至440℃时分解成银、氮气、氧气和二氧化氮。
水溶液和乙醇溶液对石蕊呈中性反应,pH约为6。
沸点444℃(分解)。
有氧化性。
在有机物存在下,见光变灰色或灰黑色。
硝酸银能与一系列试剂发生沉淀反应或配位反应(见配位化合物)。
例如,与硫化氢反应,形成黑色的硫化银Ag2S沉淀;与铬酸钾反应,形成红棕色的铬酸银Ag2CrO4沉淀;与磷酸氢二钠反应,形成黄色磷酸银Ag3PO4沉淀;与卤素离子反应,形成卤化银AgX沉淀。
还能与碱作用,形成棕黑色氧化银Ag2O 沉淀;与草酸根离子作用形成白色草酸银Ag2C2O4沉淀等。
硝酸银能与NH3、CN-、SCN-等反应,形成各种配离子。
硝酸银毒性硝酸银有一定毒性,进入体内对胃肠产生严重腐蚀,成年人致死量约10克左右。
半数致死量(小鼠,经口)50mg/kg。
误服硝酸银可引起剧烈腹痛、呕吐、血便,甚至发生胃肠道穿孔。
硝酸银的化学符号
硝酸银,又称“硝酸银纳”,是一种有色无机化合物,通常用符号AgNO3来表示,它是硝酸银氧化物和硝酸盐的混合物,由一个氧原子,一个氮原子和一个银原子组成,化学式为AgNO3,分子量为169.87克/原子。
硝酸银的物理性质:它是一种结晶固体,无色或稍带黄褐色,具有水溶液酸性,可溶于水和醇类溶剂。
它在常温下不溶于醚类溶剂。
摄氏100℃时,升华为白色气体,气体可溶于水,不受空气影响。
硝酸银的化学性质:它可以与酸质或碱质反应生成银氢氧化物,热量也可以使其与氢氧化物反应形成硝酸银和硝酸银氢氧化物。
它还可以与亚硫酸钠、磷酸和柠檬酸等进行反应,生成具有有色的物质。
硝酸银的用途:它可以作为电镀的溶剂,也可以用于电镀金属,如银、金、铜、锡等,主要用于制造装饰品和电子元件。
此外,它还可以用于检测无机物质,也可以用于抗真菌、抗菌和杀虫剂。
硝酸银的安全性:硝酸银属毒性物质,有毒性释放物,如氯化、硫酸等,应该使用口罩、护目镜、隔离服和手套来维护人身安全。
它还具有放射性,使用时应注意它会释放辐射,需要增加防护措施。
综上所述,硝酸银既是一种重要的无机物质,也有其独特的化学符号,化学式为AgNO3,可以用于制造装饰品、电子元件、检测无机物质等,但同时也有毒性和放射性,使用时应注意安全防护。
- 1 -。
硝酸银的鉴别原理
硝酸银的鉴别原理是基于硝酸银在空气中受光照射时会发生光化学反应并变黑的特性。
硝酸银(Nitrate silver)分子式为AgNO3,是一种光敏化合物,可溶于水,可形成配合物和难溶物。
硝酸银的鉴别原理如下:
1. 酸碱反应:硝酸银与酸反应生成相应的硝酸盐和一氧化氮。
例如,与盐酸反应生成硝酸银和盐酸银:
AgNO3 + HCl →AgCl↓+ HNO3
2. 钯盐鉴别:硝酸银与钯盐(如硫化钯)反应生成金色的钯镀层。
这是因为硝酸银具有较强的氧化性,在酸性溶液中可以被还原物(如硫化物)还原为银。
反应过程如下:
AgNO3 + H2S →Ag2S↓+ HNO3
Ag2S + 4NH3 + 3H2O →[Ag(NH3)2]2S↓+ 2OH-
[Ag(NH3)2]2S + H2O2 →Ag(NH3)2S + H2O + O2
最终生成的Ag(NH3)2S以及溶解的钯离子会与器壁上的银反应,形成钯镀层。
3. 光敏反应:硝酸银在紫外或可见光照射下会发生光敏反应并变黑。
这是因为硝酸银中的银离子被光激发,与电子结合生成亚银离子,亚银离子与未激发的银离子生成亚银颗粒,从而形成黑色物质。
以上是硝酸银的鉴别原理的基本说明,实际鉴别硝酸银还需要结合其他特定条件和实验情况进行判断。
硝酸银:
化学式为AgNO3,无色晶体,易溶于水,遇有机物变灰黑色,分解出银。
纯硝酸银对光稳定,但由于一般的产品纯度不够,其水溶液和固体常被保存在棕色试剂瓶中。
硝酸银溶液由于含有大量银离子,故氧化性较强,并有一定腐蚀性,医学上用于腐蚀增生的肉芽组织,稀溶液用于眼部感染的杀菌剂。
硝酸银化学式为AgNO3,无色晶体,易溶于水,遇有机物变灰黑色,分解出银。
纯硝酸银对光稳定,但由于一般的产品纯度不够,其水溶液和固体常被保存在棕色试剂瓶中。
硝酸银溶液由于含有大量银离子,故氧化性较强,并有一定腐蚀性,医学上用于腐蚀增生的肉芽组织,稀溶液用于眼部感染的杀菌剂。
基本性质
物理性质
化学式:AgNO3
CAS号: 7761-88-8
EINECS号: 231-853-9
熔点:212℃
沸点:83°C at 760 mmHg
溶解度:219 g/100 mL (20℃)
蒸汽压:49.8mmHg at 25°C
性状:无色透明斜方晶系片状晶体。
相对密度:4.35(19℃)
溶解性:易溶于水和氨水,溶于乙醚和甘油,微溶于无水乙醇,几乎不溶于浓硝酸。
其水溶液呈弱酸性。
化学性质
1.复分解反应
AgNO3+HCl=AgCl↓+HNO3(可用于检验物质中是否含有氯离子)
C l2+H2O=HCl+HClO HCl+AgNO3=AgCl↓+HNO3(检验自来水中含有氯离子)
MnCl2 +2AgNO3=Mn(NO3)2+2AgCl↓
AgNO3+NH3·H2O=Ag2O↓+H2O+NH4NO3
2NaOH+2AgNO3=2NaNO3+Ag2O↓+H2O
NaCl+AgNO3=AgCl↓+NaNO3
AgNO3+NH3·H2O=Ag2O+H2O+NH4NO3(少量氨水)
AgNO3+3NH3·H2O=Ag(NH3)2OH+NH4NO3+2H2O(过量氨水)
HBr+AgNO3=AgBr+HNO3(检验溴离子)
2.分解反应
2AgNO3=△=2Ag+2NO2↑+O2↑
3.置换反应
2AgNO3+Cu=Cu(NO3)2+2Ag(比银活动性强的金属可以置换硝酸银溶液中的银离子)
4.其他氧化还原反应
4AgNO3+2H2O=4HNO3+4Ag↓+O2↑(。