化学理科
- 格式:doc
- 大小:170.00 KB
- 文档页数:3

孝感一中高三化学试题可能用到的数据:H-1 C-12 0-16 Na-23 K-39 Fe-56 Cu-64 Br-80 7.用N A 表示阿伏加德罗常数的值,下列叙述正确的是A .标准状况下,11.2L 氯仿中含有的C —Cl 键的数目为1.5N AB .标准状况下,30g NO 和16g O 2混合所生成的气体分子数为N AC .12g 石墨晶体中碳原子构成的正六边形的数目为0.5N AD .28g 铁粉与足量Cl 2反应时转移的电子数为N A8.C 和CuO 在高温下反应可能生成Cu 、Cu 2O 、CO 2、CO 。
现将1g 碳粉跟8gCuO 混合,在硬质试管中隔绝空气高温加热,生成的气体全部通过足量NaOH 溶液,收集残余气体。
测得溶液增重1.1g ,残余气体在标准状况下的体积为560mL 。
下列说法错误的是 A .固体混合物高温加热时,有0.6g 碳参加了反应 B .试管中的所有氧化还原反应共转移电子0.15mol C .反应后的试管中固体混合物总质量为7.2g D .反应生成铜和氧化亚铜的总物质的量为0.1mol9.已知某溶液中只存在-OH 、H +、-Cl 、+4NH 四种离子,其离子浓度可能有如下关系:①)OH (c )H (c )NH (c )Cl (c 4-++->>> ②)H (c )OH (c )NH (c )Cl (c 4+-+->>> ③)H (c )OH (c )Cl (c )NH (c 4+--+>>>④)H (c )OH (c )Cl (c )NH (c 4+--+=>= 下列说法正确的是A .若①正确,则溶液中溶质一定为NH 4ClB .若③正确,则溶液中)Cl (c )NH (c )O H NH (c 423-+>+⋅C .若④正确,且混合前盐酸和氨水体积相等,则盐酸中c (H +)等于氨水中c (-OH ) D .溶质不同时,上述四种关系式均可能成立10.高效能电池的研发制约电动汽车的推广。
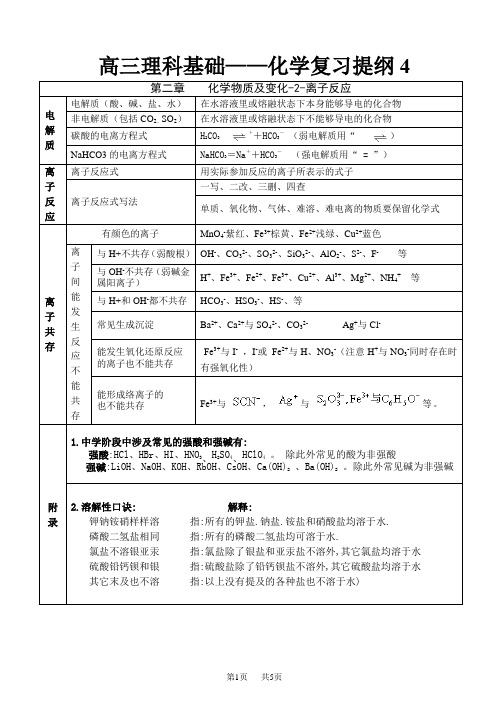
高三理科基础——化学复习提纲4第二章化学物质及变化-2-离子反应电解质电解质(酸、碱、盐、水)在水溶液里或熔融状态下本身能够导电的化合物非电解质(包括CO2、SO2)在水溶液里或熔融状态下不能够导电的化合物碳酸的电离方程式H2CO3 H++HCO3-(弱电解质用“”)NaHCO3的电离方程式NaHCO3=Na++HCO3-(强电解质用“ = ”)离子反应离子反应式用实际参加反应的离子所表示的式子离子反应式写法一写、二改、三删、四查单质、氧化物、气体、难溶、难电离的物质要保留化学式离子共存有颜色的离子MnO4-紫红、Fe3+棕黄、Fe2+浅绿、Cu2+蓝色离子间能发生反应不能共存与H+不共存(弱酸根)OH-、CO32-、SO32-、SiO32-、AlO2-、S2-、F- 等与OH-不共存(弱碱金属阳离子)H+、Fe3+、Fe2+、Fe3+、Cu2+、Al3+、Mg2+、NH4+ 等与H+和OH-都不共存HCO3-、HSO3-、HS-、等常见生成沉淀Ba2+、Ca2+与SO42-、CO32- Ag+与Cl-能发生氧化还原反应的离子也不能共存Fe3+与I-,I-或Fe2+与H、NO3-(注意H+与NO3-同时存在时有强氧化性)能形成络离子的也不能共存Fe3+与,与等。
附录1.中学阶段中涉及常见的强酸和强碱有:强酸:HCl、HBr、HI、HNO3、H2SO4、HClO4。
除此外常见的酸为非强酸强碱:LiOH、NaOH、KOH、RbOH、CsOH、Ca(OH)2、Ba(OH)2。
除此外常见碱为非强碱2.溶解性口诀: 解释:钾钠铵硝样样溶指:所有的钾盐.钠盐.铵盐和硝酸盐均溶于水.磷酸二氢盐相同指:所有的磷酸二氢盐均可溶于水.氯盐不溶银亚汞指:氯盐除了银盐和亚汞盐不溶外,其它氯盐均溶于水硫酸铅钙钡和银指:硫酸盐除了铅钙钡盐不溶外,其它硫酸盐均溶于水其它末及也不溶指:以上没有提及的各种盐也不溶于水)学 生 课 堂 笔 记1.快速判断离子方程式正误的主要内容: (1)看反应能否写离子方程式。

2023年全国高考理科综合试卷化学部分——天津(word版及解析)7、二十世纪化学合成技术地发展对人类健康平和生活质量地提高做出了巨大贡献。
下列各组物质全部由化学合成得到地是A、玻璃 纤维素 青霉素B、尿素 食盐 聚乙烯C、涤沦 洗衣粉 阿斯匹林D、石英 橡胶 磷化铟8、对平衡CO2(g) 2(aq).△H=-19.75KJ/mol,为增大二氧化碳气体在水中地溶解度,应采用地方法是A、升温增压B、降温减压C、升温减压D、降温增压9、醋酸溶液中存在电离平衡CH3COOH H++CH3COO-,下列叙述错误地是A、醋酸溶液中离子浓度地关系满足:c(H+)=c(OH-)+c(CH3COO-) B、0.10mol/L地CH3COOH溶液中加水稀释,溶液中c(OH-)减小 C、CH3COOH溶液中加少量地CH3COONa固体,平衡逆向移动 D、常温下pH=2地CH3COOH溶液与pH=12地NaOH溶液等体积混合后,溶液地pH<710、下列叙述正确地是 A、1个甘氨酸分子中存在9对共用电子 B、PCl3和了BCl3分子中所有原子地最外层都达到8电子稳定结构 C、H2S和CS2分子都是含极性键地极性分子 D、熔点由高到低地顺序是:金刚石>碳化硅>晶体硅11、下列离方程式书写正确地是 A、石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3 B、NH4HSO3溶液与足量地NaOH溶液混合加热:NH4++HSO3-+2OH-NH3•+SO32-+2H2O C、酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH- D、AgNO3溶液中加入过量地氨水:Ag++NH3·H2O=AgOH∙+NH4+12、下列叙述正确地是 A、在原电池地负极和电解池地阴极上都是发生失电子地氧化反应B、用惰性电极电解Na2SO4溶液,阴阳两极产物地物质地量之比为1:2 C、用惰性电极电解饱和NaCl溶液,若有1 mol电子转移,则生成1 molNaOH D、镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀13、下列实验方法合理地是A、可用水鉴别已烷、四氯化碳、乙醇三种无色液体B、油脂皂化后可用渗析地方法使高级脂肪酸钠和甘油充分分离C、可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液D、为准确测定盐酸与NaOH溶液反应地中和热,所用酸和碱地物质地量相等26、(14分)W、X、Y、Z是原子序数依次增大地同一短同期元素,W、X是金属元素,Y、Z是非金属元素。

第一部分基础知识一、物质的量1.物质的量(1)物质的量的单位是摩尔(mol)。
(2)1 mol任何微粒所含的微粒数=0.012 kg一种碳原子(12C)所含的碳原子数=6.02×1023(3)阿伏加德罗常数:6.02×1023 mol-1称为阿伏加德罗常数(NA)。
(4)物质的量(n)、阿伏加德罗常数(NA)与微粒数(N)之间的关系:n = NNA 。
2.摩尔质量(1)定义:单位物质的量的物质所具有的质量叫做摩尔质量(M),单位为g?mol-1。
(2)物质的摩尔质量数值上等于该物质的相对分子/原子质量。
(3)物质的量(n)、物质的质量(m)和物质的摩尔质量之间的关系:n = mM 。
3.气体摩尔体积(1)定义:一定的温度和压强下,单位物质的量的气体所占的体积叫做气体摩尔体积(Vm),单位为L?mol-1。
(2)标准状况下,Vm≈22.4 L?mol-1。
(3)物质的量(n)、气体的体积(V)和气体摩尔体积(Vm)之间的关系:n = VVm 。
4.物质的量浓度(1)定义:以单位体积的溶液中所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度(cB),单位为mol?L-1 。
(2)在一定物质的量浓度的溶液中,溶质B的物质的量(n)、溶液的体积(V)和溶质的物质的量浓度(cB)之间的关系:n = cB?V 。
(3)容量瓶:常用于配制一定体积、浓度准确的溶液。
二、胶体1.定义:分散质的微粒直径介于1-100 nm之间的分散系称为胶体。
2.溶液、浊液、胶体的本质区别:分散质粒子的大小不同。
3.丁达尔现象:当可见光束通过胶体时,在入射光侧面可观察到光亮的通路,这种现象称为丁达尔现象。
4.丁达尔现象可用于检验溶液和胶体。
5.聚沉:胶体形成沉淀析出的现象称为聚沉。
6.引起胶体聚沉的条件:加入可溶性盐、加热、搅拌等。
三、离子反应1.电解质:在水溶液里或熔融状态下能够导电的化合物称为电解质。


高考理科化学必考知识点高考是每个高中生都要经历的一场考试,而理科化学是其中一门必考的科目。
准备化学这门科目需要掌握一定的知识点,下面我将为大家总结高考理科化学必考的知识点。
一、化学元素和元素周期表化学元素是构成物质的基本单位,我们所熟悉的氢、氧、铁等都属于化学元素。
而元素周期表则是对所有化学元素按一定规律排列并进行分类的表格。
学生们需要掌握元素周期表中常见元素的名称、符号、原子序数和相对原子质量等基本信息。
二、化学键和化学式化学键是化学元素之间互相结合的方式,有共价键、离子键和金属键等。
化学式则用来表示化合物组成的方式,如H2O表示水分子,NaCl表示氯化钠等。
学生们需要掌握常见化合物的化学式、离子式和结构式等。
三、化学方程式和化学反应化学方程式用化学式和符号表示化学反应的过程,包括反应物、生成物和反应条件等。
学生们需要了解化学方程式的平衡、配平和计算等基本概念,并能够通过已知条件进行计算。
四、化学平衡和化学反应速率化学平衡是指化学反应达到一定平衡状态的过程,学生们需要了解各种平衡常数和平衡条件,如酸碱平衡中的pH值和指示剂的选择等。
化学反应速率是指反应物消耗或生成的速度,学生们需要了解影响化学反应速率的因素,如温度、浓度和催化剂等。
五、酸碱物质和氧化还原反应酸碱物质是化学中常见的一类物质,学生们需要了解酸碱物质的性质、常见的酸碱中和反应和酸碱滴定等知识。
氧化还原反应是指电子从一物质转移到另一物质的化学反应,学生们需要了解氧化还原反应的基本概念、电位和电解质溶液中的反应等内容。
六、有机化学基础知识有机化学是研究有机化合物(以碳为主要元素的化合物)的分子结构、性质和反应机理等的学科。
学生们需要了解有机化合物的结构、命名规则和常见的有机反应等知识。
七、化学实验和实验室安全化学实验是学习化学知识的重要手段,而实验室安全是进行实验过程中不可忽视的问题。
学生们需要了解常见化学实验的操作方法、实验仪器的使用和实验室安全常识等。
化学是文科还是理科姓名:学校:专业:学号:化学是文科还是理科有一些同学对化学是文科还是理科存在一些疑问,因为高中化学有大量要背诵的知识点,但是化学作为理科是毫无疑问的,这一点毋庸置疑,化学不仅在高中是理科,在任何时候都属于理科。
化学属于理科中的文科化学是理科中的文科,因为高中化学记忆内容特别多,只有理解了才能学会,尽管需要计算的东西也不少,所以才会有此称号。
化学属于理科是有依据的,化学学科研究性内容较多,很多地方都会涉及到化学实验,化学反应也比较明显,化学写论文时是要有数据作支撑的。
化学作为理科科目,学起来有一定难度,最显而易见的就是化学计算类题目,这些只有理解了才能知道如何去做,才能根据思路去解题。
化学比物理和数学要简单一些,化学没有数学复杂的解题过程和计算难度,也没有物理较复杂的思维和理解难度,但是化学有大量需要理解性记忆的知识,这就是化学的难点所在。
化学尽管是理科,但是也有一些文科的特征,学起来也并不容易,难度仅次于数学和物理学科。
高中化学怎么才能学会化学有人认为它很难,但是学会了其实很简单。
化学学科难度不大,大家要做的就是跟住老师的步调,做好课前预习,提高自学能力,然后课堂上认真去听讲,课后再好好理解消化掉知识难点,并通过做题把它学会。
化学要做一定量的题目才能学好,但是光靠刷题也未必就能学会化学,只有把化学知识点理解透了再去做题,才是学好化学的最佳途径。
化学遇到做错的题目时,一定要认真去分析,有时错题可归为一类,都是一个知识点没掌握好,只要对照教材把这个知识点学会了,分数可能会有很大提高。
学化学也要有随机应变能力及举一反三的技巧,做会一个题目就能会做一类题目,那才是真正学好了化学这科。
学化学不仅要有理科思维,还要有文科思路才能学好。
高考理科化学知识点总结化学是自然科学的一个重要分支,它研究物质的性质、组成、结构、变化规律以及与能量的关系。
在高考中,化学是理科考生必须要掌握的科目之一。
下面将对高考化学的知识点进行总结和梳理。
一、化学基础知识1. 元素与化合物元素是由同种原子构成的物质,化合物是由不同种原子按一定的化学式组成的物质。
元素和化合物是化学研究的基本对象。
2. 原子结构原子是构成物质的最小单位,由原子核和围绕原子核运动的电子组成。
原子核由质子和中子组成,电子带有负电荷。
3. 周期表和元素周期律周期表是化学元素按一定规则排列的表格,元素周期律是指元素周期表中元素的性质随着原子序数的增加而呈现周期性变化的规律。
4. 化学键化学键是原子间的相互作用力,包括离子键、共价键和金属键等。
化学键的类型和性质决定了化合物的性质。
5. 化学反应化学反应是指物质之间发生的化学变化,包括物质的合成、分解、置换和氧化还原反应等。
6. 化学式和化学方程式化学式是用元素符号和阿拉伯数字表示化合物的组成;化学方程式是用化学式和符号表示化学反应。
7. 物质的量、质量和物质的量关系物质的量是物质的基本性质之一,用摩尔表示。
摩尔质量是单质的相对分子质量或相对原子质量。
根据化学方程式,可以推导出物质的量关系,如质量守恒、摩尔守恒、体积守恒等。
8. 氧化还原反应氧化还原反应是指原子离子的电荷状态发生变化的化学反应,包括氧化反应和还原反应。
氧化还原反应中通常涉及氧化剂和还原剂的概念。
9. 酸碱中和反应酸碱中和反应是指酸和碱发生中和反应的化学过程,生成盐和水。
酸和碱的强弱可以用PH值和溶液电导率等性质来表征。
10. 溶液的稀释溶液的稀释是指在一定条件下向溶液中添加适量的溶剂,使其浓度减小的过程。
稀释后的溶液中溶质的物质量不变,质量守恒。
11. 离子反应离子反应是指溶液中离子间发生的化学反应,包括沉淀反应、酸碱反应、配位反应等。
12. 电化学电化学是研究物质在电场作用下发生的化学反应的科学。
2023年普通高等学校招生全国统一考试 理科综合能力测试化学部分(全国乙卷)可能用到的相对原子质量:H 1 C 12 O 16一、选择题:本题共13小题,每小题6分,共78分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
(化学部分为第7~13题)1. 下列应用中涉及到氧化还原反应的是 A. 使用明矾对水进行净化 B. 雪天道路上撒盐融雪 C. 暖贴中的铁粉遇空气放热D. 荧光指示牌被照发光2. 下列反应得到相同的产物,相关叙述错误的是A. ①的反应类型为取代反应B. 反应②是合成酯的方法之一C. 产物分子中所有碳原子共平面D. 产物的化学名称是乙酸异丙酯 3. 下列装置可以用于相应实验的是 制备2CO 分离乙醇和乙酸验证2SO 酸性 测量2O 体积A. AB. BC. CD. D4. 一种矿物由短周期元素W 、X 、Y 组成,溶于稀盐酸有无色无味气体生成。
W 、X 、Y 原子序数依次增大。
简单离子2-X 与2+Y 具有相同的电子结构。
下列叙述正确的是 A. X 的常见化合价有-1、-2 B. 原子半径大小为Y>X>W C. YX 的水合物具有两性D. W 单质只有4种同素异形体5. 一些化学试剂久置后易发生化学变化。
下列化学方程式可正确解释相应变化的是A. AB. BC. CD. D6. 室温钠-硫电池被认为是一种成本低、比能量高的能源存储系统。
一种室温钠-硫电池的结构如图所示。
将钠箔置于聚苯并咪唑膜上作为一个电极,表面喷涂有硫黄粉末的炭化纤维素纸作为另一电极。
工作时,在硫电极发生反应:12S 8+e -→12S 28−,12S 28−+e -→S 24−,2Na ++4x S 24−+2(1-4x)e -→Na 2S x下列叙述错误的是A. 充电时Na +从钠电极向硫电极迁移B. 放电时外电路电子流动的方向是a→bC. 放电时正极反应为:2Na ++8xS 8+2e -→Na 2S x D. 炭化纤维素纸的作用是增强硫电极导电性能7. 一定温度下,AgCl 和Ag 2CrO 4的沉淀溶解平衡曲线如图所示。
2020年普通高等学校招生全国统一考试(新课标Ⅲ卷)理科综合化学试题及考查目标分析作者:张道年周曼文王怀文张平王思毅陈胜廖伟梁来源:《中学生数理化·高考理化》2020年第12期【試题部分】(以原试卷题号为序)可能用到的相对原子质量:H 1 B ll C 12 N 14 O16 Na 23 Al 27CI 35.5 Fe 56 Ni 59 Cu 64一、选择题:本题共7小题,每小题6分,共42分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
7.宋代《千里江山图》描绘了山清水秀的美丽景色,经历千年色彩依然,其中绿色来自孔雀石颜料(主要成分为Cu(OH)2. CuCO3),青色来自于蓝铜矿颜料(主要成分为Cu (OH)2.2CuCO3)。
下列说法错误的是()。
A.保存《千里江山图》需控制温度和湿度B.孔雀石、蓝铜矿颜料不易被空气氧化C.孔雀石、蓝铜矿颜料耐酸耐碱D.Cu(OH)2 . CuCO3中铜元素的质量分数大于Cu(OH)2 . 2CuCO3中铜元素的质量分数8.金丝桃苷是从中药材中提取的一种具有抗病毒作用的黄酮类化合物,结构式如下:下列关于金丝桃苷的叙述,错误的是()。
A.可与氢气发生加成反应B.分子含21个碳原子C.能与乙酸发生酯化反应D.不能与金属钠反应9.NA是阿伏加德罗常数的值。
下列说法正确的是()。
A. 22.4 1(标准状况)氮气中含有7NA个中子B.1 mol重水比1 mol水多NA个质子C.12 g石墨烯和12 g金刚石均含有NA个碳原子D.1 L 1 mol . L-1 NaCI溶液含有28NA个电子10.喷泉实验装置如图1所示。
应用下列各组气体溶液,能出现喷泉现象的是()。
11.对于下列实验,能正确描述其反应的离子方程式是()。
该电池工作时,下列说法错误的是()。
A.负载通过0. 04 mol电子时,有0. 224 L(标准状况)O2参与反应B.正极区溶液的pH降低,负极区溶液的pH升高C.电池总反应为4VB2+11O2 +20OH+6H2O ==8B(OH)4 +4VO3D.电流由复合碳电极经负载、VB2电极、KOH溶液回到复合碳电极13.W、X、Y、Z为原子序数依次增大的短周期元素,四种元素的核外电子总数满足X+Y=W+Z;化合物XW3与WZ相遇会产生白烟。
临潼铁中2013-2014学年上学期第一次月考高二年级化学试题注意事项:1.本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分。
满分100分,考试时间60分钟。
2.在答卷纸的密封线内填写学校、班级、姓名、考号。
一、选择题(每小题有1~2个选项符合题意)1、下列变化属于吸热反应的是①液态水汽化②将胆矾加热变为白色粉末③浓硫酸稀释④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰A、①④⑤B、①②④C、②③D、②④2、下列说法正确的是()A.化学反应都伴随着能量的变化B.个别化学反应与能量变化无关C.化学反应都要放出能量D.放热反应的发生无需任何条件3、下列说法不正确的是()化学反应除了生成新物质外,还伴随着能量的变化放热反应都不需要加热就能发生吸热反应在一定条件(如常温、加热等)也能发生化学反应是放热还是吸热,取决于生成物具有的总能量和反应物具有的总能量4、下列属于放热反应的是()A.铝和盐酸反应B.焦碳和二氧化碳共热C.石灰石的分解D.氢气还原氧化铜5、已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8 kJ〃mol-1、-1411.0kJ〃mol-1和-1366.8 kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )A.-44.2 kJ〃mol-1 B.+44.2 kJ〃mol-1 C.-330 kJ〃mol-1D.+330 kJ〃mol-16、下列关于热化学反应的描述中正确的是( )A.HCl和NaOH反应的中和热ΔH=-57.3 kJ〃mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ〃mol-1B.CO的燃烧热是283.0 kJ〃mol-1,则2CO2(g) =2CO(g)+O2(g)ΔH=2×283.0 kJ〃mol-1C.需要加热才能发生的反应一定是吸热反应D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热7、已知反应X+Y==M+N为放热反应,对该反应的下列说法中正确的( )A.X的能量一定高于MB. Y的能量一定高于NC. X和Y的总能量一定高于M和N的总能量D 因该反应为放热反应,故不必加热就可发生8、热化学方程式C(s)+H2O(g)CO(g)+H2(g);△H =+131.3kJ/mol表示()A.碳和水反应吸收131.3kJ能量B.1mol碳和1mol水反应生成一氧化碳和氢气并吸收131.3kJ热量C.1mol固态碳和1mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3kJD.1个固态碳原子和1分子水蒸气反应吸热131.1kJ9、已知CH4(g)+2O2(g)→CO2(g)+2H2O(g) ΔH== - Q1;2H2(g)+O2(g) →2H2O(g) ΔH== - Q2;H2O(g) →H2O(l) ΔH== - Q3常温下,取体积比为4:1的甲烷和H2的混合气体112L(标准状况下),经完全燃烧后恢复到常温,则放出的热量为A、4Q1+0.5Q2B、4Q1+Q2+10Q3C、4Q1+2Q2D、4Q1+0.5Q2+9Q310、已知常温时红磷比白磷稳定,在下列反应中:P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-a kJ/mol4P(红磷,s)+5O2(g)=P4O10(s) ΔH=-b kJ/mol若a、b均大于零,则a和b的关系为()A.a<b B.a=b C.a>b D.无法确定11、化学反应N2+3H2= 2NH3的能量变化如下图所示,该反应的热化学方程式是( )机密★启用前A .N2(g)+3H2(g) = 2NH3(l);⊿H = 2(a —b —c)kJ 〃mol -1B .N 2(g)+3H 2(g) = 2NH 3(g) ;⊿H = 2(b —a)kJ 〃mol -1C .21N 2(g)+23H 2(g) = NH 3(l) ;⊿H = (b +c —a)kJ 〃mol -1 D .21N 2(g)+23H 2(g) =NH 3(g) ;⊿H = (a +b)kJ 〃mol -112、已知A(g)+B(g)= C(g) △H=△H 1 D(g)+B(g)= E(g) △H=△H 2,若A 和D 混合气体1mol 完全与B 反应,放热△H 3,则A 和D 物质的量之比是( ) A 、(△H 2-△H 3):(△H 1-△H 3) B 、(△H 3-△H 2):(△H 1-△H 3)C 、(△H 3-△H 2):(△H 3-△H 1)D 、(△H 1-△H 3):(△H 3-△H 1) 13、已知下列热化学方程式:CH 4(g )+2O 2(g )→CO 2(g )+2H 2O (l ) ΔH =-889.5kJ/mol 2C 2H 6(g )+7O 2(g )→4CO 2(g )+6H 2O (l ) ΔH =-3116.7kJ/mol C 2H 4(g )+3O 2(g )→2CO 2(g )+2H 2O (l ) ΔH =-1409.6kJ/mol 2C 2H 2(g )+5O 2(g )→4CO 2(g )+2H 2O (l ) ΔH =-2596.7kJ/mol C 3H 8(g )+5O 2(g )→3CO 2(g )+4H 2O (l ) ΔH =-2217.8kJ/mol现有由2mol 上述五种烃中的两种组成的气体混合物,经充分燃烧后放出3037.6kJ 热量,则下列哪些组合是不可能的( )A .CH 4和C 2H 2B .C 2H 4和C 3H 8 C .C 2H 6和C 3H 8D .C 2H 6和CH 414、根据以下3个热化学方程式:2H 2S(g)+3O 2(g)=2SO 2(g)+2H 2O(l) △H =Q 1 kJ/mol 2H 2S(g)+O 2(g)=2S (s)+2H 2O(l) △H =Q 2 kJ/mol 2H 2S(g)+O 2(g)=2S (s)+2H 2O(g) △H =Q 3 kJ/mol 判断Q 1、Q 2、Q 3三者关系正确的是( )A . Q 1>Q 2>Q 3B . Q 1>Q 3>Q 2C . Q 3>Q 2>Q 1D . Q 2>Q 1>Q 315.已知H 2(g)+Cl 2(g)=2HCl(g) △H= ―184.6kJ 〃mol -1, 则反应HCl(g)=1/2H 2(g)+1/2Cl 2(g)的△H 为 ( )A .+184.6kJ 〃mol -1B .―92.3kJ 〃mol -1C .+92.3kJD . +92.3kJ 〃mol -1二.填空题(小题,共44分)16、(5分)把煤作为燃料可通过下列两种途径:途径Ⅰ:C(s)+O 2(g)=CO 2(g) ΔH 1<0 ①途径Ⅱ:先制成水煤气:C(s)+H 2O(g)=CO(g)+H 2(g) ΔH 2>0 ②再燃烧水煤气:2CO(g)+O 2(g)=2CO 2(g) ΔH 3<0 ③ 2H 2(g)+O 2(g)=2H 2O(g) ΔH 4<0 ④ 请回答下列问题:(1)途径Ⅰ放出的热量( )(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(2)用ΔH 2、ΔH 3、ΔH 4表示ΔH 1的数学关系式是_______________17、(9分)①CaCO 3(s) == CaO(s) + CO 2(g);ΔH= 177.7kJ/mol ②C(s) + H 2O(g)== CO(g) + H 2(g);ΔH= -131.3kJ/mol③0.5H 2SO 4(l) + NaOH(l) == 0.5Na 2SO 4(l) + H 2O(l);ΔH= -57.3kJ/mol ④C(s) + O 2(g) == CO 2(g);ΔH=-393.5kJ/mol ⑤CO(g) + 1/2 O 2(g) == CO 2(g);ΔH=-283kJ/mol⑥HNO 3 (aq) + NaOH(aq) == NaNO 3(aq) + H 2O(l);ΔH= -57.3kJ/mol ⑦2H 2(g) + O 2(g) == 2H 2O(l);ΔH= -517.6kJ/mol (1)上述热化学方程式中,不正确的有( ) (2)根据上述信息,写出C 转化为CO 的热化学方程式_____________________________ 。
(3)上述反应中,表示燃烧热的热化学方程式有( );表示中和热的热化学方程式有( )。
18、(9分)据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa 下,1g 甲醇燃烧生成CO 2和液态水时放热22.68kJ 。
则表示甲醇燃烧热的热化学方程式为_________________________________________(2)若适量的N 2和O 2完全反应,每生成23克NO 2需要吸收16.95kJ 热量。
_____________________________________________________________ (3)已知拆开1molH -H 键,1molN -H 键,1molN ≡N 键分别需要的能量是436kJ 、391kJ 、946kJ ,则N 2与H 2反应生成NH 3的热化学方程式为_____________________19、(9分)已知下列热化学方程式:①H 2(g ) +21O 2 (g ) =H2O (l );ΔH=-285 kJ 〃mol -1②H 2(g ) +21O 2 (g ) =H 2O (g );ΔH=-241.8 kJ 〃mol -1③C (s ) +21O 2 (g ) =CO (g );ΔH=-110.5 kJ 〃mol -1④ C (s ) +O 2 (g ) =CO 2(g );ΔH=-393.5 kJ 〃mol -1回答下列问题:(1)H 2的燃烧热为 ;C 的燃烧热为 。
(2)燃烧1gH 2生成液态水,放出的热量为 。
(3) 写出CO 燃烧的热化学方程式 。
20、 (12分)在火箭推进器中装有强还原剂肼(N 2H 4)和强氧化剂(H 2O 2),当它们混合时,即产生大量的N 2和水蒸气,并放出大量热。
已知0.4mol 液态肼和足量H 2O 2反应,生成氮气和水蒸气,放出256.65kJ 的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H 2O(l)====H 2O(g);△H=+44kJ 〃mol-1,则16 g 液态肼燃烧生成氮气和液态水时,放出的热量是________kJ 。