引物探针设计培训资料ppt课件
- 格式:ppt
- 大小:541.00 KB
- 文档页数:17




PCR和定量PCR的引物和探针设计PCR(聚合酶链反应)是一种用于扩增特定DNA序列的技术。
引物和探针是PCR中的关键组成部分,它们的设计对PCR的灵敏度和特异性至关重要。
引物是专门设计用于扩增目标DNA序列的两个短链DNA片段。
对于PCR反应的成功与否,引物的设计是至关重要的。
在引物设计中,以下几个因素需要考虑:1.引物长度:引物通常由18-24个碱基组成。
引物过短可能导致非特异扩增,而引物过长可能导致特异扩增低下。
2.引物序列:引物的序列应与目标DNA序列互补,以确保引物与目标序列之间的碱基配对。
避免引物序列中存在重复和寡聚核苷酸,以防止非特异扩增。
3.引物Tm值:引物的熔解温度(Tm)是引物与模板DNA断裂的温度。
引物的Tm值应相似,通常在50-65℃之间。
4.引物之间的互补性:引物之间应避免自身互补或与对方互补,以防止引物形成二聚体或无特异性扩增。
探针是一种带有荧光标记的SSO(特异性杂交寡核苷酸)或DSA(二链特异性杂交寡核苷酸),它能够检测到靶序列的扩增。
探针分为两类:探针(Hydrolysis Probes)和探针(Molecular Beacon Probes)。
1. 探针(Hydrolysis Probes):这种探针包含一个与靶序列互补的引物和一个结合到引物上的荧光染料和一个淬灭器。
当DNA扩增反应进行时,引物与靶序列结合,使荧光染料与淬灭器距离远离,并发出荧光信号。
这种探针的设计需要考虑引物和探针之间的互补性,以确保特异性扩增和信号产生。
2. 探针(Molecular Beacon Probes):这种探针是一段独特的DNA 或RNA序列,两端固定一个荧光染料和一个淬灭器。
当探针与靶序列结合时,形成一个折叠的结构,将荧光染料和淬灭器分开。
这种探针的设计需要考虑探针序列的互补性和结构的稳定性。
在引物和探针设计中1.特异性:引物和探针应与目标DNA序列具有高度特异性的互补性,避免与非目标DNA序列发生杂交。




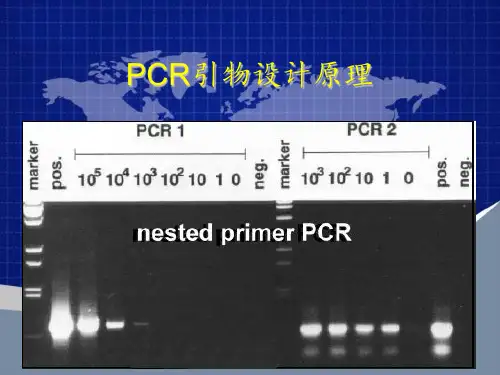
自90年代Taqman探针诞生以来,虽然荧光探针(引物)不断有新的技术出现,但是作为一种经典的定量PCR技术,Taqman探针技术仍然是许多实验研究人员进行定量检测的首选,这主要是因为相对于SYBR荧光染料,T aqman探针具有序列特异性,只结合到互补区,而且荧光信号与扩增的拷贝数具有一一对应的关系,因此特异性强灵敏度高,而且条件优化容易;而相对于杂交探针,Taqman探针只要设计一条探针,因此探针设计较便宜方便,而且也能完成基本的定量PCR要求。
当然Taqman定量方法由于还是要合成探针,也给实验操作带来了挑战。
一般T aqman定量PCR实验过程为:目的基因查找比对→探针与引物设计→探针与引物合成→配置反应体系→反应参数→重复实验,优化条件→获得曲线数据,比对标准曲线→再重复验证。
第一步:在第一步目的基因查找比对过程中可以利用NCBI genbank序列以及DNAstar等软件完成目的DNA或者RNA的查找与比对——这在分析测序报告的时候相信很多人操作过,这一步需要注意的就是要保证所分析的序列在一个contig(重叠群,即染色体的一些区域中毗邻DNA片段重叠的情况)内。
第二步:如果其它条件一致,那么这个第二步——引物探针的设计就可以说是定量PCR成败的关键了,通过各方面经验的总结有以下几个基本的原则:总体原则* 先选择好探针,然后设计引物使其尽可能的靠近探针。
* 所选序列应该高度特异,尽量选择具有最小二级结构的扩增片段——这是因为二级结构会影响反应效率,而且还会阻碍酶的扩增。
建议先进行二级结构检测,如果不能避免二级结构,那么就要相应提高退火温度。
* 扩增长度应不超过400bp,理想的最好能在100-150bp内,扩增片段越短,有效的扩增反应就越容易获得。
较短的扩增片段也容易保证分析的一致性。
* 保持GC含量在20%和80%之间,GC富含区容易产生非特异反应,从而会导致扩增效率的降低,以及出现在荧光染料分析中非特异信号。

引物设计原则:1.上下游引物要保守为了能够扩增出所需要的保守片段,必须对保守的100—200片段进行PCR 扩增。
所以引物的选取也要非常的保守.2.上下游引物的长度一般为18-30bp之间,且Tm值在58—62℃之间,上下游引物的Tm值相差最好不超过2℃。
3.确保引物中GC含量在30—80%。
应避免引物中多个重复的碱基出现,尤其是要避免4个或超过4个的G碱基出现.引物的3'端最好不为G或/和C。
引物3’端的5个碱基不应出现2个G或/和C。
4.避免引物内出现反向重复序列形成发夹二级结构,同时也应避免引物间配对形成引物二聚体.5.跨外显子设计引物,用于区别或消除基因组DNA的扩增。
探针设计的基本原则:1.保守:探针要绝对的保守,有时分型就仅仅依靠探针来决定.理论上有一个碱基不配对,就可能检测不出来。
2。
Taqman探针的长度最好在25—32bp之间,且Tm值在68-72℃之间,确保探针的Tm值要比引物的Tm值高出5-10℃,这样可保证探针在退火时先于引物与目的片段结合。
3。
确保探针中GC含量在30-80%。
4.避免探针中多个重复的碱基出现,尤其是要避免4个或超过4个的G碱基5.探针的5’端不能为G,因为即使单个G碱基与FAM荧光报告基团相连时,也可以淬灭FAM基团所发出的荧光信号,从而导致假阴性的出现。
6。
Taqman探针应靠近上游引物,即Taqman探针应靠近与其在同一条链上的上游引物.两者的距离最好是探针的5'端离上游引物的3’有一个碱基。
7.避免探针与引物之间形成二级结构。
8。
对于多重定量PCR,例如SNP分型检测时,SNP位点应设计在探针的中间位置,并且两种探针的Tm值应相近。

引物和探针设计 –PCR 和定量PCR基本原理引物设计的重要因素针对特殊应用的其他提示引物的质量和纯度目录1247基本原理引物是短的寡核苷酸,充当DNA复制的起始点。
因为几乎所有DNA聚合酶都不能从头合成,所以它们需要一个3'-羟基作为DNA合成的起始点。
这个3'-羟基由相配的引物提供。
引物在体内由RNA聚合酶(称为引物酶)生成。
这些引物(在此为小RNA)由DNA聚合酶用作延长的起始点。
在延长过程中,RNA 引物降解并由DNA取代。
体外扩增反应,如聚合酶链反应(PCR)或逆转录(RT),需要引物。
通过选择特异的引物序列,DNA 片段的所需区域可得到扩增。
对于大多数PCR反应,决定整个反应成功与否的最重要因素是引物的序列和质量。
在开始引物设计之前,必须弄清以下几点:PCR的目的(例如定量检测、克隆、基因分型)PCR类型(定量PCR、RT-PCR、长片段PCR)样品材料(基因组DNA、RNA、微小RNA)可能的问题(例如假基因、SNP)1引物设计的重要因素2有一些不同的软件工具可用于引物设计和序列分析。
它们能简化相配引物对的搜索,一般考虑以下标准。
最流行的软件为Primer 3,它是大多数基于网络引物设计应用的基础。
典型的引物长度为18-30个碱基。
短的引物(15个核苷酸以下)能非常高效地结合---但是它们的专一性不够。
非常长的引物能提高专一性,但是退火效率低,从而导致PCR 产物量低下。
应避免编码单一序列和重复序列的引物。
引物长度和专一性引物的GC 含量应介于40%和60%之间。
应避免聚-(dC )-或聚(dG )-区域,因为它们会降低退火反应的专一性。
聚-(dA )-和聚(dT )-也应避免,因为这会生成不稳定的引物-模板复合物,从而降低扩增效率。
平衡GC含量,避免GC-和AT-富集区域退火温度是基于引物的解链温度(Tm )计算。
最常用的解链温度计算公式显示如下。
“2+4”法则,亦称华莱士法则,对于极短的寡核苷酸(最多14个碱基)有效,该法则提出每个AT 对能将双链DNA 的解链温度提高2°C ,每个GC 对则能提高4°C 。