玻璃的黏度和表面性质
- 格式:ppt
- 大小:432.50 KB
- 文档页数:51

卖玻璃常见知识点总结一、玻璃的特性1. 透明度:玻璃是一种高度透明的材料,能够让光线透过并且不使光线发生散射,因此常被用于窗户、玻璃门等。
2. 硬度:玻璃的硬度很高,通常在摩氏硬度中居于5.5-7之间,比普通金属硬度更高。
3. 耐腐蚀:玻璃不受化学药品的腐蚀,因此能够长时间保存。
4. 抗压性:玻璃在受到外部压力时具有一定的抗压性,不易破碎。
5. 抗热性:玻璃在受到高温环境时不易改变形状,也不易熔化。
二、玻璃的制造工艺1. 熔制:玻璃的主要原料是石英砂、石灰和碳酸钠等,这些原料在高温下被熔融成为液态玻璃。
2. 成型:液态玻璃通过吹制、浇铸、挤压等方式成型成为各种形状和尺寸的玻璃制品。
3. 冷却:成型后的玻璃经过冷却处理,使其变得坚硬和透明。
4. 表面处理:玻璃通常需要进行磨削、抛光等表面处理以提高其外观和性能。
三、玻璃的用途1. 建筑:玻璃被广泛用于建筑领域,如窗户、门、墙面等,增加了建筑物的透光性和美观度。
2. 家具:玻璃家具如玻璃桌面、玻璃柜门、玻璃橱窗等,具有美观、易清洁等优点。
3. 车辆:汽车上的挡风玻璃、侧窗玻璃等,提高了驾驶者的视野和安全性。
4. 电子产品:手机、平板电脑、电视等电子产品上的触摸屏、显示屏等都采用了玻璃材料。
5. 日用品:玻璃杯、碗、瓶等日用品也是玻璃的常见用途。
四、玻璃的保养1. 清洁:使用软布擦拭玻璃表面,尽量避免使用化学清洁剂,以免对玻璃表面造成损坏。
2. 防霉:玻璃制品容易吸附水汽,因此要注意保持干燥,防止发霉。
3. 防磨损:使用玻璃器皿时要注意轻放,避免碰撞造成磨损或者破碎。
五、关于玻璃的行业发展1. 玻璃制造技术的不断进步,生产出了各种新型玻璃,如夹层玻璃、防弹玻璃、自清洁玻璃等。
2. 玻璃在科技、医疗、环保等领域的应用越来越广泛,如光纤通讯、医用玻璃器皿、太阳能玻璃等。
3. 玻璃回收再利用的技术不断完善,有利于减少资源浪费和环境污染。
总结玻璃是一种常见的材料,具有许多独特的特性和广泛的用途。



玻璃的基本知识玻璃结构理论:晶子学说(1930年Randell)近程有序(微晶尺寸1.0‐1.5nm)晶子学说的价值在于它第一次指出玻璃中存在微不均匀物,及玻璃中存在一定的有序区域,这对于玻璃分相、晶化等本质的理解有重要价值。
一、玻璃的结构[SiO4]石英晶体结构以及石英玻璃、钠硅酸盐玻璃晶子结构示意图2玻璃结构是指玻璃中质点在空间的几何位置、有序程度以及他们之间的结合状态。
1932年W.H.Zachariasen借助V.M. Goldschmidt的离子晶界化学原则,利用晶体结构来阐述玻璃结构,即查氏把离子结晶化学原则和晶体结构知识推演到玻璃结构,描述了离子-共价键的化合物,如熔融石英、硅酸盐玻璃、硼酸盐玻璃。
氧化物形成玻璃的四个条件:¾一个氧离子不能和两个以上的阳离子结合——氧的配位数不大于2;¾阳离子周围的阳离子熟不应多过3或4——阳离子的配位数为3或4;¾网络中氧配位多面体之间只能共顶角,不能共棱、共面。
¾如果网络是三维的,则网络中每一个氧配位多面体必须至少有三个氧离子与相邻多面体相连,以形成三维空间发展的无规则网络结构。
根据上述条件,B2O3、SiO2、P2O5是很好的玻璃形成体。
不符合上述条件的氧化物则属于网络改良体,如碱金属、碱土金属氧化物。
一些氧化物可以部分参与网络结构,称为网络中间体,如BeO、Al2O3、ZrO23无规则网络学说强调了玻璃中多面体之间互相排列的连续性、均匀性和无序性,而晶子学说则强调了不连续性、有序性和微不均匀性。
因此,玻璃的结构是连续性、不连续性,均匀性、微不均匀性,无序性、有序性几对矛盾的对立统一体,条件变化,矛盾双方可能相互转化。
Figure 1. (a) Crystalline material (regular) and (b) glassy material (irregular).无规则网络学说的玻璃结构模型B2O3玻璃在不同温度下的结构模型无序性(远程)与有序性(近程)、连续性与不连续性,均匀性与不均匀性是玻璃这个统一体的两个方面,而且根据玻璃成分、热处理等条件不同,可以相互转化。
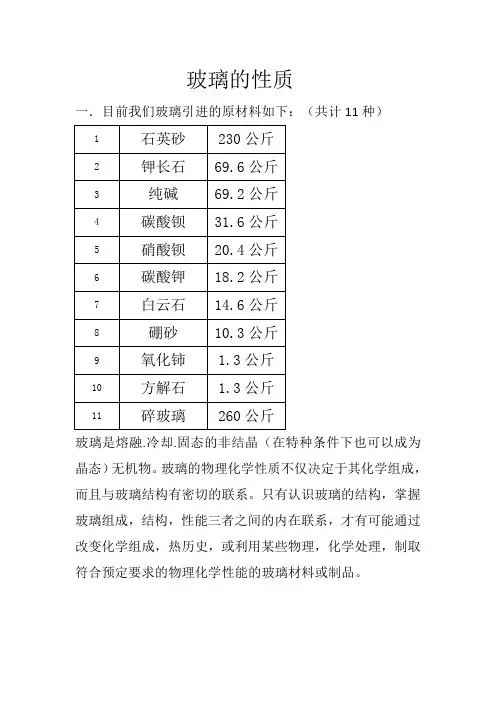
玻璃的性质一.目前我们玻璃引进的原材料如下:(共计11种)玻璃是熔融.冷却.固态的非结晶(在特种条件下也可以成为晶态)无机物。
玻璃的物理化学性质不仅决定于其化学组成,而且与玻璃结构有密切的联系。
只有认识玻璃的结构,掌握玻璃组成,结构,性能三者之间的内在联系,才有可能通过改变化学组成,热历史,或利用某些物理,化学处理,制取符合预定要求的物理化学性能的玻璃材料或制品。
二.玻璃的主要性质。
(1)粘度:粘度是玻璃的最主要物理性质之一。
在整个玻璃生产工艺过程(熔融,澄清,冷却,成形,退火)所制度的一系列温度制度往往是以此为依据的。
粘度是液态或熔体内部的分子在移动时相互之间的内摩擦力,内摩擦力越大,则分子移动越困难。
也就是粘度越大。
玻璃的粘度和温度有着密切的关系,温度升高时,粘度随之下降,但是这种变化没有一定的比例关系,通常在高温阶段,粘度的降低速度缓慢,而在低温段则急剧增加。
(2)析晶性能:玻璃是一种非晶态物质,但在一定的条件下,玻璃具有向晶态转化的倾向。
在玻璃生产中一般不希望玻璃析晶,因为析晶会造成外观上的缺陷,失去玻璃原有的性质,不能加工成型。
析晶是玻璃的缺陷。
(3)光学性能:玻璃对辐射的透射率取决于玻璃中的杂质含量。
不含氧化铁的透明玻璃大约能透过90%以上的可见辐射,仅有小部分辐射被玻璃真正吸收,大部分为玻璃两个表面的反射所损失。
(4)密度:玻璃的密度主要决定于玻璃的化学组成,分子量越大的氧化物含量越高时,玻璃的密度也越大。
如石英玻璃由SiO2所组成,它的密度最小,约2.2g/立方厘米,而含大量氧化铅的玻璃密度可达6.5g/立方厘米。
我们目前生产的钠钙硅玻璃的密度为2.46g/立方厘米。
(5)热膨胀系数:大部分物体受热以后都要膨胀,玻璃也不例外。
物体受热后膨胀的大小由它们的线膨胀系数和体膨胀系数来表明的。
玻璃的膨胀系数取决于玻璃的化学组成,系数提高。
而增加SiO2,B2O3,AL2O3的含量,就能降低膨胀系数。

第2章玻璃的黏度及表面性质2.1玻璃的黏度生产上常把玻璃的粘度随温度变化的快慢称为玻璃的料性。
粘度随温度变化快的玻璃称为短性玻璃,反之称为长性玻璃。
图中分三个温度区:A区:温度较高,表现为典型的黏性液体,其弹性性质近于消失。
黏度决定于玻璃的组成和温度B区:(转变区)黏度、弹性模量随温度的↓而↑↑。
黏度与组成、温度和时间有关。
C区:温度↓而弹性模量↑,黏滞流动变得非常小。
黏度决定于组成和温度,与时间无关黏度与玻璃组成的关系(1)氧硅比氧硅比大(如熔体中碱含量增大,游离氧增多),非桥氧多,网络结构不牢固,熔体黏度减小;反之增大。
(表4-3 )(2)键强:在其它条件相同的前提下,粘度随阳离子与氧的键强增大而增大。
黏度按Li2O-Na2O-K2O依次递减(3)离子极化:离子极化力大的阳离子对桥氧的极化力强,使得Si-O键作用减弱,网络结构易于调整与移动,使η↓。
(4)结构对称性:网络基本结构单元的结构不对称,可能在结构中存在缺陷或弱点,使结构不稳定,粘度下降。
(5)配位数:4配位形成四面体进入网络结构,使结构紧密,粘度增大。
其它配位时就从网络中分离出来,使黏度降低。
如B2O3和A2O3硼反常现象:由硼离子配位数变化引起性能曲线上出现转折的现象,称为“硼反常现象”。
总结氧化物组成对玻璃粘度作用可归纳如下SiO2Al2O3 ZrO提高粘度。
K2O Na2O 降低粘度,Li2O高温时降低粘度,低温时增加粘度。
RO降低高温粘度,增加低温粘度。
PbO CdO Bi2O3 SnO等降低粘度。
2.2玻璃的表面张力熔融玻璃表面层的质点受到内部质点的作用而趋向于熔体的内部,使表面有收缩的趋势,因此玻璃液表面分子间存在着作用力,即表面张力。
总结:依组成对表面张力的不同作用,将组成氧化物分为Ⅰ类:非表面活性组份:一般是增加玻璃表面张力,符合加合性法则Ⅱ类:中间活性组份:加入量大时,可降低表面张力,不符合加合性法则Ⅲ类:难熔表面活性强的组份:有强的降低表面张力的能力,不符合加合性法则表面张力与温度、气氛和湿度的关系1、σ与T的关系温度升高,质点热运动能增大,体积膨胀。

第4章 玻璃的粘度及表面性质4.1玻璃的粘度在重力、机械力和热应力等的作用下,玻璃液(或玻璃熔体)中的结构组元(离子或离子组团)相互间发生流动。
如果这种流动是通过结构组元依次占据结构空位的方式来进行,则称为粘滞流动。
当作用力超过“内摩擦”阻力时,就能发生粘滞流动。
粘滞流动用粘度衡量。
粘度是指面积为S 的两平行液面,以一定的速度梯度dxdV移动时需克服的内摩擦阻力f 。
dxdVSf η= (4-1) 式中: η—粘度或粘滞系数S —两平行液面间的接触面积dx dV /—沿垂直于液流方向液层间速度梯度粘度是玻璃的一个重要物理性质,它贯穿于玻璃生产的全过程。
在熔制过程中,石英颗粒的溶解、气泡的排除和各组分的扩散都与粘度有关。
在工业上,有时应用少量助熔剂降低熔融玻璃的粘度,以达到澄清和均化的目的。
在成形过程中,不同的成形方法与成形速度要求不同的粘度和料性。
在退火过程中,玻璃的粘度和料性对制品内应力的消除速度都有重要作用。
高粘度的玻璃具有较高的退火温度,料性短的玻璃退火温度范围一般较窄。
影响玻璃粘度的主要因素是化学组成和温度,在转变区范围内,还与时间有关。
不同的玻璃对应于某一定粘度值的温度不同。
例如粘度为1012s Pa •时,钠钙硅玻璃的相应温度为560℃左右,钾铅硅玻璃为430℃左右,而钙铝硅玻璃为720℃左右。
在玻璃生产中,许多工序(和性能)都可以用粘度作为控制和衡量的标志(见表4-1)。
使用粘度来描述玻璃生产全过程较温度更确切与严密,但由于温度测定简便、直观,而粘度和组成关系的复杂性及习惯性,因此习惯上用温度来描述和规定玻璃生产工艺过程的工艺制度。
4.1.1粘度与温度关系由于结构特性的不同,因而玻璃熔体与晶体的粘度随温度的变化有显著的差别。
晶体在高于熔点时,粘度变化很小,当到达凝固点时,由于熔融态转变成晶态的缘故,粘度呈直线上升。
玻璃的粘度则随温度下降而增大。
从玻璃液到固态玻璃的转变,粘度是连续变化的,其间没有数值上的突变。




1、玻璃结构:是指离子或原子在空间的几何配置以及它们在玻璃中形成的结构形成体。
2、3T图:以温度T为纵坐标,冷却时间t或lg t为横坐标绘制温度-时间-转变率(T-T-T)图(简称3T图)。
3、离子的集聚作用:是离子使小型四面体聚集为大型四面体的作用。
4、混合碱效应:在R+离子含量不变,引进两种R+离子的玻璃比只含一种R+离子的玻璃的性能发生改变,当两种金属离子(R+)的数量接近时,其性能最佳。
5、离子着色:是指过渡金属离子在3d或4f轨道中de电子未被充满,容易产生d-d跃迁或f-f跃迁而引起光吸收,使玻璃着色。
6、主要原料:是指在玻璃中引入SiO2、Al2O3、B2O3、Na2O、K2O、CaO、MgO等各种组成氧化物的原料。
7、助熔剂:是指能降低玻璃熔制温度或加速玻璃熔制过程的原料。
8、玻璃成分:是指玻璃中所含有元素和化合物的种类和比例,又称为化学组成。
9、玻璃的成型:是将玻璃液制成为具有固定几何形状的玻璃制品的过程。
10、玻璃的热处理:是指在玻璃转变温度与软化温度之间所进行的热过程。
11、玻璃的表面抛光:是对不平整的玻璃表面进行处理,使之成为平整而光滑;或者是将玻璃毛坯制品经过处理,使之达到所规定的形状和尺寸,而且表面很光滑的加工过程。
12、夹层玻璃:是由两片或两片以上的玻璃用透明的弹性胶片牢固粘合而成的,具有透明、高机械强度、耐光、耐热、耐湿和耐寒等特性的深加工玻璃制品。
13、重金属氧化物玻璃:是指以氧化铅(PbO)、氧化铋(Bi2O3)、氧化锑(Sb2O3)、氧化碲(TeO2)以及其它在元素周期表中的第五、六主簇周期中具有高原子量的金属氧化物为基础组分而形成的玻璃。
14、光功能玻璃:是指在外场(电、光、磁、热、声、力等)作用下,利用玻璃本身光学性质(如折射率或感应电极化)发生变化的原理,去实现对入射光信号的探测、调制以及能量或频率转换作用的光学材料的统称。
15、离子的解聚作用:是离子使大型四面体分解为小型四面体的作用。
玻璃材料的种类及特性玻璃的主要成分是二氧化硅,玻璃质地硬且脆,是一种无色的透明材料,并可添加各种成分制成茶色玻璃、淡墨色玻璃、钴蓝色玻璃等。
玻璃按主要成分分类:玻璃按主要成分可以分为非氧化物玻璃和氧化物玻璃。
非氧化物玻璃品种和数量很少,主要有硫系玻璃和卤化物玻璃。
氧化物玻璃又分为硅酸盐玻璃、硼酸盐玻璃、磷酸盐玻璃等。
氧化物玻璃通常按玻璃中二氧化硅以及碱金属、碱土金属氧化物的不同含量,又分为:1.石英玻璃石英玻璃的二氧化硅含量大于99.5%,其热膨胀系数低、耐高温、化学稳定性好、透紫外光和红外光、熔制温度高、粘度大、成型较难。
石英玻璃多用于半导体、电光源、光导通信、激光等技术和光学仪器中。
2.高硅氧玻璃高硅氧玻璃的二氧化硅含量约96%,其性质与石英玻璃相似。
3.钠钙玻璃钠钙玻璃以二氧化硅含量为主,还含有15%的氧化钠和16%的氧化钙,其成本低廉、易成型,适宜大规模生产,其产量占实用玻璃的90%。
钠钙玻璃可用于生产玻璃瓶罐、平板玻璃、器皿、灯泡等。
4.铅硅酸盐玻璃铅硅酸盐玻璃主要成分有二氧化硅和氧化铅,具有独特的高折射率和高体积电阻,与金属有良好的浸润性,可用于制造灯泡、真空管芯柱、晶质玻璃器皿图(如图为JAZZ系列水晶餐具)、火石光学玻璃等5.铝硅酸盐玻璃铝硅酸盐玻璃以二氧化硅和氧化铝为主要成分,软化变形温度高,用于制作放电灯泡、高温玻璃温度计、化学燃烧管和玻璃纤维等。
6.硼硅酸盐玻璃又称耐热玻璃或硬质玻璃,以氧化硅和氧化钡为主要成分,具有良好的耐热性和化学稳定性,硼硅酸盐玻璃发明于1912年,其商标名为Pyrex。
它是第一种耐高温,有较好抗热冲击能力的玻璃材料(如图硼硅酸盐玻璃材料制作的玻璃珠宝)。
硼硅酸盐玻璃可以用来制作咖啡壶、炉子、实验室用的玻璃器皿、吊灯(如图耐热玻璃制作的吊灯)及其它在高温环境中工作的设备。
它抗酸和抗化学介质腐蚀的能力很强、热膨胀率很低,因此被用来制作天文望远镜的镜片和其它精密仪器。
玻璃表面水珠的形成玻璃表面水珠的形成是由于玻璃表面的性质和环境条件的影响。
在一定的湿度和温度条件下,水分会凝结在玻璃表面形成水珠。
下面将从玻璃表面性质、湿度和温度、表面张力和凝结过程等方面详细解释玻璃表面水珠的形成过程。
一、玻璃表面性质玻璃是一种非晶态物质,表面是非常光滑平整的。
这使得水分分子在玻璃表面上无法渗透,形成了一层薄薄的水膜。
这种水膜具有一定的黏性,使得水分分子在表面上相互吸引,形成水珠。
同时,玻璃表面也具有一定的亲水性,使得水分分子更容易吸附在玻璃表面上。
这些性质为水珠的形成提供了基础。
二、湿度和温度湿度和温度是影响水珠形成的重要因素。
当环境湿度较高时,空气中的水分含量较大,水分分子更容易在玻璃表面凝结形成水珠。
而温度的升高会加快水分分子的运动速度,使得水分分子更容易从气态转变为液态,从而加速水珠的形成。
三、表面张力表面张力是水珠形成的重要力量。
水分分子在玻璃表面上会相互吸引,形成一种薄薄的水膜。
而水分分子之间的相互吸引力使得水珠呈现出一定的凸起形状。
这是因为水分分子在液态状态下会互相吸引,使得水珠在表面上呈现出尽可能小的表面积。
这种表面张力使得水珠能够保持较为稳定的形状。
四、凝结过程水珠的形成是一个凝结的过程。
当环境湿度较高时,空气中的水分分子会与玻璃表面接触后冷凝成液态水。
这些水分分子在表面上形成一层水膜,然后逐渐聚集形成水珠。
随着水分分子的不断凝结,水珠的体积逐渐增大,直到达到平衡状态。
总结起来,玻璃表面水珠的形成是由于玻璃表面的性质和环境条件的影响。
玻璃表面的光滑平整和亲水性使得水分分子容易吸附在表面上,而高湿度和适宜的温度加速了水分分子的凝结过程。
同时,表面张力使得水珠能够保持较为稳定的形状。
这些因素共同作用下,玻璃表面水珠得以形成。