肿瘤新十大特征
- 格式:doc
- 大小:156.50 KB
- 文档页数:12


癌症进展标准
癌症进展标准主要依据疾病的控制时间、肿瘤负荷的增加速度、症状的严重程度等因素进行评估。
1. 缓慢进展:患者的原发肿瘤在缓慢增大,但没有查出新的转移病灶,患者原有的症状也没有明显加重,疾病控制时间至少达到6个月,肿瘤负荷轻微增加(≤2分),症状评分≤1。
2. 局部进展:患者的原发肿瘤增大并不明显,但出现了非脑转移灶的病情有限进展,或孤立性的脑转移灶进展,疾病控制时间至少达到3个月,症状评分≤1。
3. 爆发进展:患者的原发肿瘤会迅速增大,患者在检查时除了肿瘤增大,还可能会发现新的症状也明显加重,疾病控制时间至少达到3个月,肿瘤负荷快速增加(>2分)。
另外,如果出现越来越剧烈的疼痛、发热和消瘦等症状,也可能是癌症在不断进展的标志。
以上内容仅供参考,具体标准建议咨询专业医生,他们能根据患者的具体情况和医学研究进展给出最准确的判断和建议。


肿瘤的新十大特征肿瘤是医学领域常见的疾病之一,它是由异常细胞在体内不受控制地增殖而形成的一种疾病。
近年来,随着医学技术的进步和研究的深入,人们对肿瘤的了解也不断增加。
在这篇文章中,我们将重点介绍肿瘤的新十大特征。
1. 基因突变:近年来,研究人员发现肿瘤细胞中存在大量的基因突变。
这些突变可以导致细胞从正常的生长状态转变为恶性的肿瘤细胞,进而引发肿瘤的发生和发展。
2. 免疫逃逸:肿瘤细胞可以通过多种途径来逃避机体的免疫攻击,使肿瘤细胞能够无限制地生长和扩散。
这一特性对于肿瘤的治疗和预防提出了新的挑战。
3. 代谢异常:与正常细胞相比,肿瘤细胞的代谢方式存在明显的异常。
肿瘤细胞对葡萄糖的摄取和利用更高,而且其代谢产物会影响周围的正常细胞,进一步促进肿瘤的生长。
4. 组织微环境:肿瘤细胞往往能够改变其周围的组织微环境,包括改变血管结构、增加血管通透性和产生促血管生成因子等,从而为肿瘤提供足够的氧和营养物质。
5. 转移和侵袭:肿瘤细胞具有高度的转移和侵袭能力,可以通过血液或淋巴系统远离原发病灶并在其他部位生长和扩散。
这是肿瘤治疗中最具挑战性的一方面。
6. 组织异质性:肿瘤组织通常存在着异质性,即肿瘤细胞在形态、功能和遗传特性上具有不同的表现。
这使得对肿瘤的治疗变得更加困难,因为不同的细胞亚群对治疗的反应也不同。
7. 干细胞特性:部分肿瘤细胞具有干细胞特性,即它们具有自我更新和多向分化的能力。
这些肿瘤干细胞能够持续地产生新的肿瘤细胞,从而维持肿瘤的生长和扩散。
8. 促炎性环境:肿瘤组织通常处于促炎性的环境中,这是由于肿瘤细胞和免疫细胞之间的相互作用导致的。
炎性反应不仅可以促进肿瘤的生长,还可以降低对治疗的敏感性。
9. 肿瘤微环境:肿瘤生长不仅受肿瘤细胞本身的影响,还受其周围的微环境的调控。
这些微环境包括细胞外基质、细胞因子和细胞外囊泡等,它们与肿瘤细胞的相互作用对肿瘤的发生和发展起着重要作用。
10. 肿瘤异质性:肿瘤的细胞异质性不仅仅是在细胞水平上存在的,还可以在肿瘤组织的不同区域之间存在。

肿瘤who疗效评价标准
肿瘤WHO疗效评价标准。
肿瘤WHO疗效评价标准是指世界卫生组织制定的一套评价肿瘤治疗效果的标准。
这一标准主要用于评价肿瘤治疗的疗效,对于指导临床治疗和科研具有重要意义。
肿瘤WHO疗效评价标准主要包括完全缓解、部分缓解、疾病稳定和疾病进展四个方面的评价。
完全缓解是指在治疗结束后,所有的肿瘤病灶都完全消失,且持续4周以上。
部分缓解是指治疗结束后,肿瘤病灶有明显缩小,但未达到完全消失的程度。
疾病稳定是指治疗结束后,肿瘤病灶没有明显变化,也没有新的病灶出现。
疾病进展则是指治疗结束后,肿瘤病灶有明显增大,或者出现了新的病灶。
根据肿瘤WHO疗效评价标准,医生可以对患者的治疗效果进行科学客观的评价。
在临床实践中,医生可以根据患者的病情和治疗方案,结合肿瘤WHO疗效评价标准,及时调整治疗方案,以达到最佳的治疗效果。
除了对临床治疗有指导作用外,肿瘤WHO疗效评价标准还对科研具有重要意义。
科研人员可以根据这一标准对不同治疗方案的疗效进行比较,评估治疗方案的优劣,为临床提供更科学的依据。
总的来说,肿瘤WHO疗效评价标准是一套科学客观的评价肿瘤治疗效果的标准,对临床治疗和科研具有重要意义。
医生和科研人员应当熟练掌握这一标准,以提高肿瘤治疗的效果,为患者的康复和科研的进步做出贡献。

肿瘤的分型分级及分期
肿瘤的分型分级及分期是肿瘤诊断和治疗的重要依据。
这个过程涉及到对肿瘤的详细分析和分类,目的是提供更准确的疾病描述,引导更为个性化和精准的治疗方案。
现在,我们将详述肿瘤的分型、分级和分期的过程和意义。
一、肿瘤的分型
肿瘤的分型是根据肿瘤的组织学特征来进行的。
主要分为良性肿瘤和恶性肿瘤。
良性肿瘤通常生长缓慢,病变范围有限,不会侵犯或转移到其他部位;而恶性肿瘤则生长迅速,侵犯周围组织,且有可能转移到其他部位。
在进一步的分类中,我们还可以根据肿瘤的起源组织来进行分型,如鳞状细胞癌、腺癌、肉瘤等。
二、肿瘤的分级
肿瘤的分级是根据肿瘤细胞的化学、形态和生物学特性,判定其恶性程度和预后。
通常,肿瘤的分级分为四级,即低级别(I、II)和高级别(III、IV)。
低级别肿瘤的细胞分化良好,生长缓慢,预后相对更好;高级别肿瘤的细胞分化差,生长迅速,预后比较差。
三、肿瘤的分期
肿瘤的分期是对肿瘤病性程度和扩散范围的评估,这对于制定治疗方案和判断预后至关重要。
肿瘤的分期通常包含三个方面:肿瘤的大小(T),淋巴结是否受到侵犯(N),是否有远处转移(M)。
根据
这三个因素的不同组合,我们可以将肿瘤分为四期,从I期至IV期,肿瘤的严重程度逐步增加。
综合肿瘤的分型、分级和分期,我们可以对肿瘤的性质有一个全面而深入的理解,这对于制定合适的治疗策略,改善患者预后,提高生存质量和生存期是十分重要的。
只有准确的评估肿瘤的类型、级别和阶段,我们才能有效地采取相应的治疗策略,实现精准医学的理念,为患者提供更好的治疗效果和生活质量。

肿瘤新十大基本特征分子靶点肿瘤新十大基本特征分子靶点肿瘤是一种严重的疾病,对患者的身体和心理都会造成巨大的影响。
为了更好地治疗肿瘤,科学家们一直在不断地探索肿瘤的发生机制和治疗方法。
在这个过程中,发现了许多肿瘤的基本特征分子靶点,这些靶点对于肿瘤的发生和发展起着至关重要的作用。
本文将为您介绍肿瘤新十大基本特征分子靶点,希望对您有所启发。
肿瘤新十大基本特征分子靶点:1. PI3K/AKT/mTOR信号通路:这是一个常见的肿瘤发生和发展的信号通路,其在调控细胞凋亡、增殖和生存中起着重要作用。
2. 肿瘤抑制基因:这一类基因通常能够抑制肿瘤的生长和扩散,对于肿瘤的治疗具有重要意义。
3. 转录因子:转录因子在肿瘤的发生和发展中扮演着关键角色,对于调控基因的表达和细胞功能至关重要。
4. 炎症调控因子:肿瘤常常伴随着炎症的发生,炎症调控因子对于肿瘤的发展起着重要作用。
5. 细胞周期调控:细胞周期调控是肿瘤细胞增殖的重要调节因子,对于肿瘤的治疗具有重要意义。
6. 紧张氧化应激:紧张氧化应激在肿瘤的发生和发展中扮演着关键角色,对于肿瘤的治疗具有重要意义。
7. 分化相关因子:分化是肿瘤细胞生长和扩散的重要调节因子,对于肿瘤的治疗具有重要意义。
8. 表观遗传调控:表观遗传调控在肿瘤的发生和发展中扮演着关键角色,对于肿瘤的治疗具有重要意义。
9. 血管生成因子:肿瘤的生长和扩散需要大量的营养和氧气供应,而血管生成因子则对此起着重要作用。
10. 免疫调控因子:免疫调控在肿瘤的发生和发展中扮演着关键角色,对于肿瘤的治疗具有重要意义。
这些肿瘤新十大基本特征分子靶点涵盖了肿瘤的发生和发展的多个方面,在科学家们的努力下,对于肿瘤的治疗提供了重要的思路和方法。
希望通过不断地研究和探索,我们能够找到更多的肿瘤治疗靶点,为肿瘤患者带来更多的希望。
总结回顾:本文介绍了肿瘤新十大基本特征分子靶点,从不同的角度全面探讨了肿瘤的发生和发展的重要因素。

肿瘤的分型分级和分期肿瘤的分型、分级和分期肿瘤是一种异常细胞的过度增生,形成肿块或肿瘤。
了解肿瘤的分型、分级和分期对于患者的治疗和预后评估非常重要。
本文将详细介绍肿瘤的分型、分级和分期,以帮助读者更好地理解和应对肿瘤相关问题。
一、肿瘤的分型肿瘤的分型是根据肿瘤的组织来源、形态特点及分子生物学特征进行分类的过程。
分型可以帮助医生确定肿瘤的类型,因此能够指导合理的治疗方案。
1. 组织来源分型根据肿瘤的组织或细胞来源,肿瘤可以分为上皮肿瘤、间叶肿瘤和神经内分泌肿瘤等。
上皮肿瘤起源于上皮组织,如乳腺癌、肺癌等;间叶肿瘤起源于间质组织,如肉瘤等;神经内分泌肿瘤起源于神经内分泌细胞,如胰腺神经内分泌肿瘤等。
2. 形态特点分型根据肿瘤的形态特点,肿瘤可以分为腺癌、鳞癌、混合型肿瘤等。
腺癌起源于上皮腺体,如乳腺腺癌;鳞癌起源于上皮表面,如肺鳞癌;混合型肿瘤则具有两种或更多不同的组织成分。
3. 分子生物学分型近年来,分子生物学的研究发现,肿瘤的分子特征与预后关系密切。
例如,乳腺癌根据HER2、ER和PR的表达水平,可以分为不同的亚型,包括HER2阳性、激素受体阳性和三阴性亚型。
二、肿瘤的分级肿瘤的分级是根据其组织结构的异质性、细胞分化程度和细胞增殖指标等特征进行评估的过程。
分级可以帮助医生确定肿瘤的恶性程度,从而制定相应的治疗计划。
肿瘤的分级通常采用三级制度,即G1、G2和G3。
G1表示肿瘤组织结构较为成熟,细胞分化良好,生长缓慢;G2表示肿瘤组织结构相对较为成熟,细胞分化中等,生长速度适中;G3表示肿瘤组织结构较不成熟,细胞分化差,生长速度较快。
分级的结果可以帮助医生预测肿瘤的侵袭性和预后评估。
一般来说,G1级别的肿瘤较为温和,预后相对较好;而G3级别的肿瘤则较为恶性,预后较差。
三、肿瘤的分期肿瘤的分期是根据肿瘤的扩散程度、淋巴结转移和远处转移情况进行分类的过程。
分期是评估肿瘤的临床扩散程度和分级的重要方式。
1. TNM 分期系统TNM分期系统是目前应用最广泛的肿瘤分期系统。
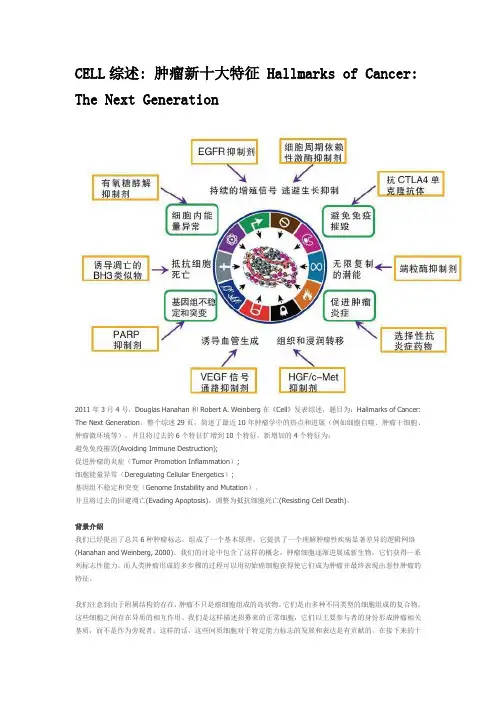
CELL综述: 肿瘤新十大特征 Hallmarks of Cancer: The Next Generation2011年3月4号,Douglas Hanahan和Robert A. Weinberg在《Cell》发表综述,题目为:Hallmarks of Cancer: The Next Generation。
整个综述29页,简述了最近10年肿瘤学中的热点和进展(例如细胞自噬、肿瘤干细胞、肿瘤微环境等),并且将过去的6个特征扩增到10个特征,新增加的4个特征为:避免免疫摧毁(Avoiding Immune Destruction);促进肿瘤的炎症(Tumor Promotion Inflammation);细胞能量异常(Deregulating Cellular Energetics);基因组不稳定和突变(Genome Instability and Mutation)。
并且将过去的回避凋亡(Evading Apoptosis),调整为抵抗细胞死亡(Resisting Cell Death)。
背景介绍我们已经提出了总共6种肿瘤标志,组成了一个基本原理,它提供了一个理解肿瘤性疾病显著差异的逻辑网络(Hanahan and Weinberg, 2000)。
我们的讨论中包含了这样的概念,肿瘤细胞逐渐进展成新生物,它们获得一系列标志性能力,而人类肿瘤形成的多步骤的过程可以用初始癌细胞获得使它们成为肿瘤并最终表现出恶性肿瘤的特征。
我们注意到由于附属结构的存在,肿瘤不只是癌细胞组成的岛状物。
它们是由多种不同类型的细胞组成的复合物,这些细胞之间存在异质的相互作用。
我们是这样描述招募来的正常细胞,它们以主要参与者的身份形成肿瘤相关基质,而不是作为旁观者;这样的话,这些间质细胞对于特定能力标志的发展和表达是有贡献的。
在接下来的十年中,这个概念已经得到确认和发展,就是肿瘤生物学不能只是通过对这些癌细胞特性描述来进行简单的理解,而是应该包括“肿瘤微环境”对肿瘤形成的贡献。

2024肿瘤免疫治疗及其相关标记物肿瘤免疫治疗作为新的治疗手段,革新了肿瘤的治疗模式,逐步发展成为继手术、化疗、放疗之后的第四种肿瘤治疗模式。
但是免疫治疗有效率有限,寻找精准的肿瘤免疫治疗生物标志物作为靶标或检测及评价指标有助于筛选免疫治疗适宜人群,探索有效免疫治疗模式,预防及应对免疫相关不良反应,以达到精准治疗的目的。
本文将介绍现时临床研究中的肿瘤免疫治疗相关生物标记物,并探讨其在临床实践中的应用。
一、肿瘤免疫微环境相关标志物肿瘤微环境(tumormicroenvironment,TME)即肿瘤细胞生存的内环境,不仅包括肿瘤细胞,还有与其密切联系的成纤维细胞、免疫和炎性细胞、肿瘤间质等多种成分,也包括微血管、淋巴管及浸润的趋化因子口]。
免疫微环境是肿瘤的十大特征之一,其多样性和复杂性对免疫治疗均具有影响。
目前,发现多种免疫治疗标记物与肿瘤微环境相关。
1.PD-L1程序性死亡配体1(PD-L1)是重要的免疫检查点,其在肿瘤细胞中的表达水平,称为肿瘤细胞阳性比例分数(TPS)[2]z TPS越高对PD-L1抑制剂的应答率也越高。
除肿瘤组织以外,肿瘤免疫微环境中的淋巴细胞、巨噬细胞及间质细胞等也会表达PD-L1,所以包括阳性肿瘤细胞、淋巴细胞、巨噬细胞在内的PD-L1表达水平,称为复合阳性分数(CPS)[3]o在食管癌、胃癌、宫颈癌、尿路上皮癌等肿瘤中多使用CPS,尤其在胃癌中,CPS 能够更好地反应PD-L1抑制剂的应答率。
在肿瘤患者治疗过程中,随着治疗的进行,PD-L1会发生明显的变化。
PD-Ll检测试剂主要包括22C3、28-8、SP142和SP263商业试齐盒,22C3作为帕博利珠单抗一线单药的伴随诊断,SP142作为阿替利珠单抗一线单药的伴随诊断(TC≥50%或IC≥10%),28-8和SP263分别作为对应PD1和(或)PD-L1单抗的补充诊断。
另外,SP263被欧盟批准用于NSCLc患者帕撕IJ珠单抗药物一线和二线以及11I期患者度伐利尤单抗药物的伴随诊断、纳武利尤单抗药物二线的补充诊断。

癌细胞的十大特征癌细胞十大特征释义众所周知,癌细胞几乎肆虐横行在人体的每一个部位,从大脑到各个器官,从表皮到骨骼,我们曾经在进化中得到的、在生物界引以为豪的人体,在癌细胞肆虐下往往显得那么脆弱,有时似乎变得不堪一击。
癌细胞并非入侵的外族,它们与组成人体各个器官的正常细胞同文同种,但不同的是癌细胞基因结构和功能的变化赋予了它们十种特殊“器物”,从而使得它们能够在人体内纵横捭阖,所向披靡。
1.自给自足生长信号(Self-Sufficiency in Growth Signals),2.抗生长信号的不敏感(Insensitivity to Antigrowth Signals),3.抵抗细胞死亡(Resisting Cell Death),4.潜力无限的复制能力(Limitless Replicative Potential),5.持续的血管生成(Sustained Angiogenesis),6.组织浸润和转移(Tissue Invasion and Metastasis),7.避免免疫摧毁(Avoiding Immune Destruction),8.促进肿瘤的炎症(Tumor Promotion Inflammation),9.细胞能量异常(Deregulating Cellular Energetics),10.基因组不稳定和突变(Genome Instability and Mutation)其一:生长信号的自给自足在人体这个迄今为止最为复杂的系统中,倘若一个细胞想要改变其现有状态(如从静止到生长分化状态的改变),必须接收到一系列相关指令,这一过程才能进行,就像军队中的令行禁止一样。
就这样,数以万亿计的细胞各司其职,在和谐统一的秩序中维系着人体的健康。
到目前为止,科学家在正常细胞中还没有发现一例例外。
这些改变细胞状态的指令,生物学上称之为信号分子,它们多是外源的,即由另一类细胞产生,这也是人体保持自我平衡的重要机制。
简述肿瘤细胞的生物学特征
肿瘤细胞是指在机体内不受控制地增殖和生长的细胞。
它们与正常细胞相比,具有以下生物学特征:
1. 无限增殖能力:肿瘤细胞丧失了正常细胞的生命周期调控机制,导致它们可以无限制地增殖和分裂。
这是肿瘤细胞形成肿瘤的基础。
2. 自主生长信号:肿瘤细胞产生了多种异常的信号通路,使其可以自主地接收生长因子信号,促进细胞生长和分裂。
这使得肿瘤细胞不再对正常生长调控机制敏感。
3. 缺乏细胞凋亡:肿瘤细胞的凋亡机制受损,导致它们不再能够自我调控和死亡。
这使得肿瘤细胞可以长期存活并继续增殖。
4. 组织侵袭和转移能力:肿瘤细胞能够穿过基底膜,入侵周围组织,并通过血液或淋巴系统转移到其他部位,形成远处转移。
这种侵袭和转移能力是肿瘤的重要特征。
5. 血管新生:肿瘤细胞可以促进新血管的形成,以供给肿瘤生长所需的养分和氧气。
这种血管新生过程被称为肿瘤血管生成,是肿瘤生长和转移的重要因素。
6. 基因突变:肿瘤细胞的基因组中常存在多个突变,包括激活的癌基因和失活的抑癌基因。
这些基因突变可以导致细胞生长和分裂的异常。
肿瘤细胞具有无限增殖能力、自主生长信号、缺乏细胞凋亡、组织侵袭和转移能力、血管新生以及基因突变等生物学特征,使得它们能够不受控制地生长和扩散,形成肿瘤并危害机体健康。
肿瘤的新十大特征肿瘤是一种常见的疾病,它给人们的生活带来了诸多困扰和威胁。
随着科学技术的不断发展,我们对肿瘤了解得越来越多。
在过去的几十年里,肿瘤的研究取得了巨大的进展,揭示出了许多具有重要意义的新特征。
本文将会探讨肿瘤的新十大特征,以期让读者对此疾病有更深入的了解。
第一,肿瘤与基因的突变相关。
研究表明,癌症是由于人体细胞的基因发生异常变异所引起的。
这些基因突变可能会使细胞失去正常的生长和分化调控,从而导致肿瘤的发生。
第二,肿瘤具有异质性。
肿瘤组织由多种类型的细胞组成,这些细胞在形态、功能和分化程度上存在差异。
异质性是肿瘤难以治愈的主要原因之一,因为不同类型的细胞对治疗手段的敏感性各不相同。
第三,肿瘤具有可塑性。
肿瘤细胞能够根据周围环境的变化调整其生长和分化方式,从而适应不同的生存条件。
这种可塑性使肿瘤能够在不同的组织中发展并产生转移。
第四,肿瘤具有侵袭性。
肿瘤细胞具有侵袭周围正常组织和器官的能力,可以通过直接侵袭或间接诱导血管生成等方式实现。
这种侵袭性使得肿瘤扩散和转移变得可能。
第五,肿瘤能够逃避免疫监视。
人体免疫系统对抗肿瘤具有重要作用,但肿瘤细胞可以通过抑制免疫应答、改变细胞表面标记物等方式逃避免疫监视,从而存活和发展。
第六,肿瘤具有高变异性。
肿瘤细胞的基因组具有高度的变异性,这使得肿瘤在不同个体和不同时间点的发展过程中表现出多样性。
这也是肿瘤治疗中个体差异和耐药性产生的原因之一。
第七,肿瘤存在肿瘤微环境。
肿瘤发展不仅仅依赖于肿瘤细胞本身,还与其周围的细胞、蛋白质以及血管等物质构成的复杂微环境密切相关。
肿瘤微环境提供了肿瘤发展所需的营养和生长因子,同时还可以抑制治疗手段的效果。
第八,肿瘤与机体的相互作用密切。
肿瘤的发展受到机体内多种因素的影响,例如患者的遗传背景、免疫状态、代谢状态等。
了解肿瘤与机体的相互作用有助于制定更个体化的治疗方案。
第九,肿瘤的治疗需综合多种手段。
由于肿瘤的复杂性和多样性,单一的治疗手段往往难以达到理想的效果。
Hallmarks of Cancer: The Next Generation摘要肿瘤的标志包括在人类肿瘤多步发展过程中所获得的6种生物学功能。
这些标志构成了一种系统化的规律,使得肿瘤疾病的复杂性变得合理化,它们包括:1.持续增殖的信号2.逃避生长抑制因子3.抵抗细胞死亡4.使其能够无限复制5.诱导血管生成6.激活肿瘤侵袭性和转移性。
在这些标志下隐藏着的是基因的不稳定性,基因的不稳定性造成了基因多样性并加快了它们的习得性和炎症表现,这种不稳定性也培养出多种标志功能。
在过去的十年里,概念上的进步在于:在这个名单里增加了两种新兴的的具有潜在普遍性的特征——能量代谢的重新编程和逃避免疫破坏。
除了癌细胞以外,肿瘤还表现出另一种复杂的维度:他们控制一群被招募的、表面看上去正常的细胞,通过建立一个“肿瘤微环境”来有利于这些标志特性的获得。
认识这些概念上的广泛适用性会日益影响人类肿瘤治疗新方法的发展过程。
简介为了了解肿瘤疾病的显著差异性,我们提出了6种癌症的标志,并将它们组织在一起形成系统性的规律,从而提供了一种符合逻辑的框架结构。
在我们的讨论中隐含着这样的一个信息:随着正常细胞逐渐发展为癌症状态,它们会逐渐获得这一系列标志功能。
初期的癌症细胞会需要获得这些特征,从而使其致癌甚至最终恶性,人类肿瘤病例特征的多级发展正是通过这一需求而表现地合理化。
我们注意到,作为一个辅助命题,肿瘤不仅仅是大量孤立增殖的癌细胞,正相反,他们是彼此之间相互参与异型性作用的由多个不同类型细胞所构成的复合组织。
我们描述出这些被招募的正常细胞(它们形成了肿瘤相关基因)在肿瘤发生过程中是积极的参与者而不只是消极的旁观者;如此一来,这些间质细胞有助于某些标志功能的发展和表现。
在随后的十年里,这一概念被固化并延伸,揭示出:肿瘤的生物学不再可以被仅仅理解为“列举肿瘤细胞的特征”,相反,必须通盘考虑“肿瘤微环境”为肿瘤的发生所做出的贡献。
在此后发表的癌症研究显著进展的过程中,新的观察研究被提供出来,得以阐明和修正这些标志功能的原始构想。
CELL综述: 肿瘤新十大特征 Hallmarks of Cancer: The Next Generation2011年3月4号,Douglas Hanahan和Robert A. Weinberg在《Cell》发表综述,题目为:Hallmarks of Cancer: The Next Generation。
整个综述29页,简述了最近10年肿瘤学中的热点和进展(例如细胞自噬、肿瘤干细胞、肿瘤微环境等),并且将过去的6个特征扩增到10个特征,新增加的4个特征为:避免免疫摧毁(Avoiding Immune Destruction);促进肿瘤的炎症(Tumor Promotion Inflammation);细胞能量异常(Deregulating Cellular Energetics);基因组不稳定和突变(Genome Instability and Mutation)。
并且将过去的回避凋亡(Evading Apoptosis),调整为抵抗细胞死亡(Resisting Cell Death)。
背景介绍我们已经提出了总共6种肿瘤标志,组成了一个基本原理,它提供了一个理解肿瘤性疾病显著差异的逻辑网络(Hanahan and Weinberg, 2000)。
我们的讨论中包含了这样的概念,肿瘤细胞逐渐进展成新生物,它们获得一系列标志性能力,而人类肿瘤形成的多步骤的过程可以用初始癌细胞获得使它们成为肿瘤并最终表现出恶性肿瘤的特征。
我们注意到由于附属结构的存在,肿瘤不只是癌细胞组成的岛状物。
它们是由多种不同类型的细胞组成的复合物,这些细胞之间存在异质的相互作用。
我们是这样描述招募来的正常细胞,它们以主要参与者的身份形成肿瘤相关基质,而不是作为旁观者;这样的话,这些间质细胞对于特定能力标志的发展和表达是有贡献的。
在接下来的十年中,这个概念已经得到确认和发展,就是肿瘤生物学不能只是通过对这些癌细胞特性描述来进行简单的理解,而是应该包括“肿瘤微环境”对肿瘤形成的贡献。
直到本文出版为止,癌症研究的非凡进程中,新的研究致力于阐明和订正标志能力的初始形式。
另外也有部份研究提出了我们在初始标志特征中未完整的问题和突出性机制概念。
受这些进展的鞭策,我们重新回顾了初始标志,考虑到新的概念应该包含到这个名单中,并对招募来的基质细胞的功能及其对肿瘤生物学的贡献进一步阐述。
标志能力—概念上的进展癌症的6个标志-这些特征性而且互补的能力使肿瘤可以生长并向远处转移,持续地为理解癌症生物学提供坚实的基础。
(图1; 见当前图片的可下载补充信息)。
在这篇综述的第一部份,我们简要地回顾了2000年初始描述的各个标志的本质,并附上选择性的概念性进展的插图(用副标题的斜位字区别),这些是过去10年来的概念进展,可以用于理解它们的基本机制。
接下来的部份,我们阐述了拓宽概念深度的新进展,按顺序描述了导致获得这6种标志性能力决定性特征,两种新发现的标志性能力,肿瘤微环境的结构和信号相互作用,这两种能力决定了癌症的表型,最后我们讨论这些概念在治疗应用方面的新领域。
维持增殖的信号癌细胞最值得争论的基本特征之一是它们持续慢性增殖的能力。
正常组织小心地控制着生长启动信号的产生和释放,这些信号指导进入细胞增殖和分化周期并在这个周期运行,从而维持细胞数量的稳态,从而维持正常组织结构结构和功能。
癌细胞通过下调这些信号而变成它们自已命运的主宰。
这些启动信号大多数是由结合在细胞表面受体上的生长因子来传输的,典型特征是包含了细胞内酪氨酸激酶区域。
这个区域通过胞内信号途径发送信号,从而调节细胞通过细胞周期,表现为细胞增殖(也就是细胞数量的增加);通常这些信号也影响细胞生物学性质,如细胞生存和能量代谢。
值得注意的是,精确地鉴定和寻找在正常组织中开启的增殖信号源头在上一个十年中是很难理解的,而现在仍然如此。
而且我们对于这个控制丝裂原信号释放的机制仍然知之甚少。
对于这个机制的部份理解是与以下事实并存的,细胞因子的信号控制细胞的数量和在组织中的位置,是通过一个短暂的而且是空间调节的方式从一个细胞向它的周围细胞传递;这种旁分泌信号在实验中难以评价。
另外生长因子的生物利用度的调节通过以下方式进行:隔离细胞周围空间和细胞基质,活化蛋白酶、硫酸酯酶以及其它对这些酶类的释放和活化有关的网络,显然这是一个高度特异性和局限性的方式。
相对来说,癌细胞中的丝裂原信号是比较好理解的(Lemmon and Schlessinger, 2010; Witsch et al., 2010; Hynes and MacDonald, 2009; Perona, 2006)。
癌细胞可以通过多种代替途径获得持续增殖的信号:它们可能自已产生生长因子配体,从而通过表达同源受体作出反应,结果导致自分泌增殖剌激。
另一种替化方法是,癌细胞可能发送信号到肿瘤相关支持间质中的细胞,作为后者的反应提供了各种生长因子给癌细胞(Cheng et al., 2008; Bhowmick et al., 2004).受体信号也可以通过上升表达于癌细胞表面的受体蛋白水平而下调,对数量有限的配体生长信号产生高度的反应性表现。
同样的结果出现在受体分子结构改变中,使配体依赖的启动更为方便。
生长因子依赖可能是从这些受体下游信号启动途径复合物结构活化衍生而来,避免了剌激这些配体介导的受体活途径的需求。
由于许多下游信号途径是由配体剌激的受体发出的,如来自Ras信号传感器的反应,可能只是一个由活化受体传导亚类的代表。
体细胞突变活化依赖的下游途径癌细胞基因组的高通量DNA测序显示了在某些人类肿瘤中存在体细胞突变,这预示着通常由活化的生长因子受体激活的信号回路的基本激活。
我们目前已经明确的是40%人类恶性黑色素瘤包含了活化的变异,可以影响B-Raf 蛋白,从而通过Raf到丝裂原活化蛋白(MAP)激酶途径(Davies and Samuels2010)。
相似地,在大量的肿瘤类型中检测出PI3-K催化亚单位的亚型,它们服务于高度活化的PI3-K回路,包括关键性的Akt/PKB信号转导蛋白(Jiang and Liu,2009; Yuan and Cantley, 2008)。
在生长因子受体发出的多种途径相互作用的功能影响方面,活化上游(受体)与下游(转导蛋白)信号对肿瘤的作用仍不明确。
破坏减弱增殖信号机制的负反馈最近的研究结果突出了负反馈链的重要作用,正常情况下它的启动是用于减缓各种类型的信号,从而通过细胞内回路的信号流得到稳定的调节。
(Wertz and Dixit, 2010; Cabrita and Christofori, 2008; Amit et al.,2007; Mosesson et al.,2008). 这些负反馈机制的缺点在于具有增强增殖信号的功能。
这一类型调节的原型包括Ras癌蛋白:Ras 的致癌效应并不是它本身信号活性高度活化的结果;而是致癌变异影响了ras基因而减弱了GTP酶活性,它作为一个本质上是负反馈的机制启动,这个机制平时是用于确保活化的信号传递是短暂的。
相似的负反馈机制在增殖信号回路中的多个节点中启动。
一个重要的例子是PTEN磷酸化酶,它通过降解PIP3而抵消PI3K的功能。
PTEN的无功能变异放大了PI3K的信号并启动多种癌症实验模型的肿瘤生成;在人类肿瘤中,PTEN的表达通常是通过启动子甲基化完成的(Jiang and Liu,2009; Yuan and Cantley, 2008).另一个例子是mTOR激酶,一个细胞生长和代谢的协调子同时位于PI3K途径的上下游。
在某些癌细胞内的回路中,mTOR的活化通过负反馈导致PI3K信号的抑制。
这样的话,当癌细胞内的mTOR在药理学水平上(如雷帕霉素)被抑制,相关负反馈的丢失导致PI3K和它的效应子Akt/PKB活性的增加,进而减弱mTOR的抗增殖抑制效应(Sudarsanam and Johnson,2010; O’Reilly et al.,2006).人类癌细胞中可能将证明广泛存在一种或另一种的信号途径减弱负反馈环,作为一种使细胞达到非依赖性增殖的方式。
此外,干扰这种减弱信号可能有利于对有丝分裂信号靶向治疗药物的适应性抵抗的进展。
过度的增殖信号能触发细胞衰老早期研究癌基因的作用确定了这样一个概念,这些基因的不断表达以及已经证明的这个信号所致的蛋白产物导致相应的癌细胞增殖速度增加从而肿瘤生长。
最近的研究破坏了这个概念,由RAS,MYC和RAF等癌蛋白剌激的信号过度表达可以引起来自细胞的抵抗反应,特别是诱导细胞衰老或/和死亡(Collado and Serrano,2010; Evan and d’Addadi Fagagna,2009; Lowe et al.,2004)。
例如,培养的细胞表达高水平的Ras癌蛋白可能进入非增殖但能存活的状态,称为衰老;相反的,如果细胞表达低水平Ras可能避免衰老而进入增殖。
衰老细胞具备的特征,包括增大的细胞质,缺乏增殖标志,以及表达衰老诱导的β-半乳糖酶,这些特征在经设计的过度表达特定癌基因的小鼠组织中大量出现。
(Collado and Serrano, 2010; Evan and d’Addadi Fagagna, 2009)并且在一些人类黑色素瘤病例中普遍存在(Mooi and Peeper,2006)。
这些相互矛盾的表现反应了不同的细胞防御机制,以减弱细胞经历过高水平的特定类型信号。
相应地,癌细胞内的致癌信号可能表现为在最大剌激有丝分裂和避免这些抗增殖防御之间的妥协。
作为代替方案,一些癌细胞可能通过使这些衰老或凋亡诱导回路失去功能而适应高水平的致癌信号。
负性调节细胞增殖逃避生长抑制除了诱导和持续的正性剌激生长信号的标志性能力外,癌细胞应该也具备有力的方案以负性调节细胞增殖;这些方案中的大部分依赖于抑癌基因。
成打的肿瘤抑制子可以在不同途径上限制细胞的生长和增殖,这些是通过这种或那种方式对动物或人类癌症进行特征性抑制发现的;很多这些基因已经通过小鼠实验以获得或失去功能来确实真正是肿瘤抑制子。
两种典型的肿瘤抑制子编码RB(视网膜母细胞相关)和TP53蛋白;它们在两个关键的细胞调节互补回路中起着中央控制节点的作用,控制着决定细胞增殖或代替以活化衰老和凋亡程序。
RB 蛋白整合来自胞内和胞外的不同信号,并相应地,决定细胞是否通过细胞生长和分裂周期(Burkhart and Sage, 2008; Deshpande et al.,2005; Sherr and McCormick, 2002). RB途径存在功能性缺陷的癌细胞缺乏了细胞周期进程的关键性守门员的功能,它的缺席允许细胞持续增殖。