组蛋白修饰 (2)
- 格式:doc
- 大小:16.00 KB
- 文档页数:2

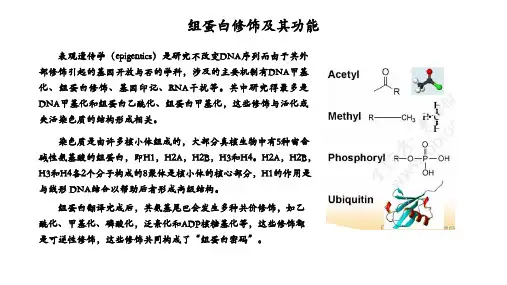
组蛋白科技名词定义中文名称:组蛋白英文名称:histone定义1:一组进化上非常保守的碱性蛋白质,其中碱性氨基酸(Arg,Lys)约占25%,存在于真核生物染色质,分为5种类型(H1,H2A,H2B,H3,H4),后4种各2个形成组蛋白八聚体,构成核小体的核心,占核小体质量的一半。
所属学科:生物化学与分子生物学(一级学科);氨基酸、多肽与蛋白质(二级学科)定义2:存在于真核生物染色质中的一组进化上非常保守的碱性蛋白质。
分为H1、H2A、H2B、H3、H4五种类型,是构成核小体的核心。
所属学科:细胞生物学(一级学科);细胞化学(二级学科)百科名片组蛋白(histones)真核生物体细胞染色质中的碱性蛋白质,含精氨酸和赖氨酸等碱性氨基酸特别多,二者加起来约为所有氨基酸残基的1/4。
组蛋白与带负电荷的双螺旋DNA结合成DNA-组蛋白复合物。
因氨基酸成分和分子量不同,主要分成5类。
组蛋白是真核生物染色体的基本结构蛋白,是一类小分子碱性蛋白质,有五种类型:H1、H2A、H2B、H3、H4,它们富含带正电荷的碱性氨基酸,能够同DNA中带负电荷的磷酸基团相互作用。
目录编辑本段简介histone是指所有真核生物的细胞核中,与DNA结合存在的碱性蛋白质的总称。
分子量约10 000~20 000。
真核生物体细胞染色质中的碱性蛋白质,含精氨酸和赖氨酸等碱性氨基酸特别多,二者加起来约为所有氨基酸残基的1/4。
组蛋白与带负电荷的双螺旋DNA结合成DNA-组蛋白复合物。
因氨基酸成分和分子量不同,主要分成5类。
组蛋白的甲基化修饰主要是由一类含有SET结构域的蛋白来执行的,组蛋白甲基化修饰参与异染色质形成、基因印记、X染色体失活和转录调控等多种主要生理功能,组蛋白的修饰作用是表观遗传学研究的一个重要领域。
组蛋白甲基化的异常与肿瘤发生等多种人类疾病相关,可以特异性地激活或者抑制基因的转录活性。
研究发现,组蛋白甲基转移酶的作用对象不仅仅限于组蛋白,某些非组蛋白也可以被组蛋白甲基转移酶甲基化,这将为探明细胞内部基因转录、信号转导、甚至个体的发育和分化机制提供更广阔的空间。

组蛋白修饰的原理和多样性调控回溯到DNA发现后,基因调控是生物学上研究的一个中心问题。
DNA的双螺旋结构及其内部化学基团的恰当组合提供了一种静态的信息储存和传输方式,基因信息由正核苷酸序列编码。
但是,如何在成千上万条基因信息中选择要表达的基因以及调控它们的水平是一个复杂而值得深入探究的问题。
组蛋白修饰是一种通过染色质结构调控基因表达的机制,是转录调控中极其重要的部分。
本文将深入探讨组蛋白修饰的原理和调节机制,探究它们的多样性、与慢性疾病的关系,并讨论未来研究的可能性。
一、组蛋白修饰的基本原理与类型组蛋白是构成染色质的主要蛋白质,它能包裹DNA,形成核小体。
组蛋白的修饰是指在组蛋白分子上添加化学修饰基团,以调节DNA靠近与远离核小体的程度,从而调节基因转录调控。
组蛋白修饰的类型可以分为三种:(1)乙酰化:添加乙酰基团到组蛋白中。
它可以去除正电荷,从而缓解组蛋白与DNA间的电性吸引力,使得DNA更容易解开并与转录因子结合。
(2)甲基化:添加甲基基团到组蛋白中。
这样做会增加组蛋白电负性,并利用静电排斥作用使核小体解开,便于RNA聚合酶等大分子访问DNA模板。
(3)泛素化:添加小的有机分子泛素到组蛋白中。
在泛素化的过程中,泛素蛋白酰化酶活化泛素,并与组蛋白链接。
泛素化作用是将修改组蛋白标记化,从而增加蛋白水溶性,并用于降解、定位和其他调控活动。
二、组蛋白修饰的调节机制与多样性组蛋白修饰具有高度的可调节性,可以根据特定的信号表达阶段和生物过程进行调节。
这种调控主要发生在特定的酶和配体之间,它们可以在水相中反应,控制组蛋白分子解开和重组的作用。
组蛋白修饰的调节和作用机制具有多样性,其中的一个原因是组蛋白修饰基团非常多,有超过百种的不同修饰。
此外,修饰在特定位置的成功完成通常与质量和时间上的特定要求有关。
三、组蛋白修饰与慢性疾病组蛋白修饰的不良调节可能会导致慢性疾病的发生。
一些疾病的发病率与组蛋白修饰的异常水平有关。

组蛋白的修饰及其在基因调控中的作用组蛋白是染色体结构的重要组成部分,它们能够与DNA分子形成核小体。
组蛋白能够通过一系列的化学修饰来调节染色体结构和功能,影响DNA的转录和表达。
在这篇文章中,我们将探讨组蛋白的修饰以及它在基因调控中的作用。
一、组蛋白的修饰组蛋白的修饰主要包括翻译后修饰和核糖体蛋白(histone variant)替代。
翻译后修饰是指组蛋白通过化学修饰改变蛋白质的性质,包括乙酰化、甲基化、泛素化、磷酸化和丝氨酸/苏氨酸磷酸化等。
这些化学修饰能够改变组蛋白的电荷、结构和亲和力,调节染色体的结构和功能。
乙酰化是最常见的一种组蛋白修饰方式。
乙酰化改变组蛋白的电荷,使其变得更为亲水性,从而影响组蛋白的结构和功能。
甲基化则是另一种重要的修饰方式,它通过添加甲基基团改变组蛋白的结构和电子表现。
甲基化能够产生不同的效应,包括启动基因转录、沉默基因表达、维持基因沉默等。
除了翻译后修饰,核糖体蛋白(histone variant)替代也是组蛋白修饰的一种方式。
核糖体蛋白与核小体结构紧密相关,由于它们的不同序列和独特的性质,它们能够影响染色体的结构和功能。
二、组蛋白的修饰对基因调控的作用组蛋白的修饰对基因调控有着重要的作用。
在 DNA 转录和表达过程中,组蛋白修饰是一个重要的关键步骤。
不同的组蛋白修饰方式会对基因的转录和表达产生不同的影响。
例如,乙酰化能够促进染色体开放,使 RNA聚合酶更容易接触到需要转录的 DNA和核小体。
相反,去乙酰化能够使染色体更加紧密,阻碍基因的表达。
这就是为什么组蛋白乙酰化和去乙酰化在细胞增殖、凋亡和分化过程中发挥关键作用的原因之一。
组蛋白的甲基化是另一个影响基因调控的重要因素。
高度甲基化的组蛋白通常与基因沉默有关,而低度甲基化则通常与基因启动有关。
甲基化水平的变化可以调节基因表达的程度,影响细胞的分化和功能。
最近有研究表明,组蛋白衍生物在恶性肿瘤和其他疾病的发展中起着重要的作用。

一、即将表达基因启动子中的组蛋白修饰研究显示,在人类胚胎干细胞中有3/4基因启动子区的组蛋白被活化修饰,并通过DNA聚合酶Ⅱ起始转录。
但是只有其中的一半能够生成可检测到的转录本。
例如,H3K4me3出现在胚胎干细胞大约80%的启动子区。
其中的许多区域并不能产生目前技术可检测到的全长转录本。
在许多情况下这些启动子区也会有抑制性表观遗传标记H3K27me3,表现为二价性。
染色质二价域多与胚胎干细胞中的分化相关基因关联,在上文中我们已经讨论过这一点(图3—4)。
有趣的是,大约一半的二价染色质域都有三个转录因子0ct4、Nanog、Sox2中至少一个转录因子的结合位点。
二价染色质域多有PcG结合。
然而,尽管胚胎干细胞中PRC1和PCR2会同时出现在许多启动子区,也有一些启动子只有一个复合物。
在胚胎干细胞中,根据PRC1、PCR2同时出现或只有PCR2出现,可将二价染色质域分为两类。
有趣的是,出现两种复合物的启动子区可以在分化过程中有效地保持PcG介导的染色质结构。
非典型性PCR2同样也出现在人类胚胎干细胞中。
这种复合物中包含EZH1——一种EZH2的同源物。
含有EZH1的复合物选择性调控发育相关关键基因,抑制这些基因的表达可以阻止胚胎干细胞的分化。
基因功能丧失实验证实PRC2(和H3K27me3)在胚胎干细胞中发挥着至关重要的作用。
PRC2成分的缺失可以导致胚胎干细胞分化缺陷。
然而,纯合删除Eed、Suz12或Ezh2后,小鼠囊胚中仍可分离出胚胎干细胞并能够在体外传代。
最近对Jarid2(与Jarid1家族密切相关)的研究显示Jarid2能调控PRC2的催化活性及其定位,从而可以精细调控H3K27me3水平。
已知Jarid2在胚胎干细胞和诱导多能干细胞中高表达并对分化至关重要,但似乎与胚胎干细胞的自我更新无关。
最近,有表观遗传学研究试图鉴定H3K4me3、H3K27me3之外的二价染色质域。
目前已经在胚胎干细胞编码发育调控因子的二价启动子区域中鉴定出了H3K9me3。

表观遗传学——甲基化,组蛋⽩修饰参考资料:1.2.3.1.什么是表观遗传学?举个例⼦:同卵双⽣的双胞胎个体,从遗传学⾓度说他们的DNA序列是⼀致的,但多种表型存在⼀些差异。
经典的孟德尔遗传定律和⽣物学表型之间还存在另外⼀层调控因素,即表观遗传。
表观遗传(Epigenetics)是指DNA序列未发⽣变化,但基因表达却发⽣了可遗传改变。
这种改变的特点:可遗传性;可逆性;没有DNA序列的变化。
可逆性:表观遗传的修饰⽅式可以在某些因素的条件下被去除。
这使得通过调控表观遗传来影响⽣物学性状称为可能。
表观遗传改变主要从四个层⾯调控基因表达(1)DNA甲基化:DNA共价结合甲基基团,使相同序列等位基因处于不同修饰状态;(2)组蛋⽩修饰:通过对结合DNA的组蛋⽩进⾏不同的化学修饰实现对基因表达的调控;(3)染⾊质重塑:通过改变染⾊质的空间构象实现对基因表达的调控;(4)⾮编码RNA的调控:RNA可通过某些机制实现对基因转录和转录后的调控。
2.DNA甲基化DNA序列上特定的碱基在DNA甲基转移酶(DNMT)的催化作⽤下,以S-腺苷甲硫氨酸(SAM)作为甲基供体,通过共价结合的⽅式获得⼀个甲基基团的化学修饰过程。
最常见能够被甲基化的碱基是胞嘧啶(C),此外腺嘌呤,鸟嘌呤也可以被甲基化。
下图是5甲基胞嘧啶。
在4位上是⼀个胺基,5位上没有其他基团的结合。
在SAM提供甲基的情况下,在DNMT(DNA甲基转移酶)的作⽤下,甲基从SAM转移到胞嘧啶的5位,成为了5甲基胞嘧啶。
DNA甲基转移酶根据序列的同源性和功能,真核⽣物DNA甲基化转移酶主要分为:Dnmt 1, Dnmt2 和Dnmt 3.Dnmt 1参与序列甲基化的维持; Dnmt 3主要作⽤是从头甲基化。
a图左边的序列通过Dnmt 3的作⽤转化为右边的序列,这两个序列的差别是,所有的C(互补链上)被甲基化,这是⼀种重头甲基化的⽅式。
b图中左边的序列其中⼀条链上C位点被甲基化,互补链上的C没有甲基化,可以在甲基化维持酶(Dnmt 1)的作⽤下可以使得另外⼀条⾮甲基化的链进⾏甲基化。
组蛋白修饰2019版高中生物学必修二说,DNA组蛋白修饰也会影响基因的表达:那么,什么是组蛋白修饰?如何影响基因的表达?天然的DNA分子很长,尤其是在真核生物中,例如人类的DNA长度为2m(Bloom et al., 2010)。
将如此庞大的遗传信息放入7μm 左右的细胞核中,就需要将长DNA分子包装成更紧凑、更致密的高度压缩结构。
这个结构叫做染色体,染色体是染色质高度螺旋后的形态。
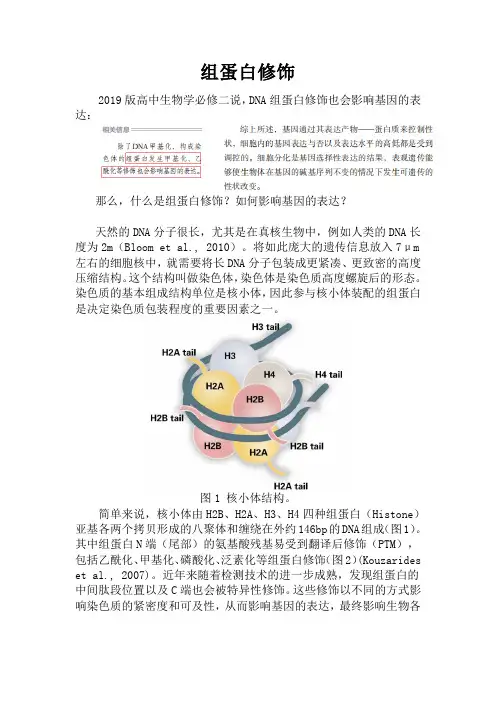
染色质的基本组成结构单位是核小体,因此参与核小体装配的组蛋白是决定染色质包装程度的重要因素之一。
图1 核小体结构。
简单来说,核小体由H2B、H2A、H3、H4四种组蛋白(Histone)亚基各两个拷贝形成的八聚体和缠绕在外约146bp的DNA组成(图1)。
其中组蛋白N端(尾部)的氨基酸残基易受到翻译后修饰(PTM),包括乙酰化、甲基化、磷酸化、泛素化等组蛋白修饰(图2)(Kouzarides et al., 2007)。
近年来随着检测技术的进一步成熟,发现组蛋白的中间肽段位置以及C端也会被特异性修饰。
这些修饰以不同的方式影响染色质的紧密度和可及性,从而影响基因的表达,最终影响生物各方面的生理和发育过程,是真核生物调节基因表达最重要的表观遗传调控方式之一(Lawrence et al., 2016)。
由于组蛋白修饰的类型众多,回顾一下组蛋白修饰的描述规则:组蛋白结构+氨基酸名称+氨基酸位置+修饰类型。
例如:H3K4ac代表H3组蛋白的第4位赖氨酸的乙酰化;H2AK119ub1代表H2A组蛋白的第199位赖氨酸的单泛素化。
图2 显示组蛋白尾部翻译后修饰的示意图(Lawrence et al., 2016)。
数字显示每个修饰的位置,字母表示每个修饰位点的氨基酸(K=赖氨酸,R=精氨酸,S=丝氨酸,T=苏氨酸)。
颜色展示了每个氨基酸残基具体的修饰类型(绿色=甲基化,粉色=乙酰化,绿松石=磷酸化,米色=泛素化)。
组蛋白修饰是目前生命科学研究的热点。

组蛋白的主要修饰类型组蛋白是一种存在于细胞核中的蛋白质,具有调控基因表达和维持染色体结构的重要功能。
组蛋白的修饰是指对其进行化学修饰,通过改变组蛋白的结构和功能,从而影响染色体的结构和基因的表达。
组蛋白的主要修饰类型包括甲基化、乙酰化、磷酸化和泛素化等。
本文将分别介绍这些主要修饰类型及其在基因表达调控中的作用。
一、甲基化甲基化是指在组蛋白上添加甲基基团。
甲基化通常发生在组蛋白N 端的赖氨酸残基上,也可以发生在其他氨基酸残基上。
甲基化可以通过甲基转移酶催化完成。
甲基化可以影响染色体的结构和基因的表达。
在某些情况下,甲基化可以抑制基因的转录,从而起到基因沉默的作用;在另一些情况下,甲基化可以促进基因的转录,起到激活基因的作用。
二、乙酰化乙酰化是指在组蛋白上添加乙酰基团。
乙酰化通常发生在组蛋白的赖氨酸残基上,通过组蛋白乙酰转移酶催化完成。
乙酰化可以改变组蛋白的电荷性质,从而影响其与DNA的结合能力,进而影响基因的转录激活。
此外,乙酰化还可以增加组蛋白的稳定性,促进染色质的松弛,从而有利于基因的转录。
三、磷酸化磷酸化是指在组蛋白上添加磷酸基团。
磷酸化通常发生在组蛋白的丝氨酸、苏氨酸或酪氨酸残基上,通过激酶催化完成。
磷酸化可以改变组蛋白的结构和功能,从而影响染色体的结构和基因的表达。
在某些情况下,磷酸化可以促进染色质的松弛,增加基因的转录活性;在另一些情况下,磷酸化可以抑制基因的转录。
四、泛素化泛素化是指在组蛋白上添加泛素基团。
泛素化通常发生在组蛋白的赖氨酸残基上,通过泛素连接酶催化完成。
泛素化可以标记组蛋白,促使其被降解或参与细胞过程。
泛素化还可以影响组蛋白的相互作用和结构,从而影响染色体的结构和基因的表达。
组蛋白的甲基化、乙酰化、磷酸化和泛素化是其主要的修饰类型。
这些修饰可以改变组蛋白的结构和功能,从而影响染色体的结构和基因的表达。
通过对这些修饰的研究,可以更好地理解基因表达调控的机制,并为相关疾病的治疗提供新的思路和方法。

表观遗传学的试题例析肖安庆1颜培辉2(1广东省深圳市盐田高级中学深圳518083;2广东省深圳市教育科学研究院深圳51800)摘要通过高考模拟试题例析了DNA甲基化、组蛋白修饰与染色质重塑、基因组印记、染色体失活和非编码RNA调控5种表观遗传学方式。
关键词表观遗传学例析高考模拟题表观遗传学是指生物体基因序列保持不变、但基因表达和表现型发生可遗传的现象。
该知识点是2017年版高中生物学课程标准新增加的重要概念,对学生形成正确的生命观念和科学思维具有重要意义。
笔者收集和改编了有关表观遗传的试题,分析了DNA 甲基化、组蛋白修饰与染色质重塑、基因组印记、染色体失活和非编码RNA调控这5种方式。
1DNA甲基化DNA甲基化是指在DNA甲基化转移酶催化下,将DNA中的某些胞嘧啶甲基化的过程,是表观遗传学最常见的方式。
例1(北京市海淀区2018届高三第二次模拟考试第2题)许多基因的启动子内富含CG重复序列。
若其中部分胞嘧啶甲基化转化成5-甲基胞嘧啶,就会抑制基因的转录。
下列叙述中,正确的是(C)A.DNA单链上相邻的C和G之间通过氢键连接B.胞嘧啶甲基化导致表达的蛋白质结构改变C.胞嘧啶甲基化会阻碍RNA聚合酶与启动子结合D.基因的表达水平与基因的甲基化程度无关解析:本题以DNA甲基化抑制基因的转录为背景,考查了学生理解能力和获取信息的能力。
在DNA 单链上相邻的C和G之间通过“脱氧核糖一磷酸一脱氧核糖”连接,而不通过氢键连接;胞嘧啶甲基化导致的是基因转录被抑制,不能指导蛋白质合成;由于基因的表达水平与基因的转录有关,所以与基因的甲基化程度有关;从题干中获取有效信息是解决本题C选项的关键。
题干中“胞嘧啶甲基化会抑制基因的转录”这一信息,可理解为:阻碍RNA聚合酶与启动子结合,C正确'2组蛋白修饰与染色质重塑组蛋白是染色体上基本的结构蛋白。
组蛋白的修饰有甲基化、乙酰化与去乙酰化等方式。
这些修饰方式与基因的失活与开启、基因转录的调控、细胞周期和死亡等生理活动有关'染色质重塑是指染色质位置和结构的变化。

组蛋白翻译后修饰的类型组蛋白翻译后修饰的类型组蛋白和组蛋白翻译后修饰通过影响染色质的结构来调控基因的表达,目前已成为表观遗传学研究的焦点之一。
染色质是一系列核小体相互连接成的念珠状结构。
核小体的核心是由组蛋白H2A 、H2B、H3 、H4各两个分子构成的八聚体, 在八聚体的表面缠绕有圈的双螺旋DNA。
相邻的两个核小体之间由DNA连接, 称为纤丝(fiber), 在纤丝部位结合有组蛋白分子H1。
在组蛋白H1存在时,核小体之间紧密接触,形成直径为10nm的纤维状结构。
这就是染色体构型变化的一级结构。
在染色质中, DNA 和组蛋白是染色质的稳定成分,组蛋白与DNA的含量之比接近1∶1 。
组蛋白是染色质的主要蛋白质成分,通过带正电荷的氨基末端区域与带负电荷的DNA骨架相互作用, 对基因的表达有重要调控作用。
染色体活性调控的一个重要的机制是组蛋白的可逆共价修饰,通常容易发生在组蛋白H3和H4的N端尾部,组蛋白H2A和H2B的N和C末端,包括甲基化,乙酰化,磷酸化,ADP-核糖基化,泛素化和小分子类泛素化修饰,这些翻译后修饰可改变组蛋白与DNA之间的相互作用,影响调控复合物与染色质结合的能力及染色质重塑,进而影响着细胞的多种功能。
⒈甲基化组蛋白甲基化是由组蛋白甲基化转移酶(histonemethyltransferase,HMT)完成的。
甲基化可发生在组蛋白的赖氨酸和精氨酸残基上,而且赖氨酸残基能够发生单、双、三甲基化,而精氨酸残基能够单、双甲基化,这些不同程度的甲基化极大地增加了组蛋白修饰和调节基因表达的复杂性。
甲基化的作用位点在赖氨酸(Lys)、精氨酸(Arg)的侧链N原子上。
组蛋白H3的第4、9、27和36位,H4的第20位Lys,H3的第2、l7、26位及H4的第3位Arg都是甲基化的常见位点。
研究表明·,组蛋白精氨酸甲基化是一种相对动态的标记,精氨酸甲基化与基因激活相关,而H3和H4精氨酸的甲基化丢失与基因沉默相关。
简述组蛋白的主要修饰类型并说出其功能组蛋白是染色质的基本组成部分,在细胞核内包含DNA序列,与DNA序列的紧密度及顺序相关联。
然而,不同的细胞类型、生命周期和环境因素会对组蛋白进行不同的修饰,进而影响染色质的结构和功能。
组蛋白修饰可以分为两类:一类是通过化学修饰改变染色质基因后果的共价修饰,另一类是针对其表现和定位调整组分交流的非共价修饰。
1. 共价修饰(1)糖基化糖基化的过程可以分为两类:N-糖基化和O-糖基化。
N-糖基化是将糖基转移到组蛋白丝氨酸或谷氨酰胺上,而O-糖基化是将糖基转移到组蛋白羟赖氨酸残基上。
糖基化可以在某种程度上改变组蛋白的空间构象,影响其结构和功能。
甲基化主要发生在赖氨酸的侧链上,另外也有少部分发生在精氨酸的侧链上。
组蛋白的甲基化修饰通常与基因表达水平和染色质结构有关,且与癌症、神经退行性疾病和心血管疾病等疾病的发生有关。
(3)乙酰化乙酰化一般是使组蛋白染色质更具松散性,加强基因转录,并且与代谢调控有关。
特别是,组蛋白乙酰化通常与染色质转录激活状态有关,因此在基因的组织特异性和细胞发育过程中起着重要的作用。
(4)磷酸化磷酸化修饰可以影响组蛋白的结构、位置和交流。
主要是通过改变电荷状态,促进发生组蛋白和其他分子之间的相互作用和响应,影响基因表达和细胞增殖等生物过程。
(1)核小体重排核小体重排是一种有趣的修饰,涉及组蛋白结合于DNA至一定距离。
目的是在溶液中重新安排DNA和组蛋白构成的核小体,在生理和病理过程中起到了平衡和适应的作用。
一些反复中度的DNA包装缺陷可能导致健康问题。
(2)RNA介导的修饰RNA介导的修饰是一种新型的非共价修饰方式,因其调节基因组表达而受到广泛关注。
这种修饰是利用非编码RNA或获得性RNA靶向某些组蛋白质类分子的整合,改变其位置和交流形式,从而影响基因组活动并调用不同的基因网络。
总之,组蛋白不同的修饰类型可与每个个体的基因组变异和外部环境作用或毒素有关,并可以影响市场疾病的治疗和预防。
常见组蛋白修饰1、H3K27ac组蛋白H3上的第27位赖氨酸残基发生乙酰化,与较高的转录激活有关,因此被定义为活性增强子信号,H3K27ac在TSS(转录起始位点)的近端远端都有发现。
1.1、赖氨酸的乙酰化与去乙酰化蛋白质通常在赖氨酸残基上发生乙酰化,这个反应依赖于乙酰辅酶A作为乙酰基团的供体。
在组蛋白乙酰化和去乙酰化过程中,组蛋白在N-末端赖氨酸残基上乙酰化和去乙酰化,是基因调控的一部分。
这些反应是由具有组蛋白乙酰转移酶(HAT)或组蛋白去乙酰化酶(HDAC)活性的酶催化的,尽管HATs和HDACs也可以改变非组蛋白的乙酰化状态。
通过乙酰化和去乙酰化对转录因子、效应蛋白、分子伴侣(molecular chaperones)和细胞骨架蛋白的调控是一种重要的翻译后调控机制。
这些调节机制类似于激酶和磷酸酶作用下的磷酸化和去磷酸化。
蛋白质的乙酰化状态不仅可以改变其活性,而且最近有研究表明,这种翻译后修饰还可以与磷酸化、甲基化、泛素化、素酰化等相互作用,以动态控制细胞信号转导。
1.2、与H3K4me1的平衡由于H3K27ac和H3K27me3修饰在组蛋白尾部的相同位置,它们相互拮抗。
H3K27ac常用于寻找活性增强子和平衡增强子,这些增强子是由含有所有增强子的另一个增强子标记H3K4me1减去的1.3、基因上调乙酰化通常与基因的上调有关。
H3K27ac是一个积极的增强标记。
它存在于基因的远端和近端区域。
它在转录起始位点(TSS)中富集。
H3K27ac与H3K27me3共享一个位置,它们之间存在拮抗作用。
2、H3K27me3H3K27me3是组蛋白H3上的27位赖氨酸发生三甲基化,这种三甲基化通过形成异染色质区域下调附近基因。
2.1 机制与功能在赖氨酸27上放置抑制标记需要通过转录因子募集染色质调节子。
这些修饰物要么是组蛋白修饰复合物(这些复合物可以共价修饰组蛋白以在核小体周围移动并打开染色质),要么是染色质重塑复合体(涉及核小体的移动而无需直接修饰它们)。
组蛋白修饰,英文histone modification
H3·H4 的乙酰化可打开一个开放的染色质结构, 增加基因的表达。
转录共同激活物如CBPöP 300、PCA F 实质上是体内的组蛋白乙酰基转移酶(HA T)。
相反, HDAC 参与组成转录共同抑制复合物, 已发现的两个共同抑制复合物S IN 3、M i22NHRD(核小体重塑蛋白去乙酰基酶) 都含有HDAC1、HDAC2。
S IN 3 的组成为核心(HDAC1、HDAC2、RBA P46öRBA P48 ) + S IN 3AöS IN 3B、SA P30öSA P18共同构成。
S IN 3 复合物通过组分S IN 3A 与序列特异性转录因子或共同抑制物包括mael2max, 核激素受体N 2CORöSMRT、甲基化CPG 粘附蛋白(N ECP2、MBD2)相互作用。
所起作用
M i22NHRD 由核心(HDAC1、HDAC2、RBA P46öRBA P48) + M i2、M TA 1öM TA 2、MBD3 组成, 其中MBD3 含有MBD 样序列, 与甲基化DNA 有低亲和力, 分析发现MBD3 与甲基化有关的氨基酸被置换, 由此推测MBD3 与MBD2 相互作用而使M i22NURD 与甲基化DNA 结合。
由此看出, DNA 甲基化和组蛋白去乙酰化协同作用共同参与转录阻遏。
此外,M i22NURD 还有染色质重塑活性, 所以S IN 3 和M i22 NURD 可能分别在长期和短期转录阻遏调节中起作用。
组蛋白修饰形式
在哺乳动物基因组中,组蛋白则可以有很多修饰形式. 一个核小体由两个H2A,两个H2B,两个H3,两个H4组成的八聚体和147bp缠绕在外面的DNA组成. 组成核小体的组蛋白的核心部分状态大致是均一的, 游离在外的N-端则可以受到各种各样的修饰, 包括组蛋白末端的乙酰化, 甲基化, 磷酸化, 泛素化,ADP核糖基化等等. ,这些修饰都会影响基因的转录活性。
组蛋白修饰方式
1.甲基化组蛋白甲基化是由组蛋白甲基化转移酶(histonemethyl transferase,HMT)完成的。
甲基化可发生在组蛋白的赖氨酸和精氨酸残基上,而且赖氨酸残基能够发生单、双、三甲基化,而精氨酸残基能够单、双甲基化,这些不同程度的甲基化极大地增加了组蛋白修饰和调节基因表达的复杂性。
甲基化的作用位点在赖氨酸(Lys)、精氨酸(Arg)的侧链N原子上。
组蛋白H3的第4、9、27和36位,H4的第20位Lys,H3的第2、l7、26位及H4的第3位Arg都是甲基化的常见位点。
研究表明·,组蛋白精氨酸甲基化是一种相对动态的标记,精氨酸甲基化与基因激活相关,而H3和H4精氨酸的甲基化丢失与基因沉默相关。
相反,赖氨酸甲基化似乎是基因表达调控中一种较为稳定的标记。
例如,H3第4位的赖氨酸残基甲基化与基因激活相关,而第9位和第27位赖氨酸甲基化与基因沉默相关。
此外,H4—K20的甲基化与基因沉默相关,H3—K36和H3—K79的甲基化与基因激活有关。
但应当注意的是,甲基化个数与基因沉默和激活的程度相关。
2.乙酰化组蛋白乙酰化主要发生在H3、H4的N端比较保守的赖氨酸位置上,是由组蛋白乙酰转移酶和组蛋白去乙酰化酶协调进行。
组蛋白乙酰化呈多样性,核小体上有多个位点可提供乙酰化位点,但特定基因部位的组蛋白乙酰化和去乙酰化是以一种非随机的、位置特异的方式进行。
乙酰化可能通过对组蛋白电荷以及相互作用蛋白的影响,来调节基因转录。
早期对染色质及其特征性组分进行归类划分时就有人总结指出:异染色质结构域组蛋白呈低乙酰化,常染色质结构域组蛋白呈高乙酰化。
最近有研究发现,某些HAT复合
物含有一些常见的转录因子,某些HDAC复合物含有已被证实的阻遏蛋白。
这些发现支持了高乙酰化与激活基因表达、低乙酰化与抑制基因表达有关的看法。
3.组蛋白的其他修饰方式相对而言,组蛋白的甲基化修饰方式是最稳定的,所以最适合作为稳定的表观遗传信息。
而乙酰化修饰具有较高的动态,另外还有其他不稳定的修饰方式,如磷酸化、腺苷酸化、泛素化、ADP核糖基化等等。
这些修饰更为灵活的影响染色质的结构与功能,通过多种修饰方式的组合发挥其调控功能。
所以有人称这些能被专识别的修饰信息为组蛋白密码。
这些组蛋白密码组合变化非常多,因此组蛋白共价修饰可能是更为精细的基因表达方式。
另外,研究发现H2B的泛素化可以影响H3K4和H3K79的甲基化,这也提示了各种修饰间也存在着相互的关联。
组蛋白修饰与基因调控
基因表达是一个受多因素调控的复杂过程.组蛋白是染色体基本结构-核小体中的重要组成部分,其N-末端氨基酸残基可发生乙酰化、甲基化、磷酸化、泛素化、多聚ADP糖基化等多种共价修饰作用.组蛋白的修饰可通过影响组蛋白与DNA双链的亲和性,从而改变染色质的疏松或凝集状态,或通过影响其它转录因子与结构基因启动子的亲和性来发挥基因调控作用.组蛋白修饰对基因表达的调控有类似DNA遗传密码的调控作用.
组蛋白修饰与DNA甲基化之间的关系
在引起基因沉默的过程中,沉默信号(DNA甲基化、组蛋白修饰、染色质重新装配)是如何进行的?谁先谁后?这是一个“鸡和蛋”的问题,目前仍处于研究阶段,还没有定论。
研究发现DNA甲基化和组蛋白乙酰化是一个相互促进、加强的过程,如许多HDAC可以和DNMTl、3a、3b相互作用;而甲基化CpG结合蛋白—2(methylcytosinebindingprotein—2,MeCP—2)又可以和HDAC相互作用。
这种作用方式提示着这两种方式中任何一种的存在都可以引起另一种修饰方式的起始。
沉默信号如何进行?它们发生的顺序如何?早期的研究多来源于对非哺乳动物生物的研究。
Tamaru在链孢霉属(Neurospora)CTaSSa中研究发现,H3K9组蛋白甲基化转移酶的突变,会引起DNA甲基化的丢失,这暗示着组蛋白甲基化可以起始DNA甲基化。
Tariq在Arabidopsis中研究也发现,CpNpG甲基化依赖于组蛋白甲基化。
以上证据都暗示着,组蛋白甲基化对DNA甲基化有指导作用。
然而在哺乳动物细胞中,这种现象还有待于进一步研究。
而从一些结果可以看出,在哺乳动物中,组蛋白修饰似乎又是DNA甲基化发生以后的事件。
但Bachman在哺乳动物中敲除p16基因时发现,染色质修饰并不完全依赖于最初的DNA甲基化。
同时,Mutskov和Felsenfeld的结果也支持了这个理论,他们认为组蛋白修饰是ILR2基因沉默的早期事件,启动子区的甲基化是一个逐步增加的过程,DNA甲基化的建立是为了长期维持基因沉默,而不是起始它。
从以上的结果可以看出,表观遗传学过程是复杂的和多层面的,不同的表观遗传修饰也可能存在区域或信号途径的特异性,有很多未知的东西有待于进一步研究。