实验题专题训练
- 格式:doc
- 大小:150.50 KB
- 文档页数:6
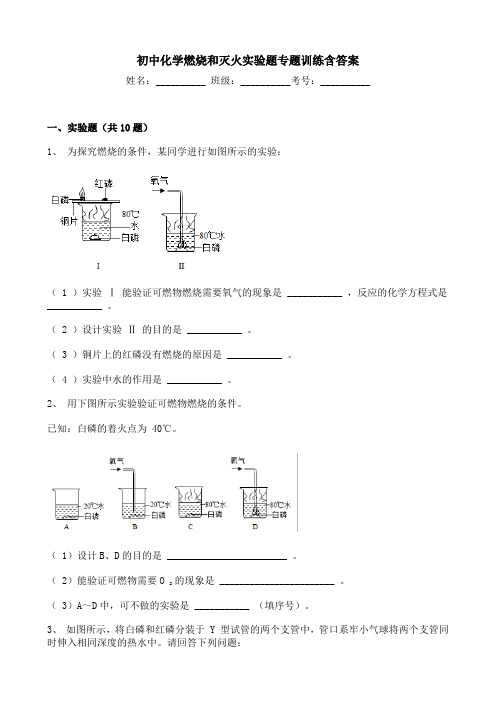
初中化学燃烧和灭火实验题专题训练含答案姓名:__________ 班级:__________考号:__________一、实验题(共10题)1、为探究燃烧的条件,某同学进行如图所示的实验:( 1 )实验Ⅰ 能验证可燃物燃烧需要氧气的现象是 ___________ ,反应的化学方程式是___________ 。
( 2 )设计实验Ⅱ 的目的是 ___________ 。
( 3 )铜片上的红磷没有燃烧的原因是 ___________ 。
( 4 )实验中水的作用是 ___________ 。
2、用下图所示实验验证可燃物燃烧的条件。
已知:白磷的着火点为40℃。
( 1)设计B、D的目的是 ________________________ 。
的现象是 _______________________ 。
( 2)能验证可燃物需要O2( 3)A~D中,可不做的实验是 ___________ (填序号)。
3、如图所示,将白磷和红磷分装于 Y 型试管的两个支管中,管口系牢小气球将两个支管同时伸入相同深度的热水中。
请回答下列问题:( 1 )燃烧的是 ____ (填“a”、“b” 或“c” )处,该处燃着的磷会很快熄灭,原因可能是 ____ (填序号)。
A .温度降低B .氧气耗尽C .试管内产生了二氧化碳气体D .着火点升高( 2 )管口的小气球可以防止 __________ (填名称)进入空气,从而使该实验绿色化。
( 3 )热水的作用是 ____________________ 和 _____________________ 。
4、“对比实验”是科学探究的重要方法,根据下列所示的实验示意图回答问题。
( 1 )硫酸铜溶液呈蓝色,为探究哪种粒子使溶液显蓝色,可选择用作对比的试剂是 _____ 溶液。
( 2 )如图二,现象①② 说明物质燃烧需要与 _____ (填名称)接触,实验中发生了异常,白磷燃烧时有火星飞溅到红磷上,引起红磷燃烧,证明了燃烧的另一个条件是 _____ 。

综合化学实验专题练习1、(06全国)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。
请选用适当的学化试剂和实验用品。
用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。
⑴A是制取CO2的装置。
写出A中发生反应的化学方程式⑵填写表中空格仪器加入试剂加入试剂的目的B 饱和NaHCO3溶液CD⑶.写出过氧化钠与二氧化碳反应的化学方程式⑷.试管F中收集满气体后,下一步实验操作是2、(96年全国)在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物.该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉.这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称"引火铁".请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和"引火铁".实验中必须使用普通铁粉和6摩/升盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去).填写下列空白:(1)实验进行时试管A中应加入的试剂是;烧瓶B的作用是;烧瓶C的作用是;在试管D中收集得到的是.(2)实验时,U型管G中应加入的试剂是;长颈漏斗H中应加入.(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母) .(4)烧瓶I中发生的反应有时要加入少量硫酸铜溶液,其目的是.(5)试管E中发生反应的化学方程式是.(6)为了安全,在E管中的反应发生前,在F出口处必须;E管中的反应开始后,在F出口处应.3、(99年全国)为了测定人体新陈代谢呼出气体中CO2的体积分数,某学生课外小组设计了如下图的实验装置。
实验中用过量NaOH溶液吸收气体中的CO2,准确测量瓶I中溶液吸收CO2后的增重及剩余气体的体积(实验时只用嘴吸气和呼气),请填空。
(1)图中瓶II的作用是______________________________。
(2) 对实验装置尚有如下A、B、C、D四种建议,你认为合理的是_________________。

九年级生物实验探究题专题练习题实验题一:观察鱼的呼吸问题描述在一定时间内观察鱼的呼吸现象,找出鱼的呼吸方式及呼吸器官。
实验材料- 水缸- 活鱼- 观察笔记本实验步骤1. 准备一个水缸,并加入适量的水。
2. 在水缸中放入活鱼,并记录下观察开始的时间。
3. 观察一段时间内鱼的呼吸现象,并记录下观察结果。
实验记录- 观察开始时间:[填入具体时间]- 观察结果:[填入观察到的鱼的呼吸方式及呼吸器官现象]实验题二:植物光合作用研究问题描述通过观察植物的光合作用现象,了解光合作用的原理和过程。
实验材料- 水培的绿色叶片植物- 透明塑料袋- 水- 磁力搅拌器实验步骤1. 准备一片健康的绿色叶片植物,并将其放入一个透明塑料袋中。
2. 加入适量的水,并将塑料袋密封。
3. 将塑料袋放置在磁力搅拌器上,以保持透明塑料袋内的氧气含量恒定。
4. 观察一段时间内植物的光合作用现象,并记录下观察结果。
实验记录- 观察结果:[填入观察到的植物光合作用现象]- 结论:[根据观察结果得出的结论]实验题三:动物生长速度比较问题描述通过观察不同动物的生长速度,了解不同动物的生长特点。
实验材料- 小鸟、小鱼和小狗实验步骤1. 准备一只小鸟、一条小鱼和一只小狗。
2. 记录下小鸟、小鱼和小狗的初始大小。
3. 每天观察一段时间内动物的生长情况,并记录下观察结果。
实验记录- 观察结果:[填入不同动物的生长速度比较结果]以上是九年级生物实验探究题专题练习题的内容,希望能帮助您进行相关实验研究。
如有其他问题,请随时咨询。

高中物理实验专题训练——观察电容器的充、放电现象一、实验题某同学用如图所示的电路观察电容器的充电放电现象。
所用器材有:电源E、电流表A、电压表V、电容器C、定值电阻R、单刀双掷开关S、导线若干。
(1)将图中的电流表换成电流传感器,可以在电脑端记录电流随时间变化的图线。
先将开关接1,待电路稳定后再接2。
已知电流从左向右流过电阻R时为正,则与本次实验相符的I-t图像是_________。
A. B.C. D.(2)将图中的电压表换成电压传感器,可以在电脑端记录放电过程中电压随时间变化的图线,如图所示。
已知开关接2瞬间开始计时,此时电压传感器记录数据为U m,利用数据处理软件得到U-t图线与坐标轴围成的面积为S0。
根据该实验数据曲线可以粗测实验中电容器的电容C=_________。
(用题中已知物理量U m、R和S0表示)【答案】(1)A(2)S0U m R【解析】【小问1详解】第一次探究过程为先给电容器充电,后电容器通过R放电,给电容器充电过程中电流从左向右流过电阻R,即为正向电流,由于充电后电容器下极板带正电,电容器通过R放电时,电流从右向左流过电阻R,即为负。
故选A。
【小问2详解】根据I=q t变形可得q=It=U R t而U-t图像与坐标轴所围面积为S0,则q=S0 R故有S0=qR=C U m R 则电容为C=S0 U m R某同学用如图甲所示电路研究电容器的放电规律,先将开关S合向1,待电路稳定后再将开关S合向2,通过电流传感器描绘出电容器放电电流I随时间t变化的规律如图乙所示。
图甲中电源两端提供稳定电压U=6V,数出图乙中图线与两坐标轴所围区域方格数约为42。
(电流I表示单位时间内通过导体横截面的电荷量,即I=qt)(1)放电过程中,通过定值电阻R的电量为Q=______C,由此求得电容器的电容为C=______F。
(2)若仅将定值电阻换用更大阻值的电阻重新实验,则电容器放电的时间会______(填“变长”、“变短”或“不变”),在放电过程中,电容器两端的电压的减少量与电容器的带电量减少量的比值会______(填“变大”、“变小”或“不变”)。
( )化学实验专题1、化学仪器及使用方法,化学实验基本操作1、下列有关试验操作的叙述正确的是 ( ) A .实验室常用右图所示的装置制取少量的乙酸乙酯 B .用 50mL 酸式滴定管可准确量取 25.00mL KMnO 4 溶液C . 用量筒取 5.00mL 1.00mol·L -1 盐酸于 50mL 容量瓶中,加水稀释至刻度,可配制 0.100 mol·L -1 盐酸 D . 在苯萃取溴水中的溴,分液时有机层从分液漏斗的下端放出2 下列有关实验操作的说法正确的是( A .可用 25ml 碱式滴定管量取 20.00ml KmnO 4 溶液B .用 pH 试纸测定溶液的 pH 时,需先用蒸馏水润湿试纸C .蒸馏时蒸馏烧瓶中液体的体积不能超过容积的 2/3,液体也不能蒸干D .将金属钠在研体中研成粉末,使钠与水反应的实验更安全3、(下列装置或操作能达到实验目的的是4、下列实验装置图正确的是()5、可用下图装置制取(必要时可加热)、净化、收集的气体是 ()A. 铜和稀硝酸制一氧化氮B. 氯化钠与浓硫酸制氯化氢C. 锌和稀硫酸制氢气D. 硫化亚铁与稀硫酸制硫化氢6、用 4 种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是)) 4 ( ) 选项操作及现象溶液A通入 CO 2,溶液变浑浊。
再升温至 65℃以上,溶液变澄清。
C 6H 5ONa 溶液B通入 CO 2,溶液变浑浊。
继续通 CO 2 至过量,浑浊消失。
Na 2SiO 3 溶液C通入 CO 2,溶液变浑浊。
再加入品红溶液,红色褪去。
Ca(ClO)2 溶液D通入 CO 2,溶液变浑浊。
继续通 CO 2 至过量,浑浊消失。
再加入足量 NaOH 溶液,又变浑浊。
Ca(OH)2 溶液7、如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是 (① CO 2、O 2 ② Cl 2、CH 4 ③ NO 2、O 2 ④N 2 、 H 2 A.①② B.②④ C.③④ D.②③ 8、下列与实验相关的叙述正确的是A .稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中B .配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出C .酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,将导致测定结果偏高D .检验某溶液是否含有S O 2时,应取少量该溶液,依次加入 BaCL 2 溶液和稀盐酸 9、正确的实验操作是实验成功的重要因素,下列实验操作错误的是10、下列实验装置(固定装置略去)和操作正确的是3 442、常见物质的分离、提纯1、写出下列物质的除杂试剂(括号内为杂质)CO 2(HCl) CO 2(CO)CO(CO 2)CO 2(O 2) CO 2(SO 2) Cl 2(HCl) FeCl 3(FeCl 2)FeCl 2(FeCl 3)Fe(Al)SiO 2 (Al 2O 3) NaHCO 3(Na 2CO 3) Na 2CO 3 (NaHCO 3) 苯(苯酚)乙醇(乙酸)乙酸乙酯(乙酸)2、除去下列括号内杂质的试剂或方法错误的是( )A .HNO 3 溶液(H 2SO 4),适量 BaCl 2 溶液,过滤B .CO 2(SO 2),酸性 KMnO 4 溶液、浓硫酸,洗气C .KNO 3 晶体(NaCl),蒸馏水,结晶D .C 2H 5OH(CH 3COOH),加足量 CaO ,蒸馏3、下列除去杂质的方法正确的是( )A .除去 CO 2 中混有的 CO :用澄清石灰水洗气B . 除去 BaCO 3 固体中混有的 BaSO 4:加过量盐酸后,过滤、洗涤C . 除去 FeCl 2 溶液中混有的 FeCl 3:加入过量铁粉,过滤D .除去 Cu 粉中混有的 CuO :加适量稀硝酸后,过滤、洗涤 4、现有三组混合液:①菜子油和醋酸钠溶液 ②苯甲酸和乙酸 ③溴化钠和单质溴的水溶 液,分离以上各混合液的正确方法依次是( ) A .分液、萃取、蒸馏 B .萃取、蒸馏、分液 C .分液、蒸馏、萃取 D .蒸馏、萃取、分液5、除去 NaHCO 3 溶液中混有的少量 Na 2CO 3 可采取的方法是:A .通入二氧化碳气体B .加入氢氧化钡溶液C .加入澄清石灰水D .加入稀盐酸3、物质的检验,鉴别 1、下列鉴别方法可行的是()A . 用氨水鉴别 Al 3+、Mg 2+和 A g +B . 用 Ba(NO 3)2 溶液鉴别 Cl -、SO 2-和 CO 2-43C . 用核磁共振氢谱鉴别 1-溴丙烷和 2-溴丙烷D .用 K M n O 4 酸性溶液鉴别 CH 3CH =CHCH 2OH 和 C H 3 CH 2CH 2CHO2、对于某些离子的检验及结论一定正确的是 ( )A . 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有 CO 2-B . 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有 SO 2-C . 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有 NH +D . 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有 Ba 2+32 32 3 44、下列实验能达到预期目的的是( )①用乙醇和浓硫酸除去乙酸乙酯中的少量乙酸②将 Cl 2 的制备和性质实验联合进行以减少实验中的空气污染 ③用食醋和澄清石灰水验证蛋壳中含有碳酸盐 ④用硝酸钡溶液鉴别硫酸根离子与亚硫酸根离子 ⑤用溴水检验汽油中是否含有不饱和脂肪烃 A.①②③ B.①③④ C.②③⑤ D.②④⑤5、能鉴别 Mg 、AgNO 3、Na 2CO 3、NaAlO 2 四种溶液的试剂是( ) A .HNO 3 B .KOH C .BaCl 2 D .NaClO6、某钠盐溶液中可能含有 NO -、S 、O 、2-、S 、O 2- CO 2- Cl -I - 等阴离子。

光合作用实验题专题训练一、实验题(共63小题)是一种酸碱指示剂。
BTB的弱碱性溶液颜色可随其中CO2浓度的增高而由蓝变绿再变黄。
某同学为研究某种水草的光合作用和呼吸作用,进行了如下实验:用少量的NaHCO3和BTB加水配制成蓝色溶液,并向溶液中通入一定量的CO2使溶液变成浅绿色,之后将等量的浅绿色溶液分别加入到7支试管中。
其中6支加入生长状况一致的等量水草,另一只不加水草,密闭所有试管。
各试管的实验处理和结果见下表。
*遮光是指用黑纸将试管包裹起来,并放在距日光灯100cm的地方。
若不考虑其他生物因素对实验结果的影响,回答下列问题:(1)本实验中,50min后1号试管的溶液是浅绿色,则说明2至7号试管的实验结果是由__________引起的;若1号试管的溶液是蓝色,则说明2至7号试管的实验结果是__________(填“可靠的”或“不可靠的”)。
(2)表中X代表的颜色应为(填“浅绿色”、“黄色”、或“蓝色”),判断依据是__________。
(3)5号试管中的溶液颜色在照光前后没有变化,说明在此条件下水草__________。
考点:细胞呼吸光合作用的基本过程答案:(1)不同光强下水草的光合作用和呼吸作用;不可靠的;(2)黄色;水草不进行光合作用,只进行呼吸作用,溶液中CO2浓度高于3号管;(3)光合作用强度等于呼吸作用强度,吸收与释放的CO2量相等。
试题解析:1号试管和其他试管对比,自变量是水草的有无。
若1号试管的溶液是蓝色,说明水草培养液中有自养型微生物,且光合作用强度大于呼吸作用强度,导致二氧化碳含量下降;2号试管遮光,水草只进行呼吸作用,不进行光合作用,二氧化碳含量越来越多,故溶液变为黄色;5号试管中的溶液颜色在照光前后没有变化,说明在此条件下水草光合速率等于呼吸速率,试管内二氧化碳的浓度不变。
2.科研人员以萌发的豌豆种子为材料,研究外源H2O2对根生长的影响。
(1)研究发现,植物细胞代谢过程中产生的H2O2可作为信息分子___________植物的生命活动。
八年级上册物理实验探究题专题训练一.实验探究题(共40小题)1.物理是一门以观察、为基础的学科,在探究声音的产生于传播时,小明和小华一起做了图中的几个实验,请认真观察后回答下列问题:(1)如图甲所示,用悬挂着的乒乓球接触正在发声的音叉,可观察到乒乓球被弹开,它说明了声音是由产生的。
此探究中悬挂着的乒乓球的作用是将音叉的振动放大,这是物理实验探究中的一种重要方法,我们称它为法。
(2)如图乙所示,敲响右边的音叉,左边完全相同的音叉也会发声,并且把泡沫塑料球弹起。
该实验能说空气可以传声。
在月球上(选填“能”或“不能”)看到塑料球弹起。
(3)如图丁所示,停表的读数s。
2.在“探究海波熔化和凝固规律”的实验中,绘制出了如图甲所示的图象。
实验装置如图乙.(1)实验时,组装器材要(选填“从上到下”或“从下到上”);不直接将装有海波的试管放在酒精灯上加热,而是放入盛有水的烧杯中加热,这样做的好处是。
(2)图甲中海波的熔化过程是段(用字母表示),熔化过程经历了min,第5min时海波处于(选填“固”“液”或“固液共存”)态。
(3)由该图象知同一种晶体的熔点和凝固点。
(4)若实验中小明发现海波熔化过快,应采取的操作是.(写出一种方法即可)3.小云用如图所示装置探究水的沸腾。
(1)组装实验器材时,应按照的顺序(选填“自上而下”或“自下而上”)。
实验室现有水银温度计(﹣20℃﹣120℃)、酒精温度计(﹣80℃﹣60℃)、体温计、寒暑表等不同种类的温度计,本实验应选用的温度计是;(2)实验中,小云观察到水在沸腾前和沸腾时水中气泡的上升情况不同,如图甲、乙所示。
表示沸腾前气泡上升情况的是图;水沸腾时,烧杯中不停地冒出“白气”,这些“白气”实际上是(选填“小冰晶”、“小水滴”或“水蒸气”);(3)实验完毕,小云撤去酒精灯后发现水继续沸腾了一段时间,原因是。
4.如图所示,小明给两个空罐的底部中央分别打上一个圆孔和一个方孔,再用两片半透明的塑料膜蒙在空罐的口上。
八年级物理上册《实验题》专项训练题及答案(人教版)学校:___________班级:___________姓名:___________考号:___________测量小车的平均速度1.如图所示是“测量小车的平均速度”的实验装置。
实验时让小车从斜面的A点由静止滑下,分别测出小车到达B点和C点的时间,即可求出不同路段的平均速度。
(1)实验原理是;(2)实验时,为了使小车在斜面上运动的时间长些,便于测量时间,应(选填“增大”或“减小”)斜面的倾斜角度;(3)小车从A点运动到B点所用时间t AB= s;从A点到C点的路程s AC=80.0cm,则小车在BC段的平均速度V BC= m/s。
2.如图所示的实验装置是用来测量玩具小车的运动速度。
从A处开始计时,图中圆圈里显示的是玩具小车到达A、B、C三处时秒表显示的时间,格式为“分:秒:百分秒”则:(1)该实验的原理是;(2)玩具小车通过AB段的速度为m/s。
玩具小车通过BC段的速度为m/s,玩具小车在做(选填“匀速”或“变速”)直线运动;(3)为了方便计时,实验时应适当(选填“增大”或“减小”)相邻两点间的距离。
声现象实验3.根据如图所示的演示实验,请按要求回答:(1)如图甲所示,将悬挂的乒乓球轻轻接触正在发声的音叉,观察到乒乓球多次被音叉弹开,声音消失,乒乓球便会停止运动,这说明发声的物体在;(2)甲实验装置能探究声音产生的原因,还能探究声音的和的关系;(3)小明进一步探究,如图乙所示,敲响右边的音叉,左边完全相同的音叉也会把乒乓球弹起。
该实验能说明哪些问题?请你写出两个:①;②。
4.如图所示,用钢尺做探究实验,把钢尺紧按在桌面上,一端伸出桌边,拨动钢尺,听它发出的声音,同时注意观察钢尺振动的快慢,改变钢尺伸出桌边的长度,再次拨动,使钢尺每次的振动幅度大致相同。
(1)本实验中应该听的声音是 _____;A.钢尺伸出桌面部分振动发出的B.钢尺拍打桌面发出的(2)实验时,钢尺伸出桌面的长度越长,振动越(选填“快”或“慢”),发出声音的音调越,说明:音调的高低与声源振动的有关;(3)本实验的研究方法是。
实验题专项训练一.铁、铝、铜等金属及其化合物在日常生活中应用广泛,请根据下列实验回答问题。
(1)生铁中含有一种铁碳化合物X(Fe3C)。
X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是;Y 与过量浓硝酸反应后溶液中含有的盐的化学式为。
(2)某溶液中有Mg2+、Fe2+、Al3+、Cu2+等离子,向其中加入过量的NaOH溶液后,过滤,将滤渣高温灼烧,并将灼烧后的固体投入过量的稀盐酸中,所得溶液与原溶液相比,溶液中大量减少的阳离子是。
A.Mg2+ B.Fe2+ C.Al3+ D.Cu2+(3)氧化铁是重要的工业颜料,用废铁屑制备它的流程如下:回答下列问题:①操作Ⅰ的名称是;操作Ⅱ的名称是;操作Ⅱ的方法为。
②请写出生成FeCO3沉淀的离子方程式:。
二从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:明矾焙烧的化学方程式为:4KAl(SO4)2·12H2O+3S=2K2SO4 +2Al2O3+9SO2↑+48H2O请回答下列问题:(1)在焙烧明矾的反应中,氧化剂是。
(2)步骤②中,为提高浸出率,可采取的措施有。
A.粉碎固体混合物 B.降低温度C.不断搅拌D.缩短浸泡时间(3)从水浸后的滤液中得到K2SO4晶体的方法是。
(4)步骤③电解的化学方程式是,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是:。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,则该电池的正极电极反应式是。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为吨(列出计算表达式)。
三.日常生活中使用的铝合金中的铝来自于电解氧化铝。
工业上电解氧化铝要求其纯度不得低于98.2%,而天然铝土矿的氧化铝含量为50%~70%,杂质主要为SiO2、Fe2O3、CaO、MgO、Na2O等。
工业生产铝锭的工艺流程示意图如下:一些氢氧化物沉淀的pH如下表:沉淀物Al(OH)3Fe(OH)3Mg(OH)2开始沉淀pH(离子初始浓度0.01 mol/L) 4 2.3 10.4完全沉淀pH(离子浓度<10-5 mol/L) 5.2 4.1 12.4请回答下列问题:(1)加入盐酸时,氧化铝发生反应的离子方程式为________________。
(2)实验室进行步骤②③④的操作名称为________。
(3)固体A的化学式为________,物质C的化学式为________;溶液中的Na+、Ca2+、Mg2+是在步骤________中分离出去的。
(4)步骤③调节pH的数值范围为________,步骤④调节pH的数值范围为________。
(5)步骤⑥反应的化学方程式为________。
四.铜是重要的金属材料。
(1)工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为________。
电解粗铜制取精铜,电解时,阳极材料是________,电解液中必须含有的阳离子是________。
(2)在100 mL 18 mol·L-1浓硫酸中加入过量的铜片,加热使之充分反应,反应中被还原的H2SO4为________mol。
(3)电子工业曾用质量分数为30%的FeCl3溶液腐蚀敷有铜箔的绝缘板制印刷电路板,为了从使用过的废腐蚀液中回收铜,并重新得到FeCl3溶液,设计如下实验流程。
上述流程中,所加试剂的化学式为:X________,Y________,Z________;第⑥步反应的离子方程式为五。
以硫铁矿烧渣(含有氧化铁和少量硫化亚铁、二氧化硅等)为原料制备聚铁{可表示为Fe2(OH)n(SO4)3-n/2,和绿矾(FeSO4.7H2O)具有成本低、反应快、产品质量高等优点。
制备流程如下图:(1)流程图中溶液X为Fe(SO4)3,溶液,据此写出操作①中属于氧化还原反应的离子方程式:____________。
(2)操作②的处理存在弊端,该弊端是_____________。
若固体W与KOH溶液昆合加热,其中一个反应的化学方程式为3S+6KOH2K2S+K2SO3+3H2O,该反应的氧化剂与还原剂质量之比为___________。
(3)操作③需要加入的物质(试剂)是_________,目的是___________________________。
(4)操作⑤是使溶液pH___________(填“增大”或“减小”)。
(5)操作⑥控制温度为70 -80℃的目的是_________________________________________ 。
(6)双氧水在酸性环境(硫酸)中是一种强氧化剂,可以将硫酸亚铁氧化成三价铁,制得Fe2(OH)n(SO4)3-n/2,反应的化学方程式为__________________________________。
六.柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4·7H2O)通过下列反应制备:FeSO4+Na2CO3=FeCO3+Na2SO4FeCO3+C6H8O7=FeC6H6O7+CO2+H2O下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
金属离子开始沉淀的pH 沉淀完全的pHFe3+ 1.1 3.2Al3+ 3.0 5.0Fe2+ 5.8 8.8(1)制备FeCO3时,选用的加料方式是________(填字母),原因是_________________________________a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_______________________________。
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应。
①铁粉的作用是_____________________。
②反应结束后,无需过滤,除去过量铁粉的方法是________________________________。
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体。
分离过程中加入无水乙醇的目的是__________________。
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁。
请结合右图的绿矾溶解度曲线,补充完整由硫铁矿烧渣制备FeSO4·7H2O晶体的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量烧渣中加入足量的稀硫酸充分反应,________,得到FeSO4溶液,________,得到FeSO4·7H2O 晶体。
一.答案:(1)Fe2+、Fe3+、H+Fe(NO3)3(2)BC(3)①过滤洗涤在漏斗中加入适量蒸馏水,浸没沉淀,让蒸馏水自然流下,重复2~3次②Fe2++2HCO3-=FeCO3↓+CO2↑+H2O二.答案:(1)KAl(SO4)2·12H2O(2分)(2) AC (2分,多选、错选0分)(3)蒸发结晶(2分,“蒸发浓缩、冷却结晶”给1分)(4)(2分)阳极中碳被氧化成CO2(CO)(2分,用化学方程式表示也可,如:C+O2CO2或2C+O22CO ,条件用加热或970℃也可)(5)NiO(OH)+H2O+e-=Ni(OH)2+OH-(2分)http://w ww.xkb1.com(6)或(3分,不带单位不扣分,化简也可以)解析试题分析:(1)明矾的焙烧已经给出了方程式,因此本题主要是考查氧化还原反应的特征。
该方程式中发生化合价变化的只有S元素,明矾中的S元素一部分发生化合价降低,而S单质的化合价升高,因此反应中的氧化剂是明矾(KAl(SO4)2·12H2O),还原剂是单质S。
(2)步骤②是水浸明矾焙烧后的固体混合物,因此要提高浸出率,往往需要增大接触面积、充分溶解;因此粉碎固体混合物、不断搅拌都是可行的。
(3)焙烧后的固体混合物是K2SO4和Al2O3,水浸后的溶液则是易溶于水的K2SO4溶液,所以要从单一组分的溶液中得到改溶质,可以直接蒸发结晶。
(4)氧化铝电解制备铝单质,该反应方程式为;在电解反应中阴极还原得到单质铝,阳极得到O2,由于阳极电极材料是C单质,所以在高温环境下,碳素材料会被氧气氧化为CO或CO2,从而导致阳极碳素电极受损,要定期更换。
(5)以Al和NiO(OH)为电极构成的碱性电池,首先判断出单质Al做负极,NiO(OH)为正极;因此放电时正极得到电子被还原,从Ni的化合价变化可以得出得失电子数目,所以充分运用电荷守恒、原子守恒,再结合反应环境可以的该正极的反应式为NiO(OH)+H2O+e-=Ni(OH)2+OH-。
(6)计算思路:计算明矾物质的量,根据方程式计算SO2的总物质的量,根据S原子守恒H2SO4溶质的物质的量等于96%的SO2,把溶质H2SO4的物质的量转化为质量,再用溶质H2SO4的质量除以质量分数求得H2SO4溶液的总质量。
计算列式为。
三.答案:(1)Al2O3+6H+=2Al3++3H2O (2)过滤(3)SiO2NaOH[或Ca(OH)2] ④(4)4.1<pH<4.5(或略大于4.1,损失一点儿Al3+,保证Fe3+沉淀完全)5.2<pH<10.4(或6<pH<10) (5)2Al2O3(熔融)4Al+3O2↑四.(1)O2粗铜Cu2+(2)小于0.9(3)Fe HCl Cl22Fe2++Cl2=2Fe3++2Cl-五.答案:1)4FeS+3O2+12H+=4Fe3++6H2O+4S(2)燃烧产物SO2会造成环境污染 2:1(3)铁粉使Fe3+还原为Fe2+(4)增大(5)促进Fe3+水解。
又不至于Fe3+完全水解生成氢氧化铁胶体(6)2FeSO4+H2O2+(1-n/2)H2SO4=Fe2(OH)n(SO4)3-n/2+(2-n)H2O解析试题分析:(1)氧化还原反应的特征是元素的化合价的升降。
发生的反应中属于氧化还原反应的为:4FeS+3O2+12H+=4Fe3++6H2O+4S。
(2)在固体W中含有S、SiO2,在灼烧时S被氧化为SO2而逸出,导致环境污染。
在反应3S+6KOH2K2S+K2SO3+3H2O中,S既作氧化剂,也作还原剂,其中2个S作氧化剂,1个S作还原剂。