钠及其化合物的简单计算
- 格式:pdf
- 大小:545.41 KB
- 文档页数:5
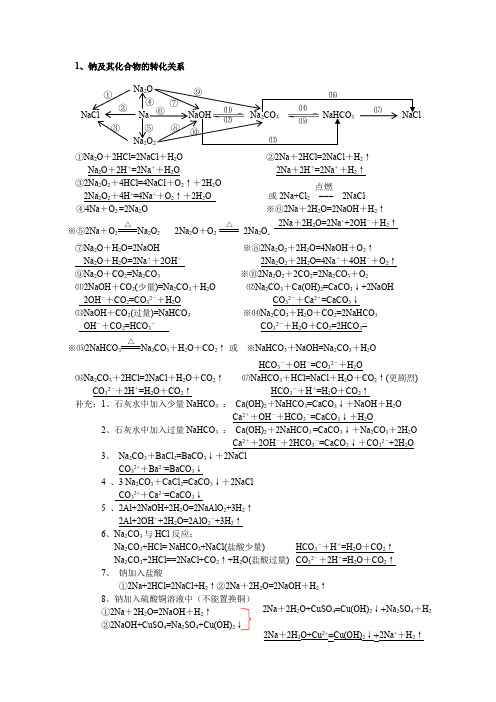
1、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑ Na 2O +2H +=2Na ++H 2O2Na +2H +=2Na ++H 2↑③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O 2Na 2O 2+4H +=4Na ++O 2↑+2H 2O 或2Na+Cl 2 ===④4Na +O 2=2Na 2O※⑤2Na +O 22O 22Na 2O +O 22Na 2O 2 ⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑⑨Na 2O +CO 2=Na 2CO 3※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2(少量)=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2OCO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2(过量)=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3-CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3Na 2CO 3+H 2O +CO 2↑或 ※NaHCO 3+NaOH=Na 2CO 3+H 2O HCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑(更剧烈)CO 32-+2H +=H 2O +CO 2↑HCO 3-+H +=H 2O +CO 2↑补充:1、石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O2、石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O3、 Na 2CO 3+BaCl 2=BaCO 3↓+2NaClCO 32++Ba 2+=BaCO 3↓4 、3 Na 2CO 3+CaCl 2=CaCO 3↓+2NaClCO 32++Ca 2+=CaCO 3↓5 、2Al+2NaOH+2H 2O=2NaAlO 2+3H 2↑2Al+2OH -+2H 2O=2AlO 2-+3H 2↑6、Na 2CO 3与HCl 反应:Na 2CO 3+HCl= NaHCO 3+NaCl(盐酸少量) HCO 3-+H +=H 2O +CO 2↑Na 2CO 3+2HCl==2NaCl+CO 2↑+H 2O(盐酸过量) CO 3-+2H +=H 2O +CO 2↑7、 钠加入盐酸①2Na+2HCl=2NaCl+H 2↑②2Na +2H 2 8①2Na +2H 2O=2NaOH +H 2↑②2NaOH+CuSO 4=Na 2SO 4+Cu(OH)2↓ △ △ △ NaCl Na NaOH Na 2Na 2① ② ③ ⑤⑾ ⑿ ⒁ ⒂ ④9①2Na +2H 2O=2NaOH +H 2↑②3NaOH+FeCl 3=3NaCl+F e(OH)3↓10、过氧化钠加入硫酸铜溶液中①2Na 2O 2+2H 2O=4NaOH +O 2↑②2NaOH+CuSO 4=Cu(OH)2↓+Na 2 11、过氧化钠加入氯化铁溶液中 ①2Na 2O 2+2H 2O=4NaOH +O 2↑ ②3NaOH+FeCl 3=F e(OH)3↓+3NaCl 12、红热的铁与水蒸气:3Fe+4H 2O(g)Fe 3O 4+4H 2 13、2AlCl 314、2Fe+3Cl 2 315、Cu + Cl 216、2Na + S =Na 2S17、2Al+3SAl 2S 3 18、Fe+S 19、2Cu+S Cu 2S20、4Al+3O 22Al 2O 3 4Al+3O 2=2Al 2O 3(常温氧化) 21、4Fe+3O 2 2Fe 2O 322、2Cu+O 22CuO△△ △△ △ △。

钠及其化合物方程式
钠是一种金属元素,化学符号为Na(来自拉丁文"Natrium")。
它与许多其他元素形成各种化合物。
以下是一些钠及其化合物的方程式:
1. 钠的单质反应:
2 Na(s) + Cl2(g) → 2 NaCl(s)
(钠与氯气反应,生成氯化钠,即食盐)
2. 钠与水的反应:
2 Na(s) + 2 H2O(l) → 2 NaOH(aq) + H2(g)
(钠与水反应,生成氢气和氢氧化钠)
3. 氯化钠(食盐)的水溶液电离:
NaCl(s) → Na+(aq) + Cl-(aq)
(氯化钠在水中溶解,产生钠离子和氯离子)
4. 碳酸钠(小苏打)与酸反应:
2 NaHCO3(s) + H2SO4(aq) → Na2SO4(aq) + 2 CO2(g) + 2 H2O(l)
(碳酸钠与硫酸反应,生成硫酸钠、二氧化碳和水)
5. 氢氧化钠(烧碱)与盐酸反应:
NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
(氢氧化钠与盐酸反应,生成氯化钠和水)
6. 硝酸钠(一种钠盐)的分解:
2 NaNO3(s) → 2 NaNO2(s) + O2(g)
(硝酸钠在高温下分解,生成亚硝酸钠和氧气)
这只是一小部分钠及其化合物的反应方程式,钠和其他元素、离子或化合物之间的反应可以产生多种化合物。
需要特别注意的是,在
进行化学反应时,请遵循正确的实验室安全操作,并在有经验的人员的指导下进行。

高中化学必修一钠及其化合物work Information Technology Company.2020YEAR高中化学必修一钠及其化合物要点一:钠单质的重要性质及其应用1.物理性质 颜色 熔点 硬度 密度导电导热性银白色低小比水的 ,比煤油的 。
良好2.化学性质从钠的结构认识钠的化学性质——还原性。
(1)与非金属单质(如O 2、Cl 2)的反应 与O 2反应⎪⎩⎪⎨⎧==+==+22222a a 2a 2a 4O N O N O N O N :加热时,化学方程式为:常温下,化学方程式为(2)与水的反应①化学方程式为:2Na+2H 2O==2NaOH+H 2↑ ②与滴加酚酞的水反应的现象与解释 浮:钠的密度比水要小;要点诠释:钠在空气中的变化过程分析 过程 现象 反应原理 ① 变暗 4Na+O 2===2Na 2O ② 成液 Na 2O +H 2O===2NaOH③ 结块 2NaOH+9H 2O+CO 2===Na 2CO 3·10H 2O ④变成粉末Na 2CO 3·10H 2O===Na 2CO 3+10H 2O综上,把钠久置在空气中,最终变成Na2CO3粉末。
(3)与酸的反应2Na+2H+=====2Na++H2↑a.若酸过量,则只考虑钠与酸的反应。
b.若钠过量,钠首先与酸反应,剩余的钠再与水反应。
(4)与盐的反应与盐溶液发生反应时先与水反应,生成的碱与盐可能发生复分解反应。
a.与NaCl、Na2SO4、NaNO3溶液反应:实质是与水反应。
b.与CuSO4溶液反应:钠先与水反应,生成的NaOH再与CuSO4反应。
写出Na与CuSO4溶液反应的离子方程式:3.工业制备与保存钠的制取及保存4.钠的重要用途典型例题1、等质量的两块钠,第一块在足量氧气中加热,第二块在足量氧气(常温)中充分反应,则下列说法正确的是()A.第一块钠失去电子多B.两块钠失去电子一样多C.第二块钠的反应产物质量最大D.两块钠的反应产物质量一样大解:A、金属钠失电子均变为+1价的阳离子,等质量的两块钠,失电子是一样的,故A错误;B、金属钠失电子均变为+1价的阳离子,等质量的两块钠,失电子是一样的,故B正确;C、根据4Na+O2=2Na2O,则1mol金属钠获得氧化钠的质量是31g,根据反应2Na+O2Na2O2,则1mol金属钠获得过氧化钠的质量是39g,等质量的两块钠,即金属钠的物质的量是相等的,所以生成过氧化钠的质量大,即第一块钠的反应产物质量最大,故C错误;D、根据C的计算可以知道第一块钠的反应产物质量最大,故D错误。


一■、钠点耀1、钠在氧气中燃烧:2Na + O2=—=Na2O2点耀2、钠在氯气中燃烧:2Na + Cl2=2NaCl3、钠常温条件下和氧气反应:4Na + O2=2Na2OA4、钠和硫共热:2Na+S^^=Na2s5、钠和水反应:2Na +2H2O^=2NaOH + H2f2Na + 2H2O^=2Na+ + 2OH- + H2 f6、钠和稀盐酸反应:2Na + 2HCl^=2NaCl + H2f2Na + 2H+^=2Na+ + H2 f7、钠投入到硫酸铜溶液中:2Na + CuSO4+2H2O^=Na2so4+Cu(OH)2;+H2 f2Na+Cu2+ + 2H2O^=2Na+ + Cu(OH)2 ;+H2 f8、向氯化铝溶液中加入少量的钠:6Na + 2AlCl3+ 6H2O^=6NaCl + 2Al(OH)3;+3H2 f6Na +2Al3+ + 6H2O^=6Na++Al(OH)3;+3H2 f9、向氯化铝溶液中加入足量的钠:4Na+AlCl3+ 2H2O^=NaAlO2+3NaCl +2H2f4Na+Al3+ + 2H2O^=4Na++AlO2- + 2H2 f高温10、钠在高温条件下与四氯化钛反应:4Na+TiCl4=^工4NaCl+Ti二、氧化钠1、氧化钠和水反应:Na2O + H2O=2NaOHNa2O + H2O^=2Na+ + 2OH-2、氧化钠与二氧化碳反应:Na2O + CO2^=Na2CO33、氧化钠与盐酸反应:Na2O + 2HCl^=2NaCl + H2ONa2O + 2H+^=2Na+ + H2O4、向硫酸铜溶液中加入氧化钠:Na2O + CuSO4+H2O^=Cu(OH)2J+Na2sO4Na2O + Cu2+ + H2O^=Cu(OH)2J+2Na+5、向氯化铝溶液中加入少量的氧化钠:3Na2O + 2AlCl3+ 3H2O^=2Al(OH)3 J+6NaCl3Na2O + 2Al3+ + 3H2O===2Al(OH)3 J+6Na+6、向氯化铝溶液中加入足量的氧化钠:2Na2O+AlCl3^=NaAlO2+3NaCl2Na2O+Al3+ ==AlO2-+4Na+三、过氧化钠1、过氧化钠与水反应:2Na2O2+2H2O^^4NaOH + O2f2Na2O2+2H2O===4Na+ +4OH-+O2 f2、过氧化钠与二氧化碳反应:2Na2O2+2CO2^=2Na2cO3+O2f3、过氧化钠与盐酸反应:2Na2O2+4HCl^』NaCl +2H2O+O2f2Na2O2+4H+=^4Na+ + 2H2O + O2 f4、向硫酸铜溶液中加入过氧化钠:2Na2O2+2CuSO4+2H2O==2Cu(OH)2;+2Na2SO4+O2 f2Na2O2+ 2Cu2+ + 2H2O^=2Cu(OH)2J+4Na++O2 f 5、向氯化铝溶液中加入少量的过氧化钠:6Na2O2+4AlCl3+ 6H2O^^Al(OH)3J+12NaCl + 3O2 f6Na2O2+4Al3+ + 6H2O^=4Al(OH)3J+12Na++3O2 f6、向氯化铝溶液中加入过量的过氧化钠:2Na2O2+AlCl3+ 2H2O^=NaAlO2+3NaCl + O2f2Na2O2+Al3+ + 2H2O^=AlO2-+4Na+ + O2f7、过氧化钠与硫酸亚铁溶液反应:4Na2O2+4FeSO4+6H2O^=4Fe(OH)3J+4Na2sO4+O2f4Na2O2+4Fe2+ + 6H2O^=4Fe(OH)3J+8Na+ + O2f四、氢氧化钠1、铝与氢氧化钠溶液反应:2Al + 2NaOH +2H2O^=2NaAlO2+3H2f2Al + 2OH- +2H2O^=2AlO2- + 3H2fC12+2OH-^=Cl- + ClQ- + H2OA3、氯气通入热的浓氢氧化钠溶液中:3C12+6NaOH^^=5NaC1 + NaC1O3+ 3H2OA3c12+ 6OH-^^=5C1- + C1O3-+3H2OA4、硫和氢氧化钠溶液共热:3S+6NaOH --------2Na2S+Na2sO3+3H2OA3S+6OH-^^=2s2-+SO32- + 3H2O5、硅溶于氢氧化钠溶液中:Si + 2NaOH + H2O^=Na2SiO3+ 2H2fSi + 2OH- + H2O^=SiO32- + 2H2f6、氧化铝溶于氢氧化钠溶液中:A12O3+ 2NaOH^=2NaA1O2+ H2OA12O3 + 2OH-^=2A1O2- + H2O7、向氢氧化钠溶液中通入少量的二氧化碳:2NaOH + CO2^=Na2CO3+ H2O2OH- + CO2^=CO32- + H2O8、向氢氧化钠溶液中通入过量的二氧化碳:NaOH + CO2^=NaHCO3OH-+CO2^=HCO3-9、向氢氧化钠溶液中通入少量的二氧化硫:2NaOH+SO2^=Na2SO3+ H2O2OH-+SO2^=SO32- + H2O10、向氢氧化钠溶液中通入过量的二氧化硫:NaOH+SO2^=NaHSO3OH-+SO2^=HSO3-11、五氧化二磷与氢氧化钠溶液反应:P2O5+ 6NaOH^=2Na3PO4+3H2OP2O5 + 6OH- ^=2PO43- + 3H2O12、二氧化氮和氢氧化钠溶液反应:2NO2+2NaOH^=NaNO2+ NaNO3+ H2O2NO2 + 2OH-^=NO2- + NO3- + H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反应:NO + NO2+ 2NaOH^=2NaNO2+ H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2^=Na2SiO3+H2O2OH-+SiO2^=SiO32- + H2O15、三氧化硫和氢氧化钠溶液反应:SO3+2NaOH^=Na2SO4+H2OSO3+ 2OH-^=SO42- + H2O16、盐酸和氢氧化钠溶液反应:HCl + NaOH^=NaCl + H2OH+ + OH-^=H2O17、醋酸和氢氧化钠溶液反应:CH3COOH + NaOH^=CH3COONa + H2OCH3COOH + OH-^=CH3COO- + H2O18、向氢氧化钠溶液中通入少量的硫化氢:H2S+2NaOH^=Na2S+2H2OH2s+2OH- =S2- + 2H2O19、向氢氧化钠溶液中通入足量的硫化氢:H2s+NaOH^=NaHS+H2OH2S + OH-^=HS- + H2O20、硫酸和氢氧化钠溶液反应:H2sO4+2NaOH^=Na2sO4+2H2OH+ + OH-^=H2O21、磷酸溶液氢氧化钠溶液反应:H3PO4+3NaOH^=Na3PO4+3H2OH3PO4+3OH-^=PO43- + 3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH^=NaAlO2+ 2H2OAl(OH)3 +OH- =AlO2- + 2H2O23、向硝酸银溶液中加入氢氧化钠溶液:AgNO3+ NaOH^=AgOH ;+NaNO3Ag+ + OH- =AgOH ;24、向硫酸铜溶液中加入氢氧化钠溶液:CuSO4+2NaOH^=Na2sO4+Cu(OH)2;CU2+ + 2OH-^=Cu(OH)2 ;25、向氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH^=Fe(OH)3;+3NaClFe3++3OH-^=Fe(OH)3 ;26、向氯化铝溶液中加入少量氢氧化钠溶液:AlCl3+3NaOH^=Al(OH)3;+3NaClA13+ + 3OH- ==Al(OH)3 ;27、向氯化铝溶液中加入足量氢氧化钠溶液:AlCl3+4NaOH^=NaAlO2+3NaCl +2H2OAl3++4OH- =AlO2- + 2H2OA28、向氯化铵溶液加入氢氧化钠溶液,加热:NH4cl + NaOH^^=NaCl + NH3f+H2OANH4+ + OH;NH3f+H2O29、向碳酸氢铵溶液中加入少量氢氧化钠溶液共热:ANH4HCO3+NaOH -------- N aHCO3 + NH3 f+H2OANH4++OH-二NH3T+H2O30、向碳酸氢铵溶液中加入足量氢氧化钠溶液共热:ANH4HCO3+2NaOH ------- =Na2cO3+NH3f+2H2OANH4+ + HCO3- + OH-^^=CO32- + NH3f+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+ NaOH^=Na2CO3+ H2OHCO3- + OH-^=CO32- + H2O32、向碳酸氢钙溶液中加入少量氢氧化钠溶液:Ca(HCO3)2+NaOH^=CaCO3 ;+NaHCO3 + H2OCa2+ + HCO3-+OH-^=CaCO3;+H2O33、向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca(HCO3)2+2NaOH^=CaCO3;+Na2CO3+ 2H2OCa2+ + 2HCO3- + 2OH-^=CaCO3 +CO32- + 2H2O34、向碳酸氢镁溶液中加入少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH^=Mg(OH)2 ;+2NaHCO3Mg2+ + OH-^=Mg(OH)2 ;35、向碳酸氢镁溶液中加入过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH^=Mg(OH)2 ;+Na2CO3+ 2H2OMg2+ + 2HCO32-+4OH-^=Mg(OH)2 ;+2CO32- + 2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3^AgCl ;+NaNO3Cl-+Ag+=AgCl ;A2、氯化钠固体和浓硫酸共热:NaCl + H2sO4^^=Na2so4+2HCl T电解3、电解饱和的氯化钠溶液:2NaCl +2H2O 2NaOH + H2T+Cl2T电解2Cl- +2H2O = 2OH- + H2T+Cl2T电解4、电解氯化钠的熔融液:2NaCl 2Na + Cl2T六、碳酸钠1、碳酸钠溶液与澄清石灰水反应:Na2cO3+ Ca(OH)2 ^=CaCO3 ;+2NaOHCO32- + Ca2+^=CaCO3;2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+ BaCl2^=BaCO3;+2NaClCO32- + Ba2+^=BaCO3 ;3、碳酸钠溶液呈碱性:Na2cO3+ H2O=NaHCO3+ NaOHCO32- + H2O^^ HCO3- + OH-4、碳酸钠溶液滴入少量的盐酸:Na2cO3+ HCl^=NaHCO3+NaClCO32- + H+^=HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2cO3+ 2HCl^=2NaCl + CO2T+H2OCO32- + 2H+^=CO2T+H2O6、碳酸钠溶液中加入醋酸:Na2cO3+ 2CH3COOH^=2CH3COONa + CO2T+H2OCO32- + 2CH3COOH^=2CH3COO- + CO2T+H2O 7、碳酸钠溶液中通入二氧化碳气体:Na2CO3+ CO2+ H2O^=2NaHCO3CO32- + CO2+ H2O^=2HCO3-8、向饱和的碳酸钠溶液中通入二氧化碳气体:Na2CO3+ CO2+H2O^=2NaHCO32Na+ + CO32- + CO2+H2O^=2NaHCO3;9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+ 2AlCl3+3H2O^=2Al(OH)3 ;+6NaCl + 3CO2 f3CO32- + 2Al3+ + 3H2O^=2Al(OH)3;+3CO2 f10、碳酸钠溶液与氯化铁溶液混合:3Na2cO3+ 2FeCl3+ 3H2O^=2Fe(OH)3;+6NaCl + 3CO2 f3CO32- + 2Fe3+ + 3H2O^=2Fe(OH)3;+3CO2 f七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+ H2O=H2cO3+ NaOHHCO3-+H2O^^ H2c O3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl^=NaCl + CO2f+H2OHCO3- + H+^=CO2f+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH^=CH3COONa + CO2f+H2OHCO3-+CH3COOH^=CH3COO-+CO2 f+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3^=Al(OH)3 ;+3NaCl+3CO2 f3HCO3-+Al3+^=Al(OH)3 ;+3CO2f5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+ FeCl3^=Fe(OH)3 ;+3NaCl + 3CO2 f3HCO3- + Fe3+^=Fe(OH)3 ;+3CO2 f6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+ NaOH^=Na2CO3+H2OHCO3-+OH-^=CO32-+H2O7、碳酸氢钠溶液中加入过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3;+NaOH + H2OCa2+ + HCO3-+OH-^=CaCO3;+H2O8、碳酸氢钠溶液中加入少量氢氧化钙溶液:2NaHCO3 + Ca(OH)2 =CaCO3; +Na2CO3 + 2H2OCa2+ + 2HCO3- + 2OH-^=CaCO3; +CO32- + 2H2OA9、碳酸氢钠受热分解:2NaHCO3^^Na2CO3+CO2 f +H20一、镁点燃1、镁在氧气中燃烧:2M g+O2==2M g O点燃2、镁在氯气中燃烧:Mg+CI2=^^MgCI2点物3、镁在氮气中燃烧:3Mg+N2^=Mg3N2点燃4、镁在二氧化碳中燃烧:2Mg+CO2^=2MgO + CA5、镁与硫共热:Mg+S :MgSA6、镁与水共热:Mg+2H2O^^=Mg(OH)2十% f7、镁和盐酸反应:Mg + 2HCI^=MgCI2 + H2 fMg + 2H+^=Mg2+ + H2 f8、镁和醋酸反应:Mg+2CH3COOH^=(CH3COO)2Mg+H2 fMg+2CH3COOH^=2CH3COO- + Mg2+ + H2 f9、镁和氯化镂溶液反应:Mg + 2NH4CI^MgCI2 + 2NH3 f +H2 fMg+2NH4+^=Mg2+ + 2NH3 f +H2 f 10、将少量的镁投入到氯化铁溶液中:Mg+2FeCI3^=2FeCI2 + MgCI2Mg+2Fe3+ Mg2+ + 2Fe2+ 11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCI3^=3MgCI2 + 2Fe3Mg+2Fe3+^=3Mg2+ + 2Fe 12、镁和硫酸铜溶液反应:Mg+CuSQ4^=MgSQ4+CuMg+Cu2+ Mg2+ + Cu13、镁和浓硫酸反应:Mg+2H2SQ4^=MgSQ4+SQ2f+2H2Q14、镁和浓硝酸反应:Mg+4HNQ3^=Mg(NQ3)2+2NQ2 f+2H2QMg+4H+ + 2NQ3-^=Mg2+ + 2NQ2 f+2H2Q15、镁和稀硝酸反应:3Mg+8HNQ3^=3Mg(NQ3)2+2NQ f+4H2Q3Mg+8H+ + 2NQ3-^=Mg2+ + 2NQ f+4H2Q二、氧化镁1、氧化镁与盐酸反应:MgQ + 2HCl^=MgCl2+ H2QMgQ + 2H+^=Mg2+ + H2Q2、氧化镁和醋酸反应:MgQ + 2CH3CQQH^=(CH3CQQ)2Mg+H2QMgQ + 2CH3CQQH^=Mg2+ + 2CH3CQQ- + H2Q3、氧化镁溶于氯化铵溶液中:MgQ + 2NH4Cl^=MgCl2+ 2NH3 f+H2QMgQ + 2NH4+ ^=Mg2+ + 2NH3 f+H2Q4、氧化镁投入到氯化铁溶液中:3MgQ + 2FeCl3+3H2Q^=3MgCl2+ 2Fe(QH)33MgQ + 2Fe3+ + 3H2Q^=3Mg2+ + 2Fe(QH)3三、氢氧化镁1、氢氧化镁和盐酸反应:Mg(QH)2+2HCl^=MgCl2+2H2QMg(QH)2+2H+^=Mg2+ + 2H2Q2、氢氧化镁和醋酸反应:Mg(QH)2+2CH3CQQH^=(CH3CQQ)2Mg+2H2QMg(QH)2+2CH3CQQH^=2CH3CQQ- + Mg2+ + 2H2Q 3、氢氧化镁溶于氯化铵溶液中:Mg(QH)2+ 2NH4Cl^=MgCl2 + 2NH3f+2H2QMg(QH)2+2NH4+^=Mg2+ + 2NH3f+2H2Q 4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+^=3Mg2+ + 2Fe(OH)3一 A5、氢氧化镁受热分解:Mg(OH)2^^MgO + H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反应:MgCl2 + 2AgNO3^2AgCl ;+Mg(NO3)2Cl-+Ag+==AgCl ;2、氯化镁溶液中加入氢氧化钠溶液:MgCl2+ 2NaOH=Mg(OH)2 ;+2NaClMg2+ + 2OH-^=Mg(OH)2 ;3、氯化镁溶液加入氨水:MgCl2+ 2NH3-H2O^=Mg(OH)2 ;+2NH4ClMg2+ + 2NH3-H2O^=Mg(OH)2;+2NH4+4、氯化镁溶液中加入偏铝酸钠溶液:MgCl2+ 2NaAlO2+4H2O^=Mg(OH)2;+2Al(OH)3 ;+2NaClMg2+ + 2AlO2-+4H2O^=Mg(OH)2 ;+2Al(OH)3 ;电解5、电解氯化镁的熔融液:MgCl2 -------- Mg+Cl2f电解6、电解氯化镁的溶液:MgCl2+ 2H2O --------------Mg(OH)2 ;+H2 f+Cl2 f电解Mg2+ + 2Cl- +2H2O ,Mg(OH)2;+H2 f+Cl2 f五、碳酸镁1、碳酸镁与盐酸反应:MgCO3+ 2HCl===MgCl2+ CO2f+H2OMgCO3+ 2H+===Mg2+ + CO2f+H2O2、碳酸镁与醋酸溶液反应:MgCO3+ 2CH3COOH===CH3cOO)2Mg+CO2f+H2OMgCO3+ 2CH3COOH===2CH3COO- + Mg2+ + CO2f+H2O3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+ H2O===Mg(HCO3)2MgCO3+ CO2+H2O===Mg2+ + 2HCO3-4、碳酸镁加入到氯化铁溶液中:3MgCO3+ 2FeCl3+3H2O===3MgCl2+ 2Fe(OH)31+3CO2f3MgCO3+ 2Fe3++3H2O===3Mg2+ + 2Fe(OH)3 "3CO2f5、碳酸镁加入氯化铵溶液中:MgCO3+ 2NH4Cl===MgCl2+ 2NH3f+CO2fMgCO3+ 2NH4+===Mg2+ + 2NH3f+CO2f6、碳酸镁高温煅烧:MgCO3高温MgO + CO2f六、碳酸氢镁1、碳酸氢镁与盐酸反应:Mg(HCO3)2+2HCl===MgCl2+ 2CO2f +2H2OHCO3- + H+==£O2T+H2O2、碳酸氢镁与少量的氢氧化钠溶液反应:Mg(HCO3)2+2NaOH===Mg(OH)J+2NaHCO3Mg2+ + 2OH-===Mg(OH)2;3、碳酸氢镁与过量的氢氧化钠溶液反应:Mg(HCO3)2+4NaOH===Mg(OH)2l+Na2cO3+2H2OMg2+ + 2HCO3-+4OH-===Mg(OH)2; +2CO32- + 2H2O4、碳酸氢镁与澄清石灰水反应:Mg(HCO3)2+ 2Ca(OH)2===Mg(OH)2l+2CaCO31+2H2OMg2+ + 2HCO3- + 2Ca2++4OH-===Mg(OH)2l +2CaCO3 1+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2MgCO3l+CO2T+H2O一、铝点燃1、铝在氧气中燃烧:4Al + 3O==2Al2O3点燃2、铝在氯气中燃烧:2Al + 3Cl2r=^=2AlCl3A3、铝和硫共热:2Al + 3S^=A12s34、铝与稀硫酸反应:2Al + 3H2sO4^=Al2(SO4)3+3H2 f2Al+6H+^=2Al3+ + 3H2 f5、铝和氢氧化钠溶液反应:2Al + 2NaOH +2H2O^=2NaAlO2+3H2f2Al + 2OH- +2H2O^=2AlO2- + 3H2fA6、铝和浓硫酸共热:2Al + 6H2sO4^^=Al2(SO4)3+3SO2 f+6H2OA7、铝和浓硝酸共热:Al + 6HNO3=Al(NO3)3+3NO2 f+3H2OAAl + 6H+ + 3NO3- Al3+ + 3NO2f+3H2O 8、铝和稀硝酸反应:Al+4HNO3^=Al(NO3)3+NO f+2H2OAl+4H+ + NO3- =Al3+ + NO f+2H2O8、铝和硝酸银溶液反应:Al + 3AgNO3^=Al(NO3)3 +3AgAl + 3Ag+^=Al3+ + 3Ag9、铝与硫酸铜溶液反应:2Al+3CuSO4^=Al2(SO4)3+3Cu2A1 + 3CU2+^=2Al3++3Cu高温10、铝和氧化铁高温下反应:2A1 + Fe2O3一^A12O3+ 2Fe高温11、铝和四氧化三铁高温共热:8A1 + 3Fe3O4= 皿4A12O3+9Fe有温12、铝和氧化铜高温共热:2A1+3Cug^LA12O3+ 3Cu而温13、铝和二氧化镒高温共热:4A1+3MnO2= 皿2A12O3+ 3Mn二、氧化铝1、氧化铝与稀硫酸反应:A12O3+3H2SO4^=A12(SO4)3+3H2OA12O3 + 6H+^=2A13++3H2O2、氧化铝与氢氧化钠溶液反应:A12O3+ 2NaOH^=2NaA1O2+ H2OA12O3 + 2OH-^=2A1O2- + H2O3、电解氧化铝的熔融液:2ALO_及生4A1 + 3O. f2 3冰晶石2三、氢氧化铝1、氢氧化铝与稀硫酸反应:2A1(OH)3 +3H2sO4^A12(SO4)3+6H2OA1(OH)3 +3H + =A13+ + 3H2O2、氢氧化铝与氢氧化钠溶液反应:A1(OH)3 +NaOH^=NaA1O2+ 2H2OA1(OH)3 +OH-^=A1O2- + 2H2OA3、加热氢氧化铝:2A1(OH)3 A12O3+3H2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:A12(SO4)3+3BaC12^=2A1C13+3BaSO4;SO42- + Ba2+ ^=BaSO4 ;2、硫酸铝的水溶液呈酸性:A12(SO4)3+ 6H2O^^2A1(OH)3+3H2SO4A13+ + 3H2O^^A1(OH)3 +3H +3、硫酸铝溶液中加入少量的氢氧化钠溶液:A12(SO4)3+6NaOH^=3Na2sO4+2A1(OH)3;A13+ + 3OH- =A1(OH)3 ;4、向硫酸铝溶液中加足量的氢氧化钠溶液:Al2(SO4)3+8NaOH^=2NaAlO2+ 3Na2SO4+4H2OA13++4OH- =AlO2- + 2H2O5、向硫酸铝溶液中加入少量的氢氧化钡溶液:A12(SO4)3+3Ba(OH)2 ^=2A1(OH)3 ;+3BaSO4 ;2A13++3SO42- + 3Ba2+ + 6OH-^=2A1(OH)3 ;+3BaSO4 ;6、向硫酸铝溶液中加入足量的氢氧化钡溶液:A12(SO4)3+4Ba(OH)2 ^=Ba(A1O2)2 +3BaSO4 ;+4H2O2A13++3SO42- + 3Ba2+ + 8OH-^=2A1O2- + 3BaSO4 ;+4H2O7、向明矾溶液中加入少量的氢氧化钡溶液:3Ba(OH)2 +2KA1(SO4)2 ^=2A1(OH)3 ;+3BaSO4 ;+K2SO43Ba2+ + 6OH- + 2A13++3SO42- ==3BaSO4 ;+2A1(OH)3 ;8、向明矶溶液中加入足量的氢氧化钡溶液:KA1(SO4)2+2Ba(OH)2 ^=KA1O2 + 2BaSO4 ;+2H2OA13+ + 2SO42- + 2Ba2++4OH- =A1O2- + 2BaSO4;+2H2O9、向硫酸铝溶液中加入氨水:A12(SO4)3+6NH3.H2O^=2A1(OH)3;+3(NH4)2SO4A13+ + 3NH3-H2O^=A1(OH)3;+3NH4+10、向硫酸铝溶液中加入碳酸钠溶液:A12(SO4)3+3Na2CO3+3H2O^=2A1(OH)3;+3Na2SO4+3CO2f2A13++3CO32- + 3H2O^=2A1(OH)3;+3CO2 f11、向硫酸铝溶液中加入碳酸氢钠溶液:A12(SO4)3+6NaHCO3^=2A1(OH)3;+3Na2SO4+6CO2 fA13+ + 3HCO3- =A1(OH)3;+3CO2f12、向硫酸铝溶液中加入硫化钠溶液:A12(SO4)3+3Na2S+6H2O^=2A1(OH)3 "3Na2sO4+3H2s f2A13++3S2- + 6H2O^=2A1(OH)3;+3H2S f13、向硫酸铝溶液中加入硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O^=2Al(OH)3 "3Na2sO4+6H2s fAl3+ + 3HS- + 3H2O^=Al(OH)3 "3H2s f14、向硫酸铝溶液中加入硅酸钠溶液:Al2(SO4)3+3Na2SiO3+ 6H2O^=2Al(OH)3 ;+3Na2SO4+3H2SiO3;2Al3++3SiO32- + 6H2O^=2Al(OH)3;+3H2SiO3 ;15、向硫酸铝溶液中加入偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+ 12H2O^=3Na2SO4+8Al(OH)3;Al3++AlO2- + 6H2O^=4Al(OH)3;五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+ 2H2O=AI(OH)3+NaOHAlO2- + 2H2O^^Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+ HCl + H2O^=Al(OH)3;+NaClAlO2- + H+ + H2O^=Al(OH)3;3、向偏铝酸钠溶液加入足量盐酸:NaAlO2+4HCl^=NaCl+AlCl3+2H2OAlO2-+4H+=Al3+ + 2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+ 3H2O^=2Al(OH)3;+Na2CO32AlO2- + CO2+3H2O^=2Al(OH)3;+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+ CO2+ 2H2O^=Al(OH)3+NaHCO3AlO2- + CO2+ 2H2O^=Al(OH)3+HCO3-6、向偏铝酸钠溶液中加入硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O^=3Na2SO4+8Al(OH)3;Al3++AlO2- + 6H2O^=4Al(OH)3;7、向偏铝酸钠溶液中加入氯化铵溶液:NaAlO2+ NH4Cl + H2O^=Al(OH)3;+NaCl + NH3 fAlO2- + NH4+ + H2O^=Al(OH)3;+NH3 f8、向偏铝酸钠溶液中加入氯化铁溶液:3NaAlO2+ FeCl3+6H2O^=3Al(OH)3;+Fe(OH)3 ;+3NaCl3AlO2- + Fe3+ + 6H2O^=3Al(OH)3;+Fe(OH)3 ;。

钠及其化合物的计算与实验探究复习目标 1.多角度认识Na 2O 2与H 2O 、CO 2的反应。
2.掌握Na 2CO 3、NaHCO 3与盐酸反应的原理与定量分析。
3.学会用实验的方法测定Na 2CO 3的质量分数。
考点一 Na 2O 2与H 2O 、CO 2的反应规律与实验探究1.Na 2O 2与CO 2、H 2O 的反应规律Na 2O 2与CO 2、H 2O(g)的混合气体反应,可看作Na 2O 2先与CO 2反应,完毕后再与H 2O(g)反应。
2.气体体积关系若CO 2和水蒸气的混合气体(或单一气体)通过足量Na 2O 2,气体体积的减少量等于原混合气体体积的12且等于生成氧气的体积,即ΔV =V (O 2)=12V (混合)。
3.电子转移关系当Na 2O 2与CO 2、H 2O 反应时,物质的量关系为2Na 2O 2~O 2~2e -,n (e -)=n (Na 2O 2)=2n (O 2)。
4.固体质量关系相当于固体(Na 2O 2)只吸收了CO 2中的“CO ”、H 2O 中的“H 2”,可以看作发生相应的反应:Na 2O 2+CO===Na 2CO 3、Na 2O 2+H 2===2NaOH(实际上两反应不能发生),所以固体增加的质量Δm (CO 2)=28 g·mol -1×n (CO 2),Δm (H 2O)=2 g·mol -1×n (H 2O)。
题组一 Na 2O 2与H 2O 、CO 2反应的定量分析 1.用单线桥分析Na 2O 2与水反应中电子转移的方向和数目:___________________________。
(1)氧化剂和还原剂是____________________________,氧化产物是_____________________, 还原产物是_____________________________________________________________________。
化学方程式一、钠1、钠在氧气中燃烧:2Na+O2Na2O22、钠在氯气中燃烧:2Na+Cl22NaCl3、钠常温条件下和氧气反响:4Na+O22Na2O4、钠和硫共热:2Na+S Na2S5、钠和水反响:2Na+2H2O2NaOH+H2↑2Na+2H2O2Na++2OH-+H2↑6、钠和稀盐酸反响:2Na+2HCl2NaCl+H2↑2Na+2H+2Na++H2↑7、钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O Na2SO4+Cu(OH)2↓+H2↑2Na+Cu2++2H2O2Na++Cu(OH)2↓+H2↑8、向氯化铝溶液中参加少量的钠:6Na+2AlCl3+6H2O6NaCl+2Al(OH)3↓+3H2↑6Na+2Al3++6H2O6Na++Al(OH)3↓+3H2↑9、向氯化铝溶液中参加足量的钠:4Na+AlCl3+2H2O NaAlO2+3NaCl+2H2↑4Na+Al3++2H2O4Na++AlO2-+2H2↑10、钠在高温条件下与四氯化钛反响:4Na+TiCl44NaCl+Ti二、氧化钠1、氧化钠和水反响:Na2O+H2O=2NaOHNa2O+H2O2Na++2OH-2、氧化钠与二氧化碳反响:Na2O+CO2Na2CO33、氧化钠与盐酸反响:Na2O+2HCl2NaCl+H2ONa2O+2H+2Na++H2O4、向硫酸铜溶液中参加氧化钠:Na2O+CuSO4+H2O Cu(OH)2↓+Na2SO4Na2O+Cu2++H2O Cu(OH)2↓+2Na+5、向氯化铝溶液中参加少量的氧化钠:3Na2O+2AlCl3+3H2O2Al(OH)3↓+6NaCl3Na2O+2Al3++3H2O===2Al(OH)3↓+6Na+6、向氯化铝溶液中参加足量的氧化钠:2Na2O+AlCl3NaAlO2+3NaCl2Na2O+Al3+AlO2-+4Na+三、过氧化钠1、过氧化钠与水反响:2Na2O2+2H2O4NaOH+O2↑2Na2O2+2H2O===4Na++4OH-+O2↑2、过氧化钠与二氧化碳反响:2Na2O2+2CO22Na2CO3+O2↑3、过氧化钠与盐酸反响:2Na2O2+4HCl4NaCl+2H2O+O2↑2Na2O2+4H+4Na++2H2O+O2↑4、向硫酸铜溶液中参加过氧化钠:2Na2O2+2CuSO4+2H2O===2Cu(OH)2↓+2Na2SO4+O2↑2Na2O2+2Cu2++2H2O2Cu(OH)2↓+4Na++O2↑5、向氯化铝溶液中参加少量的过氧化钠:6Na2O2+4AlCl3+6H2O4Al(OH)3↓+12NaCl+3O2↑6Na2O2+4Al3++6H2O4Al(OH)3↓+12Na++3O2↑6、向氯化铝溶液中参加过量的过氧化钠:2Na2O2+AlCl3+2H2O NaAlO2+3NaCl+O2↑2Na2O2+Al3++2H2O AlO2-+4Na++O2↑7、过氧化钠与硫酸亚铁溶液反响:4Na2O2+4FeSO4+6H2O4Fe(OH)3↓+4Na2SO4+O2↑4Na2O2+4Fe2++6H2O4Fe(OH)3↓+8Na++O2↑四、氢氧化钠1、铝与氢氧化钠溶液反响:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑2、氯气通入氢氧化钠溶液中:Cl2+2NaOH NaCl+NaClO+H2OCl2+2OH-Cl-+ClO-+H2O3、氯气通入热的浓氢氧化钠溶液中:3Cl2+6NaOH5NaCl+NaClO3+3H2O3Cl2+6OH-5Cl-+ClO3-+3H2O 4、硫和氢氧化钠溶液共热:3S+6NaOH2Na2S+Na2SO3+3H2O3S+6OH-2S2-+SO32-+3H2O5、硅溶于氢氧化钠溶液中:Si+2NaOH+H2O Na2SiO3+2H2↑Si+2OH-+H2O SiO32-+2H2↑6、氧化铝溶于氢氧化钠溶液中:Al2O3+2NaOH2NaAlO2+H2OAl2O3+2OH-2AlO2-+H2O7、向氢氧化钠溶液入少量的二氧化碳:2NaOH+CO2Na2CO3+H2O2OH-+CO2CO32-+H2O8、向氢氧化钠溶液入过量的二氧化碳:NaOH+CO2NaHCO3OH-+CO2HCO3-9、向氢氧化钠溶液入少量的二氧化硫:2NaOH+SO2Na2SO3+H2O2OH-+SO2SO32-+H2O10、向氢氧化钠溶液入过量的二氧化硫:NaOH+SO2NaHSO3OH-+SO2HSO3-11、五氧化二磷与氢氧化钠溶液反响:P2O5+6NaOH2Na3PO4+3H2OP2O5+6OH-2PO43-+3H2O12、二氧化氮和氢氧化钠溶液反响:2NO2+2NaOH NaNO2+NaNO3+H2O2NO2+2OH-NO2-+NO3-+H2O13、一氧化氮、二氧化氮和氢氧化钠溶液反响:NO+NO2+2NaOH2NaNO2+H2O NO+NO2+2OH-2NO2-+H2O14、将二氧化硅溶于氢氧化钠溶液中:2NaOH+SiO2Na2SiO3+H2O2OH-+SiO2SiO32-+H2O15、三氧化硫和氢氧化钠溶液反响:SO3+2NaOH Na2SO4+H2OSO3+2OH-SO42-+H2O16、盐酸和氢氧化钠溶液反响:HCl+NaOH NaCl+H2OH++OH-H2O17、醋酸和氢氧化钠溶液反响:CH3COOH+NaOH CH3COONa+H2OCH3COOH+OH-CH3COO-+H2O18、向氢氧化钠溶液入少量的硫化氢:H2S+2NaOH Na2S+2H2OH2S+2OH-S2-+2H2O19、向氢氧化钠溶液入足量的硫化氢:H2S+NaOH NaHS+H2OH2S+OH-HS-+H2O20、硫酸和氢氧化钠溶液反响:H2SO4+2NaOH Na2SO4+2H2OH++OH-H2O21、磷酸溶液氢氧化钠溶液反响:H3PO4+3NaOH Na3PO4+3H2OH3PO4+3OH-PO43-+3H2O22、将氢氧化铝溶于氢氧化钠溶液中:Al(OH)3+NaOH NaAlO2+2H2OAl(OH)3+OH-AlO2-+2H2O23、向硝酸银溶液中参加氢氧化钠溶液:AgNO3+NaOH AgOH ↓+NaNO3Ag++OH-AgOH ↓24、向硫酸铜溶液中参加氢氧化钠溶液:CuSO4+2NaOH Na2SO4+Cu(OH)2↓Cu2++2OH-Cu(OH)2↓25、向氯化铁溶液中参加氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH-Fe(OH)3↓26、向氯化铝溶液中参加少量氢氧化钠溶液:AlCl3+3NaOH Al(OH)3↓+3NaClAl3++3OH-Al(OH)3↓27、向氯化铝溶液中参加足量氢氧化钠溶液:AlCl3+4NaOH NaAlO2+3NaCl+2H2O Al3++4OH-AlO2-+2H2O28、向氯化铵溶液参加氢氧化钠溶液,加热:NH4Cl+NaOH NaCl+NH3↑+H2ONH4++OH-NH3↑+H2O29、向碳酸氢铵溶液中参加少量氢氧化钠溶液共热:NH4HCO3+NaOH NaHCO3+NH3↑+H2ONH4++OH-NH3↑+H2O30、向碳酸氢铵溶液中参加足量氢氧化钠溶液共热:NH4HCO3+2NaOH Na2CO3+NH3↑+2H2ONH4++HCO3-+OH-CO32-+NH3↑+2H2O31、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O32、向碳酸氢钙溶液中参加少量氢氧化钠溶液:Ca(HCO3)2+NaOH CaCO3↓+NaHCO3+H2OCa2++HCO3-+OH-CaCO3↓+H2O33、向碳酸氢钙溶液中参加过量氢氧化钠溶液:Ca(HCO3)2+2NaOH CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3+CO32-+2H2O34、向碳酸氢镁溶液中参加少量的氢氧化钠溶液:Mg(HCO3)2+2NaOH Mg(OH)2↓+2NaHCO3Mg2++OH-Mg(OH)2↓35、向碳酸氢镁溶液中参加过量的氢氧化钠溶液:Mg(HCO3)2+4NaOH Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO32-+4OH-Mg(OH)2↓+2CO32-+2H2O五、氯化钠1、氯化钠溶液与硝酸银溶液混合:NaCl+AgNO3AgCl↓+NaNO3Cl-+Ag+AgCl ↓2、氯化钠固体和浓硫酸共热:NaCl+H2SO4Na2SO4+2HCl↑3、电解饱和的氯化钠溶液:2NaCl+2H2O2NaOH+H2↑+Cl2↑2Cl-+2H2O2OH-+H2↑+Cl2↑4、电解氯化钠的熔融液:2NaCl2Na+Cl2↑六、碳酸钠1、碳酸钠溶液与澄清石灰水反响:Na2CO3+Ca(OH)2CaCO3↓+2NaOH CO32-+Ca2+CaCO3↓2、碳酸钠溶液与氯化钡溶液混合:Na2CO3+BaCl2BaCO3↓+2NaCl CO32-+Ba2+BaCO3↓3、碳酸钠溶液呈碱性:Na2CO3+H2O NaHCO3+NaOHCO32-+H2O HCO3-+OH-4、碳酸钠溶液滴入少量的盐酸:Na2CO3+HCl NaHCO3+NaClCO32-+H+HCO3-5、碳酸钠溶液滴入足量的盐酸:Na2CO3+2HCl2NaCl+CO2↑+H2OCO32-+2H+CO2↑+H2O6、碳酸钠溶液中参加醋酸:Na2CO3+2CH3COOH2CH3COONa+CO2↑+H2OCO32-+2CH3COOH2CH3COO-+CO2↑+H2O7、碳酸钠溶液入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO3CO32-+CO2+H2O2HCO3-8、向饱和的碳酸钠溶液入二氧化碳气体:Na2CO3+CO2+H2O2NaHCO32Na++CO32-+CO2+H2O2NaHCO3↓9、碳酸钠溶液与氯化铝溶液混合:3Na2CO3+2AlCl3+3H2O2Al(OH)3↓+6NaCl+3CO2↑3CO32-+2Al3++3H2O2Al(OH)3↓+3CO2↑10、碳酸钠溶液与氯化铁溶液混合:3Na2CO3+2FeCl3+3H2O2Fe(OH)3↓+6NaCl+3CO2↑3CO32-+2Fe3++3H2O2Fe(OH)3↓+3CO2↑七、碳酸氢钠1、碳酸氢钠溶液呈碱性:NaHCO3+H2O H2CO3+NaOHHCO3-+H2O H2CO3+OH-2、碳酸氢钠溶液滴入盐酸:NaHCO3+HCl NaCl+CO2↑+H2OHCO3-+H+CO2↑+H2O3、碳酸氢钠溶液滴入醋酸:NaHCO3+CH3COOH CH3COONa+CO2↑+H2OHCO3-+CH3COOH CH3COO-+CO2↑+H2O4、碳酸氢钠溶液与氯化铝溶液混合:3NaHCO3+AlCl3Al(OH)3↓+3NaCl+3CO2↑3HCO3-+Al3+Al(OH)3↓+3CO2↑5、碳酸氢钠溶液与氯化铁溶液混合:3NaHCO3+FeCl3Fe(OH)3↓+3NaCl+3CO2↑3HCO3-+Fe3+Fe(OH)3↓+3CO2↑6、碳酸氢钠溶液与氢氧化钠溶液混合:NaHCO3+NaOH Na2CO3+H2OHCO3-+OH-CO32-+H2O7、碳酸氢钠溶液中参加过量氢氧化钙溶液:NaHCO3+Ca(OH)2 =CaCO3↓+NaOH+H2OCa2++HCO3-+OH-CaCO3↓+H2O 8、碳酸氢钠溶液中参加少量氢氧化钙溶液:2NaHCO3+Ca(OH)2 =CaCO3↓+Na2CO3+2H2OCa2++2HCO3-+2OH-CaCO3↓+CO32-+2H2O9、碳酸氢钠受热分解:2NaHCO3Na2CO3+CO2↑+H2O一、镁1、镁在氧气中燃烧:2Mg+O22MgO2、镁在氯气中燃烧:Mg+Cl2MgCl23、镁在氮气中燃烧:3Mg+N2Mg3N24、镁在二氧化碳中燃烧:2Mg+CO22MgO+C5、镁与硫共热:Mg+S MgS6、镁与水共热:Mg+2H2O Mg(OH)2+H2↑7、镁和盐酸反响:Mg+2HCl MgCl2+H2↑Mg+2H+Mg2++H2↑8、镁和醋酸反响:Mg+2CH3COOH(CH3COO)2Mg+H2↑Mg+2CH3COOH2CH3COO-+Mg2++H2↑9、镁和氯化铵溶液反响:Mg+2NH4Cl MgCl2+2NH3↑+H2↑Mg+2NH4+Mg2++2NH3↑+H2↑10、将少量的镁投入到氯化铁溶液中:Mg+2FeCl32FeCl2+MgCl2Mg+2Fe3+Mg2++2Fe2+11、将过量的镁投入到氯化铁溶液中:3Mg+2FeCl33MgCl2+2Fe3Mg+2Fe3+3Mg2++2Fe12、镁和硫酸铜溶液反响:Mg+CuSO4MgSO4+CuMg+Cu2+Mg2++Cu13、镁和浓硫酸反响:Mg+2H2SO4MgSO4+SO2↑+2H2O14、镁和浓硝酸反响:Mg+4HNO3Mg(NO3)2+2NO2↑+2H2OMg+4H++2NO3-Mg2++2NO2↑+2H2O15、镁和稀硝酸反响:3Mg+8HNO33Mg(NO3)2+2NO ↑+4H2O3Mg+8H++2NO3-Mg2++2NO ↑+4H2O二、氧化镁1、氧化镁与盐酸反响:MgO+2HCl MgCl2+H2OMgO+2H+Mg2++H2O2、氧化镁和醋酸反响:MgO+2CH3COOH(CH3COO)2Mg+H2OMgO+2CH3COOH Mg2++2CH3COO-+H2O 3、氧化镁溶于氯化铵溶液中:MgO+2NH4Cl MgCl2+2NH3↑+H2OMgO+2NH4+Mg2++2NH3↑+H2O4、氧化镁投入到氯化铁溶液中:3MgO+2FeCl3+3H2O3MgCl2+2Fe(OH)33MgO+2Fe3++3H2O3Mg2++2Fe(OH)3三、氢氧化镁1、氢氧化镁和盐酸反响:Mg(OH)2+2HCl MgCl2+2H2OMg(OH)2+2H+Mg2++2H2O2、氢氧化镁和醋酸反响:Mg(OH)2+2CH3COOH(CH3COO)2Mg+2H2OMg(OH)2+2CH3COOH2CH3COO-+Mg2++2H2O 3、氢氧化镁溶于氯化铵溶液中:Mg(OH)2+2NH4Cl MgCl2+2NH3↑+2H2OMg(OH)2+2NH4+Mg2++2NH3↑+2H2O 4、氢氧化镁投入到氯化铁溶液中:3Mg(OH)2+2FeCl33MgCl2+2Fe(OH)33Mg(OH)2+2Fe3+3Mg2++2Fe(OH)35、氢氧化镁受热分解:Mg(OH)2MgO+H2O四、氯化镁1、氯化镁溶液与硝酸银溶液反响:MgCl2+2AgNO32AgCl ↓+Mg(NO3)2Cl-+Ag+AgCl ↓2、氯化镁溶液中参加氢氧化钠溶液:MgCl2+2NaOH=Mg(OH)2↓+2NaClMg2++2OH-Mg(OH)2↓3、氯化镁溶液参加氨水:MgCl2+2NH3·H2O Mg(OH)2↓+2NH4ClMg2++2NH3·H2O Mg(OH)2↓+2NH4+4、氯化镁溶液中参加偏铝酸钠溶液:MgCl2+2NaAlO2+4H2O Mg(OH)2↓+2Al(OH)3↓+2NaClMg2++2AlO2-+4H2O Mg(OH)2↓+2Al(OH)3↓5、电解氯化镁的熔融液:MgCl2Mg+Cl2↑6、电解氯化镁的溶液:MgCl2+2H2O Mg(OH)2↓+H2↑+Cl2↑Mg2++2Cl-+2H2O Mg(OH)2↓+H2↑+Cl2↑五、碳酸镁1、碳酸镁与盐酸反响:MgCO3+2HCl===MgCl2+CO2↑+H2OMgCO3+2H+===Mg2++CO2↑+H2O2、碳酸镁与醋酸溶液反响:MgCO3+2CH3COOH===(CH3COO)2Mg+CO2↑+H2OMgCO3+2CH3COOH===2CH3COO-+Mg2++CO2↑+H2O3、碳酸镁悬浊液通入二氧化碳气体:MgCO3+CO2+H2O===Mg(HCO3)2MgCO3+CO2+H2O===Mg2++2HCO3-4、碳酸镁参加到氯化铁溶液中:3MgCO3+2FeCl3+3H2O===3MgCl2+2Fe(OH)3↓+3CO2↑3MgCO3+2Fe3++3H2O===3Mg2++2Fe(OH)3↓+3CO2↑5、碳酸镁参加氯化铵溶液中:MgCO3+2NH4Cl===MgCl2+2NH3↑+CO2↑MgCO3+2NH4+===Mg2++2NH3↑+CO2↑6、碳酸镁高温煅烧:MgCO3高温MgO+CO2↑六、碳酸氢镁1、碳酸氢镁与盐酸反响:Mg(HCO3)2+2HCl===MgCl2+2CO2↑+2H2OHCO3-+H+===CO2↑+H2O2、碳酸氢镁与少量的氢氧化钠溶液反响:Mg(HCO3)2+2NaOH===Mg(OH)2↓+2NaHCO3Mg2++2OH-===Mg(OH)2↓3、碳酸氢镁与过量的氢氧化钠溶液反响:Mg(HCO3)2+4NaOH===Mg(OH)2↓+Na2CO3+2H2OMg2++2HCO3-+4OH-===Mg(OH)2↓+2CO32-+2H2O4、碳酸氢镁与澄清石灰水反响:Mg(HCO3)2+2Ca(OH)2===Mg(OH)2↓+2CaCO3↓+2H2OMg2++2HCO3-+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O5、碳酸氢镁受热分解:Mg(HCO3)2△MgCO3↓+CO2↑+H2O一、铝1、铝在氧气中燃烧:4Al+3O22Al2O32、铝在氯气中燃烧:2Al+3Cl22AlCl33、铝和硫共热:2Al+3S Al2S34、铝与稀硫酸反响:2Al+3H2SO4Al2(SO4)3+3H2↑2Al+6H+2Al3++3H2↑5、铝和氢氧化钠溶液反响:2Al+2NaOH+2H2O2NaAlO2+3H2↑2Al+2OH-+2H2O2AlO2-+3H2↑6、铝和浓硫酸共热:2Al+6H2SO4Al2(SO4)3+3SO2↑+6H2O7、铝和浓硝酸共热:Al+6HNO3Al(NO3)3+3NO2↑+3H2OAl+6H++3NO3-Al3++3NO2↑+3H2O 8、铝和稀硝酸反响:Al+4HNO3Al(NO3)3+NO ↑+2H2OAl+4H++NO3-Al3++NO ↑+2H2O8、铝和硝酸银溶液反响:Al+3AgNO3Al(NO3)3+3AgAl+3Ag+Al3++3Ag9、铝与硫酸铜溶液反响:2Al+3CuSO4Al2(SO4)3+3Cu2Al+3Cu2+2Al3++3Cu10、铝和氧化铁高温下反响:2Al+Fe2O3Al2O3+2Fe11、铝和四氧化三铁高温共热:8Al+3Fe3O44Al2O3+9Fe12、铝和氧化铜高温共热:2Al+3CuO Al2O3+3Cu13、铝和二氧化锰高温共热:4Al+3MnO22Al2O3+3Mn二、氧化铝1、氧化铝与稀硫酸反响:Al2O3+3H2SO4Al2(SO4)3+3H2OAl2O3+6H+2Al3++3H2O2、氧化铝与氢氧化钠溶液反响:Al2O3+2NaOH2NaAlO2+H2OAl 2O 3+2OH -2AlO 2-+H 2O3、电解氧化铝的熔融液:2Al 2O 34Al +3O 2↑三、氢氧化铝1、氢氧化铝与稀硫酸反响:2Al(OH)3 +3H 2SO 4Al 2(SO 4)3 +6H 2O Al(OH)3 +3H +Al 3++3H 2O2、氢氧化铝与氢氧化钠溶液反响:Al(OH)3 +NaOH NaAlO 2+2H 2OAl(OH)3 +OH -AlO 2-+2H 2O3、加热氢氧化铝:2Al(OH)3Al 2O 3+3H 2O四、硫酸铝1、硫酸铝溶液与氯化钡溶液混合:Al 2(SO 4)3 +3BaCl 22AlCl 3+3BaSO 4↓SO 42-+Ba 2+BaSO 4↓2、硫酸铝的水溶液呈酸性:Al 2(SO 4)3+6H 2O 2Al(OH)3 +3H 2SO 4Al 3++3H 2O Al(OH)3 +3H + 3、硫酸铝溶液中参加少量的氢氧化钠溶液:Al 2(SO 4)3 +6NaOH3Na 2SO 4+2Al(OH)3↓Al 3++3OH -Al(OH)3↓4、向硫酸铝溶液中加足量的氢氧化钠溶液: Al 2(SO 4)3 +8NaOH 2NaAlO 2+3Na 2SO 4+4H 2OAl 3++4OH -AlO 2-+2H 2O5、向硫酸铝溶液中参加少量的氢氧化钡溶液: Al 2(SO 4)3 +3Ba(OH)22Al(OH)3↓+3BaSO 4↓2Al 3++3SO 42-+3Ba 2++6OH -2Al(OH)3↓+3BaSO 4↓6、向硫酸铝溶液中参加足量的氢氧化钡溶液: Al 2(SO 4)3 +4Ba(OH)2Ba(AlO 2)2 +3BaSO 4↓+4H 2O2Al 3++3SO 42-+3Ba 2++8OH -2AlO 2-+3BaSO 4↓+4H 2O7、向明矾溶液中参加少量的氢氧化钡溶液:3Ba(OH)2 +2KAl(SO 4)22Al(OH)3↓+3BaSO 4↓+K 2SO 4冰晶石电解3Ba2++6OH-+2Al3++3SO42-3BaSO4↓+2Al(OH)3↓8、向明矾溶液中参加足量的氢氧化钡溶液:KAl(SO4)2+2Ba(OH)2KAlO2+2BaSO4↓+2H2OAl3++2SO42-+2Ba2++4OH-AlO2-+2BaSO4↓+2H2O9、向硫酸铝溶液中参加氨水:Al2(SO4)3+6NH3·H2O2Al(OH)3↓+3(NH4)2SO4Al3++3NH3·H2O Al(OH)3↓+3NH4+10、向硫酸铝溶液中参加碳酸钠溶液:Al2(SO4)3+3Na2CO3+3H2O2Al(OH)3↓+3Na2SO4+3CO2↑2Al3++3CO32-+3H2O2Al(OH)3↓+3CO2↑11、向硫酸铝溶液中参加碳酸氢钠溶液:Al2(SO4)3+6NaHCO32Al(OH)3↓+3Na2SO4+6CO2↑Al3++3HCO3-Al(OH)3↓+3CO2↑12、向硫酸铝溶液中参加硫化钠溶液:Al2(SO4)3+3Na2S+6H2O2Al(OH)3↓+3Na2SO4+3H2S ↑2Al3++3S2-+6H2O2Al(OH)3↓+3H2S ↑13、向硫酸铝溶液中参加硫氢化钠溶液:Al2(SO4)3+6NaHS+6H2O2Al(OH)3↓+3Na2SO4+6H2S ↑Al3++3HS-+3H2O Al(OH)3↓+3H2S ↑14、向硫酸铝溶液中参加硅酸钠溶液:Al2(SO4)3+3Na2SiO3+6H2O2Al(OH)3↓+3Na2SO4+3H2SiO3↓2Al3++3SiO32-+6H2O2Al(OH)3↓+3H2SiO3↓15、向硫酸铝溶液中参加偏铝酸钠溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓五、偏铝酸钠1、偏铝酸钠溶液呈碱性:NaAlO2+2H2O AI(OH)3+NaOHAlO2-+2H2O Al(OH)3+OH-2、偏铝酸钠溶液滴入少量盐酸:NaAlO2+HCl+H2O Al(OH)3↓+NaClAlO2-+H++H2O Al(OH)3↓3、向偏铝酸钠溶液参加足量盐酸:NaAlO2+4HCl NaCl+AlCl3+2H2OAlO2-+4H+Al3++2H2O4、向偏铝酸钠溶液通入少量二氧化碳气体:2NaAlO2+CO2+3H2O2Al(OH)3↓+Na2CO32AlO2-+CO2+3H2O2Al(OH)3↓+CO32-5、向偏铝酸钠溶液通入足量二氧化碳气体:NaAlO2+CO2+2H2O Al(OH)3+NaHCO3AlO2-+CO2+2H2O Al(OH)3+HCO3-6、向偏铝酸钠溶液中参加硫酸铝溶液:Al2(SO4)3+6NaAlO2+12H2O3Na2SO4+8Al(OH)3↓Al3++AlO2-+6H2O4Al(OH)3↓7、向偏铝酸钠溶液中参加氯化铵溶液:NaAlO2+NH4Cl+H2O Al(OH)3↓+NaCl+NH3↑AlO2-+NH4++H2O Al(OH)3↓+NH3↑8、向偏铝酸钠溶液中参加氯化铁溶液:3NaAlO2+FeCl3+6H2O3Al(OH)3↓+Fe(OH)3↓+3NaCl3AlO2-+Fe3++6H2O3Al(OH)3↓+Fe(OH)3↓。
钠元素单质及其化合物(1)钠的物理性质: 钠是银白色金属, 密度小(0.97g/cm3), 熔点低(97℃), 硬度小, 质软, 可用刀切割。
钠通常保存在煤油中。
是电和热的良导体。
(2)钠的化学性质: 从原子结构可知钠是活泼的金属单质。
①钠与非金属单质反应: 常温: 4Na + O2 == 2Na2O,加热: 2Na + O2 Na2O2;2Na + Cl2 △2NaCl; 2Na + S△Na2S等。
②钠与水反应:2Na + 2H2O == 2NaOH + H2↑;实验现象: 钠浮在水面上, 熔成小球,在水面上游动, 有哧哧的声音, 最后消失, 在反应后的溶液中滴加酚酞, 溶液变红注意: 钠在空气中的变化: 银白色的钠变暗(生成了氧化钠)变白(生成氢氧化钠)潮解变成白色固体(生成碳酸钠)。
常温下金属钠在空气中表面变暗,生成氧化膜, 说明钠比Al、Fe活泼得多(应用)钠保存在石蜡油或煤油中, 因为钠易与水或者空气中的氧气反应, 而钠不与煤油反应, 且钠的密度大于煤油的密度, 所以保存在煤油中③钠与酸反应: 如2Na + 2HCl == 2NaCl + H2↑,Na放入稀盐酸中, 是先与酸反应, 酸不足再与水反应。
因此Na放入到酸中Na是不可能过量的。
同时Na与H2的物质的量比始终是2:1。
当然反应要比钠与水的反应剧烈多。
④钠与盐的溶液反应:钠不能置换出溶液中的金属, 钠是直接与水反应。
反应后的碱再与溶液中的其他物质反应。
如钠投入到硫酸铜溶液的反应式:2Na + CuSO4 + 2H2O == Cu(OH)2 ↓+ Na2SO4 + H2 ↑。
⑤钠与氢气的反应: 2Na + H2 == 2NaH。
NaH + H2O == NaOH + H2 ;NaH是强的还原剂。
(3)工业制钠:电解熔融的NaCl, 2NaCl(熔融) 2Na + Cl2↑。
(4)钠的用途:①在熔融的条件下钠可以制取一些金属, 如钛、锆、铌、钽等;②钠钾合金是快中子反应堆的热交换剂;③钠蒸气可作高压钠灯, 发出黄光, 射程远, 透雾能力强。
专题——钠及其化合物的计算【技能方法1】过氧化钠与H2O、CO2反应的重要关系及计算2CO2+2 Na2O2=2 Na2CO3 +O22H2O+2 Na2O2=4 NaOH +O2(1)物质的量关系无论是H2O或CO2得单一物质还是二者的混合物,通过足量的Na2O2时,H2O或CO2与放出O2的物质的量之比均为2:1。
(2)气体体积关系若CO2和水蒸气的混合气体(或单一气体)通过足量的Na2O2时,气体体积的减少量等于原混合气体体积的1/2,也等于生成氧气的量。
(3)电子转移关系当Na2O2与H2O、CO2反应时,物质的量关系为2Na2O2∽ H2O ∽ 2e-。
(4)固体质量关系凡分子组成符合(CO)m(H2)n的物质,m g该物质在O2中完全燃烧,将其产物(CO2和水蒸气)通过足量Na2O2后,固体增重必为m g。
或者是由C、H、O三种元素组成的物质,只要C、O原子个数比为1∶1,即可满足上述条件。
中学阶段常见的符合这一关系的物质有:①无机物:H2、CO及H2和CO的混合气体。
②有机物:CH3OH(甲醇)、HCHO(甲醛)、CH3COOH(乙酸)、HCOOCH3(甲酸甲酯)、C6H12O6(葡萄糖)等。
(5)先后顺序关系一定量的Na2O2与一定量的CO2和H2O(g) 的混合物的反应,可看作Na2O2先与CO2反应,待CO2反应完全后,Na2O2再与H2O(g)发生反应。
【技能方法2】碳酸钠与碳酸氢钠与盐酸反应及图像1、盐酸逐滴加入Na2CO3溶液中①现象:开始无明显现象,后有无色气体放出。
②反应:无明显现象时反应的离子方程式:CO32-+H+===HCO3-,无色气体放出时反应的离子方程式:HCO3-+H+===CO2↑+H2O。
2、Na2CO3溶液逐滴加入稀盐酸中①现象:有无色气体放出。
②反应的离子方程式:CO32-+2H+===CO2↑+H2O。
3、碳酸钠、碳酸氢钠与盐酸反应的基本图像的归纳总结①向Na2CO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图1所示;②向NaHCO3中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图2所示;③向NaOH、Na2CO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图3所示(设NaOH、Na2CO3的物质的量之比x∶y=1∶1,其他比例时的图像略);④向Na2CO3、NaHCO3的混合物中逐滴加入盐酸,消耗HCl的体积与产生CO2的体积的关系如图4所示(设Na2CO3、NaHCO3的物质的量之比m∶n=1∶1,其他比例时的图像略)。
1.在一定条件下,将钠与氧气反应的生成物1.5 g溶于水,所得溶液恰好能被80 mL浓度为0.50 mol·L-1的HCl溶液中和,则该生成物的成分是( )
A.Na2O B.Na2O2
C.Na2O和Na2O2 D.Na2O2和NaO2
2.将0.01 mol下列物质分别加入100 mL蒸馏水中,恢复至室温,所得溶液中阴离子浓度的大小顺序是(溶液体积变化忽略不计) ( )
①Na2O2 ②Na2O ③Na2CO3 ④NaCl
A.①>②>③>④ B.①>②>④>③
C.①=②>③=④ D.①=②>③>④
3.向NaOH和Na2CO3混合溶液中滴加0.1 mol·L-1稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如下图所示。
下列判断正确的是( )
A.在0~a范围内,只发生中和反应
B.ab段发生反应的离子方程式为CO+2H+===CO2↑+H2O
C.a=0.3
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
4.将一定量的NaOH和NaHCO3的混合物X放在密闭容器中加热,充分反应后生成V1L气体Z(V1≠0)。
反应后的固体残渣Y与过量的稀盐酸反应,又生成V2 L气体Z(V1、V2均为标准状况下气体的体积)。
下列判断错误的是( )
A.Y的成分为Na2CO3
B.Z的成分为CO2
C.V1>V2
D.X中n(Na+)= mol
5.某学生用NaHCO3和KHCO3组成的混合物样品与某种浓度的盐酸反应进行实验,测得数据如下表:
实验编号①②③
盐酸体积/L505050
m(混合物)/g9.226.5636.8
V(CO2)(标准状
2.24 4.48 4.48
况)/L
分析表中数据,下列说法中不正确的是( )
A.由①②可知:①中的盐酸过量
B.由②③可知:混合物的质量增加,而气体体积没有变化,说明盐酸已经完全反应
C.所用盐酸的物质的量浓度为0.4 mol·L-1
D.该混合物中NaHCO3的物质的量分数为50%
6.工业纯碱中常含有少量的NaCl杂质,某化学兴趣小组取a g纯碱样品与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体。
则该样品中纯碱的质量分数为( )
A.×100%
B.×100%
C.×100%
D.×100%
7.将4.34 g Na、Na2O、Na2O2的混合物与足量水反应,在标准状况下
得到672 mL混合气体,将该混合气体点燃,恰好完全反应,则原固体混
合物中Na、Na2O、Na2O2的物质的量之比为( )
A.1∶1∶1 B.1∶1∶2
C.1∶2∶1 D.4∶3∶2
8.现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定
Na2O2试样的纯度。
(可供选用的反应物只有CaCO3固体、6 mol·L-1盐
酸、6 mol·L-1硫酸和蒸馏水)
回答下列问题:
(1)装置A中液体试剂选用
________________________________________________________。
(2)装置B的作用是____________________________。
装置E中碱石灰的
作用是
________________________________________________________________________ ________________________________________________________________________ (3)装置D中发生反应的化学方程式是
______________________________________________
________________________________________________________________________
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
答案解析
1.C [由于n(NaOH)=n(HCl)=80 mL×10-3L·mL-1×0.50 mol·L-1=0.04 mol,由Na原子守恒,若生成物为Na2O,则m(Na2O)=0.04 mol××62 g·mol-1=1.24 g<1.5 g;若生成物为Na2O2,则m(Na2O2)=0.04 mol××78 g·mol-1=1.56 g>1.5 g。
则生成物是Na2O与Na2O2的混合物。
] 2.D [①、②溶于水,溶质都是NaOH,且物质的量都为0.02 mol,故c(OH-)相等,即①=②;③CO+H2O HCO+OH-,溶液中出现了OH-、HCO,当1 mol CO消耗时会生成2 mol阴离子,溶液中阴离子浓度稍大于④。
]
3.C [在0~a范围内发生反应:OH-+H+===H2O和CO+H
+===HCO,A错误;而a~b段发生反应:HCO+H+===H
O+CO2↑,B
2
错误;在a~b段:n(CO2)=n(H+)=0.01 mol,V(HCl)=0.1 L,所以a=0.4 L-0.1 L=0.3 L,C正确;由碳元素守恒知n(Na2CO3)=n(CO2)=0.01 mol,在0~a范围内,生成0.01 mol HCO消耗0.01 mol盐酸,故NaOH消耗盐酸为0.03 mol-0.01 mol=0.02 mol,原混合溶液中NaOH的物质的量为0.02 mol,因此原混合溶液中NaOH与Na2CO3物质的量之比为2∶1,D错误。
]
4.C [X加热后有CO2生成,所以反应后固体残渣Y中一定无NaOH,只有Na2CO3,依据Na2CO3+2HCl===2NaCl+H2O+CO2↑可知,残渣
Y(Na2CO3)的物质的量为mol,依据Na守恒可知X中n(Na+)=×2,A、B、D均正确;C选项V2>V1。
]
5.C [由表中数据看出,在①中,盐酸过量,在③中,固体过量,
故c(HCl)===4 mol·L-1,C项错误;由数据①,9.2 g固体全部参加反应,根据碳守恒可得:n(NaHCO3)+n(KHCO3)=n(CO2)=0.1 mol,再根据质量守恒可得:m(NaHCO3)+m(KHCO3)=9.2 g,即84 g·mol -1×n(NaHCO
)+100 g·mol-1×n(KHCO3)=9.2 g,联立解得n(NaHCO3)
3
=n(KHCO3)=0.05 mol,即混合物中NaHCO3的物质的量分数为50%,D 项正确。
]
6.D [根据Na2CO3→2NaCl Δm=11,得Na2CO3的质量为×106 g,质量分数为×106÷a×100%=×100%。
]
7.D [本题涉及的反应较多,关系较复杂,宜采用关系式法求解。
因2Na→H2,2Na2O2→O2,2H2+O22H2O,由672 mL混合气体点燃恰好完全反应知V(H2)=2V(O2),则n(Na)=2n(Na2O2),由排除法可知D正确。
]
8.(1)6 mol·L-1盐酸
(2)除去气体中的HCl 吸收装置D中反应剩余的CO2
(3)2Na2O2+2CO2===2Na2CO3+O2,Na2O+CO2===Na2CO3
(4)78%
解析 (1) 硫酸与CaCO3固体反应会很快停止,因为生成的CaSO4会覆盖在CaCO3的表面,阻止二者的反应。
(2)E中的碱石灰用来吸收反应剩余的CO2,防止影响后面的氧气体积的测定。
(4)n(O2)=0.01 mol,根据2Na2O2→O2,w( Na2O2)=×100%=78%。