2015-2016学年江苏省无锡市九年级化学课后巩固作业:3.2《原子的结构》(3)(人教版上册).doc
- 格式:doc
- 大小:74.03 KB
- 文档页数:4

《原子的结构》作业设计方案(第一课时)一、作业目标本次作业旨在通过巩固课堂所学知识,让学生深刻理解原子的基本结构、原子的构成以及核外电子的排布规律等概念,掌握原子的基本性质,并能够运用这些知识解决简单的化学问题。
二、作业内容1. 基础知识巩固学生需完成关于原子结构的基础知识填空题,包括原子核、质子、中子、电子及其相互关系,以及核外电子排布的基本规律。
2. 实践操作题学生需利用提供的元素周期表,查找指定元素(如钠、氯等)的原子结构信息,并绘制出该原子的结构示意图,标明核内质子数、中子数及核外电子排布情况。
3. 理解应用题结合课堂所学的原子结构知识,分析日常生活中常见的物质(如水、盐等)的组成元素及其原子结构特点,并尝试解释其化学性质。
4. 思考探究题提供一些有关原子结构的趣味化学实验(如气体导电实验),鼓励学生探索实验背后的原理,并思考如何利用所学原子结构知识解释实验现象。
三、作业要求1. 所有题目必须独立完成,不得抄袭他人答案。
2. 基础知识的填空题需要准确无误地填写每个空白处。
3. 实践操作题需用规范的方式绘制原子结构示意图,并准确标注相关信息。
4. 理解应用题需要结合所学知识进行合理分析,并用化学语言进行表述。
5. 思考探究题需要记录实验过程和观察到的现象,并尝试用所学的原子结构知识进行解释。
6. 作业需在规定时间内提交,并保持字迹清晰、格式规范。
四、作业评价教师将根据以下标准对学生的作业进行评价:1. 基础知识的掌握程度。
2. 实践操作题的准确性和规范性。
3. 理解应用题的逻辑性和表述能力。
4. 思考探究题的探索精神和解释的合理性。
5. 作业的按时提交情况和整体规范性。
五、作业反馈教师将对每位学生的作业进行详细批改,指出错误并给出正确答案或解释。
对于共性问题,将在课堂上进行集中讲解。
同时,鼓励学生之间互相交流学习,共同进步。
通过本次作业,学生可以更好地掌握原子的结构知识,为后续学习打下坚实的基础。
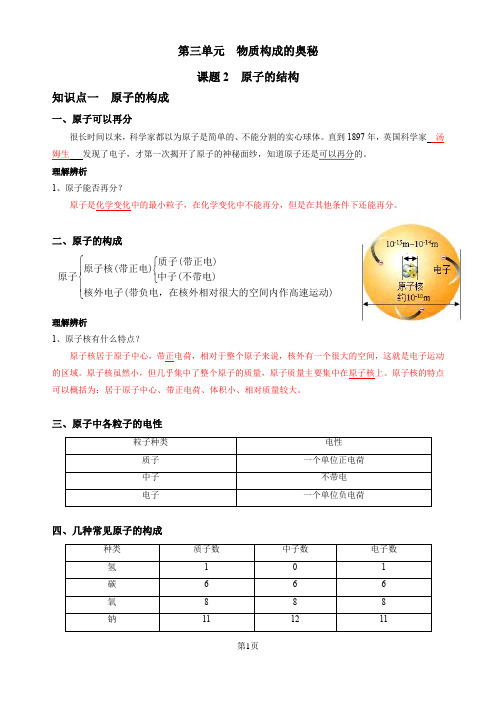
第三单元 物质构成的奥秘课题2 原子的结构知识点一 原子的构成一、原子可以再分很长时间以来,科学家都以为原子是简单的、不能分割的实心球体。
直到1897年,英国科学家 汤姆生 发现了电子,才第一次揭开了原子的神秘面纱,知道原子还是可以再分的。
理解辨析1、原子能否再分?原子是化学变化中的最小粒子,在化学变化中不能再分,但是在其他条件下还能再分。
二、原子的构成⎧⎧⎨⎪⎨⎩⎪⎩质子(带正电)原子核(带正电)原子中子(不带电)核外电子(带负电,在核外相对很大的空间内作高速运动)理解辨析1、原子核有什么特点?原子核居于原子中心,带正电荷,相对于整个原子来说,核外有一个很大的空间,这就是电子运动的区域。
原子核虽然小,但几乎集中了整个原子的质量,原子质量主要集中在原子核上。
原子核的特点可以概括为:居于原子中心、带正电荷、体积小、相对质量较大。
三、原子中各粒子的电性四、几种常见原子的构成理解辨析1、原子一定是由质子、中子、核外电子构成的吗?原子一般由质子、中子、电子这三种粒子构成,但某种氢原子中只有一个质子和一个核外电子,无中子。
五、原子中各种粒子之间的关系1、原子中,质子所带正电荷总数与核外电子所带负电荷总数相等,中子不带电,整个原子不显电性。
2、在原子中,核电荷数=质子数=核外电子数。
3、不同种类的原子,核内质子数不相等。
例题1、下列关于原子的叙述,正确的是( C)A.原子是不能再分的粒子B.一切原子的原子核都是由质子和中子构成的C.原子核内质子数等于核外电子数D.原子核内质子数必等于中子数例题2、有关原子带电情况的解释正确的是(B)A.原子中质子带浮负电,电子带正电B.原子核带正电C.电子不带电D.电子和中子电荷中和使得原子不带电例题3、在分子、原子、质子、中子、电子、原子核这些粒子中选择填空:(1)能保持物质化学性质的粒子是分子;(2)化学变化中的最小微粒是原子;(3)能直接构成物质的粒子是分子、原子;(4)构成原子核的粒子是质子、中子;(5)带正电的粒子是质子、原子核;(6)带负电的粒子是电子;(7)不带电的粒子是中子;(8)质量与氢-1原子质量近似相等的粒子是质子、中子;(9)质量最小的的是电子;(10)在同一原子中数目相等的是质子、电子。
![新人教版九年级上册化学[原子的结构重点题型巩固练习]](https://img.taocdn.com/s1/m/38b158196137ee06eef91898.png)
新人教版九年级上册初中化学重难点有效突破知识点梳理及重点题型巩固练习原子的结构【巩固练习】一、选择题 (每小题只有一个选项符合题意)1.绝大多数原子的原子核中含有( )A.质子、中子、电子B.质子、电子C.中子、电子D.质子、中子2.碳的相对原子质量是()A.12gB.12C.1.66×10-27 KgD.1/12g3.在一个原子的原子核内必定含有的微粒是()A.质子和中子B.质子C.中子D.质子和电子4.(2015?石家庄模拟)已知一个原子的核电荷数,可以推断它的()A.质子数 B.质子数和中子数之和C.中子数 D.元素的种类5.(2015?大庆模拟)据报道,上海某医院正在研究用放射性碘治疗肿瘤.这种碘原子的核电荷数为53,相对原子质量为125.下列关于这种原子的说法中,错误的是()A.中子数为72 B.质子数为72C.电子数为53 D.质子数和中子数之和为1256.已知铯-137的质子数为55,中子数为82。
下列有关铯-137的说法正确的是( )A.铯-137原子的核外电子数为82B.铯-137的相对原子质量为137gC.铯-137原子的核电荷数为55D.铯-137属于非金属元素7.下列叙述错误的是()A.分子和原子都能直接构成物质B.原子中原子核与核外电子的电量相等,电性相反,所以整个原子不显电性C.决定原子质量大小的主要是质子和电子D.原子核体积很小,原子内部有很大空间8.科学家在古城考古时,曾通过测定古生物遗骸中的碳14含量来推断古城年代。
碳14原子的核电荷数为6,相对原子质量为14。
下列关于碳14原子的说法中,错误的是()A.中子数为 6B.质子数为 6C.电子数为 6D.质子数和中子数之和为14二、填空题9.19世纪与20世纪之交,物理学中的放射现象和电子的先后发现,不仅将人们的视线引入了原子的内部,而且更进一步地驱使人类积极探索原子核的内部构成。
某学习小组的同学在关于原子和原子核的讨论中,下列说法正确的是。

部编版九年级化学上册第三单元物质构成的奥秘《课题2 原子的结构》课时作业一、单选题1.下列物质由离子构成的是A.氢气B.氯化钾C.金刚石D.二氧化碳2.下列说法正确的是A.原子都是由质子、中子、电子三种粒子构成的B.分子与原子的主要区别是分子大,原子小C.不同种原子之间的本质区别是核电荷数不同D.在原子中,质子数等于中子数3.下列对分子、原子、离子的认识正确的是()A.同种分子排列方式不同,化学性质不同B.在干冰中,分子因相互作用而静止不动C.同种原子按不同方式结合,可以构成不同的物质D.原子得失电子形成离子后,原子核发生了变化4.下列物质由离子构成的是A.汞B.氧气C.氯化钠D.二氧化碳5.如下图是五种微粒的结构示意图,下列说法正确的是A.①①属于金属元素B.①的微粒符号是Al3+C.①①①属于阳离子D.①①位于元素周期表的同一周期6.如图为某粒子结构示意图,下列说法错误的是A.该粒子属于非金属元素B.该粒子核外电子数为17C.该粒子具有3个电子层D.在化学反应中,该元素原子易得电子形成Cl-7.关于分子和原子两种微粒的叙述正确的是A.分子可分,原子不可分B.分子大原子小C.同种原子可能构成不同的分子D.分子是保持物质化学性质的最小微粒8.某微粒M的结构示意图如下,关于该微粒的说法正确的是A.M的原子易失电子B.x只能为7C.M为金属元素D.x为8时,M为阴离子9.“宏观辨识与微观探析”是化学学科的核心素养之一,下列说法正确的是①化学变化中,原子核不发生改变①向气球吹气的过程中分子之间的间隔发生了变化①同种分子构成的物质是纯净物①表示的微粒都是离子A.①①①B.①①C.①①D.①①①①10.如图是五种微粒的结构示意图,下列说法不正确的是A.上述五种微粒只涉及四种元素B.①①①表示的微粒性质较稳定C.①①①属于原子,①①属于阴离子D.①①对应元素组成化合物的化学式为NaF二、课内填空11.构成物质的粒子有_____、___________和___________等。

课题:§3.2 原子的结构班级__________姓名_________一、新课学习【目标一】了解原子核外的电子是分层排布的;了解原子结构示意图是一种模型化的方法1.核外电子的分层排布⑴电子层能量的高低⑵电子层的分法2.原子结构示意图(1)各部分的意义,(标出各部分含义)(2)画法,试着画出1-18号元素的原子结构示意图【目标二】了解典型元素(稀有气体、金属和非金属)原子核外电子的排布特点1、在原子结构示意图中,小圆圈表示____________,圈内的数字表示__________,弧线表示__________,弧线上的数字表示___________________。
2、分析与讨论:三类元素的原子结构特点最外层电子数原子结构(稳定情况)化学性质是否活泼稀有气体元素金属元素非金属元素元素的化学性质由____________________决定。
二、达标检测1、决定元素化学性质的是()A. 质子数B.中子数C.最外层电子数D. 核电荷数2、决定元素种类的是()A. 质子数B.中子数C.最外层电子数D. 核电荷数三、分层作业(一)基础题3.某元素A的原子结构示意图如右图所示:该元素原子的核电荷数为 _______,核外有______个电子层,最外层上有_________电子,A属_____________元素。
(填金属、非金属或稀有气体),在化学反应中A原子易__________电子。
4.下列各组粒子的结构示意图中,前者表示阴离子,后者表示阳离子的是()A. B. C. D.5. 元素的化学性质主要决定于其原子的()A.核外电子数B.核电荷数C.最外层电子数 D.中子数(二)提高题7.某元素的原子,其核外有一个电子层,最外层电子数为2.则在具有下列原子核外电子排布的元素中,与该元素化学性质相似的是()A. 有3个电子层,最外层电子数为2 B. 有3个电子层,最外层电子数为8C. 有2个电子层,最外层电子数为2D. 有1个电子层,最外层电子数为18.下列粒子在化学反应中容易得到电子的是 ( )A. B. C. D.9. 某元素原子的核外电子排布时,第二层电子数是第一层与第三层电子数之和,则该元素属于()A. 金属元素B. 非金属元素C. 稀有气体元素D. 不能确定10.一种元素的原子变成离子,这种原子发生的变化是()A.一定失去电子 B.一定得到电子C.有可能得到或失去电子 D.既得不到电子也不失去电子。

原子的构成课后作业1.与元素的化学性质关系最密切的是( )。
A.中子数 B.电子数C.最外层电子数 D.核外电子层数2.某原子结构示意图如图所示.下列有关该原子的说法不正确的是( )A .该原子为钠原子B .质子数和中子数总和为11C .最外层电子数为1D .核外有3个电子层3.某原子结构示意图为,则该原子核电荷数为______,核外有______个电子,第二层上有______个电子,最外层有______个电子,在化学反应中易______电子。
4.说出下列符号中数值“2”的含义。
(1)H2:________________________________。
(2)2H:________________________________。
5. 原子的结构示意图如下,下列叙述正确的是( )。
A.原子是实心球体B.原子、中子、电子均匀分布在原子中C.质子与电子质量相等D.整个原子的质量主要集中在原子核上6.如下图是某元素的原子结构示意图,下列说法正确的是( )。
A.该原子的核外电子数是16B.该原子在化学反应中容易失去6个电子,该元素的化合价为+6价C.该元素属于非金属元素,不能与氧元素形成化合物D.该原子的最外层达到了稳定结构7.已知一种碳原子可用于测定文物的年代,该原子的原子核内含有6个质子和8个中子,则该碳原子的相对原子质量为( )。
A.2 B.6 C.8 D.148.下列物质由离子构成的是( )。
A.汞 B.氧气 C.金刚石 D.硫酸铜9.下列有关微观粒子的说法中正确的是 ( )。
A.分子由原子构成B.分子是保持物质化学性质的唯一粒子C.原子中的粒子都不带电D.物质都是由离子构成原子的构成课后作业参考答案1.C2.B 3.16 16 8 6 得到4.(1)表示每个氢分子由2个氢原子构成(2)表示2个氢原子5.D 6.A 7.D 8.D 9.A。
3.2 原子的结构基础巩固练知识点1 原子的构成1.下列有关原子结构的说法正确的是()A.任何原子都含有质子中子和电子B.原子核内中子数一定等于质子数C.原子的质量主要集中在原子核上D.原子不带电是因为原子中不存在带电粒子2.道尔顿、汤姆生和卢瑟福等科学家对原子结构进行了不断探索。
下列叙述正确的是()①原子由原子核和核外电子构成②原子的质量主要集中在原子核上③原子核在原子中所占的体积极小A.①②B.①③C.②③D.①②③3.学习完“原子的构成”之后,萍萍同学形成了以下认识,其中错误的是()A.原子由居于中心的原子核和核外电子构成B.核外电子在离核远近不同的区域中运动C.原子核的质量和电子的质量相差不大D.原子核的体积与整个原子的体积相比要小很多4.原子结构模型的建立,经过了几代科学家的艰辛努力,直到现在仍在探索中。
其中,行星模型的提出标志着原子结构现代模型的问世,如图所示是锂原子结构的行星模型,图中原子核内有3个质子、4个中子。
不能根据原子结构的行星模型得出的结论是()A.原子始终在做无规则的运动B.原子核的体积只占整个原子体积的很小一部分C.构成原子核的粒子之间存在一种互相吸引的力D.原子呈电中性知识点2 原子中各粒子之间的数量关系5.钚是原子能工业的一种重要原料。
一种钚原子核电荷数为94,中子数为145,下列关于这种钚原子的说法正确的是()A.核外电子数为145B.相对原子质量为145C.质子数为94D.一个原子带145个单位的正电荷知识点3 相对原子质量6.铁的相对原子质量约为()A.9.288×10-26 kgB.9.288×10-26C.56 kgD.567.已知一种碳原子质量的1/12用于作为相对原子质量的标准,若一个该碳原子的质量为m kg,另一种原子的质量为n kg,则后一种原子的相对原子质量为()A.m12B.n12C.12mnD.12nm知识点4 原子核外电子的排布8.下列原子结构示意图中,表示相对稳定结构的是()9.右图是某原子的结构示意图,下列关于该原子的说法不正确的是()A.第一层的电子能量最高B.最外层电子数为7C.容易得到电子D.有3个电子层10.某原子的结构示意图如图,对该原子的有关认识正确的是()A.该原子核内质子数是34B.该原子在化学反应中易失去电子C.该原子的最外层电子数是2D.该原子核外有3个电子层11.如图是四种粒子的结构示意图,下列有关说法正确的是()A.④表示的粒子属于金属的原子B.①表示的粒子在化学反应中易失电子C.①②③④四种粒子的核电荷数都不同D.②④所表示的粒子化学性质相似知识点5 离子12.下列粒子结构示意图中,表示稀有气体原子的是()13.下列粒子结构示意图中,表示阳离子的是()14.某粒子结构示意图如图所示,下列说法错误的是()A.若x=17,则该粒子符号为Cl-B.若x=18,则该粒子是原子C.若x=19,则该粒子是阳离子D.若x=20,则该粒子是由一个原子得到两个电子后形成的15.原子失去最外层电子或最外层得到电子后,一定不会引起改变的是()①原子种类②化学性质③粒子的电性④原子核⑤电子层数⑥最外层电子数⑦核外电子总数A.②④⑤B.③④⑦C.①④D.①③⑤⑥16.据《自然》杂志报道,科学家最近研制的一种以锶原子做钟摆的钟是世界上最精确的钟,锶原子结构示意图如图所示(图1)。
原子的结构巩固练习一、单选题1.下列关于原子的叙述不正确的是()A. 原子可以构成物质的分子,有的原子能直接构成物质B. 相对于原子来说,原子核的体积很小,但原子的质量却主要集中在原子核上C. 在化学变化中分子发生变化,原子不发生变化D. 原子核都是由质子和中子构成的2.据报导,科学家发现了新的氢微粒。
这种氢微粒由3个氢原子核(只含质子)和2个电子构成。
下列说法中正确的是()A. 该微粒不显电性B. 该微粒比一个普通H2分子多一个氢原子核C. 该微粒含有三个中子D. 该微粒比一个普通H2分子质子数多33.下列各种微粒,不带电的是()A. 原子B. 电子C. 质子D. 原子核4.质量相同的Na、Mg、Al、K四种金属,含原子数最少的是()A. NaB. MgC. AlD. K5.下列关于原子核的说法中,错误的是()A. 原子核位于原子的中心,带正电荷B. 原子核位于原子的中心,带负电荷C. 原子核在原子中所占的体积非常小D. 原子的质量主要集中在原子核上6.关于相对原子质量,下列说法正确的是()A. 相对原子质量约等于质子数加电子数B. 相对原子质量就是原子质量C. 两种元素原子质量之比等于它们的相对原子质量之比D. 通常情况下,相对原子质量是以“千克”为单位7.2019年7月6日,中国良渚古城遗址获准列入世界遗产名录。
考古学家对有关遗址出土文物的碳−14含量进行测定,推测其年代距今约4700−5300年。
碳−14原子与碳−12原子互为同位素的原因是()A. 质子数相同B. 电子数相同C. 质子数相同,中子数不同D. 核电荷数和电子数均相同8.由下列粒子结构示意图得出的结论中错误的是()A. ④表示的是阳离子B. ①③的化学性质相似C. ②④形成的化合物是Al2O3 D. ①③属于同种元素,②④属于另一种元素9.下列关于四种粒子的结构示意图的说法中,正确的是()A. 它们都表示原子B. ④所表示的元素位于第三周期C. ①②的化学性质相似D. 它们表示四种元素的不同粒子10.下列说法错误的是()A. 分子是保持物质性质的最小粒子,原子是化学变化中的最小粒子B. 分子由原子构成,原子由质子、中子和电子构成C. 分子、原子都处在永恒的运动之中D. 分子、原子间的距离变化可能导致物质的状态变化11.已知原子的质量数等于质子数与中子数之和。
原子的结构一、选择题1.下列结构示意图中表示阴离子的是( D )A B C D解析:阴离子中质子数<核外电子数。
故选D。
2.某粒子结构示意图如图所示,下列对该粒子的判断中,错误的是( B )A.原子核内有12个质子B.该粒子是阴离子C.在化学变化中易失电子D.该粒子属于金属元素解析:原子中质子数=核外电子数,故B错。
故选B。
3.下列各结构示意图表示的原子中,最容易形成阳离子的是( C )A B C D解析:最外层是≤3个电子的,易失去电子变成阳离子。
故选C。
4.是钙的原子结构示意图,则有关钙原子的下列说法中正确的是( B )A.核外共有2个电子层B.在化学反应中易失电子C.核外电子总数为40D.在化学反应中易得电子解析:钙原子最外层有2个电子,易失去电子变成阳离子。
故选B。
5.西山公园有丰富的负氧离子,空气中氧分子得到电子就能形成负氧离子(O-2)。
一个O-2与一个O2分子比较,不相同的是( B )A.质子数B.电子数C.含氧原子个数D.相对原子质量之和解析:一个O-2是由一个氧分子得到一个电子形成的,核内质子数不变,A错误;电子数增多,B正确;所含氧原子的个数不变,C错误;电子的质量很小,可以忽略不计,故相对原子质量之和不变,D错误。
故选B。
二、填空题6.A、B、C三种粒子结构示意图如图所示.(1)当A、B表示原子时,x=10;y=1。
(2)C表示的粒子符号是Cl-,该元素与B元素形成的化合物是由离子(选填“分子”“原子”或“离子”)构成的。
7.(2016·吉林模拟)(1)随着“神舟六号”的发射成功,我国还将发射绕月探测卫星。
其任务之一是寻找一种新能源——氦3,氦3原子核是由一个中子和两个质子构成的,其原子核外电子数为2。
(2)硫原子的结构示意图为,在化学反应中易得(选填“得”或“失”)电子。
(3)写出核外电子排布与氖原子相同的阳离子和阴离子符号各一个:阳离子Na+,阴离子O2-(合理即可)。
化学人教版九年级上册练习:3.2 原子的结构(含答案)课题2 原子的结构一、选择题1.碳原子的核电荷数为()A.12 B.24 C.16 D.62.原子质量的大小主要决定于()A.核内质子的数目B.核内中子的数目C.核内质子、中子的质量D.核外电子数目3.下列结构示意图中属于离子的一组是()A.①③ B.①② C.③④ D.②⑤4.下列有关原子的说法正确的是()A.原子都是由质子、中子和电子构成的B.在原子中质子数等于核外电子数C.原子的质量主要是由质子和电子质量决定的D.保持氮气化学性质的微粒是氮原子5.如图为某粒子的结构示意图,有关该粒子的说法中,错误的是()A.该粒子的原子核内有11个质子B.该粒子的核外有三个电子层C.该粒子最外层上有一个电子D.该粒子是带负电的阴离子6.下列叙述错误的是()①原子是化学变化中的最小粒子;②原子是不能再分的粒子;③一切物质都是由原子直接构成的;④一切原子核都是由质子和中子构成的;⑤原子不显电性;⑥原子之间有间隔.A.①和② B.②③④ C.③和⑤ D.③和⑥7.高铁上装有烟雾传感器,主体是放有镅(Am)的电离室,这种镅原子的原子核内有95个质子和146个中子,该原子的核外电子数为()A.95 B.146 C.241 D.518.如图为小明制作的原子结构模型,外圈上的小球为电子,内圈为原子核,下列说法正确的是()A.该模型表示一种碳原子B.该原子的核电荷数为4C.该原子的相对原子质量为2D.该原子核由2个质子和2个中子构成9.下列关于徽观粒子的说法,正确的是()A.带电的粒子一定是离子B.在干冰中,分子因相互作用而静止不动C.所有原子都由原子核和核外电子构成D.并不是所有分子都是由原子构成的10.碳14原子的核电荷数为6.相对原子质最为14,则碳14原子的中子数与核外电子数分别是()A.8 6 B.6 6 C.14 6 D.6 811.下列关于分子、原子、离子的说法中,错误的是()A.分子、原子、离子都能构成物质B.在化学反应过程中,原子的种类、数目均不改变C.水是由氢、氧两种原子直接构成的D.物质的热胀冷缩现象是分子间隔的大小随温度而改变的缘故12.如图为碳原子的结构模型图,其中a、b、c是该碳原子内的三种不同粒子,下列说法不正确的是()A.碳原子核中可能含有6个c和6个bB.碳原子的质量主要集中在b和c上C.决定原子种类的粒子是cD.碳原子中含有6个a和8个c13.下列说法正确的是()A.原子是最小的粒子B.原子是由原子核和核外电子构成的C.一切原子都包含着质子、中子和核外电子D.原子中不存在带电荷的微粒,所以原子不显电性14.如图是元素X的原子结构示意图,下列说法不正确的是()A.X元素的原子序数为17B.在该结构示意图中n=7C.X元素的原子在化学反应中容易得到电子D.X与Ca形成的化合物为Ca2X15.原子由电子、质子与中子等粒子构成。
课题:§3.2 原子的结构(三)(021)
班级__________姓名_________
一、新课学习
成物质的一种粒子;
(1)概念:
(2).判别
原子:不显电性,质子数核外电子数
阳离子:带电,质子数核外电子数
阴离子:带电,质子数核外电子数
(3)离子符号的书写(X m±):在元素符号的右上角标明所带电荷,数值在前,正负在后(1
可省略)
[练习]试写出离子符号:
①钠离子②镁离子③氧离子④氯离子
(4) 离子符号的意义
举例:标出数字“2”的含义2Mg2+
(5)离子如何构成物质
氯化钠由__________________________________________构成。
[练习]说出下面这些元素符号,离子符号前面数字的意思
2 Na 2Al 2Mg
2 Na +2Al3+2Mg2+
【目标二】了解化学在宏观物质与微观粒子之间建立联系的途径和特点。
离子与原子区别
二、达标检测
1、下列哪种物质是由离子构成 ( )
A. 氧气
B.氯化钠
C. 铜
D. 过氧化氢
2、在离子结构中,核电荷数和核外电子数的关系正确的是 ( )
A. 核电荷数一定等于核外电子数
B.核电荷数一定小于核外电子数
C.核电荷数一定大于核外电子数
D. 核电荷数一定不等于核外电子数
3、下列粒子的结构示意图中属于阳离子的是 ( )
A .
B .
C .
D .
三、分层作业
(一)基础题 .1. 写出对应的离子符号:
(1)氢离子_________(2)氯离子_________(3)硫酸根离子_________(4)铵根离子_________
(5)镁离子_________(6)氢氧根离子_________
2. 指出下列符号表示的意义
(1)2O__________________________ (2)3Al 3+__________________________
3. 下列叙述中不正确的是 ( )
A .钠原子失去电子后变成钠离子
B .氯离子失去电子后变成氯原子
C .原子的质量主要集中在原子核上
D .化学变化中分子不能再分
4. Ca 2+右上角的数字表示的意义是 ( )
A .钙原子最外层上有2个电子
B .1个钙离子带两个单位正电荷
C .钙原子有2个电子层
D .2个钙离子
5. M 元素的单质可用于原子反应堆的导热剂,其原子结构示意图如右:
(1) 该原子有个电子层,X 的值是,
+11 2 8 1 +9 2 8 +10 2 8 +12 2 8
. M 元素属于(填“金属”或“非金属”)元素;
(2) M 元素的化学性质与下列(填序号)元素的化学性质相似。
6.由下列结构图回答:
(1)写出下列示意图的符号
ABCDEF 。
(2)属于原子的是,属于阳离子的是。
(3)图F 表示元素,在化学反应中,易电子变成离子。
(4)最外电子层未达到稳定结构的是。
(二)提高题
7.如果该图表示的是原子,X 值为______,该原子的符号是______。
如果该图表示的是带两个单位正电荷的阳离子,X 值为_____,符号是_____。
如果该图表示的是带两个单位负电荷的阴离子,X 值为_____,符号是_____。
8.对于下面粒子的结构示意图,说法不正确的是: ( )
A .三者的核外电子排布相同
B .三者的结构都为稳定结构
C .三者分别表示阴离子、阳离子、原子
D .它们都显电性。