无机化学 S区元素概述单质及其物理化学性质
- 格式:pptx
- 大小:5.63 MB
- 文档页数:16
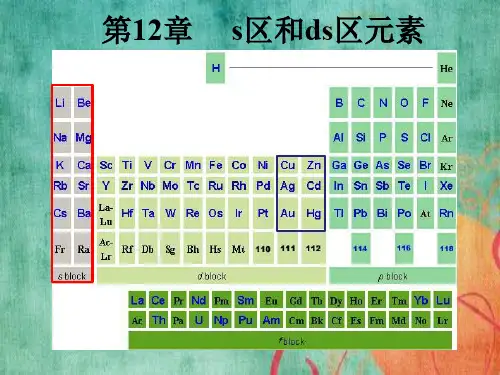


无机化学S区元素概述单质及其物理化学性质S区元素是指周期表中第三周期的元素,包括Sc、Ti、V、Cr、Mn、Fe、Co、Ni、Cu和Zn。
这些元素的单质是指它们在自然界中以纯态存在的形态。
下面将对这些S区元素的单质及其物理化学性质进行概述。
Scandium(Sc)是一种银白色金属,熔点1541℃,沸点2836℃。
它的密度为2.989 g/cm³,熔化热为15.8 kJ/mol。
Scandium的化学性质活泼,可以与氢气、氧气和氮气反应。
它可以形成多种化合物,如ScCl3、Sc2O3等。
Titanium(Ti)是一种银灰色金属,熔点1668℃,沸点3260℃。
它的密度为4.506 g/cm³,熔化热为13.8 kJ/mol。
Titanium具有低密度、高强度和良好的耐腐蚀性。
它与氧、氮、氢等非金属元素反应生成化合物,如TiO2、TiN等。
Vanadium(V)是一种银白色金属,熔点1890℃,沸点3380℃。
它的密度为6.0 g/cm³,熔化热为21.5 kJ/mol。
Vanadium的化学性质活泼,可以与氧气、氮气和氟气反应。
它可以形成多种氧化态,如V2O5、VO2等。
Chromium(Cr)是一种银灰色金属,熔点1907℃,沸点2672℃。
它的密度为7.18 g/cm³,熔化热为20.5 kJ/mol。
Chromium的外层电子构型为3d54s1,具有良好的抗腐蚀性。
它可以形成多种化合物,如Cr2O3、CrCl3等。
Manganese(Mn)是一种银灰色金属,熔点1244℃,沸点1962℃。
它的密度为7.21 g/cm³,熔化热为13.2 kJ/mol。
Manganese与氧气反应生成二氧化锰(MnO2),具有一定的催化性能。
它还可以形成多种化合物,如MnCl2、MnSO4等。
Iron(Fe)是一种银灰色金属,熔点1538℃,沸点2861℃。
它的密度为7.874 g/cm³,熔化热为13.8 kJ/mol。

无机化学第七章S区元素第七章主要介绍了S区元素的性质和应用。
S区元素是指周期表中第16族元素,包括氧、硫、硒、碲和钋。
这些元素具有一些共同的性质和特点,包括氧化态的规律和趋势、同族元素的化学性质等。
S区元素的氧化态规律和趋势是其重要的特点之一、氧化态是指元素在化合物中的电荷数。
在S区元素中,氧通常呈-2的氧化态,露卜那呈-1的氧化态,硫、硒和碲的氧化态则比较复杂,可以是正或负的多个值。
这种规律是由于这些元素的外层电子结构决定的。
氧的外层有6个电子,可以通过接受2个电子来填满外层,从而达到稳定的8个电子的结构。
而露卜那的外层只有一个电子,可以通过捐赠一个电子来达到稳定的结构。
而硫、硒和碲的外层电子结构类似,有6个电子,可以通过得失2个电子来达到稳定的8个电子的结构。
在S区元素中,氧是一个非金属元素,而硫、硒和碲则是亚稳金属。
氧具有较高的电负性,能够与其他元素形成较强的电负性键。
它在自然界中广泛存在,包括空气中的氧气、水中的水分子等。
由于氧的高电负性,它可以与其他元素形成氧化物,包括过氧化物、酸性氧化物和碱性氧化物等。
氧化物有着重要的应用,例如过氧化氢可用作漂白剂和消毒剂。
硫、硒和碲是黄顺子亚稳金属,它们具有较高的化学活性。
它们主要存在于矿石中,包括铁矿石中的硫化铁矿石。
硫还广泛存在于化学品中,包括硫酸、硫酸铜等。
硫还可以形成众多的无机化合物,例如硫化物和亚硫酸盐。
硫化物在冶金工业中有重要应用,例如焦炭的熔融炉和脱硫设备。
在亚稳金属中,硒是比较特殊的元素。
它可以形成六亚硒酸盐,具有良好的光敏性。
六亚硒酸盐可以用于摄影中的胶片和相纸的显影剂,以及红外线辐射计的探测剂。
此外,硒还可以形成硒化物,具有一定的半导体性能。
碲也是一种亚稳金属,具有类似硒的性质。
它可以形成一种黑色固体的碲化铋,具有比较好的半导体性能。
碲化铋被广泛应用于红外线成像和热电传感器等领域。
除了硫、硒和碲,S区元素中还有钋,它是一种放射性元素。




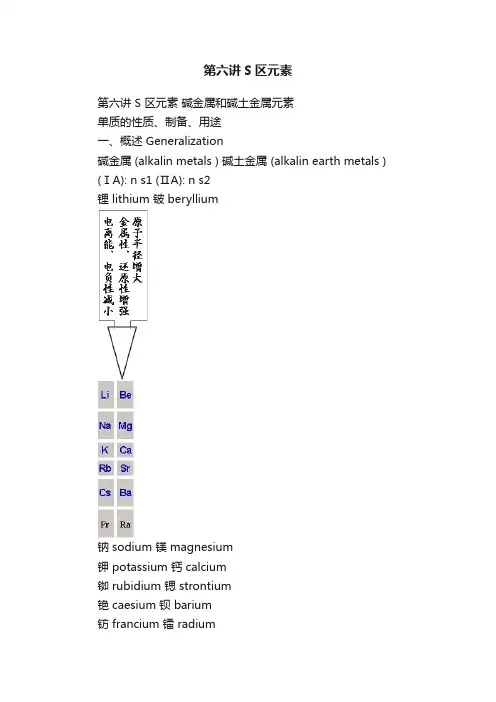
第六讲S区元素第六讲 S 区元素碱金属和碱土金属元素单质的性质、制备、用途一、概述 Generalization碱金属 (alkalin metals ) 碱土金属 (alkalin earth metals ) (ⅠA): n s1 (ⅡA): n s2锂 lithium 铍 beryllium钠 sodium 镁 magnesium钾 potassium 钙 calcium铷 rubidium 锶 strontium铯 caesium 钡 barium钫 francium 镭 radium通性:都是最活泼的金属同一族自上而下性质的变化有规律通常只有一种稳定的氧化态形成的化合物大多是离子型的二、物理性质:有金属光泽,密度小,硬度小,熔点低、导电、导热性好的特点三、单质的化学性质1、与氧、硫、氮、卤素反应,形成相应的化合物(1)单质在空气中燃烧,形成相应的氧化物:Li 2O Na 2O 2 KO 2 RbO 2 CsO 2BeO MgO CaO SrO BaO 2为何空气中燃烧碱金属所得产物不同?哪一个燃烧反应的ΔG 负值最大,产物就是哪一个。
Na 生成Na 2O 、Na 2O 2 和 NaO 2的ΔG 分别是―376 kJ·mol-1, ― 430 kJ·mol-1和― 389.2 kJ·mol-1, 因此燃烧产物就是 Na 2O 2 。
ΔG 的大小由 m r m r m r S T H G ?-?=? 决定。
其中ΔG 的大小主要由 m r H ? 来决定。
则要由Born-Haber 循环来决定。
循环中的晶格能值的大小对整个反应能否进行及产物稳定性关系重大。
晶格能则要求阴、阳离子具备一定的“匹配” 条件,产生最好的能量效应。
此即所谓的“大-大,小-小”规则。
2、与水作用碱金属被水氧化的反应为: 2 M(s) + 2 H 2O (l) = 2 M +(aq) + 2 OH -(aq) + H 2(g)碱土金属被水氧化的反应为:M(s) + 2 H 2O (l)= M 2+(aq) + 2 OH -(aq) + H 2(g)远不如相邻碱金属那样剧烈,镁和铍在水和空气中因生成致密的氧化物保护膜而显得十分稳定。
第四章 s 区元素第二节 s 区元素的单质4.2.1 单质的物理性质和化学性质物理性质单质的物理性质:多为银白色金属;有金属光泽密度小;硬度小;熔点低导电、导热性好熔点沸点钠钾合金用作核反应堆的冷却剂镁合金用作结构材料锂用于高能电池和储氢材料金属铍和铍基合金用于各种空间飞行器。
还用于制造原子能反应堆中的中子减速剂。
化学性质•与氧、硫、氮、卤素反应,形成相应的化合物。
单质在空气中燃烧,形成相应的氧化物:Li 2O Na 2O 2 KO 2 RbO 2 CsO 2BeO MgO CaO SrO BaO 2镁带的燃烧正常氧化物 (O 2―)M + O 2 ② 过氧化物 (O 22―)③ 超氧化物 (O 2―)2Li + 1/2O 2 Li 2OM + 1/2O 2 MO (M 为碱土金属)M + O 2 M 2O 2 过氧化物 (M 为碱金属除Li 外)M + O 2 MO 2 (M=K, Rb, Cs)Q1.为何空气中燃烧碱金属所得产物不同? 哪一个燃烧反应的Δr G m 负值最大,产物就是哪一个。
Na 生成Na 2O 、Na 2O 2 和 NaO 2的Δr G m 分别是 -376 kJ·mol -1, -430 kJ·mol -1和-389.2 kJ·mol -1, 因此燃烧产物就是 Na 2O 2 。
•与水作用◆碱金属被水氧化的反应为:2 M(s) + 2 H 2O (l) → 2 M +(aq) + 2 OH -(aq) + H 2(g)Li Na K◆碱土金属被水氧化的反应为:M(s) + 2 H 2O (l)→ M 2+(aq) + 2 OH -(aq) + H 2(g)远不如相邻碱金属那样剧烈,镁和铍在水和空气中因生成致密的氧化物保护膜而显得十分稳定。
Q2:锂的标准电极电势比钠或钾的标准电极电势小,为什么 Li与水反应没有其他碱金属与水的反应激烈?答:电极电势属于热力学范畴,而反应剧烈程度属于动力学范畴,两者之间并无直接的联系。
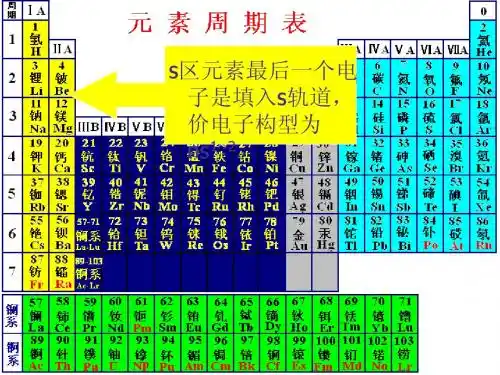
第17章s区元素(碱金属与碱土金属)(一)通性1.它们的价电子构型为ns1-2,内层为稀有气体稳定电子层结构。
价电子很易失去呈+1、+2氧化态。
都是活泼性很高的金属,只是碱土金属稍次于碱金属而己。
2.有较大的原子半径。
因为每一周期是从碱金属开始建立新的电子层。
原子半径变化的规律:同周期从IA到IIA减小,同族中从上到下增大。
3.电离势和电负性均较小,其变化规律为同周期从IA到IIA增大,同族中从上到下顺序减小。
(二)物理性质单质具有金属光泽,有良好的导电性和延展性,除Be和Mg外,其它均较软。
它们在密度、熔点、沸点和硬度方面往往差别较大。
(三)化学性质1.它们具有很高的化学活泼性,能直接或间接地与电负性较高的非金属元素形成相应的化台物。
如可与卤素、硫、氧、磷、氮和氢等元素相化合。
一般均形成离子化台物(除Li、Be及Mg的卤化物外)。
2.单质与水反应放出氢气。
其中Be和Mg由于表面形成致密的氧化膜因而对水稳定。
3.标准电极电势均很负,是很强的还原剂。
它们的还原性在于态及有机反应中有广泛的应用。
如高温下Na、Mg、Ca能把其它一些金属从氧化物或氯化物中还原出来.4.单质制备由于它们的化学活泼性,决定它们只可能以化合物形式存在于自然界中。
单质的制备多数采用电解它们的熔盐。
(四)氧化物和氢氧化物1.碱金属的氧化物比碱土金属的氧化物种类多。
它除有正常氧化物外,还有过氧化物、超氧化物及臭氧化物。
如碱金属在空气中燃烧时,只有Li的主要产物是Li2O(正常氧化物),而Na、K、Rb、Cs的主要产物分别是Na2O2(过氧化物)、KO2(超氧化物)、RbO2(超氧化物)和Cs2O2(过氧化物)。
2.氢氧化物除Be(OH)2呈两性外,其余均为中强碱或强碱。
(五)盐类1.碱金属的盐类有MX(卤化物)、MNO3、M2SO4、M2CO3、M3PO4等。
它们的共性如下:①都是离子晶体(Li盐除外);②都易溶解。
除Li盐和极少数大阴离子组成的盐以外,例如LiF、Li2CO3、Li3PO4、Na[Sb(OH)6]、NaZn(UO2)3(CH3COO)9·6H2O等均难溶。