水通道蛋白
- 格式:docx
- 大小:16.25 KB
- 文档页数:9


水通道蛋白的名词解释水通道蛋白是一类存在于生物体细胞膜上的蛋白质,其主要功能是调节细胞内外水分的平衡。
这些蛋白质以其独特的细胞膜通透性,通常被形容为“细胞的水渠”。
尽管细胞膜对水具有一定的渗透性,但水通道蛋白的出现使得水分的跨膜运输变得更加高效和方便。
水通道蛋白主要通过形成一个微小的通道,让水分子直接穿过细胞膜,从而加速细胞内外的水分交换。
水通道蛋白最早被发现于红细胞膜,其中最为著名的是被称为Aquaporin-1(AQP1)的蛋白质。
AQP1被发现能够高效地传输水分子,使其成为研究者们研究水通道蛋白的重要起点。
此后,越来越多的水通道蛋白被发现,它们在各种生物体的细胞膜上广泛存在。
水通道蛋白家族主要包括两类:小分子量蛋白(20~35kDa)和大分子量蛋白(约为50~90kDa)。
小分子量蛋白包括AQP1、AQP2和AQP4等,它们主要负责水分子的传输。
大分子量蛋白则包括AQP0、AQP5和AQP6等,除了与水分交换有关,这些蛋白质还可能参与其他细胞功能的调节。
水通道蛋白在生物体中具有广泛而重要的作用。
例如,在人体内,水通道蛋白在器官和组织中起着维持水分平衡的关键作用。
当体内水分过多或过少时,水通道蛋白能够根据需要调整细胞膜的通透性,控制水分大量吸收或排泄。
这一过程在保持人体内部环境稳定方面非常重要。
此外,水通道蛋白还在植物、昆虫、微生物等生物体中发挥着类似的功能。
在植物体内,水通道蛋白不仅参与了水分的吸收和输送,还对维持细胞渗透稳定性和调节植物生长发育起到了重要作用。
在昆虫和微生物中,水通道蛋白也发挥着类似的水分调节作用,确保它们能够在不同环境下生存和繁衍。
随着科学技术的发展,研究人员对水通道蛋白进行了深入的研究。
他们通过结构生物学、细胞生物学以及分子生物学等多种手段,揭示了水通道蛋白的分子结构和生理功能,并进一步研究了其与疾病之间的关系。
例如,某些疾病,如肾脏功能障碍、肿瘤、水肿等,与水通道蛋白的异常表达或功能失调密切相关。

水通道蛋白水通道蛋白(Aquaporin),又名水孔蛋白,是一种位于细胞膜上的蛋白质(内在膜蛋白),在细胞膜上组成“孔道”,可控制水在细胞的进出,就像是“细胞的水泵”一样。
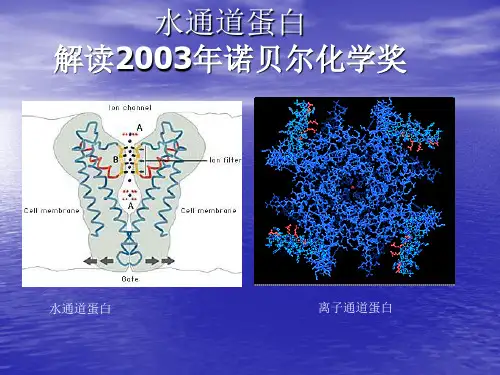
水通道是由约翰霍普金斯大学医学院的美国科学家彼得·阿格雷所发现,他与通过X射线晶体学技术确认钾离子通道结构的洛克斐勒大学霍华休斯医学研究中心的罗德里克·麦金农共同荣获了2003年诺贝尔化学奖。
水分子经过Aquaporin时会形成单一纵列,进入弯曲狭窄的通道内,内部的偶极力与极性会帮助水分子旋转,以适当角度穿越狭窄的通道,因此Aquaporin的蛋白构形为仅能使水分子通过之原因水通道蛋白的发现编辑Agre等(1988)在分离纯化红细胞膜上的Rh多肽时,发现了一个28 kD的疏水性跨膜蛋白,称为形成通道的整合膜蛋白28(channel-forming inte—gral membrane protein,CHIP28),1991年完成了其cDNA克隆(Verkman,2003)。
但当时并不知道该蛋白的功能,在进行功能鉴定时,将体外转录合成的CHIP28 mDNA 注入非洲爪蟾的卵母细胞中,发现在低渗溶液中,卵母细胞迅速膨胀,并于5 min 内破裂。
为进一步确定其功能,又将其构于蛋白磷脂体内,通过活化能及渗透系数的测定及后来的抑制剂敏感性等研究,证实其为水通道蛋白。
从此确定了细胞膜上存在转运水的特异性通道蛋白,并称CHIP28为Aquaporinl(AQPl)。
水通道蛋白分类编辑AQP0AQP0最初称之为主体内在蛋白(major intrinsic protein,MIP),在晶状体纤维中细胞中表达丰富,与晶状体的透明度有关.AQpo的突变可能导致晶状体水肿和白内障。
小鼠缺乏AQPO将患先天性白内障[61]。
AQP1AQP1是1988年发现的,开始将这种蛋白称为通道形成整合蛋白(CHIP),是人的红细胞膜的一种主要蛋白。

细胞膜上的水通道蛋白作者:Marokko摘要:物质的跨膜运输是细胞维持正常生命活动的基础之一。
主要分为被动运输,主动运输,胞吞作用及胞吐作用。
但是事实上细胞的物质转运过程中,透过脂双层的简单扩散现象很少,绝大多数情况下,物质是通过载体或者通道来转运的。
离子、葡萄糖、核苷酸等物质有的是通过质膜上的运输蛋白的协助,按浓度梯度扩散进入质膜的,有的则是通过主动运输的方式进行转运。
而维持细胞之间的跨膜运输的膜转运蛋白则主要分为载体蛋白与通道蛋白。
其中通道蛋白(channel protein)是跨膜的亲水性通道,允许适当大小的离子顺浓度梯度通过,故又称离子通道。
有些通道蛋白长期开放,如钾泄漏通道;有些通道蛋白平时处于关闭状态,仅在特定刺激下才打开,又称为门通道(gated channel).而水扩散通过人工膜的速率很低,所以人们推测膜上有水通道.1991年Agre发现第一个水通道蛋白CHIP28 (28 KD ),目前在人类细胞中已发现的此类蛋白至少有11种,被命名为水通道蛋白(Aquaporin,AQP)。
水通道蛋白广泛存在于生物体中的各组织部位,影响着生物机体水代谢的过程。
随着分子生物学技术的进步,对水通道蛋白的基础研究已经比较深入和成熟。
目的可以利用水通道蛋白研究的基础成果,阐释临床水代谢障碍类疾病的发病机理提供可能的解决思路。
关键词:跨膜运输,通道蛋白,水通道蛋白正文:包括人类在内的大多数生物都是由细胞组成的。
单个细胞就像一个由城墙围起来的微小城镇,有用的物质不断被运进来,废物被不断运出去。
早在100多年前,人们就猜测细胞这一微小城镇的城墙中存在着很多“城门”,它们只允许特定的分子或离子出入。
这就是细胞之间的跨膜运输。
物质的跨膜运输主要分为被动运输,主动运输,胞吞作用及胞吐作用。
而事实上细胞的物质转运过程中,透过脂双层的简单扩散现象很少,绝大多数情况下,物质是通过载体或者通道来转运的。
下图分别为载体蛋白与通道蛋白。

动物医学进展,021,42(3)=102-105Progress in Veterinary Medicine水通道蛋白在动物疾病发生过程中的作用研究进展张玉婷,张琪,郭抗抗,许信刚*,周宏超*(西北农林科技大学动物医学院,陕西杨凌712100)摘要:水通道蛋白(AQP)是细胞上存在的一种膜孔道蛋白。
动物、植物、微生物细胞上均有水通道蛋白的表达,其主要功能是参与机体的水与电解质代谢。
近年来,针对水通道蛋白在机体所发挥的功能方面研究较多,发现水通道蛋白不仅参与机体生理方面的调控,而且在一些疾病的发生发展过程中也发挥重要的作用。
综述概括了水通道蛋白在脑、肺、肾脏、肠道等组织器官的定位;重点阐述了水通道蛋白在动物脑部疾病、肺部疾病、肾脏疾病、肠道疾病发展过程中所发生的变化。
旨在为患病动物出现水与电解质代谢紊乱症状时,对水通道蛋白发生的变化研究提供参考。
关键词:水通道蛋白;脑水肿;肺动脉高压;肾损伤;腹泻中图分类号:S852.2文献标识码:A 文章编号=^^5038^1)3-0102-0.-1水通道蛋白(aquaporin,AQP)作为一种水转运蛋白在机体各个部位广泛分布,尤其在涉及水液输送的组织细胞内分布量较多,例如在大脑、胃、肠道,肾脏及膀胱等器官均有表达,水通道蛋白在保持机体内环境稳态方面发挥重要作用,增强了机体的代谢能力[]。
研究发现,哺乳动物体内所表达的水通道蛋白已经有13种亚型,分别为AQP0、AQP1、AQP2、AQP3、AQP4、AQP5、AQP6、AQP7、AQP8、AQP9、AQP10、AQP11、AQP12。
水通道蛋白家族根据各个亚型在机体发挥的功能不同,可分为3类:①单纯的水通道蛋白,如AQP1,AQP2,AQP4, AQP5;②水甘油通道蛋白,如AQP3,AQP9、AQP10;③超级水通道蛋白,如AQP6,AQP8, AQP11、AQP12[]。
近年来,某些疾病的发生与水通道蛋白异常表达现象,得到了广泛的关注。

水通道蛋白水通道- 从原子结构到临床医学生物膜的透水性在生理学上是一个长期存在的问题,但负责此类蛋白质的蛋白质仍然未知,直到发现水通道蛋白1(AQP1)水通道蛋白。
AQP1由渗透梯度驱动的水选择性渗透。
人类AQP1的原子结构最近被定义。
四聚体的每个亚基含有允许水分子单文件通过但中断氢键通过质子所需的单独水孔。
已经鉴定了至少10种哺乳动物水通道蛋白,并且它们被水(水通道蛋白)或水加甘油(水甘油聚糖)选择性渗透。
表达位点与临床表型密切相关,从先天性白内障到肾源性尿崩症。
在植物,微生物,无脊椎动物和脊椎动物中发现超过200个水通道蛋白家族成员,并且它们对这些生物体的生理学的重要性正在被揭开。
在20世纪20年代发现脂质双层提供了当沐浴在较低或较高pH或含有毒性浓度的Ca2 +或其他溶质的细胞外液中时细胞如何维持其最佳细胞内环境的解释。
从1950年代开始发现离子通道,交换剂和共转运体为溶质的跨膜运动提供了分子解释。
然而,长期以来,假定水的输送是由于通过脂质双层的简单扩散。
来自具有高膜渗透性的多个实验系统的观察,例如两栖膀胱和哺乳动物红细胞,表明通过脂质双层的扩散不是水跨越膜的唯一途径。
虽然提出了各种解释,但直到10年前发现AQP1才能知道分子水- 特异性转运蛋白(Preston等,1999)。
现在人们普遍同意扩散和通道介导的水分运动都存在。
通过所有生物膜以相对较低的速度发生扩散。
水通道蛋白水通道发现于上皮细胞的一部分10至100倍的水渗透能力。
值得注意的是,水通道蛋白水通道的选择性非常高,甚至质子(H3O +)被排斥。
在大多数组织中,扩散是双向的,因为水进入细胞并从细胞释放,而水通道蛋白介导的体内水流则由渗透或液压梯度引导。
扩散的化学抑制剂是未知的,扩散发生在高Ea(Arrhenius活化能)。
相比之下,大多数哺乳动物水通道蛋白受汞的抑制,Ea等同于大量溶液中水的扩散(〜5 kcal mol_1)。
水通道蛋白的发现说明了偶发性在生物学研究中的重要性,并且引起了上游流体运输过程中水如何穿过生物膜的范式的完全转变。

水通道蛋白的基本结构与特异性通透机理王晶桑建利(北京师范大学生命科学学院北京 100875)摘要水通道蛋白是一个具有跨膜运输水分子功能的蛋白家族。
从1988 年Agre 等发现水通道蛋白起,目前在不同物种中已经发现了200 余种水通道蛋白,其中存在哺乳动物体内的有13 种。
概述了水通道蛋白的结构、组织特异性分布及特异性通透机理。
关键词水通道蛋白水分跨膜转运水分子的跨膜转运对维持不同区域的液体平衡和内环境稳态非常重要。
水分子作为一种不带电荷且半径极小的极性分子,很早被证实能通过自由扩散穿透脂质双分子层。
在发现水通道蛋白以前,人们一直认为这是水分子透过质膜的唯一方式。
但通过实验发现,红细胞和肾小管细胞中水的通透速率之快远非简单扩散强度所能提供的,因此猜测,质膜上可能存在某种通道介导水的转运。
1 水通道蛋白的发现1988年,Agre 等从人类红细胞膜上纯化分离分子量为32×106的Rh 多肽时,偶然鉴定到一种新的分子量为28×106的整合膜蛋白,并且通过免疫印迹发现这类蛋白也存在于肾脏的近端肾小管中[1],把它称为类通道整合膜蛋白(channel-like integralmembrane protein, CHIP28)。
随后,在1991 年Agre 和Preston 成功克隆得到了CHIP28 的cDNA,通过分析其编码的氨基酸序列,发现CHIP28 含有6个跨膜区域、2个N-糖基化位点、且N 端和C 端都位于膜的胞质一侧。
另外,对比CHIP28 与早期从牛晶体纤维中克隆得到的主要内源性蛋白(major intrinsicprotein,MIP)的DNA 序列,发现二者具有高度同源性。
由于很早以前就证实了MIP 家族的成员蛋白参与形成允许水和其他小分子通透的膜通道,因此,推测CHIP28 可能也具有类似功能[2]。
1992 年,Preston 等通过在非洲爪蟾的卵母细胞中表达CHIP28,首次证实它是一种水通道蛋白。


四.水通道蛋白相关疾病当水通道蛋白的调节出现紊乱的时候,则可能引起多种疾病。
(一)肾脏水通道蛋白和相关疾病研究表明,水通道蛋白基因突变将引起尿崩症(diabetesinsipidus,DI)。
尿崩症广义上讲是指多饮、低比重尿和低渗尿为特征的一组综合征。
目前报道的多数遗传性肾性尿崩症病例是以X连锁方式遗传的,由编码V2 受体的基因突变引起,另外的病例则是由于编码AQP2基因的突变引起,以常染色体显性或隐性方式遗传[11]。
(二)肺部水通道蛋白和相关疾病肺水通道蛋白的异常与肺疾病的关系已有诸多实验报道。
AQP可能参与肺水肿的发病机制。
在各种肺损伤中,存在着大量的水的异常跨膜转运及在肺组织中的异常聚集等情况,这些情况均可能与水通道蛋白有关。
在小鼠病毒性肺炎模型中,发现AQP1和AQP5在鼠肺中的表达降低,这说明肺水在肺间质中聚集的重要原因就是水通道蛋白的减少,导致水不能及时排出而出现水肿。
哮喘发作时,水分子运动在气道阻塞中起重要作用,特别在冷哮喘或运动哮喘时, 上皮黏膜下血管(含AQP1) 、气管及支气管(含AQP3 和AQP4) 的肿胀是形成气道阻塞的重要原因[1]。
从而说明了水通道蛋白和哮喘的发生也有密切关系。
(三)水通道蛋白及癌症水通道蛋白在肿瘤组织的表达及其与肿瘤细胞转移的关系可能将会是今后研究的热门。
多年研究表明,为满足快速增殖、分裂和侵袭转移的需要,肿瘤细胞内一系列酶的活性和表达会发生改变,细胞基本结构成分如蛋白质、脂类和核酸的合成加强。
癌细胞的所有生命活动都离不开水的微环境和参与,癌细胞比正常细胞更需要水分子的快速跨膜转运。
目前的研究表明,部分AQPs在肿瘤组织中表达明显增高或降低。
在脑胶质瘤中水通道蛋白的表达明显增多,脑胶质瘤多伴有脑水肿的发生。
经证实,AQP 1和AQP4在脑胶质瘤中的表达明显高于正常组织,且在星型细胞的表达量与恶性程度有直接关系[8]。
AQPs同时还可能促进肿瘤血管增生,增强肿瘤血管渗透性,在肿瘤的生长和扩散、侵袭和转移中有重要作用。

膜转运蛋白的类型及区别膜转运蛋白是一类存在于细胞膜上的蛋白质,能够通过细胞膜将物质从细胞内转运到细胞外或者从细胞外转运到细胞内。
根据其结构和功能的不同,膜转运蛋白可以分为多种类型,下面将分别介绍这些类型及其区别。
1. 离子通道蛋白(Ion Channel Proteins)离子通道蛋白是一类能够形成离子通道的蛋白质,通过这些通道,离子可以在细胞膜上快速通透。
离子通道蛋白根据对离子的选择性可分为阳离子通道和阴离子通道。
阳离子通道蛋白主要负责钠、钾、钙等阳离子的传输,而阴离子通道蛋白则主要负责氯离子和其他阴离子的传输。
离子通道蛋白的开闭状态通常受到电压、配体或其他信号的调控。
2. 载体蛋白(Carrier Proteins)载体蛋白是一类能够将物质从一个细胞膜侧转运到另一个细胞膜侧的蛋白质。
通过结合物质并经过构象变化,载体蛋白可以将物质从高浓度区域转运到低浓度区域,这个过程不需要能量的消耗。
载体蛋白在细胞内物质的摄取、排泄和信号传导等过程中起到重要作用。
3. 水通道蛋白(Aquaporins)水通道蛋白是一种特殊的膜转运蛋白,它具有高度选择性地传输水分子。
水通道蛋白能够形成水分子通过的通道,使得水分子能够快速地通过细胞膜进入或者离开细胞。
水通道蛋白在维持细胞内外水分平衡、调节细胞内压力和保护细胞免受渗透胁迫等方面发挥着重要的作用。
4. ABC转运体(ABC Transporters)ABC转运体是一类能够通过ATP酶活化的方式将物质跨越细胞膜的转运蛋白。
它们通过耗能的方式将物质从低浓度区域转运到高浓度区域,这个过程需要ATP的参与。
ABC转运体在多种物质的转运中起到关键作用,包括药物的转运、细胞内代谢产物的排泄等。
5. P型转运酶(P-type ATPases)P型转运酶是一类能够通过ATP酶活化的方式将物质跨越细胞膜的转运蛋白。
与ABC转运体不同的是,P型转运酶在转运过程中直接利用ATP水解产生的能量。
水通道蛋白4的研究进展水通道蛋白4(AQP4)是一种与水的通透性有关的蛋白,主要存在于中枢神经系统,并广泛表达于中枢神经系统的星形胶质细胞、脉络丛上皮细胞、室管膜上皮细胞等支持细胞中,目前大量研究表明,AQP4不仅与脑水肿的发生发展密切相关,同时还参与多种神经系统疾病的病理过程,对临床神经系统疾病的诊断及治疗具有重要的意义,本文就AQP4与几种常见神经系统疾病的联系作一综述。
水通道蛋白(aquaporins,AQPS)就是一組与水的通透性有关的蛋白,其中AQP1最早被发现,随后又陆续发现了包括AQP0-AQP12在内的13种水通道蛋白,其中AQP1、AQP3、AQP4、AQP5、AQP8和AQP9主要存在于哺乳动物的脑组织中,尤以AQP4的存在及表达最为重要,参与了脑水肿及多种神经系统疾病的发展。
1 AQP4基本结构及分布AQP4基因位于人类染色体18q11.2与q12.1的连接处,包含4个外显子,负责127、55、27、92位氨基酸序列的编码,3个内含子位于其间。
从结构上看,其包括6个跨膜结构和A、C、E 3个细胞外环和B、D 2个细胞内环。
AQP4的四级结构是由相对分子质量约34 KD的4个具有独立活性的且均含有6条疏水性跨膜结构的单体组成的四聚体,每个单体的6条疏水性跨膜结构形成类似沙漏的水通道,仅允许单线通过1个水分子。
AQP4主要分布于中枢神经系统的星形胶质细胞、脉络丛上皮细胞、室管膜上皮细胞等支持细胞中,并大量表达在星形胶质细胞足突、胶质界膜、软脑膜及室管膜与其下星形胶质细胞的空隙中,目前尚未发现其在兴奋性细胞中表达[1]。
此外,AQP4呈极性分布于星形胶质细胞足突上,锚定蛋白和细胞周围环境对其这种分布起到了一定的作用[2]。
由此可以简单的通过AQP4的分布及表达特点推断其与中枢系统的水平衡有关。
2 AQP4与Kir4.1内向整流钾离子通道4.1(Inwardly rectifying K+ channel,Kir4.1)是中枢神经系统的一种膜蛋白,其具有内向整流的特点并能通过调节胞外过高的钾离子浓度而维持内环境的稳态。
水通道蛋白研究进展水通道蛋白是一种专门负责水分子跨膜运输的蛋白,对于生物体的水分平衡和调节具有重要意义。
近年来,随着研究的深入,水通道蛋白的作用机制和应用领域逐渐引起人们的。
本文将概述水通道蛋白的基本概念、分类、功能,并重点介绍其研究进展。
水通道蛋白概述水通道蛋白是一种位于细胞膜上的运输蛋白,主要负责水分子在细胞膜上的跨膜运输。
水通道蛋白可根据其分布位置和功能不同分为不同类型,例如:AQP0、AQP1、AQP2等。
这些蛋白在细胞膜上形成水通道,帮助水分子快速、高效地通过细胞膜,从而维持细胞内外水平衡及细胞生长代谢。
水通道蛋白研究进展1、水通道蛋白的分子结构与功能关系水通道蛋白的分子结构由6个跨膜片段组成,形成一种特定的构象,从而有利于水分子通过。
不同的水通道蛋白具有不同的构象和功能,例如:AQP0主要分布于视网膜色素上皮细胞,参与调节眼部水分平衡;AQP1主要分布于肾脏、膀胱等器官,参与调节水平衡和尿生成;AQP2主要分布于肾小管和集合管,参与调节尿浓缩和稀释。
2、水通道蛋白的研究方法与技术目前,水通道蛋白的研究方法主要包括以下几种:基因克隆、表达与纯化;蛋白质结晶与结构解析;功能及动力学研究等。
这些方法分别从基因、蛋白质和功能等方面对水通道蛋白进行研究。
同时,随着生物技术的发展,如荧光标记、基因敲除等技术也为水通道蛋白研究提供了有力支持。
3、水通道蛋白的应用领域与展望水通道蛋白在生物学、医学等领域具有广泛的应用价值。
首先,水通道蛋白参与维持生物体内环境稳态,对治疗与预防水肿、脱水等疾病具有重要意义。
例如,AQP1在急性肾损伤和慢性肾功能衰竭等疾病中表达异常,成为治疗上述疾病的潜在靶点。
此外,水通道蛋白还与某些肿瘤细胞的生长和转移密切相关,因此有望为肿瘤治疗提供新思路。
其次,水通道蛋白在物质跨膜转运、药物研发等方面也具有潜在应用价值。
例如,通过研究AQP4在脑内的分布和作用机制,有助于理解脑内物质跨膜转运的规律,为药物研发提供新靶点。
浅析植物水通道蛋白的研究进展-植物学论文-生物学论文——文章均为WORD文档,下载后可直接编辑使用亦可打印——水通道蛋白(也称水孔蛋白,AQPs)促使着水分的双向跨膜运动,它所介导的自由水快速被动地跨生物膜转运,是水进出细胞的主要途径。
第1 次从分子水平上证实细胞膜上存在水转运通道蛋白是Pe-ter Agre 研究小组[1]于1988 年从血红细胞和肾小管中分离纯化出的CHIP28 蛋白,并由实验证明了CHIP28 蛋白具有允许水分子进入的功能。
CHIP28 蛋白也因此被重新命名为l 号水通道蛋白(AQPl)。
第1 个植物水通道蛋白---2-TIP 是Maurel 等[2]于1993 年从拟南芥Arabidopsis thaliana 中分离出来的。
目前,已经从细菌、酵母、植物、动物中分离出多种水通道蛋白的同源基因,并且证明水通道蛋白除了担负细胞间或细胞内外水分子输导的功能,还参与细胞伸长与分化、气孔运动等生理过程。
本文主要从水通道蛋白家族成员组成、结构、生理功能及表达等方面对植物水通道蛋白的研究进展进行系统介绍。
1 水通道蛋白家族成员植物水通道蛋白的结构与动物水通道蛋白同属于一个古老的跨膜通道蛋白MIP 超家族。
已经测序的植物基因组揭示植物水通道蛋白是一个超家族:拟南芥中有38 个水通道蛋白基因编码的35 种水通道蛋白同源蛋白,其中10 个属于液泡膜水通道及其类似蛋白,13 个为质膜水通道及其类似蛋白,12 个属于NLM 类。
此外,玉米Zea mays 和水稻Oryza sativa 中分别有35 个和33 个水通道蛋白基因[3]. Johan-son 等[4]根据氨基酸序列同源性和亚细胞定位将水通道蛋白划分为5 个家族:质膜内在蛋白(PIPs),液泡膜内在蛋白(TIPs),类Nodulin26(NOD26)膜内在蛋白(NIPs),小的碱性膜内在蛋白(SIPs)和类GlpF 膜内在蛋白(GIPs)。
水通道蛋白的发现及对人体的作用刘彦成(渭南师范学院环境与生命科学系陕西渭南 714000)摘要:水通道蛋白(aquaporin,AQP) 是一种对水专一的通道蛋白。
具有介导水的跨膜转运和调节体内水代谢平衡的功能。
水通道蛋白调节失控与水平衡紊乱等一系列疾病密切相关。
关键词:细胞膜;水通道蛋白(AQP);跨膜转运;疾病;调节Abstract:The pass of water protein (aquaporin, AQP) is one kind of adding water single-minded channel protein.Has lies between leads the water the cross membrane transportation and the adjustment body domestic waters metabolism balance function.Pass of water protein adjustment out of control and level balance disorder and so on a series of disease close correlation.Key word:Cell membrane pass of water protein (AQP) cross membrane transportation disease adjusts1 水通道蛋白的发现1.1 细胞膜的运输方式细胞是构成生物的基本单位,细胞与细胞之间则是通过细胞膜来沟通和实现基本的生命活动。
细胞膜的主要成分为磷脂和蛋白质,其结构为磷脂双分子层,磷脂双分子层上有糖蛋白,糖蛋白所在一侧为细胞外侧。
物质跨膜运输可分为自图1 细胞膜的立体结构由扩散(不需能量、载体),协助扩散(不需要能量、需载体),主动运输(要能量、需载体)三种。
还有一些大分子物质是通过胞吞、胞吐方式通过细胞膜,它们需要能量、不要载体。
水通道蛋白
水通道蛋白是介导水跨膜转运的一大
膜蛋白家族,分布于高等脊椎动物上皮细胞或内皮细胞。
结构上由28-KDa 亚单位组成
四聚体,每个亚单位构成孔径约的水孔通道,在渗透压驱动下实现水双向跨膜转运【1】。
目前11 种亚型已经在哺乳动物中被确定,
各种亚型的体内分布具有组织特异性,其中水通道蛋白-4 (Aquaporin 4,AQP4)以极化
形式集中分布于中枢神经系统脑毛细血管
周边的星形胶质细胞足突或室管膜细胞【2】。
血脑屏障为脑内另一调控水平衡的复合体,由无窗孔的脑毛细血管内皮细胞及细胞间
紧密连接、基底膜、星形胶质细胞等组成,介于血液和中枢神经系统之间,限制血液中某些离子、大分子物质转移到脑实质,此屏障作用为维持CNS 内环境稳定、保障脑功能正常行使提供了重要保障。
BBB 分化发育过程中脑毛细血管内皮细胞间紧密连接的形
成虽被认为是其成熟的标志,但BBB 生理功
能的实现有赖于各组成成分间的相互作用。
近来对星形胶质细胞调控BBB 物质交换和
脑内水平衡方面的作用日益受到重视,并认为与AQP4 表达有关。
本文就AQP4 与血脑屏障发育及其完整性关系的研究进展作一综述。
分化发育过程中AQP4 的表达
目前由于对鸡胚视顶盖中血管及BBB 分化的研究已较完善,因此常被用于BBB 的研究模型。
Nico 及其同事【3】采用免疫细胞化学、分子生物学技术研究了鸡胚视顶盖AQP4 在BBB 分化发育过程的动态表达。
免疫电镜显示鸡胚视顶盖发育第9 d,BBB仅由不规则的内皮细胞组成,内皮细胞间紧密连接尚未形成,AQP4 未见表达。
待发育至第14 d,Western blot 技术首次在约30 kDa 链附近检测出AQP4 的免疫活性,电镜下显示短的内皮细胞间紧密连接已形成,并串联构成BBB 的微血管,星形胶质细胞间断黏附于血管壁,AQP4 不连续地表达于血管周边,血管周围仍然存在小空隙。
发育第20 d BBB 成熟,内皮细胞间紧密连接形成,BBB 微血管
被星形胶质细胞紧紧包被,血管周边星形胶质细胞足突上的AQP4 呈现强阳性表达,且冷冻断裂研究显示AQP4 的正交排列阵也同步形成。
而在啮齿类动物, BBB 分化发育发生于出生后,AQP4 表达与BBB 发育也表现出一定的同步性。
大鼠出生后脑毛细血管呈最大速率增殖,BBB 逐步发育完全,脑内AQP4 的首次检出也恰在出生后,且随BBB 分化发育逐渐增加【4】。
以上证据显示不论BBB 于胚胎期发育完全的禽类还是出生后发育完全的啮齿类动物,AQP4 表达与BBB 分化发育都表现出一定意义的同步性,说明脑内水调控与血脑屏障关系密切。
在BBB发育过程中的作用
水通道蛋白的表达与BBB生理功能间的联系在胚脑发育过程中得到了很好地体现。
啮齿类动物胚脑发育之初,巨大的细胞外间隙容纳着大量水和离子,仅通过简单扩散将其转移入血液,ECS 容积改变不明显。
随着BBB 分化发育,胶质细胞在脑毛细血管外层被膜形成,AQP4表达增多,待到脑发育后期BBB。