硝酸性质与计算技巧
- 格式:ppt
- 大小:2.37 MB
- 文档页数:5



硝酸的相关计算可能用到的原子量:Cu-64 Ag-108 Fe-56 O-16 Mg-24一、从反应的本质看:在浓硝酸中放入铜片:1、开始反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2OCu +4H++2NO3-=Cu2+ +2NO2↑+2H2O2、若铜有剩余,则反应将要结束时的化学方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O3Cu +8H+ +2NO3-=3Cu2+ +2NO↑+4H2O3、反应停止后,再加入少量的25%的稀硫酸,这时铜片上又有气泡产生,其原因是(用离子方程式表示)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O二、计算的技巧:1、利用N守恒计算:参加反应的硝酸一部分显酸性,生成硝酸盐,另一部分作氧化剂,一般转化为氮的氧化物(NO或NO 2),根据氮元素守恒解题。
浓HNO3+足量Cu(金属)型:M+HNO3=M(NO3)X+氮的氧化物+H2O根据氮元素守恒,分析硝酸的去向:n(起氧化性作用硝酸)=n(NO)+n(NO2)n(起酸性作用硝酸)=n(金属)×金属化合价n(参加反应的总硝酸)=n(起氧化性作用硝酸)+n(起酸性作用硝酸)=n(NO)+n(NO2)+n(金属)×金属化合价例1.将1.92g铜粉与一定量浓硝酸恰好完全反应,反应后收集到的气体在标准状况下的体积为1120mL。
(假设反应中只产生NO或NO 2)则消耗硝酸的物质的量为 mol。
A.0.12 B.0.11 C.0.09 D.0.08解析:因为0.03mol Cu 参加反应生成Cu(NO3)2 对应0.06mol HNO3 显酸性,0.05mol氮的氧化物(NO或NO2)对应0.05molHNO3起氧化性作用,所以共消耗硝酸0.11mol。
答案选B 【巩固练习】若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生5.6L气体(标准状况)。



硝酸的性质及相关计算唐山市开滦第二中学-------范子阳硝酸是中学化学中常用的一种强酸,纯硝酸是无色、具有刺激性气味的液体,极易溶于水,低沸点、易挥发。
对于硝酸的物理性质掌握起来比较容易,但对于硝酸的化学性质掌握起来就不太轻松了,尤其是解决硝酸与金属反应的计算问题时,要用对方法才能解的快又准。
一、 掌握硝酸的化学性质1、 硝酸是一元强酸,具有酸的通性:①能使指示剂变色;②能跟金属反应;③能跟碱反应;④能跟碱性氧化物反应;⑤能和某些盐反应。
2、 硝酸具有不稳定性:4HNO 4NO 2↑+2H 2O + O 2↑注:有时浓硝酸呈黄色,就是由于分解产生的NO 2溶于其中,因此浓硝酸应贮存在棕色瓶中并放黑暗低温处。
3、硝酸具有强氧化性①硝酸可以溶解除了Au 、Pt 之外的所有金属(需要指出的是与氢前金属反应不生成H 2)3Cu+8 HNO 3(稀)=3Cu(NO 3)2+2NO ↑+4H 2O(实验室制NO 法)Cu+4 HNO 3(浓)= Cu(NO 3)2+2NO 2↑+2H 2O(实验室制NO 2法)对于以上的反应我们可以用口决“硝稀三八无,浓硝一四棕”(“无”指NO 无色,“棕”指NO 2为红棕色)加以记忆。
②浓硝酸在常温下可以使Al 、Fe 钝化,钝化恰恰证明了浓硝酸具有强氧化性(当然加热可以解“钝”)③硝酸可以氧化P 、S 、C 等非金属单质P +5HNO 3(浓)△ H 3PO 4+5NO 2↑+H 2O 3P +5HNO 3(稀)+2H 2O △ 3H 3PO 4+5NO 2↑ S +6HNO 3(浓) △H 2SO 4+6NO 2↑+H 2OS +2HNO 3(稀) △ H 2SO 4+2NO ↑④王水(浓硝酸与浓盐酸的体积比为1:3配制)可以溶解包括Au 、Pt 在内的所有金属Au+HNO 3+4HCl=HAuCl 4+NO ↑+2H 2O3Pt+4 HNO 3+18HCl=3H 2PtCl 6+4NO ↑+8H 2O二、哪些实例可以证明浓硝酸的氧化性比稀硝酸强①稀硝酸只能将氢碘酸氧化成I 2,而浓硝酸则能把HI 氧化成HIO 3: 6HI +2 HNO 3(稀) △2+2NO ↑+4H 2O光照或 △HI 2+6 HNO 3(浓) △ 3+6NO 2↑+3H 2O②稀硝酸与硫化物反应时,只能将S 2-离子氧化成单质S ,而浓硝酸与硫化物反应时能将S 2-进一步氧化成SO 42-:3PbS+8 HNO 3(稀) △3)2+2NO ↑+4H 2O +3S ↓PbS+8 HNO 3(浓) △3PbSO 4↓+8NO 2↑+4H 2O以上事实可以证明,浓硝酸得电子能力比稀硝酸强,所以浓硝酸的氧化性比稀硝酸的要强。

硝酸的物理性质一物理性质:1. 纯硝酸是无色油状液体, 开盖时有烟雾, 挥发性酸[沸点低→易挥发→酸雾]2. M.p. -42℃, b.p. 83℃. 密度: 1.5 g/cm3, 与水任意比互溶.3. 常见硝酸a%= 63%-69.2% c= 14-16mol/L. 呈棕色(分析原因) 发烟硝酸.二化学性质:1. 强腐蚀性: 能严重损伤金属、橡胶和肌肤, 因此不得用胶塞试剂瓶盛放硝酸.2. 不稳定性: 光或热4HNO3 ===== 4NO2 + O2 + 2H2O所以, 硝酸要避光保存.3. 强酸性: 在水溶液里完全电离, 具有酸的通性.4. 强氧化性: 浓度越大, 氧化性越强.氧化性:王水HNO3+HCI>浓HNO3>稀HNO3。
a) 与金属反应:Cu + 4HNO3(浓) == Cu(NO3)2 + 2NO2 ↑+ 2H2O3Cu + 8HNO3(稀) == 3Cu(NO3)2 + 2NO↑ + 4H2OAg + 2HNO3(浓) == AgNO3 + NO2 ↑+H2O3Ag + 4HNO3(稀) == 3AgNO3 + NO ↑+ 2H2O能氧化活泼金属,且无H2放出硝酸能与除金、铂、钛等外的大多数金属反应.通常浓硝酸与金属反应时生成NO2, 稀硝酸(<6mol/L)则生成NO.钝化反应: 常温下浓硝酸可使铁、铝、铬(都可呈+3价金属化合物)表面形成具有保护性的氧化膜而钝化. 而稀硝酸则与它们反应.Fe + 4HNO3(稀) == Fe(NO3)3 + NO + 2H2O王水: 1体积浓硝酸与3体积浓盐酸的混合溶液.可溶解金、铂.Au + HNO3 + 4HCl == HAuCl4 + NO + 2H2OM + HNO3(12∽14mol/L) ↗NO2为主.M + HNO3(6∽8mol/L) ↗NO为主M + HNO3(约2mol/L)↗N2O为主, M较活泼.M + HNO3(<2mol/L) ↗NH4+为主(M活泼)M + HNO3还可能有H2产生(M活泼)b) 与非金属反应: 浓硝酸; 需要加热.C + 4HNO3(浓) == CO2 ↑+ 4NO2↑ + 2H2O (实验演示)H2S + 8HNO3(浓) == H2SO4 + 8NO2↑ + 4H2O3H2S + 2HNO3(稀) == 3S + 2NO + 4H2O (冷)SO2 + 2HNO3(浓) == H2SO4 + 2NO23SO2 + 2HNO3(稀) + 2H2O == 3H2SO4 + 2NOH2S、SO2以及S2-、SO32-都不能与硝酸共存.c) 与有机物反应: 生成硝基化合物和硝酸酯.三硝酸的制法:1. 实验室制法: 微热NaNO3(s) + H2SO4(浓) == NaHSO4 + HNO32. 氨氧化法制硝酸:4NH3 + 5O2 == 4NO + 6H2O (氧化炉中)2NO + O2 == 2NO2 (冷却器中)3NO2 + H2O = 2HNO3 + NO (吸收塔)4NO2 + O2 + 2H2O == 4HNO3 (吸收塔)过程:(1)先将液氨蒸发, 再将氨气与过量空气混合后通入装有铂、铑合金网的氧化炉中, 在800℃左右氨很快被氧化为NO. 该反应放热可使铂铑合金网(催化剂)保持赤热状态.(2)由氧化炉里导出的NO和空气混合气在冷凝器中冷却, NO与O2反应生成NO2.(3)再将NO2与空气的混合气通入吸收塔. 由塔顶喷淋水, 水流在塔内填充物迂回流下. 塔底导入的NO2和空气的混合气, 它们在填充物上迂回向上. 这样气流与液流相逆而行使接触面增大, 便于气体吸收. 从塔底流出的硝酸含量仅达50%, 不能直接用于军工、染料等工业, 必须将其制成98%以上的浓硝酸. 浓缩的方法主要是将稀硝酸与浓硫酸或硝酸镁混合后, 在较低温度下蒸馏而得到浓硝酸, 浓硫酸或硝酸镁在处理后再用.尾气处理: 烧碱吸收氮的氧化物, 使其转化为有用的亚硝酸盐(有毒)即”工业盐”.NO + NO2 + 2NaOH == 2NaNO2 + H2O。

硝酸密度摩尔
摘要:
一、硝酸的定义与性质
1.硝酸的定义
2.硝酸的性质
二、硝酸密度的计算
1.摩尔质量的计算
2.摩尔密度的计算
三、硝酸密度的实际应用
1.在化学实验中的应用
2.在工业生产中的应用
四、硝酸密度的相关知识
1.摩尔质量与摩尔密度的关系
2.硝酸的浓度计算
正文:
硝酸是一种无机化合物,化学式为HNO3,具有强氧化性和腐蚀性。
硝酸的密度是其质量与体积之比,通常用摩尔密度来表示。
要计算硝酸的摩尔密度,首先需要知道硝酸的摩尔质量。
硝酸的摩尔质量是由其构成原子的相对原子质量相加而得,即1×氢的相对原子质量+1×氮的相对原子质量+3×氧的相对原子质量=63.01g/mol。
硝酸的摩尔密度即为硝酸的摩尔质量,为63.01g/mol。
在化学实验中,
摩尔密度常用于测量溶液的浓度。
在工业生产中,摩尔密度可用于硝酸的储存和输送,帮助企业合理配置资源。
摩尔质量与摩尔密度之间的关系是,摩尔质量是摩尔密度的单位。
例如,氢气的摩尔质量为2g/mol,其摩尔密度即为2g/L。
硝酸的浓度可以通过摩尔质量和摩尔密度计算得出,公式为:浓度=摩尔质量/摩尔密度。
总之,硝酸密度摩尔是一个重要的物理性质,不仅与硝酸的化学性质密切相关,还在实际应用中具有广泛的价值。

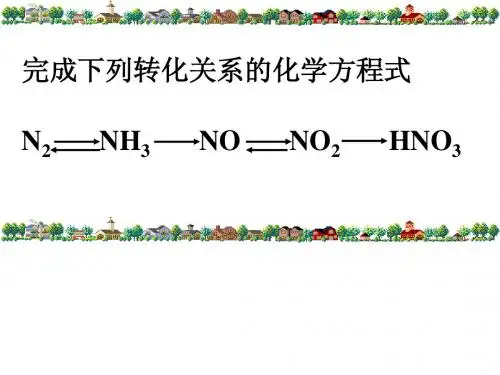
硝酸与硝酸盐的计算一、硝酸与金属反应中硝酸的作用:(1)酸性(2)氧化性二、硝酸盐(1)硝酸盐的受热分解规律①_________________________②___________________________________________③___________________________________________(2)硝酸盐在酸性的条件下具有强的氧化性:与_______________________________不共存三、混酸的计算_______________________________________________________________________四、硝酸的计算技巧例1:15.36gCu与200mL某浓度的硝酸恰好完全反应,生成气体3.58L(标况),求原硝酸的浓度?变式:38.4mg铜与适量的浓硝酸反应,铜全部作用后共收集到气体1m mol,则参加反应的硝酸的物质的量可能是()A 1 m molB 1.6 m molC 2.2 m molD 2.4 m mol例2:在体积为40ml的稀硝酸中加入4.2g铁粉充分反应后,恰好完全反应,硝酸的还原产物是NO,通过计算该硝酸的物质的量浓度?例3:14g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标况)氧气混合,通入水中恰好被全部吸收求:(1)原合金中铜的质量?(2)若所用的硝酸溶液为40mL,刚好完全反应,试确定其物质的量浓度可能的范围?【练习】1.浅绿色的Fe(NO 3)2溶液Fe 2++2H 2O →Fe(OH)2+2H +,向该溶液中逐滴加入稀盐酸,溶液的颜色变化情况是 ( )A.变为深绿色B.褪为无色C.变为棕黄色D.没有变色2.足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO 2、N 2O 4、NO 的混合气体,这些气体与1.68LO 2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。

硝酸的知识点总结1. 硝酸的性质硝酸是一种具有强酸性的化合物,它在水中瞬间离解产生氢离子和硝酸根离子。
硝酸的酸性强于许多其他普通酸,它在浓度较高的情况下能够腐蚀金属和灼伤皮肤。
此外,硝酸也具有强烈的氧化性,能够氧化许多有机物和氢气,因此在实验室中常用来进行氧化反应。
2. 硝酸的制备硝酸可以通过多种方法进行制备,其中最常见的是通过硫酸与硝酸铵的反应来制备。
该反应如下所示:NH4NO3 + H2SO4 -> NH4HSO4 + HNO3制备硝酸时,硝酸铵与浓硫酸反应生成硫酸铵和硝酸。
除了这种方法外,硝酸的制备还可以采用其他化合物的氧化反应或者通过电解硝酸盐溶液来实现。
3. 硝酸的用途硝酸有着广泛的应用领域,包括工业生产、实验室实验和其他领域。
在工业生产中,硝酸用于生产硝酸铵、硝基化合物、有机合成和金属表面处理等。
在实验室中,硝酸常用于氧化反应、制备其他化合物和清洗玻璃器皿等。
此外,硝酸也用作一种杀菌剂、消毒剂和氧化剂,在一些特定的领域也有一定的应用。
4. 硝酸的安全注意事项由于硝酸具有强烈的腐蚀性和氧化性,因此在使用时需要注意安全。
首先,硝酸不宜与可燃物和还原剂混合使用,以免发生爆炸或火灾。
其次,硝酸应远离皮肤和眼睛,使用时应佩戴防护眼镜和手套。
另外,硝酸在储存和使用时需要注意避免与有机物和其他化学品混合,避免产生有害气体或剧烈反应。
综上所述,硝酸是一种具有重要意义的化合物,它具有强酸性和氧化性,广泛应用于工业生产和实验室实验中。
使用硝酸时需要严格遵守安全操作规程,以免发生事故。
希望本文对硝酸的相关知识有所帮助。
硝酸[重要知识点]硝酸的物理性质,硝酸的酸性、不稳定性、强氧化性。
[重点讲解]一、硝酸的性质1.硝酸的物理性质:无色,具有刺激性气味的液体,易挥发,易溶于水。
69%以上为浓硝酸。
98%以上的称之为发烟硝酸。
2.硝酸的化学性质(1)酸的通性:一元强酸,具有酸的通性。
稀硝酸使石蕊试液变红色,浓硝酸使石蕊试液先变红(H+作用),后褪色(强氧化作用,即漂白作用)。
用此实验可以证明浓硝酸的氧化性比稀硝酸强。
(2)强氧化性:硝酸的氧化性源于其氮元素为+5价,由于硝酸的结构不是很稳定,所以易表现出氧化性。
①与金属单质反应:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O3Cu+8H++2NO3-(稀)=3Cu2++2NO↑+4H2O注意:a.浓HNO3被还原为NO2,稀HNO3被还原为NO(极稀HNO3被还原为N2O或NH3)。
b.硝酸越浓,其氧化性越强。
硝酸氧化性强弱并不是根据硝酸的被还原产物的化合价改变的大小来决定,而是得电子难易程度来决定。
c.由于硝酸的强氧化性,故还原剂一般被氧化成最高价态。
d.除Pt、Au外,硝酸几乎可以和所有常见金属反应,但无H2放出。
e.常温下A l、Fe等在浓硝酸中钝化,即表面生成致密的氧化物薄膜阻止反应进一步进行。
因此浓HNO3可用铝槽车贮运。
f.王水(浓HNO3与浓盐酸按体积比1∶3配制),可溶解Au、Pt等极不活泼金属。
g.常温浓硝酸可使铝、铁钝化,但加热能使它们剧烈的发生化学反应。
Al+6HNO3(浓)Al(NO3)3+3NO2↑+3H2O②与非金属单质反应:浓硝酸可以将S、C、P等非金属单质氧化到最高价态。
C+4HNO3(浓)CO2↑+4NO2↑+2H2OS+6HNO3(浓)H2SO4+6NO2↑+2H2O③与还原性化合物反应:若在化合物中存在有还原性较强的微粒时,HNO3可以将其氧化。
例如:Fe2+→Fe3+SO32-→SO42-I-→I2等。
教育论坛Education BBS■ 周启宇硝酸的性质及相关计算摘要:本文以硝酸的性质与其运算问题为切入点,就其各类化学性质以及涉及到硝酸反应的运算试题,进行细致的探讨研究,期望为提升学生对硝酸的理解认知,优化其相关问题的求解与运算技巧,提供有益的参考。
关键词:硝酸;性质;计算硝酸是高中化学课程的重点教育内容之一,特别是实验教学中常用的一类强酸,其特点在于纯硝酸通常为无色并带有强烈的刺激性味道,自身液体的特征又容易与水溶合,同时其还具备沸点较低与容易挥发等物质特征,这些硝酸的性质较为直观、易懂,容易为高中学生所理解认知,但其化学性质就相对存在学习、掌握困难的问题,同时硝酸又常涉及到化学反应的运算试题,因此需要对硝酸的具体性质与有关的运算问题,予以详细的探究分析。
1硝酸的化学性质研究(1)首先硝酸作为强酸的一个分类,自身会带有酸的共通化学性质,例如能够与金属、碱(包含碱性氧化物)以及部分盐发生反应作用,同时硝酸也能够让化学实验的指示剂产生变色,以方便学生对实验现象的观察学习。
(2)同时硝酸也带有较强的不稳定特性,其化学反应方程式表示为:4HNO3光照△=4NO2↑+2H2O+O2↑如此不稳定性也是硝酸容易挥发的原因所在,因此对于硝酸的贮存,特别是浓硝酸的保存,应基于分解反应作用生成的NO2会呈现黄色的特点以及不稳定性质,将其存储在棕色容器瓶并放置在阴暗低温的区域,避免其出现分解反应造成物品挥发。
[1](3)此外硝酸还具备较强的氧化性质,其强氧化性的作用体现在:①硝酸能够溶解绝大多数的金属(除了Au与Pt两类金属),比如化学实验常用的制作NO的手段:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O就是通过硝酸的强氧化性来溶解金属制成所需的化学反应生成物。
②浓硝酸在常温状态下,能将Al与Fe两类金属进行钝化反应作用,进而通过此两类金属的钝化现象反过来印证浓硝酸的氧化性特征。
③硝酸同时也可以和P、S等非金属单质进行氧化反应,具体氧化反应方程式为:P+5HNO3(浓)△=H3PO4+5NO2↑+H2O3P+5HNO3(稀)+2H2O△=3H3PO4+5NO2↑S+6HNO3(浓)△=H2SO4+6NO2↑+H2O④由浓硝酸与浓盐酸两者之间依照1:3的体积比例,所配制而成的带有更高氧化性性质的王水,能够溶解涵盖Au与Pt在内的所有金属种类,其具体的氧化反应方程式为:Au+HNO3+4HCl=HAuCl4+NO↑+2H2O3Pt+4HNO3+18HCl=3H2PtCl6+4NO↑+8H2O2与硝酸相关运算问题的解题思路与技巧与硝酸相关的运算问题,最为常见的就是硝酸与金属之间的反应运算试题,这类问题的运算步骤与流程较为繁琐,学生对其问题的运算效率与准确率也就难以保证。
硝酸计算专题计算的技巧:一、利用N守恒计算:溶液中的NO3-和生成的NO(或NO2)中N的物质的量之和等于原HNO3的物质的量1、若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生5.6L气体(标准状况)。
则所消耗的硝酸的物质的量为_______。
2、38.4gCu跟适量的浓HNO3反应,Cu全部反应后共收集到气体22.4L(标准状况),反应中作氧化剂的硝酸与总消耗的HNO3的物质的量比( )A、5/11B、6/11C、5/6D、6/5二、利用电子守恒计算:金属转移的电子=氮元素转移的电子1、1.92g铜投入到一定量浓硝酸中,铜完全溶解,生成气体颜色越来越淡,共收集到标准状况下672mL气体,将盛此气体的容器倒扣在水槽中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水,则通入氧气的体积为( )A、504mLB、336mLC、224mLD、168mL2、一定量的铁与一定量的浓HNO3反应,得到硝酸铁液和NO2、N2O4、NO的混合气体,这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。
若向所得硝酸铁溶液中加入2 mol•L-1的NaOH 溶液至Fe3+恰好沉淀,则消耗NaOH 溶液的体积是( )A、300 mLB、150 mLC、120 mLD、90 mL3、某浓度稀HNO3与金属M反应时,能得到+2价硝酸盐,反应时M与HNO3的物质的量之比为5 ∶12,则反应时HNO3的还原产物是()A、NH4NO3B、N2C、N2OD、NO 4.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。
当参加反应的单质与被还原硝酸的物质的量之比为2:1时,还原产物是()A. NO2B. NOC. N2OD. N2三、利用电荷守恒计算:一般应用于硝酸有剩余的反应,反应后存在:n(NO3-) =n(H+)+2n(Cu2+)1、6.4g铜与过量的硝酸(8 mol/L 60mL)充分反应后,硝酸的还原产物有NO、NO2,反应后溶液中所含H+离子为nmol,此时溶液中所含NO3-的物质的量为( )A、0.28 molB、0.31 molC、(n+0.2)molD、(n+0.4)mol 计算的常见题型:1. 浓HNO3+足量Cu型:计算原理:Cu+4HNO3=Cu(NO3)2+2NO2+2H2O3Cu+8HNO3=3Cu(NO3)2+2NO +4H2O或:Cu+4H++2NO3-=Cu2++2NO2 +2H2O3Cu+8H++2NO3-=3Cu2++2NO +4H2O n(被还原的硝酸)=n(NO)+n(NO2)n(参加反应的硝酸)= n(NO)+n(NO2)+2n(Cu2+)例1. 将1.92gCu与一定量的浓硝酸反应,生成的气体颜色逐渐变浅,当Cu全部溶解时,共收集到标况下气体1.12L,则反应中消耗的硝酸的物质的量为________mol练习:铜与某浓度的硝酸反应后产生气100ml (标况).该混合气的密度是相同状况下H2密度的26.7倍.将此气体在密闭容器中用水充分吸收后,剩余气体的体积为70ml(标况)(1).该混合气各组分的体积是多少ml?(2).被还原的硝酸是多少克?2.HNO3+H2SO4+Cu或硝酸盐+H2SO4+Cu型:计算原理:3Cu+8H++2NO3-=3Cu2++2NO +4H2O 例1. 在1molKNO3和4molH2SO4的混合稀溶液中,加入 1.5molCu粉,充分反应后,生成的气体在标况下的体积约为_________L.练习:某溶液中含有H+、NO3—、SO42—三种离子,其中H+和SO42-的物质的量浓度分别为7.0mol/L和2.0mol/L.取该溶液20ml,加入3.2gCu粉,加热使它们充分反应,收集的气体在标况下的体积是多少?3.得失电子守恒的应用:例2. 为了测定某铜银合金的成分,将30.0g该合金溶于80mL13.5mol/L的浓硝酸中,待合金完全溶解后,收集到气体6.72L(标况),并测得溶液的c(H+)=1mol/L.设反应后溶液的体积仍为80mL,试计算 (1).合金中银的质量分数 . (2).所得气体水洗后的体积(标况)4.HNO 3与Fe 恰好完全反应型:计算原理:Fe+4HNO 3=Fe(NO 3)3+NO +2H2O 3Fe+8HNO 3=3Fe(NO 3)2+2NO+4H2O 所得溶质为硝酸铁或硝酸亚铁或混合物例1. 含ag 硝酸的稀溶液,恰好使5.6gFe 粉完全溶解,若有n/4gHNO 3被还原,则n 值不可能是A.12.6B.16.8C.18.9D.25.2 5. Fe 、Cu 混合与HNO 3反应的计算:现有Fe 、Cu 组成的合金,总物质的量为a mol ,其中Cu 的物质的量分数为x ;研成粉末后,全部投入含bmolHNO 3的稀溶液中,微热使其充分反应,且HNO3的还原(2). 当残留金属离子只有Fe 和Cu 时,求b 的取值范围(3). 当x=0.5时,若溶液中Fe 2+和Fe 3+的物质的量相等时,在标况共产生672ml 气体,求a 、b 的值。
2014年高中化学知识点复习:硝酸的性质
摘要高中学生在学习中或多或少有一些困惑,的编辑为大家总结了2014年高中化学知识点复习:硝酸的性质,各位考生可以参考。
物理性质:无色液体,易挥发,沸点较低,密度比水大。
化学性质:具有一般酸的通性,浓硝酸和稀硝酸都是强氧化剂。
还能氧化排在氢后面的金属,但不放出氢气。
4HNO3(浓)+Cu == Cu(NO3)2+2NO2 uarr;+4H2O
8HNO3(稀)+3Cu 3Cu(NO3)2+2NO uarr;+4H2O
反应条件不同,硝酸被还原得到的产物不同,可以有以下产物:N(+4)O2,HN(+3)O2,N(+2)O,N(+1)2O,N(0)2,N(-3)H3△硫酸和硝酸:浓硫酸和浓硝酸都能钝化某些金属(如铁和铝)使表面生成一层致密的氧化保护膜,隔绝内层金属与酸,阻止反应进一步发生。
因此,铁铝容器可以盛装冷的浓硫酸和浓硝酸。
硝酸和硫酸都是重要的化工原料和实验室必备的重要试剂。
可用于制化肥、农药、炸药、染料、盐类等。
硫酸还用于精炼石油、金属加工前的酸洗及制取各种挥发性酸。