高中化学 1-1元素周期表 新人教版必修2
- 格式:ppt
- 大小:1.65 MB
- 文档页数:16



必修2第一章 物质结构 元素周期律一、元素周期表1、元素周期表是俄国科学家门捷列夫发明的2、写出1~18号元素的原子结构示意图3、元素周期表的结构7个周期(三短、三长、一个不完全),周期数=电子层数7个主族、7个副族、一个零族、一个Ⅷ族,主族序数=最外层电子数 4、碱金属元素(1)碱金属元素的结构特点:Li 、Na 、K 、Rb 的最外层电子数、原子半径对其性质的影响。
(2)Na 与K 分别与水、氧气反应的情况 分别与出K 、Na 与水反应的化学方程式(3)从上到下随着核电荷数的增加性质的递变规律 (4)同族元素性质的相似性 5、卤族元素(1)卤族元素的结构特点:F 、Cl 、Br 、I 的最外层电子数、原子半径对其性质的影响。
(2)单质与氢气发生反应的条件与生成气态氢化物的稳定性 (3)卤素间的置换反应(4)从上到下随着核电荷数的增加性质的递变规律 (5)同族元素性质的相似性结论:同主族元素从上到下,元素的金属性逐渐增强,非金属性逐渐减弱。
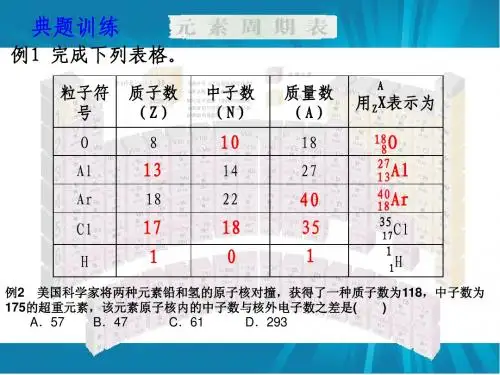
3、核素(1)核素的定义: A P X(2)同位素: 1 1H 、 2 1H 、 3 1H(3)原子的构成:二个关系式:质子数 = 核电荷数 = 核外电子数 质量数A = 质子数P + 中子数N(3)几种同位素的应用: 126C 、146C 、 2 1H 、 3 1H 、238 92U二、元素周期律1、原子核外电子的排布(1)原子核外电子是分层排布的,能量高的在离核远的区域运动,能量低的在离核近的区域运动(2)电子总是先从内层排起,一层充满后再排入下一层,依次是K、L、M、N(3)每个电子层最多只能容纳2n2个电子。
最外层最多只能容纳8个电子(氦原子是2 个);次外层最多只能容纳18 个电子;倒数第三层最多只能容纳32 个电子。
2、元素周期律随着原子序数的递增,元素的性质呈周期性变化的规律原子的电子层排布的周期性变化原子半径的周期性变化主要化合价的周期性变化3、第三周期元素化学性质变化的规律金属性的递变规律(1)钠镁与水反应现象,比较钠镁与水反应的难易(方程式书写)(2)镁铝与盐酸反应的难易(现象,方程式)(3)比较钠镁铝最高价氧化物对应水化物的碱性强弱非金属性的递变规律(1)比较硅、磷、硫、氯与氢气反应的难易以及气态氢化物的稳定性(2)比较它们的最高价氧化物对应的水化物的酸性强弱(3)向硫化氢水溶液中滴入氯水的现象结论:同一周期从左到右,元素的金属性逐渐减弱,非金属性逐渐增强。



![【化学】1[1].1.1《元素周期表》教案 (人教版必修2)](https://uimg.taocdn.com/8384e106eff9aef8941e06b6.webp)
第一章物质结构元素周期律第一节元素周期表第一课时●教学目标:使学生了解元素周期表的结构以及周期、族等概念。
●教学重点:元素周期表的结构●教学方法:启发、诱导、阅读、讨论、练习、探究等●教学用具:投影仪、多媒体、元素周期表挂图等●教学过程【引入】丰富多彩的物质世界是由一百多种元素组成的,这一百多种化学元素有什么内在联系呢?那么,有没有一种工具可以把我们已知的一百多种元素之间的这种内在联系很好地表现出来呢?答案是肯定的。
那就是元素周期表,也是我们本节课所要讲的主要内容。
【板书】第一节元素周期表(第一课时)【阅读】请同学们阅读课本第四页的文字,回答:(1)哪一位科学家首先制得了第一张元素周期表?(2)编排第一张元素周期表时,是以什么为编排顺序?现在的周期表又以什么为编排顺序?(3)什么叫原子序数?它和核电核数、质子数有什么关系?【板书】原子序数=核电核数=质子数=核外电子数【探究】你能否将1—18号元素编成一个小小的周期表?要求:1.将性质相似的元素归类。
2.体现元素性质的周期性递变规律。
编制原则:1.将最外层电子数相同的元素归为一列。
2.将相同电子层数相同的元素排在一行。
3.按原子序数的递增编排。
【投影】收集具代表性的由学生所编制的周期表。
用实物投影仪投影到屏幕上。
设计1:设计2:H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar H HeLi Be B C N O F Ne Na Mg Al Si P S Cl Ar【讨论】请大家讨论一下以上两种周期表的编排,哪一种更为合理呢?【小结】虽然He的最外层电子数与Be和Mg相同,但He原子的最外层已经排满了,达到了稳定结构,而Be和Mg都没达到稳定结构,因此He的性质与Be和Mg并不相似,反而与同是达到稳定结构的Ne和Ar相似,所以将He、Ne、Ar归为一列更合理。
【讲述】把电子层数目相同的元素,按原子序数递增的顺序从左到右排成横行;再把不同横行中最外层的电子数相同的元素,按电子层数递增的顺序由上而下排成纵行。

元素周期表【典例导悟】【典例1】结合元素周期表回答下列问题:(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。
(2)表中所列元素,属于短周期元素的有_______ ,属于主族元素的有_______ ;g元素位于第____周期_____族;i元素位于第____周期_______族。
(3)元素f是第___周期、第___族元素,请在右边方框中按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量。
(4)元素在元素周期表中的位置与元素原子结构的关系__________________________________________ 。
【思路点拨】解答本题要注意以下三点:(1)元素周期表中周期和族的编排依据。
(2)周期和族的分类。
(3)周期表单元格中的各信息及意义。
【自主解答】(1)根据元素周期表的结构知:第一周期有2种元素,第二、三周期有8种元素,分列于第1、2、13~18列,第四、五、六、七周期为长周期,包括1~18列。
由此可画出周期表的边界。
(2)画出周期表的边界,对照周期表,很容易找出各元素在周期表中的位置。
(3)第三周期、第ⅥA族元素为硫,原子序数为16,相对原子质量为32。
(4)元素原子结构与元素在元素周期表中的位置关系为:①元素所在周期序数等于其原子的电子层数,元素所在的主族序数等于原子的最外层电子数,由元素原子的电子层数和最外层电子数可确定元素在元素周期表中的位置。
②同一周期元素原子的电子层数相同,同一主族元素原子的最外层电子数相同。
答案:(1)(2)a、b、c、d、e、f、ga、b、c、d、e、f三0四ⅡB(3)三ⅥA(4)元素的主族序数即为原子结构的最外层电子数,元素的周期数即为原子核外的电子层数【变式训练】关于元素周期表的说法正确的是()A.元素周期表有8个主族B.ⅠA族的元素全部是金属元素C.元素周期表有7个周期D.短周期是指第一、二周期【解析】选C。

元素周期表【教学目标】1.使学生了解元素周期表的结构以及周期、族等概念。
2.使学生理解同周期、同主族元素性质的递变规律,并能运用原子结构理论解释这些递变规律。
3.使学生了解原子结构、元素性质及该元素在周期表中的位置三者间的关系,初步学会运用周期表。
4.通过对元素周期律的发现及元素周期表的编制过程的了解,使学生正确认识科学发展的历程,并以此来引导自己的实践,同时促使他们逐渐形成为科学献身的高贵品质。
5.使学生了解元素周期律和周期表的意义,认识事物变化由量变引起质变的规律,对他们进行辩证唯物主义教育。
6.使学生对同位素及元素相对原子质量的测定有常识性的认识。
【教学重点】元素周期表的结构、元素的性质、元素在周期表中的位置与原子结构的关系【教学难点】元素的性质、元素在周期表中的位置和原子结构的关系、同位素【课时安排】3课时【教学方法】启发、诱导、阅读、讨论、练习、探究等【教学用具】元素周期表挂图【教学过程】【第一课时】[引言]上一节我们学习了元素周期律,知道元素的性质随着原子序数的递增而呈现周期性的变化。
那么,有没有一种工具可以把我们已知的一百多种元素之间的这种周期性很好地表现出来呢?答案是肯定的。
那就是元素周期表,也是我们本节课所要讲的主要内容。
[板书]元素周期表[师]请大家拿出自己亲手绘制的元素周期表。
[学生取表,教师把元素周期表的挂图挂于黑板上][师]元素周期表是元素周期律的具体表现形式,它反映了元素之间相互联系的规律,是我们学习化学的重要工具,下面,我们就来学习元素周期表的有关知识。
首先,我们来认识元素周期表的结构。
[板书]元素周期表的结构[师]元素周期表有不同的形式,我们这里介绍的是一种最常见的形式。
把元素周期表打乱重新排列:1.按原子序数递增的顺序从左到右排列。
2.将电子层数相同的元素排成一个横行。
3.把最外层电子数相同(严格地说是外围电子排布相似)的元素按电子层递增的顺序从上到下排成纵行。