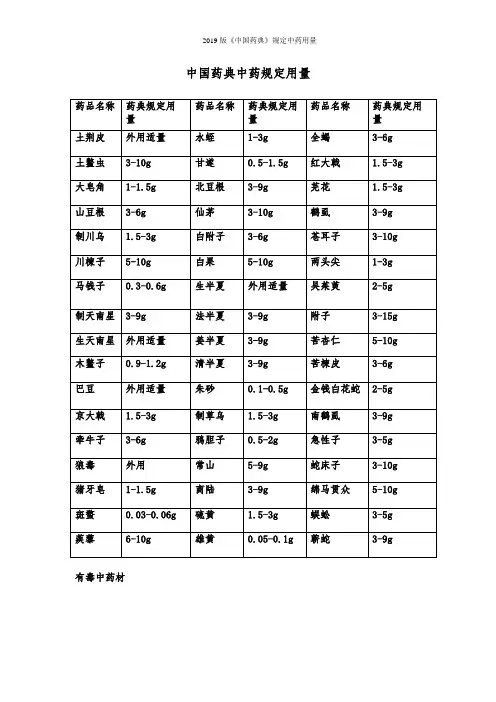
2019 中国药典 中药规定用量
- 格式:xlsx
- 大小:17.13 KB
- 文档页数:10

一枝黄花YizhihuanghuaSOLIDAGINIS HERBA本品为菊科植物一枝黄花Solidago decurrens Lour.的干燥全草。
秋季花果期采挖,除去泥沙,晒干。
【性状】本品长30~lOOcm。
根茎短粗,簇生淡黄色细根。
茎圆柱形,直径~;表面黄绿色、灰棕色或暗紫红色,有棱线,上部被毛;质脆,易折断,断面纤维性,有髓。
单叶互生,多皱缩、破碎,完整叶片展平后呈卵形或披针形,长1~9cm,宽~;先端稍尖或钝,全缘或有不规则的疏锯齿,基部下延成柄。
头状花序直径约,排成总状,偶有黄色舌状花残留,多皱缩扭曲,苞片3层,卵状披针形。
瘦果细小,冠毛黄白色。
气微香,味微苦辛。
【鉴别】 (1)叶表面观:上表皮细胞多角形,垂周壁略呈念珠状增厚。
下表皮细胞垂周壁波状弯曲,气孔不定式,略下陷。
非腺毛有两类:表皮非腺毛由3个细胞组成,壁薄,顶端1个细胞常萎缩成鼠尾状,较小;叶缘非腺毛睫毛状由3~7个细胞组成,壁稍厚,长180~500μm。
(2) 取本品粉末2g,加石油醚(60~90℃)50ml,超声处理30分钟,放冷,滤过,弃去石油醚液,药渣挥干溶剂,加70%乙醇30ml,加热回流1小时,放冷,滤过,滤液蒸干,残渣加甲醇1ml使溶解,作为供试品溶液。
另取一枝黄花对照药材2 g,同法制成对照药材溶液。
再取芦丁对照品,加甲醇制成每1ml含的溶液,作为对照品溶液。
照薄层色谱法(附录ⅥB)试验,吸取供试品溶液5~10μl、对照药材溶液和对照品溶液各5μl,分别点于同一以含4%磷酸氢二钠溶液制备的硅胶G薄层板上,以乙酸乙酯-甲醇-甲酸-水(8:1:1:1)为展示剂,展开,取出,晾干,喷以3%三氯化铝乙醇溶液,晾干,置紫外光灯(365nm)下检视,供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的荧光斑点。
;再喷以5%三氯化铁乙醇溶液,供试品色谱中,在与对照药材色谱和对照品色谱相应的位置上,显相同颜色的斑点。
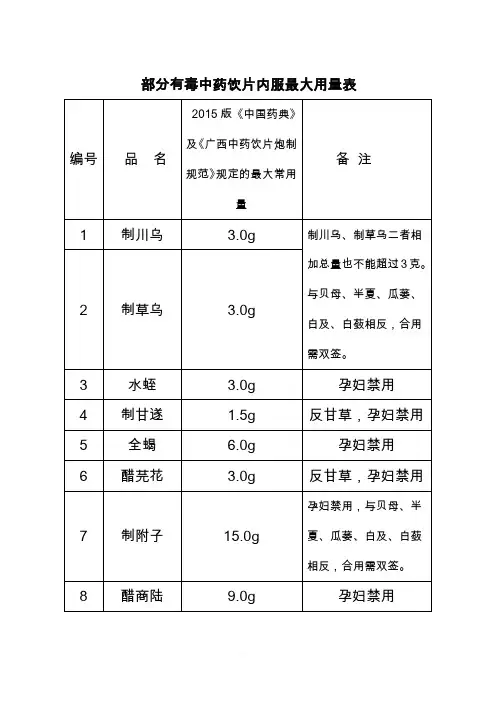
部分有毒中药饮片内服最大用量表
2015年中国药典对有毒、有小毒的部分中药饮片进行了修订,根据药典要求,对原《有毒中药饮片内服最大用量表》进行了修改。
原目录中,新增加的中药饮片为:艾叶(内服最大量9g)、两面针(内服最大量10g)、苦杏仁(内服最大量10g)、苍耳子(内服最大量10g)、醋红大戟(内服最大量3g)、九里香(内服最大量12g)、鹤虱(内服最大量9g)、仙茅(内服最大量10g)、香加皮(内服最大量6g)、蕲蛇(内服最大量9g),
对新增的有毒、有小毒中药饮片,内服超过药典规定的最大剂量,请医生在电子处方上双签字,否则按不合格处方论处;原目录中,取消的中药饮片为:法半夏、细辛、制蜂房、胆南星,对已取消的中药饮片,在用量上超过药典规定最大剂量,不再要求双签。
Welcome To Download !!!
欢迎您的下载,资料仅供参考!。
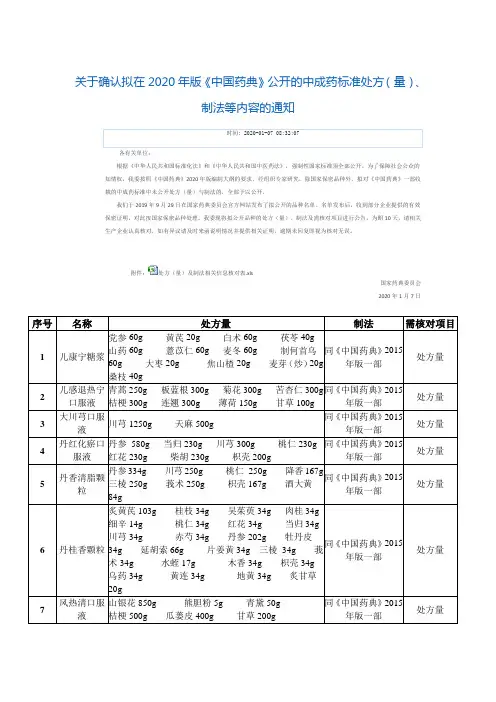
关于确认拟在2020年版《中国药典》公开的中成药标准处方(量)、制法等内容的通知时间: 2020-01-07 08:32:07各有关单位:根据《中华人民共和国标准化法》和《中华人民共和国中医药法》,强制性国家标准须全部公开。
为了保障社会公众的知情权,我委按照《中国药典》2020年版编制大纲的要求,经组织专家研究,除国家保密品种外,拟对《中国药典》一部收载的中成药标准中未公开处方(量)与制法的,全部予以公开。
我们于2019年9月29日在国家药典委员会官方网站发布了拟公开的品种名单。
名单发布后,收到部分企业提供的有效保密证明,对此按国家保密品种处理。
我委现将拟公开品种的处方(量)、制法及需核对项目进行公告,为期10天,请相关生产企业认真核对,如有异议请及时来函说明情况并提供相关证明,逾期未回复即视为核对无误。
附件:处方(量)及制法相关信息核对表.xls国家药典委员会2020年1月7日序号名称处方量制法需核对项目1 儿康宁糖浆党参60g 黄芪20g 白术60g 茯苓40g山药60g 薏苡仁60g 麦冬60g 制何首乌60g 大枣20g 焦山楂20g 麦芽(炒)20g桑枝40g同《中国药典》2015年版一部处方量2 儿感退热宁口服液青蒿250g 板蓝根300g 菊花300g 苦杏仁300g桔梗300g 连翘300g 薄荷150g 甘草100g同《中国药典》2015年版一部处方量3 大川芎口服液川芎1250g 天麻500g同《中国药典》2015年版一部处方量4 丹红化瘀口服液丹参580g 当归230g 川芎300g 桃仁230g红花230g 柴胡230g 枳壳200g同《中国药典》2015年版一部处方量5 丹香清脂颗粒丹参334g 川芎250g 桃仁250g 降香167g三棱250g 莪术250g 枳壳167g 酒大黄84g同《中国药典》2015年版一部处方量6 丹桂香颗粒炙黄芪103g 桂枝34g 吴茱萸34g 肉桂34g细辛14g 桃仁34g 红花34g 当归34g川芎34g 赤芍34g 丹参202g 牡丹皮34g 延胡索66g 片姜黄34g 三棱34g 莪术34g 水蛭17g 木香34g 枳壳34g乌药34g 黄连34g 地黄34g 炙甘草20g同《中国药典》2015年版一部处方量7 风热清口服液山银花850g 熊胆粉5g 青黛50g桔梗500g 瓜蒌皮400g 甘草200g同《中国药典》2015年版一部处方量金银花125g 连翘125g 玄参125g板蓝根125g 赤芍50g 黄芩75g 桑叶50g 菊花50g 前胡50g 苦杏仁50g 牛蒡子50g 泽泻50g 胖大海50g 僵蚕(麸炒)50g 蝉蜕50g木蝴蝶50g。

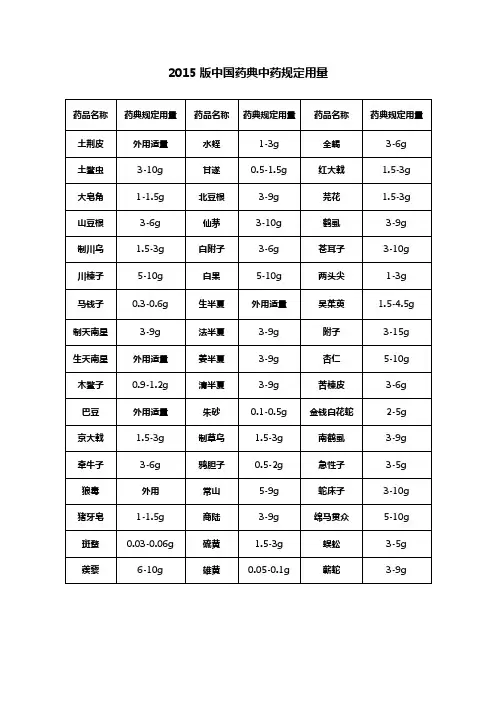
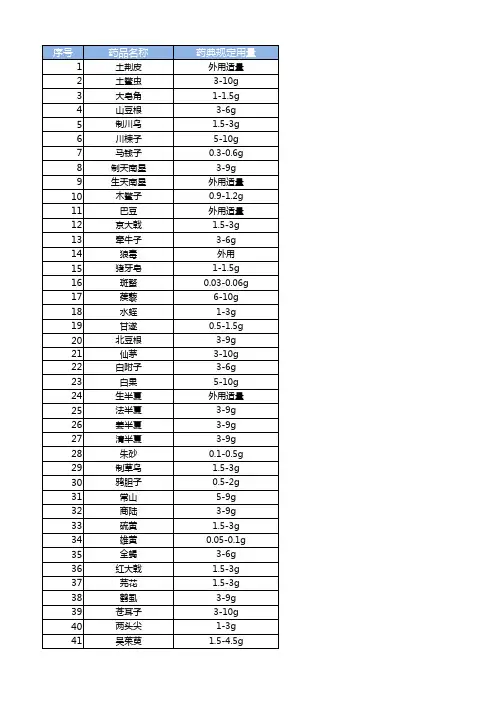
2015版《中国药典》规定中药饮片用量2015版中国药典中药规定用量下表列出了2015版中国药典中常用中草药的规定用量。
药品名称规定用量土荆皮外用适量土鳖虫 3-10g大皂角 1-1.5g山豆根 3-6g制川乌 1.5-3g川楝子 5-10gXXX 0.3-0.6g制天南星 3-9g生天南星外用适量木鳖子 0.9-1.2gXXX 外用适量京大戟 1.5-3g牵牛子 3-6g狼毒外用猪牙皂 1-1.5g斑蝥 0.03-0.06g 蒺藜 6-10g水蛭 1-3g甘遂 0.5-1.5g北豆根 3-9g仙茅 3-10g白附子 3-6g白果 5-10g生半夏外用适量法半夏 3-9g姜半夏 3-9g清半夏 3-9g朱砂 0.1-0.5g制草乌 1.5-3g鸦胆子 0.5-2g常山 5-9g商陆 3-9g硫黄 1.5-3g雄黄 0.05-0.1g 全蝎 3-6g红大戟 1.5-3g芫花 1.5-3g鹤虱 3-9g苍耳子 3-10g两头尖 1-3g吴茱萸 1.5-4.5g 附子 3-15g杏仁 5-10g苦楝皮 3-6g金钱白花蛇 2-5g 南鹤虱 3-9g急性子 3-5g蛇床子 3-10g绵马贯众 5-10g 蜈蚣 3-5g蕲蛇 3-9g丁香 1-3g人参 3-9g九香虫 3-9g 三七 3-9g三棱 5-10g 大血藤 9-15g 大黄 3-15g 大腹皮 5-10g 大蓟 9-15g 山茱萸 6-12g 山药 15-30g 山慈菇 3-9g 川木通 3-6g 川贝 3-10g 川牛膝 5-10g 木贼 3-9g木通 3-6g五味子 2-6g 五倍子 3-6g 太子参 9-30g XXX 9-15g车前草 9-30g 瓦楞子 9-15g 牛蒡子 6-12g 牛膝 5-12g 升麻 3-10g 姜黄 3-9g化橘红 3-6g 丹参 10-15g 乌药 6-10g 石膏 15-60g 龙胆 3-6g北沙参 5-12g 仙鹤草 6-12g 白及 6-15g 白术 6-12g 白头翁 9-15g 白芍 6-15g 白芷 3-10g 白前 3-10g 白扁豆 9-15g白蔹 5-10g白鲜皮 5-10g剔除格式错误,并对每段话进行小幅度改写:1.9-15g川芎,女贞子,小茴香,小蓟,马勃,马鞭草,XXX,天冬,天花粉,天竺黄,天麻,天葵子,木瓜,木香,地榆,芒硝,地锦草,西红花,青果这些药品的用量为每日9-15克,包括川芎、女贞子、小茴香、小蓟、马勃、马鞭草、王不留行、天冬、天花粉、天竺黄、天麻、天葵子、木瓜、木香、地榆、芒硝、地锦草、西红花和青果。

对药典规定中药饮片用量的分析2010年版《中国药典》一部对药材和饮片的用量和用法进行了规定,提供了绝大部分饮片的用量范围。
该文采用描述性统计方法,探讨药典中饮片的最大剂量、最小剂量及剂量阈值的分布,比较有毒和无毒中药的用量特点。
《中国药典》(2010年版)共录入药物617种,除16种未规定剂量,饮片最常见的最小剂量是3 g,最大剂量是10 g,剂量阈值是6 g。
经比较发现,对有毒药物用量的规定比无毒药物严格;与经方本原剂量和临床实际用量比较,药典中规定的剂量阈值较窄;药典规定可用于食品或保健食品的药物与其他药物剂量相差不大。
标签:用量;药典;中药药典,是国家记载药品标准、规格的法典,主要用于制定药品标准,加强药品质量监督管理、保证质量、保障用药安全有效。
药品标准是药品现代化生产和质量管理的重要组成部分,是药品生产、供应、使用和监督管理部门共同遵循的法定依据。
1953年我国编写了建国以来的第一部《中华人民共和国药典》,至今已修订再版9次,最新一版为2010年版《中国药典》。
《中国药典》(2010年版)分为三部,对中药“药材和饮片”的若干规定收录于第一部,其中也包括对饮片用量及用法的规定,是临床用量的最高标准。
本文采用统计学方法,对药典规定饮片用量与用法的特点进行分析。
1 研究对象2010年版《中国药典》一部中饮片[用法与用量]的规定。
2 研究内容及方法使用Epidata 3.1软件建立药典数据库。
录入药物名称、入药部位、饮片性味与归经、毒性、功能与主治、用法、用量、特殊用量说明等。
采用SPSS 17.0软件进行统计。
采用描述性统计方法,分析饮片的最大剂量、最小剂量及剂量阈值(剂量阈值=最大剂量-最小剂量)的分布特点;按照药物毒性分类,分析毒性药物和无毒药物饮片的剂量分布特点差异;以我国卫生部2002年公布的《卫生部关于进一步规范保健食品原料管理的通知》(以下简称《通知》)中收录的药物为参照,分析药典中“既是食品又是药品的物品名单”、“可用于保健食品的物品名单”、“保健食品禁用物品名单”及其他药物的剂量分布特点和差异。

中华人民共和国药品管理法(2019年8月26日修订)(1984年9月20日第六届全国人民代表大会常务委员会第七次会议通过2001年2月28日第九届全国人民代表大会常务委员会第二十次会议第一次修订根据2013年12月28日第十二届全国人民代表大会常务委员会第六次会议《关于修改〈中华人民共和国海洋环境保护法〉等七部法律的决定》第一次修正根据2015年4月24日第十二届全国人民代表大会常务委员会第十四次会议《关于修改〈中华人民共和国药品管理法〉的决定》第二次修正2019年8月26日第十三届全国人民代表大会常务委员会第十二次会议第二次修订)目录第一章总则第二章药品研制和注册第三章药品上市许可持有人第四章药品生产第五章药品经营第六章医疗机构药事管理第七章药品上市后管理第八章药品价格和广告第九章药品储备和供应第十章监督管理第十一章法律责任第十二章附则第一章总则第一条为了加强药品管理,保证药品质量,保障公众用药安全和合法权益,保护和促进公众健康,制定本法。
第二条在中华人民共和国境内从事药品研制、生产、经营、使用和监督管理活动,适用本法。
本法所称药品,是指用于预防、治疗、诊断人的疾病,有目的地调节人的生理机能并规定有适应症或者功能主治、用法和用量的物质,包括中药、化学药和生物制品等。
第三条药品管理应当以人民健康为中心,坚持风险管理、全程管控、社会共治的原则,建立科学、严格的监督管理制度,全面提升药品质量,保障药品的安全、有效、可及。
第四条国家发展现代药和传统药,充分发挥其在预防、医疗和保健中的作用。
国家保护野生药材资源和中药品种,鼓励培育道地中药材。
第五条国家鼓励研究和创制新药,保护公民、法人和其他组织研究、开发新药的合法权益。
第六条国家对药品管理实行药品上市许可持有人制度。
药品上市许可持有人依法对药品研制、生产、经营、使用全过程中药品的安全性、有效性和质量可控性负责。
第七条从事药品研制、生产、经营、使用活动,应当遵守法律、法规、规章、标准和规范,保证全过程信息真实、准确、完整和可追溯。

附件:《中国药典》中药质量标准起草说明编写细则国家药典委员会中药质量标准起草说明是说明标准起草过程中,制订各个项目的理由及规定各项指标和检测方法的依据;也是对该药品从历史考证,药材的原植(动、矿)物品种,生药形态鉴别,成方制剂的处方、制法,以及它们的理化鉴别,质量控制,临床应用,贮藏等全面资料的汇总。
一、编写原则:1、起草说明不属于药品法规,也不是药典的注释,而是制订各个项目的说明。
内容、文字,特别是名词、术语应力求与药典一致。
计量单位等统一按药典“凡例”中规定要求编写。
2、起草说明包括理论性解释和实践工作中的经验总结。
尤其是对中药的真伪鉴别及质量控制方面的经验和实验研究,即使不太成熟,但有实用意义的也可编写在内。
3、每一篇起草说明均应写明作者、审核人的单位、姓名、职称或职务、日期。
二、编写格式及要求(一)中药材1、来源(历史沿革)扼要说明始载于何种本草,历来本草的考证及历代本草记载中有无品种改变情况,目前使用和生产的药材品种情况,以及历版药典的收载、修订情况。
2、【名称】对正名选定的说明,历史名称、别名或国外药典收载名。
原植(动)物原植(动)物形态按常规描写。
突出重点,同属两种以上的可以前种为主描述,其他仅写主要区别点。
学名有变动的应说明依据。
生境野生或栽培(有无GAP基地)。
主产地主产的省、市、自治区名称,按产量大小次序排列。
地道药材产地明确的可写出县名。
采收时间采收时间与药材质量有密切关系的,采收时间应进行考察,并在起草说明中列入考察资料。
采收加工产地加工的方法,包括与主要主产地不同的方法或有关这方面的科研结果。
3、【性状】(1) 正文描述性状的药材标本来源及彩色照片。
(2) 增修订性状的理由,由于栽培发生性状变异,应附详细的质量研究资料。
(3) 未列入正文的某些性状特点及原由。
(4) 各药材标本间的差异,多品种来源药材的合写或分写的原由。
(5) 曾发现过的伪品,类似品与本品性状的区别点。

《中国药典》1. 甘草 (2)2. 黄芪 (2)3. 党参 (2)4. 黄连 (2)5. 丹参 (2)6. 碧玉散 (3)7. 佛手 (3)8. 三棱 (3)9. 莪术 (3)10. 红花 (4)11. 桃仁 (4)12. 川芎 (4)13. 芡实 (4)14. 制大黄 (5)15. 金樱子 (5)16. 煅龙骨 (5)17. 煅牡蛎 (5)18. 石韦 (6)19. 六月雪 (6)20. 玉米须 (6)21. 淫羊藿 (6)22. 连钱草 (7)23. 蚕茧壳 (7)24. 积雪草 (7)1.甘草【性味】甘,平。
【归经】归心、肺、脾、胃经。
【功能主治】补脾益气,清热解毒,祛痰止咳,缓急止痛,调和诸药。
用于脾胃虚弱,倦怠乏力,心悸气短,咳嗽痰多,脘腹、四肢挛急疼痛,痈肿疮毒,缓解药物毒性、烈性。
【用法用量】 1.5~9g。
【注意】不宜与京大戟、芫花、甘遂同用。
2.黄芪Huánɡ Qí【性味】甘,温。
【归经】归肺、脾经。
【功能主治】补气固表,利尿托毒,排脓,敛疮生肌。
用于气虚乏力,食少便溏,中气下陷,久泻脱肛,便血崩漏,表虚自汗,气虚水肿,痈疽难溃,久溃不敛,血虚痿黄,内热消渴;慢性肾炎蛋白尿,糖尿病。
【用法用量】 9~30g。
3.党参【性味】甘,平。
【归经】归脾、肺经。
【功能主治】补中益气,健脾益肺。
用于脾肺虚弱,气短心悸,食少便溏,虚喘咳嗽,内热消渴。
【用法用量】 9~30g。
【注意】不宜与藜芦同用。
4.黄连【性味】苦,寒。
【归经】归心、脾、胃、肝、胆、大肠经。
【功能主治】清热燥湿,泻火解毒。
用于湿热痞满,呕吐吞酸,泻痢,黄疸,高热神昏,心火亢盛,心烦不寐,血热吐衄,目赤,牙痛,消渴,痈肿疔疮;外治湿疹,湿疮,耳道流脓。
酒黄连善清上焦火热。
用于目赤,口疮。
姜黄连清胃和胃止呕。
用于寒热互结,湿热中阻,痞满呕吐。
萸黄连舒肝和胃止呕。
用于肝胃不和,呕吐吞酸。
【用法用量】 2~5g。
2010《药典》规定中药饮片使用剂量及注意(按比划)二划:丁公藤3-6g,孕妇禁用;丁香1-3g,不宜与郁金使用;八角茴香3-6g;人参3-9g,另煎或研末冲服,不宜与藜芦、五灵脂使用;儿茶1-3g,包煎;九香虫3-9g。
三划:|三七3-9g,研末吞服;三棱5-10g,孕妇禁用,不宜与芒硝、玄明粉使用;干姜3-10g;炮姜3-9g;土木香3-9g;土茯苓15-60g;土鳖虫3-10g,孕妇禁用;大血藤9-15g;大青叶9-15g;大枣6-15g;大黄3-15g,泻下不宜久煎,孕妇及月经期、哺乳期慎用;大蓟9-15g;大蓟炭5-10g;大腹皮5-10g;山豆根3-6g;山茱萸6-12g;山药15-30g;山楂9-12g;山楂叶3-10g;山慈菇3-9g;千年健5-10g;千里光15-30g,外用;川木通3-6g;川贝母3-10g;川牛膝5-10g,孕妇慎用;制川乌1.5-3g,先煎,久煎,孕妇慎用,不宜与半夏、瓜蒌、贝母、白蔹、白及使用;川芎3-10g;川射干6-10g;川楝子5-10g,外用;广金钱草15-30g;广藿香3-10g;女贞子6-12g;小茴香3-6g;小蓟5-12g;马齿苋9-15g,外用;马勃2-6g,外用;马兜铃3-9g,儿童、老人慎用,孕妇、婴幼儿及肾功能不全四划:|王不留行5-10g,孕妇慎用;天仙藤3-6g;天冬6-12g;天花粉10-15g, 孕妇慎用,不宜与乌头类使用;制天南星3-9g,孕妇慎用;天麻3-10g;天葵子9-15g;木瓜6-9g;木香3-6g;木贼3-9g;木通3-6g;木蝴蝶1-3g;五加皮5-10g;五味子2-6g;五倍子3-6g,外用适量;太子参9-30g;车前子9-15g,包煎;车前草9-30g;瓦楞子9-15g,先煎;牛蒡子6-12g;牛膝5-12g;升麻3-10g;化橘红3-6g;月季花3-6g;丹参10-15g,不宜与藜芦同用;乌药6-10g;乌梢蛇6-12g;乌梅6-12g;火麻仁10-15g;巴豆,外用,孕妇禁用,不宜与牵牛子同用;巴戟天3-10g;水牛角15-30g,宜先煎3h以上;水蛭1-3g,孕妇禁用。
中药的剂量与疗效、不良反应息息相关。
剂量小,达不到理想的疗效,剂量大,则药过病所,可能引起一系列不良反应。
2015年版《中华人民共和国药典》(以下简称为“《中国药典》”)一部凡例中说明:“饮片的[用法与用量],除另有规定外,用法系指水煎内服;用量系指成人一日常用剂量,必要时可根据需要酌情增减”[1]。
从上述表述中可知,《中国药典》推荐剂量只是一个参考。
中药饮片的合理剂量范围,尚缺乏统一的标准。
有文献报道中药饮片超药典剂量用药的现象比较严重[2-4],为了解本院常用中药饮片的临床用药剂量,本研究选取本院2018年1~6月使用频次占总处方数10%以上的单味药,对其剂量分布进行统计,并与《中国药典》等法定标准的推荐剂量进行比较分析,旨在为研究和规范中药饮片剂量提供参考依据。
1资料与方法1.1处方来源与筛选处方来自本院2018年1~6月门诊的所有中药饮片处方,包括传统中药饮片处方和中药配方颗粒处本院常用中药饮片剂量分析吕凤芹黄颖华▲厦门市仙岳医院药学部,福建厦门361012[摘要]目的分析单味中药饮片的使用剂量的特点和规律,为确定其合理的剂量范围提供参考依据。
方法调查2018年1~6月使用频次占总处方数10%以上的单味药的剂量分布,并与2015年版《中华人民共和国药典》(以下称“《中国药典》”)等法定标准的推荐剂量进行比较分析。
结果单味中药饮片使用频次占总处方数≥10%32种,剂量分布前5位分别为10g、15g、9g、30g、6g,占比接近90%。
32个品种在本院门诊处方中,无超大剂量应用,有个别超小剂量应用;剂量90%以上在《中国药典》范围内的品种有21个。
中药饮片在临床使用中存在超药典剂量使用的情况,但是并不突出。
结论常用中药合理的剂量范围有待更深入的研究;临床使用中药饮片既要考虑安全性,也要考虑量效关系。
[关键词]中药饮片;剂量;量效关系;合理用药[中图分类号]R288[文献标识码]B[文章编号]1673-9701(2019)10-0143-05 Analysis on the dosage of traditional Chinese medicine decoction pieces in our hospitalLV Fengqin HUANG YinghuaDepartment of Pharmacy,Xianyue Hospital of Xiamen City,Xiamen361012,China[Abstract]Objective To analyze the characteristics and regularity of the dosage of single-flavored traditional Chinese medicine decoction pieces,and to provide reference for determining the reasonable dosage range.Methods The dose distribution of single-flavored drugs with a frequency of more than10%of the total prescriptions from January to June 2018was investigated,and compare with the2015edition of the Pharmacopoeia of the People's Republic of China (hereinafter referred to as"Chinese Pharmacopoeia")and other recommended doses.Results There were32kinds of single-flavored traditional Chinese medicine decoction pieces,which accounted for more than10%of the total pre⁃scription.The top5dose distributions were10g,15g,9g,30g and6g,respectively,accounting for nearly90%. These32pieces were not used in large-dose applications in our outpatient prescriptions,and there were some ultra-low-dose applications;there were21pieces with more than90%of the doses in the scope of the Chinese Pharma⁃copoeia.In the clinical use of traditional Chinese medicine decoction pieces,there were cases of out of the scope of the Chinese Pharmacopoeia,but were not prominent.Conclusion The reasonable dosage ranges of commonly used tradi⁃tional Chinese medicines needs further study;the clinical use of traditional Chinese medicine decoction pieces should consider both safety and dose-effect relationship.[Key words]Traditional Chinese medicine decoction pieces;Dosage;Dosage comparison;Rational drug use▲通讯作者143CHINA MODERN DOCTOR Vol.57No.10April2019方,排除退药的处方,最终共筛选出1719张处方。
品名药典用量拟修订用量白果 4.5~95~10 白蔹 4.5~9 5~10 白薇 4.5~9 5~10 白鲜皮 4.5~9 5~10 北沙参 4.5~9 5~12 荜茇 1.5~3 1~3荜澄茄 1.5~3 1~3沉香 1.5~4.5 1~5茺蔚子 4.5~9 5~10 川楝子 4.5~9 5~10 川牛膝 4.5~9 5~10 大腹皮 4.5~9 5~10 地龙 4.5~9 5~10 防风 4.5~9 5~10 防己 4.5~9 5~10 枫香脂 1.5~3 1~3干漆 2.4~4.5 2~5甘草 1.5~9 2~10 谷精草 4.5~9 5~10 合欢花 4.5~9 5~10胡黄连 1.5~9 3~10 胡芦巴 4.5~9 5~10 花蕊石 4.5~9 5~10 急性子3~4.5 3~5 金沸草 4.5~9 5~10 金钱白花蛇3~4.5 2~5 荆芥 4.5~9 5~10 卷柏 4.5~9 5~10 苦参 4.5~9 5~10 苦楝皮 4.5~9 3~6 苦木3~4.5 3~5 苦杏仁 4.5~9 5~10 莱菔子 4.5~9 5~12 荔枝核 4.5~9 5~10 莲房 4.5~9 5~10 两头尖 1.5~3 1~3 马鞭草 4.5~9 5~10 马勃 1.5~6 2~6 玫瑰花 1.5~6 3~6 绵马贯众 4.5~9 5~10 木蝴蝶 1.5~3 1~3木香 1.5~6 3~6 南五味子 1.5~6 2~6 牛膝 4.5~9 5~12 千年健 4.5~9 5~10 青黛 1.5~3 1~3 青果 4.5~9 5~10 拳参 4.5~9 5~10 肉桂1~4.5 1~5 三棱 4.5~9 5~10 柿蒂 4.5~9 5~10 水蛭 1.5~3 1~3 丝瓜络 4.5~9 5~12 桃仁 4.5~9 5~10 天仙藤 4.5~9 3~6 土贝母 4.5~9 5~10 王不留行 4.5~9 5~10 吴茱萸 1.5~4.5 2~5 五加皮 4.5~9 5~10 五味子 1.5~6 2~6 小蓟 4.5~9 5~12 小通草 2.5~4.5 3~6血余炭 4.5~9 5~10 禹州漏芦 4.5~9 5~10 月季花 1.5~4.5 3~6 浙贝母 4.5~9 5~10 竹茹 4.5~9 5~10 白芷3~93~10 淡竹叶6~9 6~10 佛手3~93~10 茯苓9~15 10~15 干姜3~9 3~10 葛根9~15 10~15 广藿香3~9 3~10 荷叶3~93~10 槐花5~9 5~10 火麻仁9~1510~15 鸡内金3~9 3~10 桔梗3~93~10 菊花5~9 5~10 橘红3~93~10 陈皮3~9 3~10 马齿苋9~15 10~15麦芽9~15 10~15 木瓜6~9 6~10 蒲公英9~15 10~15 肉豆蔻3~93~10 桑叶5~95~10 沙棘3~9 3~10 生姜3~9 3~10 酸枣仁9~15 10~15 乌梢蛇9~12 6~12 香薷3~9 3~10 香橼3~9 3~10 薤白5~9 5~10 益智仁3~9 3~10 郁李仁6~9 6~10 栀子6~9 6~10 紫苏5~9 5~10 紫苏子3~9 3~10 巴戟天3~9 3~10 白前3~9 3~10 百部3~9 3~10 柏子仁3~9 3~10半夏3~9 3~10 槟榔3~9 3~10 补骨脂6~9 6~10 苍耳子3~9 3~10 苍术3~9 3~10 柴胡3~9 3~10 川贝母3~9 3~10 川芎3~9 3~10 穿山甲5~9 5~10 大黄3~30 3~15 丹参9~15 10~15 地黄9~15 10~15 独活3~9 3~10 杜仲6~9 6~10 莪术6~9 6~10 藁本3~9 3~10 钩藤9~15 10~15 瓜蒌皮6~9 6~10 桂枝3~9 3~10 海螵蛸5~9 5~10 诃子3~9 3~10何首乌6~12 3~6 红花3~9 3~10 厚朴3~9 3~10 黄芩3~9 3~10 蒺藜6~9 6~10 姜黄3~9 3~10 僵蚕5~9 5~10 款冬花5~9 5~10 路路通5~9 5~10 麻黄2~9 2~10 蔓荆子5~9 5~10 佩兰3~9 3~10 枇杷叶6~9 6~10 蒲黄5~9 5~10 前胡3~9 3~10 茜草6~9 6~10 羌活3~9 3~10 秦艽3~9 3~10 青皮3~9 3~10 肉苁蓉6~9 6~12 桑螵蛸5~9 5~10蛇床子3~9 3~10 射干3~9 3~10 升麻3~9 3~10 石菖蒲3~9 3~10 石决明3~15 6~20 锁阳5~9 5~10 天麻3~9 3~10 葶苈子3~9 3~10 土鳖虫3~9 3~10 威灵仙6~9 6~10 乌药3~9 6~10 西红花3~9 1~3 仙茅3~9 3~10 香附6~9 6~10 辛夷3~9 3~10 延胡索3~9 3~10 淫羊藿3~9 6~10 银柴胡3~9 3~10 郁金3~9 3~10 远志3~9 3~10 皂角刺3~9 3~10泽泻6~9 6~10 枳壳3~9 3~10 枳实3~9 3~10 紫草5~9 5~10 紫苏梗5~9 5~10 紫菀5~9 5~10《中国药典》2010年版药材及饮片拟调整用量一览表共173个品种。