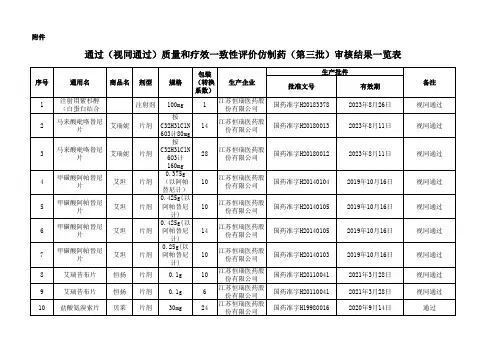
通过一致性评价品种名单(前三批)
- 格式:xlsx
- 大小:19.51 KB
- 文档页数:6

一、已上市一致性评价进展:共572个品种、2702个申请已获受理;1. 注射用头孢曲松钠申报最多,已有57个;申报排名前三的品种为:注射用头孢曲松钠、阿莫西林胶囊和苯磺酸氨氯地平片。
2. 齐鲁制药申报最多,已有86个;目前申报最多的三家企业为:齐鲁制药、科伦药业和扬子江药业。
3. 一致性评价受理节奏稳步加快:截至目前,2021年1月CDE共受理55项,2020年12月共受理83项,较上一年度同期水平均有所提速。
4. 2702个申请中,289目录品种药品占37%,130个289目录品种药品暂未审评。
二、一致性评价成果:已上市+新注册分类申报,共1490个申请通过一致性评价;1. 共(视同)通过759个品种(以通用名+规格计),130个品种(视同)通过企业数已达3家及以上。
2. 齐鲁制药(视同)通过评价品种最多,共计78个;共25家企业已有至少10个品种(视同)通过一致性评价。
3. 近期(视同)通过重点品种:人福,枸橼酸舒芬太尼注射液。
4. 通过一致性评价的仿制药中,289目录品种药品占53%,194个289目录品种药品暂未有审评通过记录。
三、BE申报进展:已开展1667项已上市品种的BE试验,节奏或有放缓;1. 已可公开查询到1667项已上市仿制药的BE试验,其中1224项已完成。
2. 阿莫西林胶囊为BE试验开展最多的仿制药品种,共66项。
3. 上海医药为BE试验开展最多的企业,共48项。
4. BE试验的节奏可能受医院临床的影响有所减缓。
2020年H1共可查询到133项BE试验的开展,7-12月目前共计130项。
但考虑到数据公开的滞后性,实际节奏变化仍待观察。
四、注射剂一致性评价进展:共157个品种、1006个申请已获受理。
1. 注射用头孢曲松钠申报最多,已有57个;注射剂申报排名前三的品种为:注射用头孢曲松钠、盐酸氨溴索注射液和注射用头孢他啶。
2. 科伦药业申报最多,已有56个;目前申报最多的三家企业为:科伦药业、齐鲁制药和中国生物制药。

附件1-2
黑龙江省药品通过仿制药一致性评价
奖励政策申报材料
(编制提纲)
申报品种名称、通过时间、是否为全国同类仿制药中前三个通过情况:
申报单位(盖章):
联系人及手机:
填报日期:
填写说明
1.申报企业需按照提纲要求全面、完整填报内容并提交相关佐证材料,
可根据申报品种实际情况增加材料内容,包括不限于规定材料范围。
2.企业如有多个品种申报此项政策,需按照不同品种分别填报政策编制提纲并提交相关材料。
3.整个材料形式要求编辑成册,清晰完整,开篇设置目录索引。
申请书填报项目页面不足时,可另附页。
以下表格每项均为必填项,若没有或不涉及某项,可填“无”
三、其他材料清单
1.企业营业执照、药品生产许可证等资质材料;
2.信用中国、中国执行信息公开网查询下载的企业信用查询报告(报告生成时间为申报截止日期前一个月内);
3.相关材料,药品监督管理部门的批准文件及相关材料,若为全国同类仿制药中前三个通过仿制药一致性评价的药品需提供全国同类仿制药通过一致性评价排名,其他相关材料。
承诺书
我单位郑重承诺,本次提交的(品种名称)申报药品通过仿制药一致性评价奖励政策材料及相关证明文件均合法、有效、文实相符,所报扫描(复印)件与原件内容一致,材料具备真实性、完整性、准确性和规范性。
如有不实之处,本单位完全承担相应责任和后果。
法定代表人(签字):
申报单位(盖章):。


国家食品药品监督管理局关于开展仿制药质量一致性评价工作的通知文章属性•【制定机关】国家食品药品监督管理局(已撤销)•【公布日期】2013.02.16•【文号】国食药监注[2013]34号•【施行日期】2013.02.16•【效力等级】部门规范性文件•【时效性】现行有效•【主题分类】药政管理正文国家食品药品监督管理局关于开展仿制药质量一致性评价工作的通知(国食药监注[2013]34号)各省、自治区、直辖市食品药品监督管理局(药品监督管理局),新疆生产建设兵团食品药品监督管理局:开展仿制药质量一致性评价,全面提高仿制药质量是《国家药品安全“十二五”规划》的重要任务,是持续提高药品质量的有效手段,对提升制药行业整体水平,保障公众用药安全具有重要意义。
为此,国家食品药品监督管理局决定,对2007年修订的《药品注册管理办法》实施前批准的基本药物和临床常用仿制药,分期分批进行质量一致性评价。
现将有关事宜通知如下:一、充分认识重要意义。
各省级药品监督管理部门务必高度重视仿制药质量一致性评价工作,充分认识该项工作的重要性、复杂性和长期性,充分认识开展仿制药质量一致性评价对确保药品质量安全,促进医药经济结构调整和产业升级,进一步增强我国医药产业国际竞争能力的重要意义。
应将仿制药质量一致性评价工作纳入“十二五”期间药品监管工作重点,加强组织领导,落实工作责任,按照国家食品药品监督管理局工作部署,结合本行政区域实际情况,制定具体实施方案,确保各项工作落到实处。
二、积极宣传有关政策。
国家食品药品监督管理局制定了《仿制药质量一致性评价工作方案》(以下简称《工作方案》,附件),明确了质量一致性评价的工作目标、原则、内容和程序,对工作进行了总体部署。
国家食品药品监督管理局还将陆续下发相关技术指导原则,规范质量一致性评价的研究和技术审查。
各省级药品监督管理部门要积极落实《工作方案》,做好质量一致性评价工作的宣贯和培训,及时传达有关政策,使药品生产企业深刻认识质量一致性评价的重要性和必要性,引导药品生产企业积极开展研究,合理安排工作进度、主动作为。

附件仿制药质量和疗效一致性评价品种分类的指导意见(征求意见稿)为了进一步推动仿制药质量和疗效一致性评价(以下简称一致性评价)工作的开展,现对289 品种的分类情况提出如下指导意见:一、原研进口品种。
无需开展一致性评价,经仿制药质量和疗效一致性评价专家委员会审核确定和食品药品监管总局发布后,可选择为参比制剂。
二、原研企业在中国境内生产上市的品种(一)上市前按照与原研药品质量和疗效一致原则申报和审评的, 可列为参比制剂。
由企业在规定时间内,参照《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)》,向食品药品监管总局一致性评价办公室提交相关资料及证明性文件。
一致性评价办公室安排食品药品监管总局药品审评中心(以下简称药审中心)审核并出具意见,需进行研制现场检查、生产现场检查、临床试验核查的,由药审中心提出,食品药品监管总局食品药品审核查验中心具体实施,并反馈给药审中心。
依据药审中心意见,一致性评价办公室提出审批意见,报食品药品监管总局审核发布。
所提交资料不足以证明与原研药品质量和疗效一致的,可补充相关试验研究。
(二)未按照与原研药品质量和疗效一致原则申报和审评的,需按照有关规定开展一致性评价。
三、进口仿制品种。
上市前按照与原研药品质量和疗效一致原则申报和审评的,按照上述第二条第一款规定的程序执行;上市前未按照与原研药品质量和疗效一致原则申报和审评的,需按有关规定开展一致性评价。
四、国内仿制品种。
上市前按照与原研药品质量和疗效一致原则申报和审评的,按照上述第二条第一款规定的程序执行;未按照与原研药品质量和疗效一致原则申报和审评的,需按照有关规定开展一致性评价。
五、改规格、改剂型、改盐基的仿制品种需按照食品药品监管总局发布的相关指导原则开展一致性评价。
(一)改规格品种。
按照《仿制药质量和疗效一致性评价改规格药品评价一般考虑》(待发布)的要求,对不改变用法、用量、适应症的,且在治疗剂量范围内,药物呈现线性药代动力学特征,以改规格药品和参比制剂以相同剂量给药(单次给药剂量不超过最大给药剂量),进行生物等效性试验;对不满足上述条件的,应参照《仿制药质量和疗效一致性评价临床有效性试验一般考虑》(待发布,以下简称临床有效性试验一般考虑)的要求,开展临床有效性试验研究。
2017年度药品审评报告2017年,国家食品药品监督管理总局(以下简称总局)认真贯彻中共中央办公厅、国务院办公厅《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(厅字〔2017〕42号,以下简称42号文件)和国务院《关于改革药品医疗器械审评审批制度的意见》(国发〔2015〕44号,以下简称44号文件)文件精神,以保证药品有效安全、满足公众临床用药需求为工作目标,在鼓励药物研发创新、提高药品质量方面开展了一系列工作,不断推进审评审批制度改革,坚持依法依规、科学规范审评,切实保护和促进公众健康。
一、药品注册申请审评审批完成情况(一)审评审批总体完成情况1.批准上市药品情况2017年,总局批准上市药品394个(以药品批准文号计),其中化学药品369个,中药民族药(以下简称中药)2个,生物制品23个;国产药品278个,进口药品116个;国产药品中化学新药28个,中药新药1个,生物制品10个,化学仿制药238个,中药仿制药1个;纳入优先审评审批品种53个,占13.5%。
2。
全年审评审批完成情况根据总局《关于调整部分药品行政审批事项审批程序的决定》(局令第31号),在原有技术审评职能的基础上,国家食品药品监督管理总局药品审评中心(以下简称药审中心)承接药物临床试验、药品补充申请和进口再注册3项行政审批决定职能。
2017年,药审中心完成审评审批的注册申请共9680件(以受理号计,下同),其中完成审评的注册申请8773件,完成直接行政审批(无需技术审评,下同)的注册申请907件。
排队等待审评的注册申请已由2015年9月高峰时的近22000件降至4000件(不含完成审评因申报资料缺陷等待申请人回复补充资料的注册申请),中药、化药、生物制品各类注册申请基本实现按法定时限审评审批,基本完成了国务院44号文件确定的解决药品注册申请积压的工作目标。
2014年—2017年排队等待审评的注册申请数量变化情况详见图1。
图1 2014年—2017年排队等待审评的注册申请数量变化情况完成审评的申请中,化药注册申请为7729件,约占全部审评完成量的88%.各类药品注册申请审评完成情况详见图2。

总局关于仿制药质量和疗效一致性评价工作有关事项的公告(2017年第100号)为做好仿制药质量和疗效一致性评价工作(以下简称一致性评价),现就有关事宜公告如下:一、为便于企业选择参比制剂,国家食品药品监督管理总局将把《关于落实〈国务院办公厅关于开展仿制药质量和疗效一致性评价的意见〉有关事项的公告》(2016年第106号)所附289个品种的原研企业药品列出清单并向社会公布,供企业选择参比制剂时参考。
清单分为已在中国境内上市和未在中国境内上市两类。
建议企业按以下顺序选择其一作为参比制剂备案:(一)原研药品:进口原研药品、经审核确定的原研企业在中国境内生产上市的药品、未进口原研药品;(二)在原研企业停止生产的情况下,可选择美国、日本或欧盟获准上市并获得参比制剂地位的药品。
对国家食品药品监督管理总局已公布的参比制剂,建议企业按照公布的参比制剂开展研究,未备案的无需再备案;对已公布的参比制剂存疑的,可向国家食品药品监督管理总局药品审评中心提出异议并说明理由,国家食品药品监督管理总局召开专家咨询委员会会议公开审议,并公开审议结果。
二、企业报国家食品药品监督管理总局备案的参比制剂全部向社会公开。
对国家食品药品监督管理总局未公布参比制剂的品种,由国家食品药品监督管理总局组织专家咨询委员会讨论后区别情况提出如下指导性意见:(一)可以确认符合参比制剂条件的;(二)存疑的;(三)明显不符合条件的。
对于(二)(三)两种情况是否继续进行研究或重新选择参比制剂,由企业自主决定并承担相应的责任。
三、企业自行从境外采购的参比制剂产品,在提交一致性评价资料时需提供购买凭证、产品包装及说明书等材料,或以其他适当方法证明所用参比制剂是标明企业的产品。
企业发现所使用的参比制剂产品为假冒产品的,应终止正在进行的研究工作,已申报的,应及时向国家食品药品监督管理总局药品审评中心报告并撤回一致性评价申请,视情况免于责任;监管部门发现企业使用的参比制剂产品为假冒产品的,应及时通报相关企业,终止审评审批;已批准上市的要撤销批准文件并向社会公开信息,责成企业作出解释并根据情况立案调查。

仿制药一致性评价一:背景信息1) 2016年2月6日,国务院颁布了国办发【2016】8号文件“国务院办公厅关于开展仿制药质量和疗效一致性评价的意见”,随后国家又在短时间内连续颁布了一系列关于仿制药一致性评价工作的相关文件和指南,真正拉开了仿制药产品质量和疗效一致性评价工作的序幕。
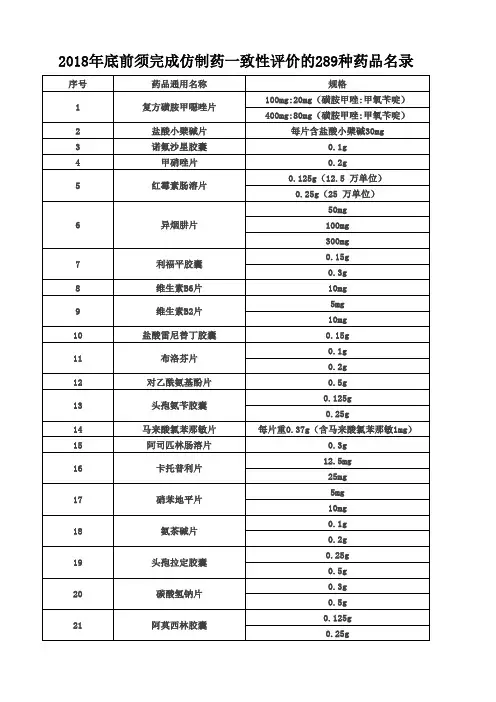
2) 根据国家仿制药一致性评价政策和时限要求,289种基本药物要求在2018年底完成评价,其他仿制药产品若能成为“首名”或“前三名”,对市场和经济意义重大。
否则,则存在较大风险失去市场甚至文号不保。
二:认识与建议虽然国家提出了明确的时间要求和评价原则,但当前的法规并不具体,企业左右为难。
公司基于长期从事药政法规研究的工作经验,我们对本轮要求的认识如下:1) 不等不靠、主动研究。
2) 要充分重视对产品的信息回顾与整理,重视仿制药评价的整体策划,为开展研究工作打基础。
3) 重视药学研究。
仿制药研究的重点是药学部分,也是国家评价仿制药质量的重要内容,CMC是重中之重,必须先行。
4) 时间紧迫仿制药一致性评价,尤其是基本药物的评价看起来还有2年多时间,实际分解后留给企业的时间已经非常紧张,即使一切顺利也需要20-25个月。
5) 逐步开展,分段进行。
仿制药一致性评价是一个综合工程,链条长,费用高。
尤其是早年完成注册的产品,注册研究与申报资料更加薄弱,适合先初步摸索产品质量现状再进行系统深入的研究。
6) 仿制药一致性评价应分为四个阶段开展三:优势与业绩仿制药一致性评价工作是一个系统工程,需要完整的服务链条和资源配置,包括CMC研发实验室、动物GLP实验室、BE临床实验基地、生化分析实验室和注册服务团队,以及良好的公共资源,并且各个环节都要有经验丰富的技术团队与完善的质量管理体系,要经得起注册现场核查与临床现场核查。
1) 咨询拥有的优势包括以下几方面:✔建立了高水平配置的国家级CMC研发实验室,拥有专业的研发人员和十多年药品研发经验,为中国三大医药技术研究成果转化平台之一,国家基本药物标准溶出度曲线制作承担单位之一;✔合作动物GLP实验室,比格犬等大动物试验不是问题;✔集团内拥有BE临床试验基地与通过FDA审计的生化分析实验室(海口、长春、南京3个BE基地),BE试验优先快速安排;✔18年丰富经验的注册团队,轻松化解技术难题。

现在,甲硝唑片、头孢拉定胶囊、奥美拉唑肠溶胶囊等289个基药品种须在2018年底前完成一致性评价。
如要按期完成一致性评价,必须加强药学一致性研究。
其中新近发布的一致性评价申报资料要求征求意见稿中对参比制剂的批次要求如下:“1.10.3 质量考察每个规格需至少提供3批参比制剂的考察数据,考察与一致性评价紧密相关的关键质量属性,例如晶型、含量、有关物质等(检验报告可列为附件)。
”《意见稿》关于参比制剂的选择和要求虽然已经比较清楚地讲述了操作流程。
但关于参比制剂到底需要几批方面,参比制剂理论上是稳定的,也就是说,用一批做一次对照,应当与用三批的结果一样。
”此外,美国FDA没有批次要求。
因为对参比制剂进行稳定性实验,仅仅是仿制药自愿的做法。
理论上讲,只要参比一批结果有上限,企业就可以使用最高的上限来调整自己的产品。
如果担心一批做出来的结果不能反映参比最不好的情况,根据意愿多做几批也可以。
实际上,企业拿到手的原研药已上市一段时间,到手的三批参比制剂间的购买人所不可控的生产时间,都会直接影响其稳定性结果。
为此,参比的多条溶出对照虽然极重要也是必须的,但可能以一批(参比制剂)为妥。
资深药学专家则表示,“应多批次来观测。
因为仿制药企业需要剖析多批参比制剂,并观测参比制剂批间波动的情形。
基于此,每个品种都需通过多批来观测。
”尽管一致性评价还有不少实操层面的细节需进一步明确,但机遇同样诱人。
越早过一致性评价的厂家,越可能享受到政策福利。
不难预判,接下来大企业会进行产品线的整合,选择竞争力强、市场占有率高的品种进行一致性评价,部分小企业会主动选择放弃。
“现在企业特别关心的是,高投入之后会否有高回报。
尤其是和一致性评价工作配套的招标采购等政策能否落地。
除了可以加分,是不是还可以优质优价?如果仍唯低价是取,估计很多药企难以坚持做下去。
”左联坦言。
据悉,已有企业直接开始申请备案。
多家药企也在找行业协会推荐参比制剂。
预计很多低端产品将被清理出市场,腾出来的空间对有竞争力的产品而言是继续做大做强的良机。
诺氟沙星胶囊等三个品种仿制药一致性评价可行性分析报告作者:万攀攀来源:《科技风》2019年第03期摘要:分析开展一致性评价工作的可行性及通过一致性评价的品种能否给企业带来市场竞争力。
关键词:时限;竞争;销售预测1 项目概述(1)目的:促进我国仿制药整体水平提升,为保证药物的安全性和有效性,促进医药产业升级和结构调整,增强国际竞争力。
(2)背景分析:自2012年国务院药品安全“十二五”规划,启动仿制药一致性评价工作。
2016年2月6日,国办发【2016】8号提出,化学仿制药自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价;逾期未完成的,不予再注册。
2017年8月,总局《关于仿制药质量和疗效一致性评价工作有关事项的公告》,公告规定同品种药品通过一致性评价的企业达到 3 家以上的,在药品集中采购等方面不再选用未通过一致性评价的品种。
(3)项目目标:我公司准备开展一致性评价工作,前期经过调研、考察预计对诺氟沙星胶囊、维生素B2片、维生素B6片进行一致性评价工作。
2 三個品种基本情况介绍(1)诺氟沙星胶囊:诺氟沙星属氟喹诺酮酸类药物,对多种革兰阳性菌和革兰阴性菌均有强大的抗菌作用;国内同品种同规格(0.1g)690个。
(2)维生素B2片:维生素B2为体内黄酶类辅基的组成部分,缺乏会影响机体的生物氧化,使代谢发生障碍;国内同品种同规格(5mg)360个。
(3)维生素B6片:维生素B6为人体内某些辅酶的组成成分,参与多种代谢反应,尤其是和氨基酸代谢有密切关系,与体内辅酶代谢密切相关;国内同品种同规格(10mg)479个。
3 三个品种一致性评价进度通过药智网一致性评价进度数据库查询情况如下:(1)诺氟沙星胶囊开展一致性评价企业数:114家;参比备案:54家;开展BE:3家;试验状态:招募完成2家。
完成BE:0家。
(2)维生素B2片开展一致性评价企业数:46家;申报:0家。
可豁免BE,不推荐参比制剂,需满足药学研究和评价要求。
289种药品列入一致性评价目录CFDA今日发布关于落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》有关事项的公告(2022年第106号),指出289种化学药品仿制药口服固体制剂原则上应在2022年底前完成一至性评价。
以下全文:为贯彻落实《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》(国办发〔2022〕8号),提高仿制药质量,现将有关事项公告如下:一、评价对象和实施阶段(一)化学药品新注册分类实施前批准上市的仿制药,包括国产仿制药、进口仿制药和原研药品地产化品种,均须开展一致性评价。
(二)凡2007年10月1日前批准上市的列入国家基本药物目录(2022年版)中的化学药品仿制药口服固体制剂(附件),原则上应在2022年底前完成一致性评价。
(三)上述第(二)款以外的化学药品仿制药口服固体制剂,可以自行组织一致性评价;自第一家品种通过一致性评价后,三年后不再受理其他药品生产相同品种的一致性评价申请。
二、参比制剂的选择和确定(四)药品生产企业对拟进行一致性评价的品种,参照《普通口服固体制剂参比制剂选择和确定指导原则》(食品药品监管总局公告2022年第61号)要求选择参比制剂。
(五)药品生产企业按照《仿制药质量和疗效一致性评价参比制剂备案与推荐程序》(食品药品监管总局公告2022年第99号),将选择的参比制剂向食品药品监管总局仿制药质量一致性评价办公室(以下简称一致性评价办公室)备案。
行业协会可向一致性评价办公室推荐参比制剂,原研药品生产企业、国际公认的同种药物生产企业可向一致性评价办公室申报参比制剂。
一致性评价办公室主动对参比制剂的备案、推荐和申报信息向社会公开。
食品药品监管总局及时公布推荐和确定的参比制剂信息,药品生产企业原则上应选择公布的参比制剂开展一致性评价。
(六)企业找不到且无法确定参比制剂的,由药品生产企业开展临床有效性试验。
三、一致性评价的研究内容(七)在开展一致性评价过程中,药品生产企业须以参比制剂为对照,全面深入地开展比对研究。
盐酸帕罗西汀片Paroxetine Hydrochloride Depression 头孢呋辛酯片Cefuroxime Axetil Antibiotics
利培酮片Risperidone Tablets Schizophren ia
吉非替尼片Gefitinib Tablets Oncology (NSCLC)
福辛普利钠片Fosinopril sodium CVD
苯磺酸氨氯地平片Amlodipine Besylate Tablets CVD
苯磺酸氨氯地平片Amlodipine Besylate Tablets CVD 富马酸替诺福韦二吡呋酯Tenofovir Disoproxil Fumarate Tablets HIV 富马酸替诺福韦二吡呋酯Tenofovir Disoproxil Fumarate Tablets HIV 富马酸替诺福韦二吡呋酯Tenofovir Disoproxil Fumarate Tablets HIV
片剂
20mg片剂浙江华海250mg 片剂国药集团致君1mg片剂浙江华海
0.25g片剂齐鲁制药
10mg片剂浙江华海
厄贝沙坦150mg/氢
片剂浙江华海
氯噻嗪12.5mg
10mg 片剂正大天晴
75mg 片剂浙江华海
75mg 片剂海正辉瑞150mg片剂海正辉瑞300mg片剂海正辉瑞
5mg片剂浙江华海
10mg片剂浙江华海300mg片剂成都倍特
50mg片剂浙江华海100mg片剂浙江华海
5mg片剂浙江京新
10mg片剂浙江京新
0.3g片剂齐鲁制药
10mg片剂四川科伦
5mg片剂江苏黄河
0.25g胶囊剂珠海联邦
0.25 g片剂石药集团欧意药业25mg片剂深圳信立泰
5mg片剂扬子江药业集团
10mg片剂扬子江药业集团150mg/12.5mg片剂南京正大天晴
0.5 g片剂石药集团欧意药业
300mg片剂成都倍特药业有限公司300mg片剂成都倍特药业有限公司
Yes Yes No No No。