第三章_酰化反应(1-2节)
- 格式:ppt
- 大小:7.00 MB
- 文档页数:15


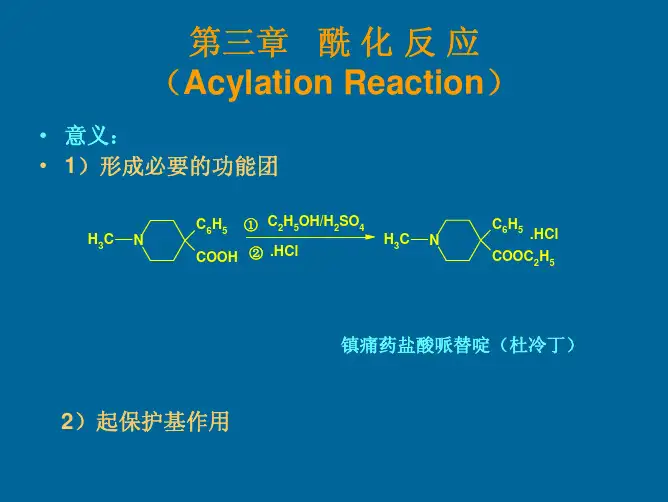





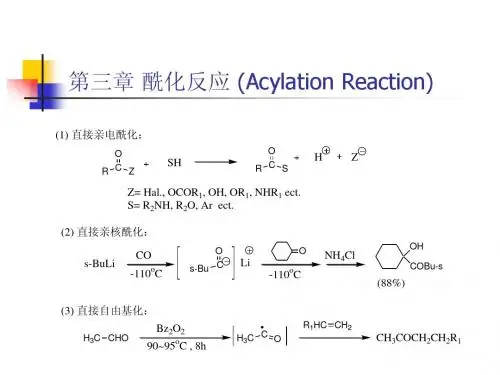
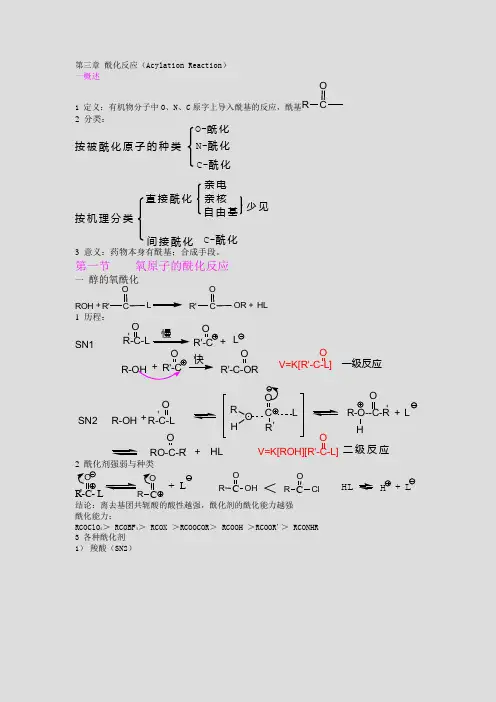
第三章 酰化反应(Acylation Reaction ) 一概述1 定义:有机物分子中O 、N 、C 原字上导入酰基的反应,酰基RCO2 分类:按被酰化原子的种类O-酰化N-酰化C -酰化按机理分类直接酰化间接酰化亲电亲核自由基少见C-酰化3 意义:药物本身有酰基;合成手段。
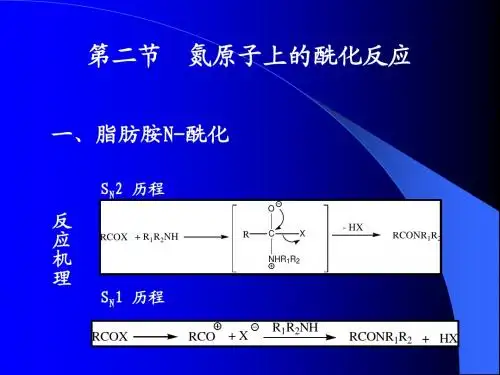
第一节氧原子的酰化反应一 醇的氧酰化R O H +R 'COLR 'COO R +H L1 历程:R -C -LO'O R '-C -O R快O'R -C -LOR HC LR 'OR-O --C -R 'HO++H LR -O H +L R O -C -R 'OV =K [R O H ][R'-C -L]OS N1S N 2L+慢R-O H +R'-COR '-C O V =K [R'-C -L]O一级反应二级反应2 酰化剂强弱与种类O'R -C - L OCR +L HL H L+OC R <OC R C lO H结论:离去基团共轭酸的酸性越强,酰化剂的酰化能力越强 酰化能力:RCOClO 4> RCOBF 4> RCOX >RCOOCOR > RCOOH >RCOOR'> RCONHR 3 各种酰化剂 1) 羧酸(SN2)R -O H +R 'C O OHR 'C O OR +H 2O提高收率(1)增加反应物浓度(2)减少生成物(3)除水共沸带水加脱水剂加快反应速率(1)提高温度(2)催化剂(降低活化能)催化剂(1)质子酸(2)Lew is 酸:(A lC l 3,sN C l 4,FeC l 3,等)(3)酸性树脂(V e s l e y 采用强酸型离子交换树脂加硫酸钙法RCO O HA lC l 3RCO O HA lC l 3配位键(增加C 的正电性)R COO HH +RCO H O HRCO H O Ha :硫酸氧化性√磺化 √脱水性×催化性×醇的结构对酰化反应的影响R O H+C OO HR '立体影响因素:伯醇>仲醇>叔醇O 'R -C -OC H 3CH 3CO HC H 3C H 3CH 3CO H 2C H 3HC H 3CH 3CC H 3C H 3C C H 3OC H 3OC RC H 3CH 3C O HC H3H -OHC H 2=C H -C H 2O HC H 2=C H -C H 2H 2CCC H 2H +- H 2OC H 2=C H -C H 2-O H 2C H 3C H 2H叔丁醇、苄醇、烯丙醇?用弱酸作酰化剂,除非加入偶氮二羧酸二乙酯R O H +C H 3C OO HC H 3C OO R +H 2O醇 C H 3O H E t O H n -C 3H 7O H C H 2=C H C H 2O H P h C H 2O H 异丙醇 叔丁醇V 1 0.84 0.84 0.64 0.68 0.47 0.026R CR CRO HO <RC O HO立体效应H 3CC OHO<F 3CC OHO电效应O HH OOH OC (C H 2)3C H 3OC H 3(C H 2)3C O O H100℃+ H 2OH 2N CH 2CO O H +C 3H 7O HH ClH 2N C H 2CO O C 3H 7H C l (气)H 2N +H C lN H 4C lHC l 防止H 2N C H 2C O O H 发生环内酯化C H =CH -CO O H+CH 3O HB F 3/E t 2OC H =C H -C O O CH 3BF 3催化适用于不饱和酸O HO HH OC O O HO HO HH OC O O C 12H 25+ C 12H 25O HT s O HX y l e ne对甲苯磺酸不用硫酸,因为其与二甲苯不溶没食子酸对无机酸敏感的醇,以及一些反式γ或δ脂环羟基酸形成内酯的反应可采用TsO H 、苯磺酸等有机酸作催化剂(4) DC C 二环己基碳二亚胺NCN+R -C -OHOOR -C H -OCN HH N CH NH NO CRO +OR -C H -OCN HNH +活性酯O HH 3C OC H 3C O O HH O C HC H 3H 2C +O HH 3C OC H 3C O OC H C H 3H 2CD CC /Et2O R.T.20m inO HH 3C OC H 3COO H酰化能力强,因为可形成分子内氢键R -N=C =N -RC H 3-N=C =N -C (C H 3)3C H 3C H 2-N=C =N -(C H 2)3-NE t 2(C H 3)2C H-N =C =N-C H (C H 3)2N CN NO(C H 2)2(5)偶氮二羧酸二乙酯法(活化苄醇制备羧酸酯)N NCO O E t C O O EtEtO -C-N -N -C -O E tOOPPh 3EtO -C -N H -N -C -O EtOOPPh 3R CO OR 1CR 2OR 3PPh 3R 1CR 2O HR 3R C O O+Ph 3PR O O H叔醇 构型反转此法可将叔醇酰化C H 2-C -C H 2C H 2O HC H 3C HC H 2C H 2O C OP hPh 3P +E tO O C -N +N -CO O E tPh CO O H /T H FOHO H部分选择酰化2) 羧酸酯为酰化剂共轭酸的酸性强,其酰化能力才强活性酯的应用COR'O R R '=C H 3,C 2H 5⑴羧酸硫醇酯NSCR ONN O 2②羧酸吡啶酯N C H 3C l.IN C H 3O -C -RO+RCOOH③羧酸三硝基苯酯O 2NN O 2O 2NO CO RO 2NN O 2O 2NC lO 2NN O 2O 2NOCO RR ''O H +R -C -OH O+R -C -O R ''O 难于分离,所以三种物质一起加入④羧酸异丙酯(适用于立体障碍大的羧酸)C H 3CC H 2OOCRRC O O H +H 3CCCHR 'O HR C O R'O C H 2=C =O + CH 3-C-CH 3O制I P ACCH 2C H 3H 3CCCH 3O H O产物稳定3)酸酐为酰化剂(酸酐多用在反应困难或位组较大的醇羟基上酰化)CR OOC OR HRCO OCO R+① H +催化O CR COOROCRO HCR OHOHC R COOR+CC H 3O N HCC H 3OO H OCH 3CCO OH 3C+NH 2+OCH 3C COOH 3CNH 2+H A c② Lewis 酸催化O CR COORA lC l3CROOC RO AlC l 3+③碱催化无机碱:(N a 2CO 3、N aH C O 3、 N aO H ) 去酸剂有机碱:吡啶, Et 3NNRC O C ROO+NCRORCOCH 3O H+Ac 2OD M A F回流CH 3O A cD M A F :对二甲氨基吡啶NC H 3H 3C例C 3H 7C O HC H 3C H 3+CCO O OE t 3N TEAC C O O OO HC C H 3C 3H 7C H 3混合酸酐的应用①羧酸-三氟乙酸混合酸酐(适用于立体位组较大的羧酸的酯化)OCR COOF 3CO HCR CO OF 3CCRO C F 3COO HH+例CROO OC F 3C(CF 3CO)2O+RCOOH+CF 3COOH羧酸-三氟乙酸混合酸酐的制备(CF 3C O )2OH 2NC H 2O H +C H 3C H 2COO H H 2N C H 2O CO C H 2C H 373%C O O HC H 3CH 3CO HC H 3+(C F 3C O )2OC O O B u-t蒽甲酸②羧酸-磺酸混合酸酐OCR SO 2OR'R COOH + R 'SO 2C l R COC l + R 'SO 2ClCRO +R 'SO 2OH③羧酸-取代苯甲酸混合酸酐C lC lC lC O C l C lC lC lCROO OC +R C O OHC C lO ClC C lO O E t CE tOOO E t CC lO OOC R碳酸酯RC OO H其它:O PC lC lC lC ROO HC ROOPC lC lO+4)酰氯为酰化剂(酸酐酰氯均适于位阻较大的醇的酰化)C l OC RLewis 酸催化C lOCRA lCl 3CRO A lCl4C lO CR+A lCl 3C lO CRA lC l 3配位键,增大碳的正电性碱催化:①无机碱:去酸剂②有机碱:Py, E t 3N , D M A P N N4-吡咯烷基吡啶PPY :NNC H 3C H 3D M A P :例;NC lOCRNC lOC+COCl+OHCOOPyRtC H 3H 3CC H 3C O C lC H 3H 3CC H 3C O O C Et 3+Et 3-C -O HA gC NH M PT六甲基磷酰胺采用酰氯和吡啶的方法,制备位阻大的酯时,AgCl 催化效果不好,加入AgCN 可是反映得到较好的效果O 2NC H 2OHCHO HC H N H C O C H C l 2O 2NC H 2O HC H N H C O C H C l 2H 2C OC C 15H 31OC 15H 31CO O HSO C l 2/Py无味氯霉素5)酰胺为酰化剂(活性酰胺)C RO NR R ''' N 的共轭效应使酰胺酯化作用弱CRO NNCRO NN CRON N N将氮固定在缺电子环上NN C N N ORCNNO HNNH+RCO OH++CO 2CDI 碳酰二咪唑RCNNO R CNNOBrRCNNOBr+NB S活性强的酰化剂B rN OONOON B S+ B r +6)乙烯酮为酰化剂(乙酰化)(对于某些难以酰化的叔羟基,酚羟基以及位阻较大的羟基采用本法)H 2C OH OH H 2O650~700℃(E t 3P )CH 2=C=O乙酸脱水H 3CCH OO丙酮脱C H 4- C H 4C H 2=C =OH 2CC H 2CO COH 2CC H 2CO C OO RHH 3CCH 2C CO ROO 2C H 2=C =ORO H乙酰乙酯的工业制法H 2C COOH RH 2C COHORH 3C COROCH 2=C=O + RO Hδ- HH 3C CCH 2OH 2C CO H Oγ酮酸类在TsO H 催化下与烯酮作用得内酯H 3C CC H 2OH 2C COOCC H 3O +C H 2=C =O TsO HH 3CCC H 2OH2C COγ酮酸类在TsO H 催化下与烯酮作用得内酯H 3C CC H 2OH 2C COO CC H 3O +C H 2=C =OTsO HH 3C CC HOHH 2C COOCC H 3O C H C OCC H 2H 3COO HH 2C CO H 3C COCROO +δRCOHOH 3C CC H 3OH 3CCC H 2O H H 3CCOOCC H 3C H 2C H 2=C =O +IPA 乙酸异丙烯酯良好的乙酰化试剂二 酚的氧酰化(用强酰化剂:酰氯、酸酐、活性酯)O HR CLO'p -π共轭,使酚羟基不易被酰化例O H CH 3O OCO Ph OCO CH 3+PhC OClPy 中和生成的HC lH 2C H 2CC O O H C O O HH 2C H 2CC OO C O OO H2+PO Cl 3RCO H O OPC lC l C lRCOPC l O O C l 混合酸酐O HC O O HO AcC O O H +Ac 2OC H 3H OH 3CC H 3O C 16H 33C H 3C H 3A cOH 3CC H 3OC 16H 33C H 3A c 2O PyC O O HH 3CC H 3C H 3O HH 3CC H 3C O O C H 3H 3CC H 3H 3CH 3C+(C F 3C O )2O立体位阻较大的羧酸C C NC NH 3COH 3CC O C H 3C H 3O乙酰化试剂与反应(专门酰化酚羟基)O H活性部位N -乙酰基-1,5,5-三甲基-乙内酰脲(Ac-TM M)H O CH 2O H +A c-TM HCH 3CNA cO C H 2O H△第二节 氮原子上的酰化反应 一脂肪氨-N 酰化OR -C -LR -CO'SN1:+LOR -C -L SN2:+H 2NR 'R 'NC ROL酰化剂种类与强弱顺序R C OC l > R C O OC O R >R C O O R '> R C O N HR ' >R C O OHR C O O H 酰化能力最弱的原因:H 2N RR 'C OO HH 3N R R 'C O O所以,R C OO H 与 R N H 2反应最佳催化剂:DC C 、C D I 、PO C l 3被酰化的结构对反应的影响:伯胺>仲胺脂肪胺>芳胺NH 2Rp-π共轭因为1羧酸为酰化剂RCOOH + H 2NR'RCONH R' + H 2ONN HCO CRO DC C(1)CR ONN(2)CDIRC OPO H O HO O(3)含磷化合物 PO C l 3、P P A (多聚磷酸)、PP YNN2 羧酸酯为酰化剂R C O R 'ORC NH RO ''+H 2N R ''+H O R 'R C O OH + C H 3OHR C O OC H 3H 2N R 'RCN HR 'O 有时宁可增加一个反应,也不让RC O O H 与H 2N R 直接反应例O 2NH C C HC H 2O HO HNH 2O 2NH C C HC H 2O HO HNH C O C HC l 2Cl 2C H C O O CH 3不用酰氯作催化剂,否则羟基易被酰化C H 2N H C O C H 2C H 2OHOC H 2N H 2+OOO**H 2N C H 2NON H C C CN HC R ROOO'R 'RCC OO Et C OO Et+巴比妥类通用方法NC OO E tNC ON H N H 2+H 2N N H 2H 2OE tO Href 1hO 2SH 2NO C H 3C ON O 2N O 2O N H 2CH 2NC 2H 5O 2S H 2NO C H 3C O N H 2CH NC 2H 5+舒比利活性酯H O O 2NN O 2因其为强酸3 酸酐为酰化剂R C OCR OO RC H NR O 'SN 1:+H 2N R'Py Et3N过量H2NR 'N O 2N H C H 3N O 2NA c C H 3例:A c 2O +H 3CH CC O O HN H C O C H 3H 3CH CCN H C O C H 3OC OO OE tH 3CH CCN H C O C H 3H NH CO C O O HC lCOO EtC H N H 2C O O H羧酸中加入三氟乙酐或氯甲酸酯生成混合酸酐活性酰化剂4 酰氯为酰化剂(由于酰氯活性强,多用于位阻较大的胺及热敏性物质的酰化)R C Cl OR C HN R O 'SN 1:+H 2NR '+H C l (加去酸剂:有机碱P y, Et3N )例HC C O C lN H HC lSNM e 3S iO O CC H 3H 2NOC H C O N H 2S NH O O CC H 3HNO+Et 3NC H 3C N ,-25℃保护此酰化剂用酰氯在-25℃就可反应,用其它弱酰化剂时需要升高反应温度,但温度一高,内酰氨易分解,所以此反应的酰化剂必须是酰氯 5 酰胺为酰化剂CRO NN OSNCRO O SH NR C O OH +C DI如用环状酸酐酰化时,在低温下常生成单酰化产物,高温加热则可得双酰化亚胺C OC OO C OC OO HH NC HC H 2Ph C O OH+△C OCON C HC H 2P h C OO H二、芳胺N-酰化N H 2+A c 2ON H A cC O O Et C O O EtN H 2C lC O N H C O N HC lC l +2N a在酰化反应中,加入N a 或者 RCON a 使Ph-N H ,使酰化反应易于进行N H 2C lON H C O O E tC lON H C OC lONNC O O E tH NN H+ClCOOEtPyNNC O O Et+C l C OO Et1:1H NN HNNC O O E t+Cl COO Et芳核上有硝基、卤素等吸电子取代基时,氨基的酰化则受到影响而变得迟缓,可加入浓硫酸进行催化N H 2B rB rBrN H C O C H 3Br BrB rA c 2O /H 2SO 4三、选择性的酰化反应(立体效应,电效应)CC H 2O H OO H O1117O HC H 3O H C H 3OCH 2COOH O1117O HO C C H 2C H 2C O O HOH 2C C H 2CCOO OP y/R T立体效应O H位阻大HC HH 3C H OOC O O C H 3O H 312OC O O C H 3O H O COH90% H COO H 65 ℃3h保护基的选择3位被酰化OH OH ONH NO O C H 3OP hC OH ONH NO O C H 3O PhC O O H Ph 3PHH伯醇位阻小,Ph C O O - 进攻-O H/N NC O O Et C O O E t/dioxane偶氮二羧酸二乙酯。