焙烧试验2
- 格式:pptx
- 大小:234.73 KB
- 文档页数:18

药物灰分测定操作方法
药物灰分测定操作方法通常包括以下步骤:
1. 准备样品:取一定数量的药物样品,通常为2-5g,确保样品的代表性。
2. 烘干:将药物样品放入事先称好质量的干燥皿中,将其放入烘箱中,在100-105摄氏度下烘干2小时,使样品中的水分彻底蒸发。
3. 冷却:将烘干后的样品取出放在干燥器中,使其冷却到室温。
4. 焙烧:将样品所在的干燥皿放入预热到550-600摄氏度的焙烧炉中,进行焙烧。
根据药物的特性和实验要求,焙烧时间通常在2-3小时之间。
5. 冷却:将焙烧后的干燥皿取出放在干燥器中,使其冷却到室温。
6. 灼烧:将冷却后的干燥皿中的灼烧残渣用酸洗净。
7. 烘干:将洗净的干燥皿放入烘箱中,在100-105摄氏度下烘干1小时,使其完全干燥。
8. 冷却:将烘干后的干燥皿取出放在干燥器中,使其冷却到室温。
9. 称量:将干燥皿放入电子天平上进行称量,记录下干燥皿的质量。
10. 计算:根据质量差值计算出样品中的灰分含量,一般以百分比表示。
需要注意的是,在操作过程中要保持实验器皿的干净和干燥,避免任何可能引入灰分的污染物。
此外,根据不同药物的特性,可能需要对操作方法进行一些适当的调整和改变。

cufes2焙烧化学方程式
CuFeS2是一种含铜的硫化物矿石,也被称为黄铜矿。
焙烧是一种通过加热来进行化学反应的过程,可以将CuFeS2转化为铜金属和铁氧化物。
在焙烧过程中,CuFeS2的结构会发生变化,硫化铜和硫化铁会被氧化分解,产生硫酸铜和氧化铁。
以下是CuFeS2焙烧的化学方程式:
2CuFeS2 + 7O2 → 2CuS + 2FeO + 4SO2
在这个方程式中,CuFeS2和氧气反应生成了硫化铜、氧化铁和二氧化硫。
CuFeS2中的硫化铜被氧气氧化成了硫化铜,而硫化铁则被氧化成了氧化铁。
同时,CuFeS2中的硫也被氧化成了二氧化硫,释放出来。
这个反应反映了CuFeS2焙烧的基本过程,但实际上,焙烧过程可能会有一些副反应和其他化学变化。
例如,在高温下,CuFeS2中的硫化铜会进一步氧化生成Cu2S和SO2。
此外,在一定条件下,CuFeS2还可以与氯化铵反应生成铜和氯化铁。
焙烧是一种常用的冶金过程,用于从硫化矿石中提取金属。
通过控制焙烧的温度、氧气供给和反应时间,可以实现对CuFeS2的高效转化。
焙烧的产物中,硫化铜可以进一步经过冶炼和电解过程得到纯铜,而氧化铁可以用于其他工业应用。
总结一下,CuFeS2焙烧的化学方程式如下:
2CuFeS2 + 7O2 → 2CuS + 2FeO + 4SO2
这个方程式描述了CuFeS2在焙烧过程中与氧气反应产生硫化铜、氧化铁和二氧化硫的化学反应。
焙烧是一种常用的冶金过程,可以将硫化矿石中的金属提取出来,为工业生产提供重要的材料。

探讨二次焙烧隧道窑的工艺流程优化设计摘要本文以二次焙烧隧道窑为研究对象,首先针对传统浸渍电极支持下二次焙烧隧道窑存在的问题进行了简要分析,进而研究了建立在内燃式电极支持下二次焙烧隧道窑的基本工艺流程,在此基础之上针对整个工艺流程有待改进的问题做出了详细分析与研究,旨在于引起各方工作人员的特别关注与重视。
关键词二次焙烧;隧道窑;工艺流程;优化;设计;分析1 传统二次焙烧隧道窑存在的问题分析大量的工程实践研究结果显示:在应用浸渍电极支持二次焙烧作业的过程当中,不利问题主要表现为以下几个方面:首先,对于燃料的消耗较高,对于环境污染影响较大;其次,由焦油沥青挥发所产生的可燃性气体极有可能在窑内作业环境下出现燃烧问题,导致整个二次焙烧生产系统的使用寿命严重下降;最后,无法确保二次焙烧制品在整个预热过程中预热性能的均衡性,受到上下部位置较大的温度差异因素影响,无法确保制品质量的有效性。
针对以上问题,展开有关建立在内燃式电极支持下的二次焙烧隧道窑应用研究工作。
2 二次焙烧隧道窑基本工艺流程分析1)在二次焙烧制品进入隧道窑生产作业系统内部之后,需要按照预先设定的送车速度均匀通过预热带区域(在本文所研究二次焙烧隧道窑结构系统当中,预热带整体长度表现为9.5个移动车位长度),在此过程当中完成二次焙烧制品的预热处理。
特别需要注意的一点在于:在预热带的末端位置,需要将隧道窑窑顶位置温度严格控制在300℃单位以上。
2)在二次焙烧制品完成预热处理之后,需要进入烧成带区域进行二次焙烧处理。
在本文所研究二次焙烧隧道窑结构系统当中,整个烧成带共包括15个移动车位长度,总长度约为45.5m单位。
可以说,烧成带区域是整个二次焙烧隧道窑最主要的处理区域。
按照这一区域内工作温度要求的差异性,还可以对其进行进一步细化。
具体而言,主要可以归纳为以下几个方面。
①首先是均热升温区域:这一区域主要包括9个移动车位长度,经由上一步骤对二次焙烧制品进行有效预热处理的基础之上,在制品通过均热升温区域的过程当中,能够通过有效的加热反应确保制品能够基本达到或是接近电极二次焙烧对于制品温度状态的相关要求。


cufes2焙烧化学方程式CuFeS2焙烧化学方程式焙烧是一种矿石处理方法,通过加热来使矿石发生物理和化学变化,从而提取有用的金属。
CuFeS2是一种含铜、铁和硫的矿石,也称为黄铜矿。
下面我们将探讨CuFeS2焙烧的化学方程式,并解释其反应过程。
CuFeS2的化学方程式可以写作:2CuFeS2 + 3O2 -> 2FeO + 2CuS + 2SO2这个方程式可以分解成几个步骤来解释。
第一步,CuFeS2与氧气反应生成铁氧化物(FeO)、硫化铜(CuS)和二氧化硫(SO2)。
第二步,CuFeS2和氧气之间的反应是氧化还原反应。
在这个反应中,CuFeS2中的铜(Cu)和铁(Fe)被氧气氧化,同时氧气还原为二氧化硫。
第三步,生成的铁氧化物(FeO)、硫化铜(CuS)和二氧化硫(SO2)是焙烧过程中的主要产物。
焙烧的目的是将金属从矿石中提取出来。
在CuFeS2焙烧过程中,铜和铁被氧气氧化,生成氧化铁和硫化铜。
这些产物可以通过进一步处理提取出铜和铁。
二氧化硫则是一种有害气体,需要进行处理以减少对环境的影响。
CuFeS2焙烧的化学方程式说明了该反应的基本过程,但实际的焙烧过程可能还涉及其他的反应和产物。
例如,当矿石中还存在其他金属时,这些金属也可能被氧化或还原,并生成相应的氧化物或金属。
此外,矿石中的杂质也可能影响焙烧过程和产物的生成。
CuFeS2焙烧是一种重要的矿石处理方法,通过加热CuFeS2与氧气反应,生成铁氧化物、硫化铜和二氧化硫。
这个化学方程式描述了该反应过程的基本原理,但实际的焙烧过程可能还涉及其他反应和产物。
了解这些反应过程对于矿石处理和金属提取具有重要意义,有助于提高金属的回收率和降低对环境的影响。

氧化铝含铝废渣经硫酸钠水解焙烧提取铝制备氧化铝氧化铝(Al2O3)是一种常见的无机化合物,被广泛应用于陶瓷、电子、建筑材料等领域。
氧化铝的制备过程中,常用的原料是含铝废渣,通过硫酸钠(Na2SO4)的水解焙烧来提取铝,制备氧化铝。
本文将详细介绍氧化铝含铝废渣经硫酸钠水解焙烧提取铝制备氧化铝的相关理论基础和实验步骤。
一、理论基础:1.1 氧化铝(Al2O3)的性质和应用:氧化铝是由氧化铝矿石制备而成的,是一种白色结晶固体。
它具有良好的物理和化学性质,具有高的熔点、硬度和化学稳定性,可在高温下保持稳定的形态。
因此,氧化铝被广泛应用于陶瓷、电子、建筑材料等领域。
1.2 含铝废渣的特点和利用:含铝废渣是含有一定氧化铝含量的固体废弃物,通常是铝冶炼过程中的副产物。
含铝废渣的特点是含有较高的氧化铝含量,但同时也含有其他杂质,如铁、钙、硅等。
因此,含铝废渣不能直接用于制备氧化铝,需要进行水解焙烧提取铝的处理过程。
1.3 硫酸钠的水解反应:硫酸钠在水中进行水解反应,生成硫酸和氢氧化钠。
其反应方程式如下:Na2SO4 + 2H2O → 2H2SO4 + 2NaOH二、实验步骤:2.1 处理含铝废渣:首先,将含铝废渣进行预处理。
将废渣进行破碎、磁选等处理,去除其中的石块和磁性杂质。
然后,将处理后的含铝废渣与硫酸钠按一定比例混合均匀。
2.2 硫酸钠水解焙烧:将混合好的含铝废渣与硫酸钠放入反应釜中,加入适量的水,搅拌均匀。
然后,将反应釜加热,控制温度在120-150摄氏度,持续反应一段时间。
在这个过程中,硫酸钠发生水解反应,生成硫酸和氢氧化钠,并与废渣中的氧化铝发生反应。
2.3 过滤和洗涤:经过水解焙烧后,废渣中的氢氧化钠溶解在水中,而氧化铝则固定在废渣中。
将反应混合物过滤,将固体废渣和液体分离开。
然后,对固体废渣进行多次的水洗,以去除其中的杂质。
2.4 煅烧和氧化:将洗涤干净的固体废渣放入炉中进行煅烧和氧化处理。
首先,将固体废渣进行预热,控制温度在200-350摄氏度,去除其中的水分。

深圳实验学校高中部2023-2024学年度第一学期第二阶段考试高一化学时间:90分钟满分:100分可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 C1-35.5 K-39 Fe-56 Cu-64第一卷(共48分)一、选择题(每题只有一个正确答案,共12小题,每小题2分,共24分)1.下列日常生活中的常见物质不属于金属材料的是选项 A.铝合金门窗 B.青铜器 C.“故宫红”涂料 D.铀锆储氢合金2.杭州亚运会主火炬用了一种全球大型赛事中从未使用过的燃料——“零碳甲醇”,其制备过程包括:①H2O经太阳光光解制成H2;②空气中CO2与H2反应生成CH3OH。
下列叙述不正确的是A.过程①氧化产物和还原产物的物质的量比为1:2B.过程②既属于化合反应,也属于氧化还原反应C.CO2既属于酸性氧化物,也属于非电解质D.该制备方式的优点是零污染排放,且循环使用3.五育并举,劳动先行。
下列劳动项目与所述的化学知识没有关联的是选项劳动项目化学知识A 学科实验:用KMnO4标准溶液测定菠菜中铁元素的含量酸性KMnO4溶液能氧化Fe2+B 家务劳动:用卤水点热豆浆制豆腐卤水中电解质能使豆浆胶体聚沉C 学工活动:用FeCl3溶液制作印刷电路板Fe的活动性比Cu强D 环保行动:宜传废旧电池分类回收电池中重金属可造成土壤和水体污染4.下列实验操作能达到实验目的且离子方程式正确的是A.向污水中通入H2S气体除去Hg2+:H2S+Hg2+=HgS↓+2H+B.向溴化亚铁溶液中通入足量氯气:2Br-+Cl2=Br2+2Cl-C.用KSCN溶液检验FeCl2是否完全变质:Fe3++3SCN-=Fe(SCN)3NH+Al3++4OH-=NH3·H2O+Al(OH)3↓D.向硫酸铝铵溶液中加入过量NaOH:+45.下列各组离子一定能大量共存的是SOA.酸性透明溶液:K+、Fe2+、I-、2-4B.遇铝单质放出H 2的溶液中:Na +、K +、2-3SO 、Cl -C.含有大量Fe 3+的溶液中:Na +、Cu 2+、-3NO 、SCN - D.遇紫色石蕊试剂变蓝的溶液:Na +、+4NH 、Cl -、-3HCO6.复印机工作时易产生臭氧,臭氧具有强氧化性,可使润湿的淀粉-KI 试纸变蓝。

CuS氧化焙烧过程的实验研究赵洁婷郭兴敏(北京科技大学冶金与生态工程学院,北京 100083)摘要本文采用热重、气体分析以及X射线衍射等分析手段,对CuS氧化焙烧过程机理进行了研究。
实验结果表明:在空气下以3℃/min的升温速率,CuS的焙烧过程可分为四个阶段,第一阶段(200~300℃),CuS氧化生成Cu2S 和SO2,Cu2S进一步氧化生成CuO·CuSO4、CuSO4,最终稳定产物是CuSO4;第二阶段(300~400℃),此过程没有SO2逸出,第一阶段残留的Cu2S和CuO·CuSO4不断地被氧化成硫酸盐;第三阶段(400~600℃),硫酸盐在此温度范围内可以稳定存在;第四阶段(600~760℃),CuSO4和CuO·CuSO4分解生成SO2,最终产物为CuO。
关键词CuS 氧化焙烧SO2热重Experimental Study on Oxidizing Roasting Process of CuSZhao Jieting Guo Xingmin(School of Metallurgical and Ecological Engineering, University of Science andTechnology Beijing, Beijing, 100083)Abstract The oxidizing roasting mechanism of CuS was studied by employing thermogravimetric (TG), tail assay and X-ray diffraction (XRD) analysis. Results showed that the roasting process can be divided into four stages with heating rates of 3℃/min in air. In the first stage (200~300℃), CuS was oxidized into Cu2S and SO2, subsequently Cu2S was further oxidized into CuO·CuSO4 and CuSO4, then final product viz. stable CuSO4 was obtained. In the second stage (300~400℃), no SO2 was detected, whereas Cu2S and CuO·CuSO4 remained during the first stage were oxidized into sulfate constantly.In the third stage (400~600℃),sulfate was found stable in this temperature range. In the fourth stage (600~760℃), CuO·CuSO4 and CuSO4 decompose into SO2, and the final product was confirmed to be CuO.Key words CuS oxidizing roasting SO2TG1 引言近十几年来,我国钢铁工业持续高速发展,铁矿石资源随之日益枯竭,且我国的铁矿资源丰而不富,自给率仅为50%左右,是世界上最大的铁矿进口国。
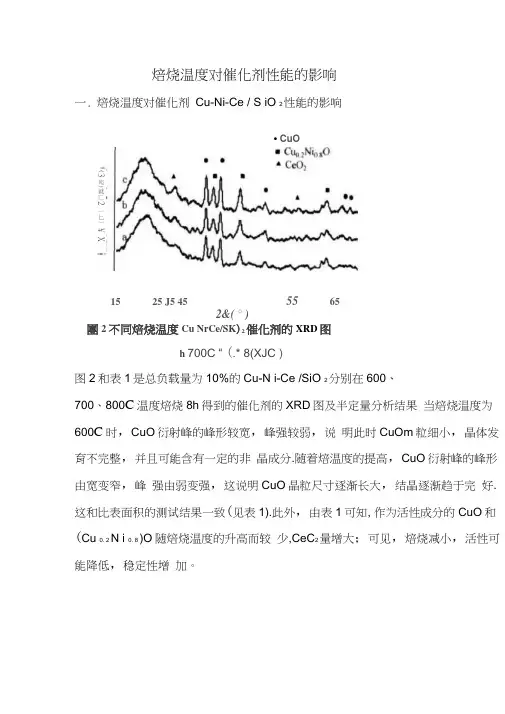
焙烧温度对催化剂性能的影响一. 焙烧温度对催化剂 Cu-Ni-Ce / S iO 2性能的影响團2 不同焙烧温度Cu NrCe/SK )2催化剂的XRD 图h 700C “ (.* 8(XJC )图2和表1是总负载量为10%的Cu-N i-Ce /SiO 2分别在600、700、800C 温度焙烧8h 得到的催化剂的XRD 图及半定量分析结果 当焙烧温度为600C 时,CuO 衍射峰的峰形较宽,峰强较弱,说 明此时CuOm 粒细小,晶体发育不完整,并且可能含有一定的非 晶成分.随着焙温度的提高,CuO 衍射峰的峰形由宽变窄,峰 强由弱变强,这说明CuO 晶粒尺寸逐渐长大,结晶逐渐趋于完 好.这和比表面积的测试结果一致(见表1).此外,由表1可知, 作为活性成分的CuO 和(Cu 0. 2 N i 0. 8 )O 随焙烧温度的升高而较 少,CeC 2量增大;可见,焙烧减小,活性可能降低,稳定性增 加。
• CuO15 25 J5 4555652&( ° )《3宛)就匚2一匕一 ¥ X叢I 培烧温度时懼化捌堵构的影响T 曲' 】tln % fjils'ia KIKII TiTnpiFliJTr 011 di rlyTiir -Htnii ufiarr 焙烧温度C ;i]O 轴含里w 打含里比表面稅“和MX>163 2m】站"图3是各催化剂表面Cu 元素的XPS 谱图.由图可知,不同焙烧温 度下制备的Cu-N i -Ce /SQ 2表面Csp 峰均比较尖锐,峰位对应的 结合能没有发生明显的变化,Cu2p3 /2峰位所对应的结合能大约 在934C 0eV,对应于CuO 勺Cu2p3 /2 XPS 谱图, 说明Cu 元素主 要是以CuO 形式存在于催化剂表面的.各焙烧温度下催化剂的 峰形均不对称,说明催化剂表面Cu 还有其它价态出现,可能就 是固溶体的存在,这与XRD 吉果一致.600 C 焙烧得到的催化剂 峰形的不对称性较大。

cufes2焙烧化学方程式Cufes2焙烧化学方程式指的是二硫化铜(CuS2)在高温下进行焙烧反应的化学方程式。
在这个过程中,二硫化铜会发生分解反应,产生氧化铜(CuO)和硫化铜(Cu2S)。
化学方程式可以用以下方式表示:2CuS2 -> 2CuO + Cu2S在这个方程式中,左边的反应物是二硫化铜,右边是产物,包括氧化铜和硫化铜。
方程式中的系数表示了反应物和产物之间的物质的摩尔比例关系。
例如,方程式中的系数2表示了两个二硫化铜分解产生两个氧化铜和一个硫化铜。
焙烧是一种高温处理过程,通常用于将物质转化为其他化合物或改变其物理性质。
在Cufes2焙烧的过程中,二硫化铜在高温下分解为氧化铜和硫化铜。
焙烧反应的实际过程可以通过以下步骤来描述:1. 加热:将二硫化铜样品加热到足够高的温度。
通常,焙烧反应需要在高温下进行,例如800°C至1000°C。
2. 分解:在高温下,二硫化铜开始发生分解反应。
分解反应是一个化学反应,其中一个复合物分解成两个或更多的简单物质。
在这种情况下,二硫化铜分解为氧化铜和硫化铜。
3. 生成产物:分解反应产生氧化铜和硫化铜。
氧化铜是一种黑色固体,而硫化铜是一种蓝色固体。
通过这个焙烧反应,二硫化铜转化为氧化铜和硫化铜。
这种转化可以用化学方程式2CuS2 -> 2CuO + Cu2S来表示。
这个焙烧反应在实际应用中具有一定的重要性。
氧化铜和硫化铜都是重要的工业原料,可以用于制备其他化合物或进行其他化学反应。
此外,焙烧还可以改变物质的物理性质,例如提高材料的热稳定性或改变其导电性能。
总结起来,Cufes2焙烧化学方程式描述了二硫化铜在高温下发生分解反应,产生氧化铜和硫化铜。
这个方程式可以说明焙烧反应的化学过程,并揭示了焙烧反应的重要性和应用价值。

2硫化铅精矿的烧结焙烧硫化铅精矿的粒度小,大都小于200目(0.074mm),其中除PbS外,还含有其他的金属硫化物和脉石。
在鼓风炉还原熔炼条件下,精矿中的PbS是不能被还原产出金属铅的,所以应预先进行氧化焙烧,使PbS变为PbO。
此外,精矿原料这种细粒物料进鼓风炉处理时,容易被鼓风吹出炉外,或者将炉料中的空隙堵死,使炉料透气性变坏,风难鼓入,熔炼过程难以进行。
所以硫化铅精矿的烧结焙烧是在有大量空气参与下的强氧化过程,其目的是:①氧化脱硫,使金属硫化物变成氧化物,以便被碳还原,而硫以SO2逸出,以便制酸;②在高温下将粉料烧结成块,以适应鼓风熔炼作业的要求。
2.1硫化铅精矿的烧结焙烧2.1.1烧结焙烧的脱硫率确定烧结块中残硫多少的原则是按精矿中铜、锌含量来加以控制。
如果铅精矿含Zn高,则焙烧时应尽量把硫除净,使Zn全部变为ZnO,这样可减少ZnS对还原熔炼时的危害。
如果精矿含铜较多(如Cu>l%),便希望焙烧时残余一部分硫在烧结块中,使铜在熔炼时以Cu2S形态进入铅,从而提高铜的回收率。
如果烧结块中残硫不够,则在还原熔炼时大部分铜会被还原为金属铜而入粗铅,少量以硅酸铜和亚铁酸铜形态进入炉渣,前者会导致鼓风炉操作上的困难,后者增加了铜的渣损失。
实践证明,当铅锍中含Cu10%~15%时,铜在铅锍中的回收率可达80%~90%。
如果精矿中含Cu、Zn都高,残硫问题只能根据各厂的具体情况而定。
有的工厂首先进行“死焙烧”,使铜和锌的硫化物都变成氧化物,而在鼓风炉熔炼时加入黄铁矿作硫化剂,将铜的氧化物再硫化成为Cu2S,使之进入铅锍,而锌以ZnO形态进入炉渣。
国内铅厂对含Cu、Zn都较高的精矿一般不造铅锍,而是采用“死焙烧”。
这样既免除ZnS的危害,又减少造锍的麻烦和锍处理的费用,同时铅的直收率也得到提高。
我国炼铅厂实践证明,粗铅含Cu2.5%左右时,操作中没有多大困难。
如某厂处理含锌和铜都比较高的精矿时,鼓风炉产出粗铅含Cu达3.5%~4.5%,只要采用高焦高钙炉渣进行熔炼,并维持较高的炉缸温度,操作无多大困难,但铜在粗铅中的回收率为70%~75%。
二次隧道窑工艺、安全标准审批:审核:编制:时间: 2006年9月29二次隧道窑工艺、安全标准1、目的为掌握设备的技术性能及参数,为设备的工艺、操作、检修提供依据,特制定本标准。
2、本标准适用范围本标准适用于广汉士达炭素有限公司二次焙烧隧道窑。
3、设备结构二次焙烧隧道窑是32车位外燃式隧道窑,沿窑的长度方向分为隔离带、加热焙烧带、予冷带、主冷带。
二次焙烧隧道窑由窑体、通风设备、燃烧设备及运输设备等组成。
4、设备主要技术参数二次焙烧隧道窑主要尺寸及技术性能表-15、二次焙烧隧道窑砌体的允许误差及检验方法。
5.1 二次焙烧隧道窑砖缝厚度应符合表-2的规定。
二次焙烧隧道窑窑砖缝厚度表表-26、装窖车程序6.1 检查吊具是否安全牢固。
6.2 检查窑车车况及运行情况(裙板是否变形、开焊,车轮运转是否正常),发现异常及时维修。
6.3 检查底盘、匣钵是否变形、裂纹,发现异常及时维补。
6.4 检查窑车耐活砌体及密封槽纤维毯,发现损坏及时维补。
6.5 底盘、匣钵吊装到窑车上,摆放时窑车上收集底盘、匣钵东西与窑车上耐火砖偏中40mm(向西偏即偏向窑头),南北不得偏移,南北与耐火砖墩对正、对齐、对称。
6.6 产品卧装在中间位置,产品两端缝隙均匀,产品每层装,每层产品间对称摆放两根隔铁且大尖朝上,隔铁共放两层。
6.7 在底盘的四边槽中平铺20mm厚硅酸铝纤维毯条,装好产品后,把匣钵轻轻吊放到底盘的纤维毯上,罩住产品。
6.8 记录好窑车号,产品品种、规格、数量。
6.9 将装好的产品车推拉到装窑位置。
7. 卸窖车程序7.1 用天车把匣钵吊下窖车放到空地上7.2 用天车把底盘上的产品一层一吊地卸下放到堆料场地上,按产品规格堆放好,卸下的隔铁放在指定地点。
7.3 要专人吊放,立即标明窖车号等检查员检查。
7.4 经检查后的产品按规格、批号、品种分类堆放整齐。
7.5 清除底盘里的沥青焦物,并清扫干净运走。
7.6 注意事项:指挥天车操作,注意安全,不准超重,天车吊物行驶避开下面人员。
焙烧原理22.2.2 固体沸腾沸腾焙烧技术的理论基础是固体沸腾。
所谓“固体沸腾”,是指固体物料粒子被自下而上的空气抬起,而又不至于吹跑,这样料粒在容器内互相分离处于悬浮状态,作上下、左右、前后不停的往复运动,其外状如同水的沸腾,这种状态习惯称之为“固体沸腾”。
2.2.2.1沸腾过程如果在玻璃管内装有固体粒子,管底有孔眼,当由下面经管底孔眼吹风时,随着气流速度不同,管内固体粒子呈图2—3所示各种状态。
根据实验数据,把气流的直线速度(直线速度又称表面速度,就是单位时间内流过的气体体积除以管子总截面所得的商)和气体通过床层的压力降都取对数值,以纵坐标表示压力降对数值,以横坐标表示直线速度对数值,则可得图2—4曲线。
图2—3风速对炉料层状态的影图2—4 直线速度与床层压由于通过固体料层的气流速度不同,沸腾过程可分为四个阶段:固定床、膨胀床、沸腾床和稀相沸腾床。
当上升气流直线速度较小时,料粒之间的点接触关系不改变,粒子总体积也不发生变化,上升气流仅从粒子间空隙通过,如图2—3中(a)所示,这种床称为固定床。
在这种情况下,一个直线速度就有一个压力降,压力降随着直线速度加大而增大,如图2—4中的AB线段所示。
固定床的孔隙度ε波动在0.26~0.57,一般在0.4左右。
当继续增大上升气流直线速度到B点时,床层的压力降等于单位床层面积上物料的有效重量,于是粒子开始移动,部分点接触发生破坏又重新建立,床层开始膨胀,体积开始增大。
B点为使固体粒子开始移动的最小速度,此建度称为临界速度。
此时床层呈不稳定状态,就象水接近于沸腾时的状态,如图2—3中(b)所示。
上升气流直线速度过B点后再继续增大时,压力降的上升变为较前平缓,到C点达最大值,如图2—4中BC线段所示。
此时床层上的粒子开始彼此分离。
再继续增大上升气流直线速度时,由于粒子彼此逐渐分离,空隙增加,阻力减小,因而压力降开始减小,增大到D点时的压力降与B点压力降相等,如图2—4中CD线段所示。
焙烧二车间班前会内容1. 会议目的焙烧二车间班前会是为了及时传达工作安排、交流工作经验和解决问题,确保车间生产运行的顺利进行。
本次班前会的目的是:•传达重要信息和工作安排•分享工作经验和技巧•讨论和解决当前存在的问题•提高员工的工作积极性和团队凝聚力2. 会议时间和地点•时间:每天早上8:30 - 9:00•地点:焙烧二车间会议室3. 会议议程3.1. 会议开场•主持人宣布会议开始•介绍与会人员和客人•确定会议议程和时间安排3.2. 上一班工作总结•由上一班班长或代表总结上一班的工作情况•分享工作中的亮点和成功经验•汇报上一班的产量、质量和安全情况3.3. 重要信息和工作安排通知•传达上级领导或生产部门下达的重要工作通知•介绍近期的生产计划和目标•分发和解读相关的文件和文件夹3.4. 安全生产和质量管理•强调安全生产的重要性,提醒员工遵守操作规程和安全操作流程•介绍最新的安全生产标准和操作要求•分享近期的安全事故案例和处理经验•强调质量管理的重要性,提醒员工严格按照质量标准执行工作3.5. 技术交流和培训•分享焙烧工艺、设备和仪器的使用技巧和经验•介绍新技术和新设备的操作方法和注意事项•邀请技术专家进行专题培训和讲座3.6. 问题讨论和解决•提供员工发言的机会,让他们提出工作中遇到的问题和困难•分析问题的原因和影响,并提出解决方案•确定问题解决的责任人和时间节点3.7. 班前动员和总结•鼓励员工提高工作积极性和团队凝聚力•引导员工关注工作的重点和难点•总结本次会议内容和下一班的工作重点4. 会议记录和反馈•会议期间由会议记录员记录会议内容,包括讨论的问题和解决方案•会议结束后,将会议记录整理成文档,并发送给与会人员•会议记录还可以作为后续工作的参考和评估依据5. 会议注意事项•准时参加会议,如有特殊情况请提前请假•会议期间手机静音或关闭,专心听会•尊重他人发言,不打断和争论•遵守会议纪律,不随意离席•会议结束后,按时完成会议安排的工作以上是焙烧二车间班前会的内容安排和要求,希望大家能够认真参与,共同提高工作效率和质量。
石墨一浸二焙的指标石墨是一种重要的非金属矿产资源,广泛应用于电池、涂料、橡胶、陶瓷等行业。
为了获得高品质的石墨产品,石墨的一浸二焙工艺至关重要。
下面将介绍石墨一浸二焙的指标,以帮助大家更好地了解和掌握这一工艺。
一浸指的是将石墨矿石浸泡在浸出液中,以溶解和去除其中的杂质。
浸出液可以是酸性溶液、碱性溶液或有机溶剂。
在浸出过程中,应特别关注浸出液的浓度、温度和浸泡时间。
首先,浸出液的浓度需要适度。
如果浸出液过浓,可能会发生局部结晶,在浸泡过程中会产生大量气泡,影响石墨的浸出效果。
相反,浸出液过稀,可能导致浸泡时间过长,造成资源浪费。
其次,浸出液的温度也是一个关键指标。
一般来说,适宜的浸出温度应保持在50-90摄氏度之间。
温度过低会导致石墨矿石难以充分分解和溶解,而温度过高则可能引发石墨氧化、损失和消耗过多的浸出剂。
此外,浸泡时间也要合理控制。
单次浸泡时间一般在2-6小时,但具体时间需视石墨矿石的含量、细粉和石墨矿石的状态而定。
如果浸泡时间过长,可能会造成石墨的丢失,也会降低生产效率。
浸出工艺完成后,就需要进行二焙处理。
二焙指的是将石墨矿石在高温条件下进行煅烧,去除其中的挥发物和水分。
二焙的关键指标是焙烧温度和时间。
一般来说,石墨的二焙温度应控制在1000-3000摄氏度之间,短时间高温焙烧可保证石墨的结晶度和石墨晶粒的尺寸。
此外,在焙烧过程中还需注意保护石墨颗粒,避免其在高温下相互碰撞、破碎和粘连。
对于大块石墨,可采用分段焙烧,降低石墨受热不均匀带来的破损。
总之,石墨一浸二焙是获得高品质石墨产品的关键工艺之一,其控制指标包括浸出液的浓度、温度和浸泡时间,以及二焙的焙烧温度和时间。
合理控制这些指标,可以提高石墨产品的品质和产量,促进石墨行业的可持续发展。
石墨一浸二焙的指标-回复石墨一浸二焙的指标是指在石墨生产过程中的一种工艺方法,该方法主要包括石墨料浸泡和焙烧两个步骤。
石墨是一种具有高导电性和高热稳定性的材料,广泛应用于电池、石墨化学品、电极材料等领域。
石墨一浸二焙方法的目的是改善石墨的导电性和稳定性,以提高其性能和应用范围。
本文将详细介绍石墨一浸二焙的指标,并逐步回答下面的问题。
1. 石墨料浸泡的指标石墨料浸泡是指将石墨颗粒在一定的溶液中浸泡一段时间,以改善其导电性和稳定性。
在浸泡过程中,需要关注以下指标:- 浸泡液浓度:石墨颗粒在浸泡液中的浓度越高,浸泡效果可能越好。
但同时,高浓度的浸泡液可能会使石墨颗粒聚集,影响后续的焙烧步骤。
- 浸泡时间:石墨颗粒在浸泡液中浸泡的时间越长,浸泡效果可能越好。
但如果时间过长,可能会造成过度浸泡,导致石墨颗粒结构的变化。
- 浸泡温度:浸泡温度的选择和浸泡液的种类有关。
通常情况下,较高的温度可以加快浸泡过程,但过高的温度可能会引起石墨颗粒的变形。
2. 焙烧的指标焙烧是指将浸泡后的石墨料在高温下进行处理,以进一步提高其导电性和稳定性。
在焙烧过程中,需要关注以下指标:- 焙烧温度:焙烧温度的选择取决于所需的石墨颗粒性能。
通常情况下,较高的焙烧温度可以提高石墨的导电性和稳定性,但过高的温度可能会引起石墨的结构破坏。
- 焙烧时间:焙烧时间一般较长,根据不同的石墨材料和工艺条件而定。
较长的焙烧时间可以使石墨颗粒更加结实和稳定,但时间过长可能会导致纯度降低。
- 焙烧气氛:焙烧气氛的选择也很重要。
一般情况下,惰性气氛如氮气或氩气可以避免石墨颗粒的氧化和结构破坏,提高石墨的导电性和稳定性。
3. 浸泡和焙烧的影响因素浸泡和焙烧的效果受多种因素的影响,包括石墨料的性质、浸泡液的种类和浓度、浸泡时间和温度、焙烧温度和时间等。
不同的石墨料和工艺条件可能需要不同的浸泡和焙烧参数。
通过优化这些参数,可以获得具有良好导电性和稳定性的石墨颗粒。
高温焙烧对fe_(2 )的吸附特性Fe(2) 是一种含有铁的实质物质,也是高温焙烧中容易吸附的物质之一。
对于Fe(2) 的吸附特性,需要进行更深入的研究。
(一)Fe(2) 吸附机制Fe(2) 吸附在高温焙烧中主要受熔盐和气相中的有机离子、碳酸根,氧化物以及水分子等参与过程的影响。
这些参与体系的化学反应,有可能形成一种水平联络桥,在熔盐表面和Fe(2) 之间,通过立体对应关系发生化学吸附。
可以看出,Fe(2) 吸附的关键机制,是有机离子的作用所导致的水平联络桥的形成。
(二)Fe(2) 吸附和温度的关系Fe(2) 吸附的温度范围可以归结为两个主要的温度区域:室温~300℃温度区域和高于300℃温度区域。
室温~300℃温度范围内,Fe(2) 的吸附是由有机离子与Fe(2) 表面结合来实现的,吸附作用通常会受温度变化而减少,但是不会随温度显著变化。
而在高温300℃以上,Fe(2) 吸附由于氢键和氧原子的影响,会有较强的吸附作用,温度的升高会使Fe(2) 吸附的反应向右移动,从而提高Fe(2) 的吸附程度。
(三)Fe(2) 吸附和pH 的关系Fe(2) 的吸附受pH 的影响很大,pH 值对Fe(2) 的吸附具有重要作用,高pH 值会抑制Fe(2) 的吸附,低pH 值增强Fe(2) 的吸附,甚至是定性吸附发生。
特别是处于室温~300℃的温度范围内,Fe(2) 吸附的变化会受pH 的影响,但是当温度到达300℃以上之后,Fe(2) 的吸附变化就与pH 相关性不大了。
(四)Fe(2) 吸附实验对于Fe(2) 吸附的实验,研究人员使用设备模拟高温烧结反应,采集样品,进行检测分析。
他们调整了不同的温度,pH 值和熔盐浓度,用来模拟高温焙烧中Fe(2) 的吸附情况。
实验结果表明,当温度、熔盐浓度和pH 都达到一定条件时,Fe(2) 吸附率会极大地增加。
总之,Fe(2) 的吸附机制与温度、pH 的变化之间有一定的关联,为深入研究Fe(2) 吸附特性提供了有价值的依据。