化学平衡移动及常见图像分析分解
- 格式:pptx
- 大小:858.12 KB
- 文档页数:59








化学平衡图像专题(超详细版)化学平衡是化学反应中一个非常重要的概念,它描述了在封闭系统中,反应物和物之间的动态平衡状态。
在化学平衡状态下,反应物和物的浓度保持不变,尽管反应仍在进行。
为了更好地理解和应用化学平衡原理,我们可以通过图像来直观地展示和解释这一概念。
一、化学平衡图像概述1. 反应物和物浓度随时间变化的曲线图2. 反应速率随时间变化的曲线图3. 平衡常数与温度、压力等条件的关系图二、反应物和物浓度随时间变化的曲线图在化学平衡图像中,反应物和物浓度随时间变化的曲线图是最常见的一种。
这种图像可以清晰地展示出反应物和物在反应过程中的浓度变化趋势,以及它们何时达到平衡状态。
1. 反应物浓度随时间变化的曲线图:在反应初期,反应物浓度较高,随着反应的进行,反应物浓度逐渐降低。
当反应达到平衡状态时,反应物浓度不再变化,形成一条水平直线。
2. 物浓度随时间变化的曲线图:在反应初期,物浓度较低,随着反应的进行,物浓度逐渐升高。
当反应达到平衡状态时,物浓度不再变化,形成一条水平直线。
3. 反应物和物浓度随时间变化的曲线图:将反应物和物浓度随时间变化的曲线图叠加在一起,可以更直观地展示它们之间的浓度关系。
在平衡状态下,两条曲线会相交,形成一个平衡点。
三、反应速率随时间变化的曲线图反应速率随时间变化的曲线图可以展示出反应速率在反应过程中的变化趋势,以及它如何受到反应物浓度、温度、压力等条件的影响。
1. 反应速率随时间变化的曲线图:在反应初期,反应速率较快,随着反应的进行,反应速率逐渐降低。
当反应达到平衡状态时,反应速率不再变化,形成一条水平直线。
2. 反应速率与反应物浓度的关系图:反应速率通常与反应物浓度成正比,即反应物浓度越高,反应速率越快。
当反应物浓度达到一定值时,反应速率达到最大值,不再随反应物浓度变化。
3. 反应速率与温度的关系图:反应速率通常与温度成正比,即温度越高,反应速率越快。
这是因为温度升高,反应物分子运动加快,碰撞频率增加,从而提高反应速率。

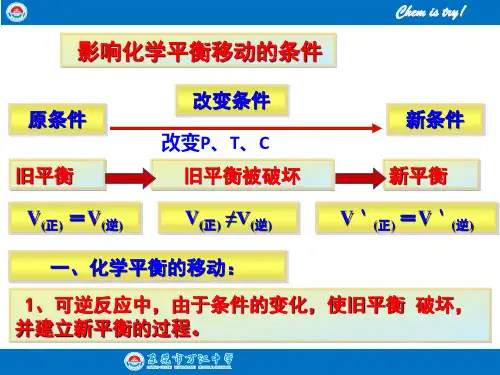
化学平衡标志、平衡移动及常见图形总结work Information Technology Company.2020YEAR可逆反应达到平衡状态的标志及判断在一定条件下的可逆反应里,当正反应速率与逆反应速率相等时,反应物和生成物的物质的量浓度不再发生改变的状态,叫化学平衡状态。
其特点有:(1)“逆”:化学平衡研究的对象是可逆反应。
(2)“等”:化学平衡的实质是正、逆反应速率相等,即:v(=v(逆)。
正)=v(逆) ≠0(3)“动”:v(正)(4)“定”:平衡体系中,各组分的浓度、质量分数及体积分数保持一定(但不一定相等),不随时间的变化而变化。
(5)“变”:化学平衡是在一定条件下的平衡,若外界条件改变,化学平衡可能会分数移动。
(6)“同”:在外界条件不变的前提下,可逆反应不论采取何种途径,即不论由正反应开始还是由逆反应开始,最后所处的平衡状态是相同的,即同一平衡状态。
可逆反应达到平衡状态的标志及判断方法如下:以m A(g) + n B(g) p C(g)+ q D(g)为例:一、直接标志:①速率关系:正反应速率与逆反应速率相等,即:A消耗速率与A的生成速率相等,A消耗速率与C的消耗速率之比等于m : p;②反应体系中各物质的百分含量保持不变。
二、间接标志:①混合气体的总压强、总体积、总物质的量不随时间的改变而改变(m + n≠p + q);②各物质的浓度、物质的量不随时间的改变而改变;③各气体的体积、各气体的分压不随时间的改变而改变。
对于密闭容器中的可逆反应:m A(g) + n B(g) p C(g)+ q D(g)是否达到平衡还可以归纳如下表:化学反应m A(g) + n B(g) p C(g)+ q D(g) 是否平衡混合物体系中各成分的含量①各物质的物质的量或物质的质量分数一定平衡②各物质的质量或质量分数一定平衡③各气体的体积或体积分数一定平衡④总体积、总压强、总物质的量一定不一定平衡正、逆反应速率之间的关系①在单位时间内消耗了m mol A,同时也生成了mmol A,即v(正) = v(逆)平衡②在单位时间内消耗了n mol B,同时也消耗了pmol C,即v(正) =v(逆)平衡③v(A) : v(B) : v(C) : v(D) =m : n : p :q,v(正) 不一定等于v(逆)不一定平衡④在单位时间内生成了n mol B,同时也消耗了qmol D,即叙述的都是v(逆)不一定平衡压强①其它条件一定、总压强一定,且m + n≠p + q平衡②其它条件一定、总压强一定,且m + n=p + q不一定平衡混合气体的平均相对分子质量①平均相对分子质量一定,且m + n≠p + q平衡②平均相对分子质量一定,且m + n=p + q不一定平衡温度任何化学反应都伴随着能量变化,当体系温度一定时平衡气体的密度密度一定不一定平衡颜色反应体系内有色物质的颜色稳定不变平衡三、例题分析:【例题1】可逆反应:2NO2(g) 2NO(g) + O2(g),在体积固定的密闭容器中,达到平衡状态的标志是①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2 : 2 : 1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态A. ①④⑥⑦B. ②③⑤⑦C. ①③④⑤D. 全部解析:①单位时间内生成n mol O2必消耗2n mol NO2,而生成2n mol NO2时,必消耗n mol O2,能说明反应达到平衡;②不能说明;③中无论达到平衡与否,化学反应速率都等于化学计量系数之比;④有颜色的气体颜色不变,则表示物质的浓度不再变化,说明反应已达到平衡;⑤体积固定,气体质量反应前后守恒,密度始终不变;⑥反应前后△V ≠ 0,压强不变,意味着各物质的含量不再变化;⑦由于气体的质量不变,气体的平均相对分子质量不变时,说明气体中各物质的量不变,该反应△V ≠ 0,能说明该反应达到平衡。
第5讲用图像分析化学反应速率和平衡移动化学平衡的图像分析方法及思路1.看懂图像:看点:原点、拐点、交点,定量图像中点的数量关系看线:走向、变化趋势,未体现出的关系可作辅助线:等温线、等压线看面:横、纵坐标轴的意义2.联想规律:准确熟练地联想外界条件对化学反应速率、化学平衡的影响规律3.作出判断:①“先拐先平数值大”原则;②“定一议二”原则。
例.对反应aA(g)+bB(g) cC(g) △H ,有A、B两图的实验结果,判断a、b、c的关系和△H的符号。
【解析】A图是不同温度下,产物C的分数随时间的变化曲线。
“先拐先平数值大”原则:温度越高,反应速率越快,先达到平衡,∴T2>T1。
“定一议二”原则:将时间定为平衡后的的某一时刻,T1温度下的平衡变为T2温度下的平衡:T1→T2,升高温度,平衡向吸热方向移动(勒沙特列原理);C1% →C2%,C的分数减小,平衡向逆反应方向移动(已知反应);∴逆反应方向是吸热方向,即正反应方向是放热方向,即△H<0 。
B图是不同压强下,反应物A的分数随时间的变化曲线。
“先拐先平数值大”原则:压强越高,反应速率越快,先达到平衡,∴p2>p1。
“定一议二”原则:将时间定为平衡后的的某一时刻,p1压强下的平衡变为p2压强下的平衡:p1→p2,增大压强,平衡向气体体积减小的方向移动(勒沙特列原理);A1% →A2%,A的分数减小,平衡向正反应方向移动(已知反应);∴正反应方向是气体体积减小方向,即a + b > c。
例1.某可逆反应:3A(g)+B(g)2C(g)在温度分别为t1和t2 ,压强分别为p1和p2的条件下得到C的物质的量n与时间t的关系如图,下列判断中正确的是()A.p1>p2,正反应为放热反应B.p2>p1,正反应为放热反应C.p2>p1,逆反应为吸热反应D.p1>p2,逆反应为放热反应【答案】BC【解析】温度为t2时,压强p2时先到平衡,所以p2>p1。