化学平衡常见图像分析完整版
- 格式:docx
- 大小:64.28 KB
- 文档页数:3
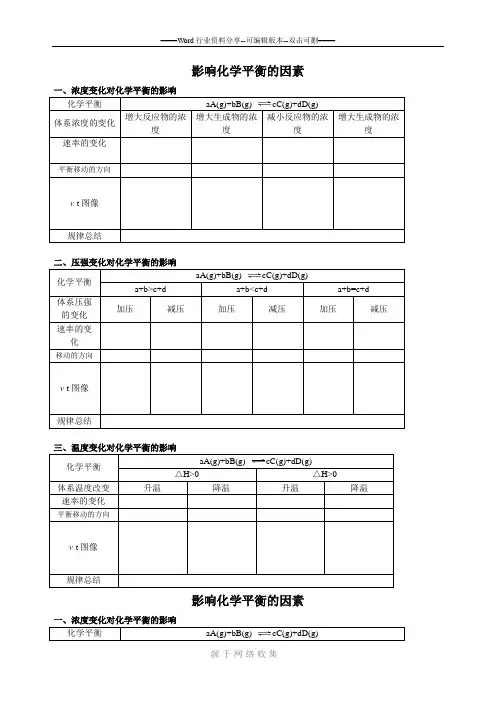
影响化学平衡的因素一、浓度变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)体系浓度的变化增大反应物的浓度增大生成物的浓度减小反应物的浓度增大生成物的浓度速率的变化平衡移动的方向v-t图像规律总结二、压强变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)a+b>c+d a+b<c+d a+b=c+d体系压强的变化加压减压加压减压加压减压速率的变化移动的方向v-t图像规律总结三、温度变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)△H>0 △H>0体系温度改变升温降温升温降温速率的变化平衡移动的方向v-t图像规律总结影响化学平衡的因素化学平衡aA(g)+bB(g)cC(g)+dD(g)体系浓度的变化增大反应物的浓度增大生成物的浓度减小反应物的浓度增大生成物的浓度速率的变化平衡移动的方向v-t图像规律总结二、压强变化对化学平衡的影响化学平衡aA(g)+bB(g)cC(g)+dD(g)a+b>c+d a+b<c+d a+b=c+d体系压强的变化加压减压加压减压加压减压速率的变化移动的方向v-t图像规律总结化学平衡aA(g)+bB(g)cC(g)+dD(g)△H>0 △H>0体系温度改变升温降温升温降温速率的变化平衡移动的方向v-t图像规律总结。




or personal use only in study and research; not for commercial use化学平衡图像专题解题思路:一看轴(纵、横坐标的意义),二看线(线的走向和变化趋势),三看点(起点、折点、交点、终点、零点的意义),四看要不要作辅助线(等温线、等压线、平衡线),五看量的变化(如浓度变化、温度变化等),六想规律(外界条件对反应速率的影响规律和化学平衡移动规律)1. 速率-时间图1. 对于达平衡的可逆反应X+Y W+Z,增大压强则正、逆反应速度(v)的变化如上图,分析可知X,Y,Z,W的聚集状态可能是()。
(A)Z,W为气体,X,Y中之一为气体(B)Z,W中之一为气体,X,Y为非气体(C)X,Y,Z皆为气体,W为非气体(D)X,Y为气体,Z,W中之一为气体2. 在一定条件下,反应A(g)+B(g)C(g)(正反应为放热反应)达到平衡后,根据下列图象判断A. B. C. D.E.(1)升温,达到新的平衡的是( )(2)降压,达到新的平衡的是( )(3)减少C的量,移向新平衡的是( )(4)增加A的量,移向新平衡的是( )(5)使用催化剂,达到平衡的是( ) 2. 浓度(物质的量)-时间图3. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图,下列表述中正确的是()A.反应的化学方程式为:2 M NB.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率 D.t1时,N的是M浓度的2倍3. 含量-时间-温度(压强)图4. 可逆反应m A(s)+n B(g ) e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是()。
(A)达平衡后,加入催化剂则C%增大(B)达平衡后,若升温,平衡左移(C)化学方程式中n>e+f(D)达平衡后,增加A的量有利于平衡向右移动5. 在密闭容器中进行下列反应:M(g)+N(g )R(g)+2L此反应符合下面图像,下列叙述是正确的是()(A) 正反应吸热,L是气体(B) 正反应吸热,L是固体(C) 正反应放热,L是气体(D) 正反应放热,L是固体或液体6. 可逆反应m A(s) + n B(g) p C(g) + q D(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中正确的是()(A)到达平衡后,若使用催化剂,C的质量分数增大(B)平衡后,若升高温度,平衡则向逆反应方向移动(C)平衡后,增大A的量,有利于平衡向正反应方向移动(D)化学方程式中一定n>p+q7. 现有可逆反应A(气)+B(气)3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则__ _曲线是表示有催化剂时的情况。





化学平衡图像专题(超详细版)化学平衡是化学反应中一个非常重要的概念,它描述了在封闭系统中,反应物和物之间的动态平衡状态。
在化学平衡状态下,反应物和物的浓度保持不变,尽管反应仍在进行。
为了更好地理解和应用化学平衡原理,我们可以通过图像来直观地展示和解释这一概念。
一、化学平衡图像概述1. 反应物和物浓度随时间变化的曲线图2. 反应速率随时间变化的曲线图3. 平衡常数与温度、压力等条件的关系图二、反应物和物浓度随时间变化的曲线图在化学平衡图像中,反应物和物浓度随时间变化的曲线图是最常见的一种。
这种图像可以清晰地展示出反应物和物在反应过程中的浓度变化趋势,以及它们何时达到平衡状态。
1. 反应物浓度随时间变化的曲线图:在反应初期,反应物浓度较高,随着反应的进行,反应物浓度逐渐降低。
当反应达到平衡状态时,反应物浓度不再变化,形成一条水平直线。
2. 物浓度随时间变化的曲线图:在反应初期,物浓度较低,随着反应的进行,物浓度逐渐升高。
当反应达到平衡状态时,物浓度不再变化,形成一条水平直线。
3. 反应物和物浓度随时间变化的曲线图:将反应物和物浓度随时间变化的曲线图叠加在一起,可以更直观地展示它们之间的浓度关系。
在平衡状态下,两条曲线会相交,形成一个平衡点。
三、反应速率随时间变化的曲线图反应速率随时间变化的曲线图可以展示出反应速率在反应过程中的变化趋势,以及它如何受到反应物浓度、温度、压力等条件的影响。
1. 反应速率随时间变化的曲线图:在反应初期,反应速率较快,随着反应的进行,反应速率逐渐降低。
当反应达到平衡状态时,反应速率不再变化,形成一条水平直线。
2. 反应速率与反应物浓度的关系图:反应速率通常与反应物浓度成正比,即反应物浓度越高,反应速率越快。
当反应物浓度达到一定值时,反应速率达到最大值,不再随反应物浓度变化。
3. 反应速率与温度的关系图:反应速率通常与温度成正比,即温度越高,反应速率越快。
这是因为温度升高,反应物分子运动加快,碰撞频率增加,从而提高反应速率。
化学平衡常见图像分析集团标准化办公室:[VV986T-J682P28-JP266L8-68PNN]
化学平衡常见图像分析
化学平衡图像问题的综合性强,思维难度大,是许多学生感到困难的题型之一。
化学平衡图像题的特征是以图像的形式将一些相关量之间的关系通过形象直观的曲线表示出来,把习题中的化学原理抽象为数学问题,旨在考查学生对曲线的数学意义和化学意义之间对应关系的分析、理解和运用能力。
一、化学平衡常见图像及其分析
图像I:
图像分析:
(1)若a、b无断点,则平衡移动肯定是改变某一物质的浓度导致。
(2)若a、b有断点,则平衡移动可能是由于以下原因所导致:①同时不同程度地改变反应物(或生成物)的浓度;②改变反应体系的压强;③改变反应体系的温度。
(3)若平衡无移动,则可能是由于以下原因所导致:①反应前后气体分子个数不变;②使用了催化剂。
(4)若在的上方,即平衡向正反应方向移动;若在的上方,即平衡向逆反应方向移动。
图像II:
图像分析:
(1)由曲线的拐点作垂直于时间轴(t线)的垂线,其交点即为该条件下达到平衡的时间。
(2)由达到平衡的时间长短,推断与、与的相对大小(对于此图像:、)。
(3)由两平衡时,不同p、T下的量的变化可判断纵坐标y代表的物理量。
图像III:
图像分析:
(1)固定温度T(或压强p),即作横坐标轴的垂线,观察分析图中所示各物理量随压强p(或温度T)的变化结果。
(2)关键是准确判断所作垂线与原温度(或压强)曲线的交点的纵坐标。
(3)y可以是某物质的质量分数、转化率、浓度、浓度比值、体积分数、物质的量分数等。
图像IV:
图像分析:
(1)温度为点为化学平衡点。
(2)温度段是随温度(T)升高,反应速率加快,产物的浓度增大或反应物的转化率增大。
(3)温度段是随温度升高平衡向吸热反应方向移动的结果。
二、解答化学平衡图像问题的技巧
在解答化学平衡图像问题时,要注意技巧性方法的应用。
1、“先拐先平,数值大”:在含量—时间曲线中,先出现拐点的,则先达到化学平衡状态,说明该曲线的温度较高或压强较大;
2、“定一议二”:在含量—温度(或压强)曲线中,图像中有三个变量,先确定一个量不变,再讨论另外两个量的关系(因为化学平衡移动原理只适用于外界“单因素”的改变,导致的平衡移动的分析),即确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后(通常作一条横坐标的垂线),讨论横坐标与曲线的关系。
三、典型考题例析
例:下图是温度和压强对X+Y2Z反应影响的示意图。
图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
下列叙述正确的是()
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的
解析:根据题目中的图像,在压强不变的情况下,例如1000kPa,随着温度的升高,Z的体积分数增大,即随着温度的升高,平衡向正反应方向移动。
所以,正反应为吸热反应,;逆反应为放热反应,,故A、D项错误。
同样,在温度不变的情况下,从1000→100→10kPa,随着压强的减小,Z的体
积分数增大,即随着压强的减小,平衡向正反应方向移动,正反应为气体体积增大的反应,所以C项正确。
答案:C
三、典型考题例析
例:下图是温度和压强对X+Y2Z反应影响的示意图。
图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。
下列叙述正确的是()
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种是气态,Z为气态
D.上述反应的逆反应的。