GMP自检记录表(2010版)
- 格式:doc
- 大小:475.69 KB
- 文档页数:48

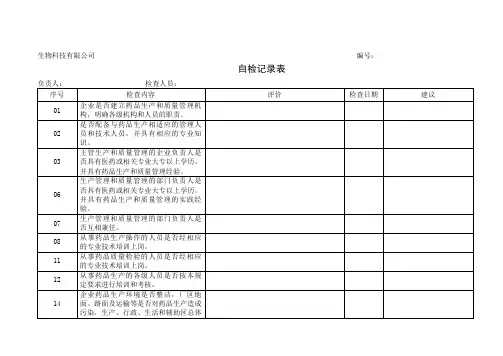
一、机构与人员在实施GMP的过程中,组织机构是组织保证,人员是执行主体,培训是重要环节,这是实施GMP的先决条件之一。
企业必须建立适合自身实际的组织机构,明确各部门的职能及各岗位的职责,并配备专业、学历、经验符合相应岗位要求、经培训考核合格的人员,为顺利实施GMP做好组织与人员方面的保障。
因此在进行质量体系内部审计时应重点检查:1、组织机构设置是否合理;2、部门职能、岗位职责是否明确;3、是否按组织机构配备相应的人员;4、各岗位的人员素质是否规范要求;5、各级人员是否进行了相关培训并建立培训档案;(1)是否制定和执行培训计划、(2)培训是否涉及所有人员、(3)是否分层次进行培训、(4)是否建立了人员培训档案、(5)是否进行岗前培训、(6)是否进行在岗培训、(7)任务变化后、(岗位调动后)的是否进行相关培训、(8)培训考核不合格人员的是否进行再培训、(9)是否持证上岗(10)员工能否胜任本职工作、(11)培训记录是否完整、(12)培训效果评价二、厂房与设施厂房和设施是实施GMP管理最根本的条件之一,厂房的位置、设计、建筑、改建、养护及设施的选型、安装、运行(使用)、维护保养等都应能满足工艺生产的要求,为避免产生交叉污染、混淆、差错以及灰尘、污垢的产生与聚集,厂房的布局、设计与设施的选型、安装等都应使产生差错的危险减到最低限度,并应考虑便于清洁和养护。
因此在进行质量体系内部审计时应重点检查:厂区总体布局是否合理;生产厂房A、设计、布局是否满足工艺要求;B、是否有足够的面积和空间;C、生产操作是否互相影响;D、是否有防止外界异物进入的设施;洁净区内表面是否光滑、密封;设施是否能避免产生或聚集尘埃,便于清洁;照度、温度、湿度是否符合要求;空气是否经过净化并定期监测;人员与物料的净化设施是否合理;特殊操作间是否有相应防止交叉污染的设施及措施;储存区面积与空间是否与生产规模相适应;各状态物料存放是否能防止交叉污染与差错;检验区是否与生产区分开;生物检定与微生物检定是否分开;特殊要求设备、仪器是否有相应设施;实验动物房是否符合国家规定。

gmp自检表在实施GMP的过程中,组织机构是组织包管,人员是履行主体,培训是重要环节,这是实施GMP的先决前提之一。
企业必须建立合适自身实际的组织机构,明白各部分的本能机能及各岗亭的职责,并配备专业、学历、体会相符响应岗亭要求、经培训考察合格的人员,为顺利实施GMP做好组织与人员方面的保证。
是以在进行质量体系内部审计时应重点检查:1、组织机构设置是否合理;2、部分本能机能、岗亭职责是否明白;3、是否按组织机构配备响应的人员;4、各岗亭的人员本质是否规范要求;5、各级人员是否进行了相干培训并建立培训档案;(1)是否制订和履行培训筹划、(2)培训是否涉及所有人员、(3)是否分层次进行培训、(4)是否建立了人员培训档案、(5)是否进行岗前培训、(6)是否进行在岗培训、(7)义务变更后、(岗亭调动后)的是否进行相干培训、(8)培训考察不合格人员的是否进行再培训、(9)是否持证上岗(10)职员可否胜任本职工作、(11)培训记录是否完全、(12)培训后果评判二、厂房与举措措施厂房和举措措施是实施GMP治理最全然的前提之一,厂房的地位、设计、建筑、改建、养护及举措措施的选型、安装、运行(应用)、爱护保养等都应能知足工艺临盆的要求,为幸免产生交叉污染、混淆、缺点以及尘土、污垢的产生与集合,厂房的构造、设计与举措措施的选型、安装等都应使产生缺点的危险减到最低限度,并应推敲便于洁净和养护。
是以在进行质量体系内部审计时应重点检查:厂区总体构造是否合理;临盆厂房A、设计、构造是否知足工艺要求;B、是否有足够的面积和空间;C、临盆操作是否互相阻碍;D、是否有防止外界异物进入的举措措施;洁净区表里面是否滑腻、密封;举措措施是否能幸免产生或集合尘埃,便于洁净;照度、温度、湿度是否相符要求;空气是否经由净化并按期监测;人员与物料的净化举措措施是否合理;专门操作间是否有响应防止交叉污染的举措措施及方法;储存区面积与空间是否与临盆范畴相适应;各状况物料存放是否能防止交叉污染与缺点;考查区是否与临盆区分开;生物检定与微生物检定是否分开;专门要求设备、仪器是否有响应举措措施;实验动物房是否相符国度规定。



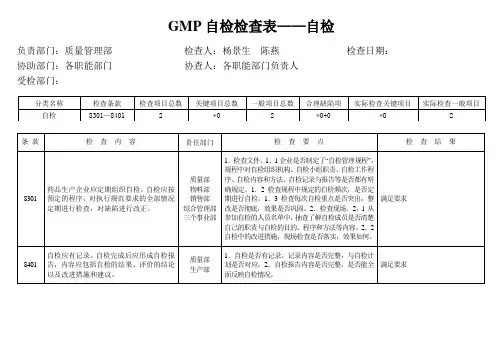

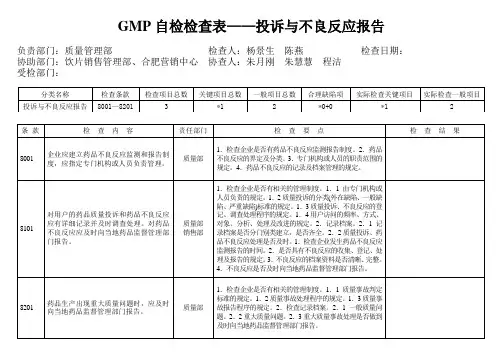
GMP⾃检检查表**制药有限公司药品GMP⾃检检查表⾃检项⽬:机构与⼈员、⼚房、设施、设备、物料、卫⽣、⽣产管理、《药品⽣产质量管理规范》(2010年版)部分内容⾃检⼩组:第⼀⼩组组长:成员:条款检查内容⾃检要点检查结果备注⼀、组织机构与职能:要点:1、组织机构设置应合理;2、部门职能、岗位职责应明确;3、应按组织机构要求配备相应⼈员;4、⼈员素质应符合规范要求。
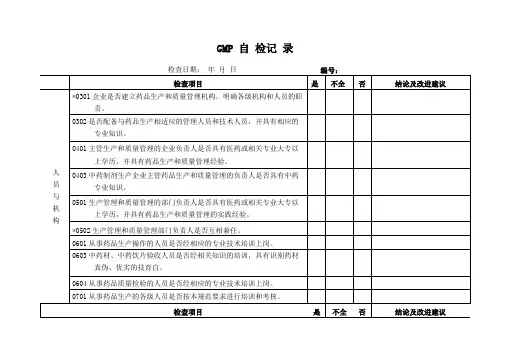
*0301企业应建⽴药品⽣产和质量管理机构,明确各级机构和⼈员的职责。
1.查企业组织机构图是否与现⾏机构相符;2. 查总经理岗位是否明确对企业的产品质量负责。
查各部门⼈员职责、部门职能是否明确合理。
0302 企业应配备⼀定数量的与药品⽣产相适应的具有相应的专业知识、⽣产经验及⼯作能⼒,应能正确履⾏其职责的管理⼈员和技术⼈员。
1.查各级管理⼈员是否有公司任命书;2.查管理⼈员和技术⼈员的学历、专业、资历。
*0401 主管⽣产和质量管理的企业负责⼈应具有医药或相关专业⼤专以上学历,并具有药品⽣产和质量管理经验,应对本规范的实施和产品质量负责。
查主管⽣产和质量管理的企业负责⼈的学历、专业、资历。
*0501 ⽣产管理和质量管理的部门负责⼈应具有医药或相关专业⼤专以上学历,并具有药品⽣产和质量管理的实践经验,有能⼒对药品⽣产和质量管理中的实际问题作出正确的判断和处理。
1.查主管⽣产和质量管理的部门经理的学历、专业、资历;2.现场询问⽣产或质量管理的部门经理有关⽣产质量管理的相关知识。
*0502 药品⽣产管理部门和质量管理部门负责⼈不得互相兼任。
查⽣产部经理、质量部经理的任命⽂件。
⼆、培训:要点:各级⼈员应进⾏相关培训并建⽴培训档案;1、应制定和执⾏培训计划;2、培训应涉及所有⼈员;3、应分层次培训;4、应建⽴培训档案;5、培训不合格⼈员应进⾏再培训;6、应持证上岗0601企业应建有对各级员⼯进⾏本规范和专业技术、岗位操作知识、安全知识等⽅⾯的培训制度、培训计划和培训档案。
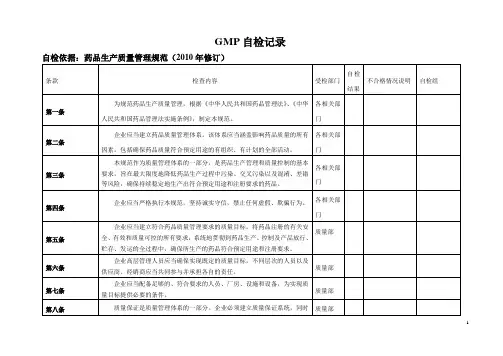
GMP自检记录自检日期受检部门检查项目检查要求检查结果人 1. 有GMP培训管理制度及培训计划。
员 2. 有培训教案和培训记录及培训考核情况。
培 3. 对维修人员、辅助人员的洁净区卫生管理方面,微生物知识、洁净作业训等方面应有培训记录及考核。
厂4. 有厂区平面示意图,卫生区域划分图,仓储平面图。
房5. 主要道路应畅通,路面平整,无堆放物,生产区周围无花絮飞扬。
与厂区环6. 厂区内无积水,杂草、垃圾、蚊蝇滋生地,有厂区环境卫生管理制度。
设境 7. 检查厂区下水道畅通及排水情况。
施 8. 检查水源供给情况是否良好。
9. 对卫生间应有特殊要求,有管理制度。
厂 10. 有车间平面示意图及工艺布局图。
11. 进入生产区的人流、物流要符合要求,进入洁净区均需净化和缓冲。
房12. 有工艺用水管理配制图。
13. 检查洁净区的内表面,应平整光滑,无缝隙,接口严密,无脱落物,耐与受清洗消毒,棚面与墙面,墙与地面成弧形,并密封好。
14. 穿墙管线应暗装并密封。
设 15. 厂房应有防止昆虫和其它动物进入的设施。
16. 洁净室(区)内,使用无脱落物,易清洗、易消毒的卫生工具,限定区施厂房布域使用及存放。
局 17. 储存及物料、中间产品、待验品的存放应明确,有防止差错和交叉污染的措施。
18. 洁净室(区)内各种管道、灯具、风口等公用设施是否有不易清洁部位,照度是否符合要求。
19. 厂房应有应急照明设施。
20. 照度、应急灯、洁净级别不同的相邻房间之间的静压差,温度、相对温度应符合规范要求。
21. 洁净区的水池、地漏应易清洁消毒并不得对环境产生污染。
22. 10000级洁净室使用的传输设备是否穿越较低级别区域。
23. 空气净化系统的尘埃数,微生物数,温度相对湿度、压差监测结果,应有记录并存档。
空气净24. 有洁净室的监测制度和检测规程。
化系统 25. 空气净化系统应按规定清洁、维修、保养并做记录。
26. 与药品直接接触的干燥用空气、压缩空气是否经净化处理。