2015届高考化学(二轮复习)专题训练:物质的量浓度.pdf
- 格式:pdf
- 大小:79.01 KB
- 文档页数:3

第1章 第节 [热点集训] .下列溶液中,溶质的物质的量浓度为1 mol·L-1的是将40 g NaOH溶于1 L水所得的溶液将80 g SO溶于水并配成1 L的溶液将0.5 mol·L-1的NaNO溶液100 mL加热蒸发掉50 g水的溶液含K+为2 mol的K溶液解析 A项溶液体积不为1 L,B项生成1 mol H,C项溶液体积不是50 mL,D项缺少溶液体积。
答案 B下列溶液中,跟100 mL 0.5 mol·L-1溶液中所含的Cl-物质的量浓度相同的是-1溶液-1溶液-1溶液-1溶液解析 物质的浓度与溶液的体积无关,100 mL 0.5 molL-1溶液中(Cl-)=0.5 mol·L-1,而A、B、C、D项中,(Cl-)分别为1 mol·L-1,0.75 mol·L-1,-1,0.5 mol·L-1,故D项正确。
答案 D容量瓶上需要标有:①温度,②浓度,③容量,④压强,刻度线,⑥碱式或酸式六项中的 B.②④⑥容量瓶上标有温度、容量和刻度线。
答案 A在80 g密度为·cm-3的硫酸铁溶液中,含有2.8 g Fe+,则此溶液中SO的物质的量浓度(mol·L-1)为d B.dC.dD.d 解析 (Fe3+)0.05 mol,[Fe2(SO4)3]=0.025 mol,(SO)=0.075 mol,(溶液)=,(SO)===-1。
答案 A某同学用Na配制0.10 mol·L-1(aq),其称量操作如下图所示,最终配制溶液的浓度 A.偏高 B.偏低可能偏高也可能偏低 D.准确解析 结合天平称量规则,实际称得样品的质量为,最终浓度偏低。
答案 B有下列化学仪器:托盘天平 ②玻璃棒 ③药匙 ④烧杯 ⑤量筒 容量瓶 ⑦胶头滴管1)现需要配制500 mL 1 mol·L-1溶液,需要质量分数为98%、密度为1.84 g·cm-3的浓H________ mL。

1.下列关于物质的量浓度表述正确的是( )-1的Na溶液中含有Na+和SO的总物质的量为0.9 mol水吸收22.4L氨气时所得氨水的浓度是1 mol·L-1在K和NaCl的中性混合水溶液中如果Na+和SO的K+和Cl-的物质的量浓度一定相同时 0.35 mol·L-1的KCl饱和溶液蒸发掉5 g水冷却到10 ℃时其体积小于100 mL它的物质的量浓度仍为0.35mol·L-1答案:D下列溶液中跟100 mL 0.5 mol/L NaCl溶液中所含的Cl-物质的量浓度相同的是( )溶液溶液l溶液溶液答案:D(SO4)3溶液中含Fe3+溶液中SO的物质的量浓度是( )A. mol/LB. mol/LC. mol/LD. mol/L 答案:D(2014·河南省豫北五校质量检测)向质量分数为2体积为10 mL物质的量浓度为-1的稀H中加入的水使之质量分数变为此时物质的量浓度为-1则下列关系正确的是( A.V>10 2= 2 2 2解析:选C。
因为水的密度小于稀H要使10 mL稀H中溶质质量分数由2变为则所加水的体积大于10 mL;由=可知当稀H中溶质质量分数时其密度也变小故其物质的量浓度小于原来的故选项C正确。
利用碳酸钠晶体(Na)来配制0.5 mol·L-1的碳酸钠溶液1 000 mL假如其他操作均是准确无误的下列情况会引起配制溶液的浓度偏高的是( )称取碳酸钠晶体100 g定容时俯视观察刻度线移液时对用于溶解碳酸钠晶体的烧杯没有进行洗涤定容后将容量瓶振荡均匀解析:选B。
A项碳酸钠晶体质量应为143 g所以结果偏低;B项俯视观察时液面低于刻度线溶液体积偏小浓度偏大;C项中不洗涤烧杯会损失溶质导致结果偏低;D项摇匀后发现液面低于刻度线是由于液体沾在瓶壁和磨口处所致不会造成偏差若加水则使所配溶液浓度偏低。
在时将完全溶于水得到溶液假设该溶液的密度为-1w,其中含有NH的物质的量是下列叙述正确的是( )溶质的质量分数=溶质的物质的量浓度=-1溶液中(OH-)=-1+(H+)向上述溶液中加入水所得溶液的质量分数大于0.5解析:选C。

第二单元 物质的量浓度 一、选择题 1.下列溶液中溶质的物质的量浓度为1 mol·L-1的是( ) A.将58.5 g NaCl溶解于1 L水中配成的溶液 B.将80 g SO3溶于水并配成1 L溶液 C.将0.5 mol·L-1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液 D.含K+为2 mol的K2SO4溶液 解析 A中“1 L水”,溶液体积不一定为1 L;C中蒸发掉50 g水后,溶液的体积不一定是50 mL;D中未指明溶液体积。
答案 B 2.实验中需用2.0 mol·L-1的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为( ) A.950 mL;201.4 g B.1 000 mL;212.0 g C.100 mL;21.2 g D.500 mL;100.7 g 解析 实验室中没有950 mL容量瓶,故只能配制1 000 mL 2.0 mol·L-1的Na2CO3溶液。
答案 B 3. 答案 D 4.某同学用Na2CO3配制0.10 mol·L-1的500 mL Na2CO3溶液的过程如图所示: 你认为该同学的错误步骤有( ) A.1处 B.2处 C.3处 D.4处 解析 两处错误:在第③步后要有摇匀,定容时视线要与凹液面平齐。
答案 B 5.300 mL Al2(SO4)3溶液中,含Al3+为1.62 g,在该溶液中加入0.1 mol·L-1 Ba(OH)2溶液300 mL,反应后溶液中SO的物质的量浓度为( ) A.0.4 mol·L-1 B.0.3 mol·L-1 C.0.2 mol·L-1 D.0.1 mol·L-1 答案 D 6. 解析 B项,如下图1所示,定容后液面高于容量瓶的刻度线,溶液体积偏大,NaOH物质的量浓度偏小;C项,如图2所示,情况与B项相反;A、D两项易判断会偏小。

开卷速查 规范特训课时作业 实效精练 题组一 物质的量浓度的含义及根据cB=的计算 1.观察两个试剂瓶上的标签,回答下列问题。
5%硫酸铜溶液 0.4 mol·L-1 NaCl溶液 (1)“5%硫酸铜溶液”中的5%是什么含义。
______________________________________________________________________________________。
(2)0.4 mol·L-1 NaCl溶液中的0.4 mol·L-1表示的含义是什么?____________________________________________________________________。
(3)从上述两种溶液中分别取出5 mL,硫酸铜溶液的质量分数为_____,NaCl溶液的浓度为________。
答案:(1)5%表示硫酸铜溶液的质量分数,即100 g硫酸铜溶液中含有5 g硫酸铜溶质。
(2)1 L该NaCl溶液中所含NaCl的物质的量是0.4 mol。
(3)5% 0.4 mol·L-1 2.在80 g密度为d g·cm-3的硫酸铁溶液中,含有2.8 g Fe3+,则此溶液中SO的物质的量浓度(mol·L-1)为( )A.dB.dC.dD.d 解析:n(Fe3+)=0.05 mol,n[Fe2(SO4)3]=0.025 mol,n(SO)=0.075 mol,V(溶液)= L,c(SO)=。
答案:A 题组二 关于物质的量浓度、质量分数、溶解度的换算 3.在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g·cm-3,质量分数为w,物质的量浓度为c mol·L-1,溶液中含氢氧化钠的质量为m g。
(1)用w来表示该温度下氢氧化钠的溶解度(S)为________。
(2)用m、V表示溶液中溶质的物质的量浓度(c)为________。
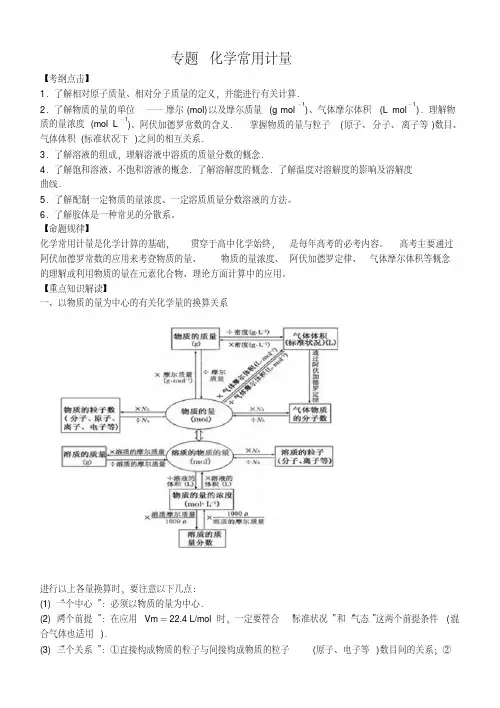
专题化学常用计量【考纲点击】1.了解相对原子质量、相对分子质量的定义,并能进行有关计算.2.了解物质的量的单位——摩尔(mol)以及摩尔质量(g·m ol-1)、气体摩尔体积(L·mol-1).理解物质的量浓度(mol·L-1)、阿伏加德罗常数的含义.掌握物质的量与粒子(原子、分子、离子等)数目、气体体积(标准状况下)之间的相互关系.3.了解溶液的组成,理解溶液中溶质的质量分数的概念.4.了解饱和溶液、不饱和溶液的概念.了解溶解度的概念.了解温度对溶解度的影响及溶解度曲线.5.了解配制一定物质的量浓度、一定溶质质量分数溶液的方法。
6.了解胶体是一种常见的分散系。
【命题规律】化学常用计量是化学计算的基础,贯穿于高中化学始终,是每年高考的必考内容。
高考主要通过阿伏加德罗常数的应用来考查物质的量、物质的量浓度、阿伏加德罗定律、气体摩尔体积等概念的理解或利用物质的量在元素化合物、理论方面计算中的应用。
【重点知识解读】一、以物质的量为中心的有关化学量的换算关系进行以上各量换算时,要注意以下几点:(1)“一个中心”:必须以物质的量为中心.(2)“两个前提”:在应用Vm=22.4 L/mol时,一定要符合“标准状况”和“气态”这两个前提条件(混合气体也适用).(3)“三个关系”:①直接构成物质的粒子与间接构成物质的粒子(原子、电子等)数目间的关系;②摩尔质量与相对分子质量的关系;③强电解质、弱电解质、非电解质与溶质粒子(分子或离子)数之间的关系.(4)“四个无关”:物质的量、质量、粒子数的多少均与温度、压强的高低无关;物质的量浓度的大小与所取该溶液的体积多少无关(但溶质粒子数的多少与溶液体积有关).二、阿伏加德罗定律及其推论1.定律同温同压下,相同体积的任何气体都含有相同数目的分子.2.推论(1)同温同压下,气体的体积之比等于气体的物质的量之比,即V 1∶V 2=n 1∶n 2.(2)同温同压下,两种不同气体的密度之比等于气体的摩尔质量之比,即ρ1∶ρ2=M 1∶M 2.(3)同温同压下,同体积的任何气体的质量之比等于气体的摩尔质量之比,即m 1∶m 2=M 1∶M 2.(4)同温同压下,同质量的任何气体的体积之比与其摩尔质量成反比,即V 1∶V 2=M 2∶M 1.(5)同温同体积下,气体的压强之比等于气体的物质的量之比,即p 1∶p 2=n 1∶n 2.注意:(1)1 mol 任何粒子的数目为阿伏加德罗常数,其不因温度、压强等条件的改变而改变.(2)应用阿伏加德罗定律及其推论时,首先要判断物质在所给温度和压强下是否为气体,若物质为非气态则不能应用阿伏加德罗定律.(3)阿伏加德罗定律既适用于单一气体,也适用于混合气体.若为混合气体,则组成成分间不能发生化学反应,如2NO +O 2 === 2NO 2不适用.三、物质的量浓度的计算与换算1.物质的量浓度与溶质质量分数之间的换算c B =n/v =m/MV =m aq w/MV =1000ρw/M w =c B M/1000ρ2.物质的量浓度与溶解度(S)的换算c =n/v =1000ρS/M(100+S) 3.质量分数与溶解度之间的换算饱和溶液中:w =S/(100+S)×100%4.气体溶质溶于水中制得溶液,其物质的量浓度的计算在标准状况下, 1 L 水中溶解某气体V L ,所得溶液密度为ρ,则:c =n/v =1000ρ1000×1+V/22.4×M=22400+MV 1000ρVw =m 溶质/m 溶液×100%=1000×1+V/22.4×M V/22.4×M×100%=22400+MV MV×100% 5.稀释定律(1)如用V 1、V 2、c 1、c 2分别表示稀释前后溶液的体积和物质的量浓度,有:c 1V 1=c 2V 2. (2)如用m 1、m 2、w 1、w 2分别表示稀释前后溶液的质量和质量分数,有:m 1w 1=m 2w 2.注意:同一溶质不同浓度的溶液混合后溶质质量分数的判断方法:设溶质质量分数分别为w 1和w 2的两溶液混合所得溶液的质量分数为w.(1)两溶液等质量混合,则w =(w 1+w 2)/2.(2)两溶液等体积混合:①若溶液中溶质的密度大于溶剂的密度,则w> (w 1+w 2)/2.如:H 2SO 4溶液.②若溶液中溶质的密度小于溶剂的密度,则w< (w1+w2)/2.如:氨水、酒精溶液.【考点突破】考点一以物质的量为核心的计算考点二阿伏加德罗常数的应用有关阿伏加德罗常数的应用问题,实质上是以物质的量为中心的各物理量间的换算,需要特别注意的主要有:1.条件:考查气体时经常给定非标准状况,如常温常压下(1.01×105 Pa、25℃时)等。

专题四* 物 质 的 量一.考点梳理1.理解物质的量(n )、摩尔质量(M )、阿伏加德罗常数(N A )、气体摩尔体积(V m )及物质的量浓度(C B )等重要概念。
2.掌握以物质的量为中心的相互关系及有关计算3.阿伏加德罗定律⑴阿伏加德罗定律:在同温、同压条件下,相同体积的任何气体都含有相同数目的分子。
⑵阿伏加德罗定律的推论:①同温同压:气体的体积之比等于气体的物质的量之比或气体分子数之比。
关系式:111222V n V n N N ==②同温同体积:气体的压强之比等于气体的物质的量之比或气体分子数之比。
关系式:111222P n N P n N ==③同温度同压:气体的密度之比等于气体的摩尔质量之比或相对分子质量之比。
关系式:1122M M ρρ=④同温度同压强同质量两种气体:其体积之比与摩尔质量成反比。
关系式:1221V M V M =注意:还可以归纳出其他的规律,对这些规律要理解及灵活运用。
4.一定物质的量浓度溶液的配制步骤:计算→称量(或量取)→溶解→移液→洗涤→定容→摇匀。
二.方法归纳1.阿伏加德罗常数(N A )与气体摩尔体积关系的换算由已知一定量(质量、物质的量、体积等)去计算其中所含有微粒数(分子、原子、质子、中子、电子等)N A 的值是近年高考中的热点,通常结合其他化学知识进行考查。
如:(1)常温常压下,11.2L H 2所含的氢分子数为0.5N A 。
这句话叙述是错误的,22.4L · mol -1是标准状况下的气体摩尔体积。
在标准状况下,11.2L H 2物质的量为0.5 mol ;若非标准状况下则不一定为0.5 mol ,但也有可能。
(2)常温常压下,1g H 2所含氢分子数为0.5N A 。
这句话叙述则是正确的。
不论任何条件都有:n=m/M 。
(3)标准状况下,11.2L 水含有的分子数为0.5N A 。
这句话是错误的,在标况下,水不是气体。
在标况下不是气体的还有SO 3、辛烷、CCl 4等。

物质的量及溶液浓度练习题一、选择题1.在标准状况下,烧瓶内充满HCl 气体,将此烧瓶倒扣在盛水的水槽内,当液面上升到烧瓶容积的53时,此时烧瓶内溶液的物质的量浓度为 ( )A . 0.74 mol / LB . 0.045 mol / LC . 0.037 mol / LD . 0.025 mol / L 2.用m g 10%的NaOH 溶液,蒸发掉4 g 水后,余下溶液10 mL ,溶质的质量分数为15%,浓缩后碱液的物质的量浓度是 ( )A. 1.8 mol / LB. 2.3 mol / LC. 3 mol / LD. 4.4 mol / L3.将硫酸钾、硫酸铝、硫酸钾铝三种盐混合溶于硫酸酸化的水中,测得c (SO 42-)=0.105 mol / L ,c (Al 3+)=0.055 mol / L ,溶液的pH =2.0(假设溶液中H 2SO 4完全电离为H +和SO 42-),则c (K +)为 ( )A. 0.045 mol / LB. 0.035 mol / LC. 0.055 mol / LD. 0.040 mol / L 4.由2 mol / L 磷酸溶液和2 mol / L 磷酸溶液各50 mL 组成的混合溶液的物质的量浓度是 ( ) A. 1 mol / L B. 2 mol / L C. 3 mol / L D. 4 mol / L5.A L 硫酸铝溶液中,含有B mol 铝离子,则此溶液的物质的量浓度是 ( ) A.B Amol / L B. 2A B mol / L C. B A 2 mol / L D. AB 2 mol / L6.配制500 mL 0.1 mol / L 硫酸铜溶液,需用胆矾 ( ) A. 8.00 g B. 16.0 g C. 25.0 g D. 12.5 g7.在100 mL 0.1 mol / L NaOH 的溶液中,所含NaOH 的质量是 ( ) A. 40 g B. 4 g C. 0.4 g D. 0.04 g8.将等体积的氯化铝溶液和氢氧化钾溶液混合,所得沉淀物中含铝元素的物质的量与反应之后混合溶液中含铝元素的物质的量相等。

一、单项选择题1.某同学用Na2CO3配制0.10 mol·L-1Na2CO3(aq),其称量操作如下图所示,最终配制溶液的浓度()A.偏高B.偏低C.可能偏高也可能偏低D.准确解析:结合天平称量规则,实际称得样品的质量为4.7 g,最终浓度偏低。
答案:B2.1 L 0.1 mol·L-1的K2SO4溶液中()A.K+的物质的量为0.1 molB.SO2-4的物质的量为0.2 molC.K+的物质的量浓度为0.1 mol·L-1D.SO2-4的物质的量浓度为0.1 mol·L-1解析:由c·V可知,n(K2SO4)=0.1 mol;由K2SO4===2K++SO2-4可知,n(K+)=2n(K2SO4)=0.2 mol;n(SO2-4)=n(K2SO4)=0.1 mol;c(K+)=2c(K2SO4)=0.2 mol/L;c(SO2-4)=c(K2SO4)=0.1 mol/L;故D正确。
答案:D3.配制250 mL 0.10 mol/L NaOH溶液时,下列实验操作能使所配溶液浓度偏大的是()A.转移溶液后未洗涤烧杯和玻璃棒就直接定容B.在容量瓶中定容时仰视刻度线C.在容量瓶中定容时俯视刻度线D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度解析:不洗涤导致n B变小,由n B/V可知,c B变小,故A错;仰视定容导致V变大,由n B/V可知,c B变小,故B错;俯视定容导致V变小,由n B/V可知,c B变大,故C正确;补加水导致V变大,由n B/V可知,c B变小,故D错。
答案:C4.设N A为阿伏伽德罗常数的值,下列说法正确的是()A.1L 0.1 mol/L Na2S溶液中含有的S2-离子数小于0.1N AB.1L 0.1 mol/L Na2SiO3的溶液中含有0.1N A个 2SiO3C. 1L 0.1 mol/L的醋酸溶液中含有0.1N A个H+D.25℃时,1LpH=13的Ba(OH)2溶液中含有Ba2+的数目为0.1N A解析:由c·V可知,n(Na2S)=0.1 mol,由Na2S===2Na++S2-可知,n(S2-)=n(Na2S)=0.1 mol,由盐类水解可知,溶液中n(S2-)<0.1 mol,故A正确;由c·V可知Na2SiO3为0.1 mol,由盐类水解可知溶液中SiO2-3小于0.1 mol,故B错;由c·V可知醋酸为0.1 mol,由电离程度可知H+小于0.1 mol,故C错;25 ℃时溶液中c(OH-)=K w/c(H+)=10-1mol/L,由c·V可知,n(OH-)=0.1 mol,由Ba(OH)2===Ba2++2OH-可知,n(Ba2+)=n(OH-)/2=0.05 mol,故D错。

第二讲 物质的量浓度1、掌握物质的量浓度的基本概念、含义及相关的计算与换算。
2、掌握一定物质的量浓度溶液配制的步骤、方法、注意事项。
3、能够对配制一定物质的量浓度溶液的过程进行误差分析。
一、物质的量浓度1、定义:以1L 溶液里所含溶质B 的物质的量来表示溶液的浓度叫做物质的量浓度。
符号为:c B ;单位为: mol ﹒L -12、表达式:c B =n V(n 为溶质B 的物质的量,单位为mol ;V 为溶液的体积,单位为L)3、难点提示(1)理解物质的量浓度的物理意义和相关的量。
物质的量浓度是表示溶液组成的物理量,衡量标准是单位体积溶液里所含溶质的物质的量的多少。
这里的溶质可以是单质、化合物,也可以是离子或其他的特定组合,单位是mol ;体积指溶液的体积而不是溶剂的体积,单位是L ;因此,物质的量浓度的单位是mol·L -1。
(2)明确溶液中溶质的化学成分。
求物质的量浓度时,对一些特殊情况下溶液的溶质要掌握清楚,如NH 3溶于水得NH 3·H 2O ,但我们习惯上认为氨水的溶质为NH 3;SO 3溶于水后所得溶液的溶质为H 2SO 4;Na 、Na 2O 、Na 2O 2溶于水后所得溶液的溶质为NaOH ;CuSO 4·5H 2O 溶于水后所得溶液溶质为CuSO4(3)在计算物质的量浓度时,要注意概念中的体积是溶液的体积,而不是溶剂的体积,如将1 mol NaCl 、标准状况下22.4 L HCl 溶于1 L 水形成的溶液浓度都不是1 mol·L -1,因为最终溶液体积不是1 L 。
(4)溶液浓度与体积多少无关,即同一溶液,无论取出多大体积,其各种浓度(物质的量浓度、溶质的质量分数)均不发生变化。
4、溶质的质量分数质量分数指溶液中溶质的质量分数是溶质质量与溶液质量之比。
计算公式:ω=m(溶质)m(溶液)×100% 5、溶解度在一定的温度和压力下,在100g 溶剂中所能溶解溶质最大的克数。

选择题。
(本大题共5小题) 1.将质量分数为a%的NaOH溶液蒸发掉m g水后,变成V mL 2a%的NaOH不饱和溶液,则蒸发后的溶液的物质的量浓度是( )A. mol·L-1B. mol·L-1C. mol·L-1D. mol·L-1 解析:由题意可知,原NaOH溶液的质量为2m g,则溶质的质量为m(NaOH)=(2m×a%)g,故有n(NaOH)=,从而推知c(NaOH)= mol·L-1。
答案:C 2.某溶液含有①NO ②HCO ③SO ④Br- ⑤SO五种阴离子;向其中通入过量氯气后,溶液中的离子浓度基本保持不变的是(忽略溶液体积的变化)( ) A.① B.①②④ C.①③⑤ D.①③④⑤ 解析:Cl2具有强氧化性,可将SO、Br-分别氧化成SO和Br2。
氯气溶于水使溶液呈酸性,HCO与H+反应生成CO2和H2O。
答案:A 3.已知某溶液中存在较多的H+、SO、NO,则该溶液中还可能大量存在的离子组是( ) A.Al3+、CH3COO-、Cl- B.Mg2+、Ba2+、Br- C.Mg2+、Cl-、I- D.Na+、NH、Cl- 解析:CH3COO-与H+生成弱电解质CH3COOH,A项错误;Ba2+与SO生成沉淀BaSO4,B项错误;NO在酸性条件下具有强氧化性,能将I-氧化,C项错误。
答案:D 4.用惰性电极进行下列电解,有关说法正确的是( ) ①电解稀硫酸 ②电解CuSO4溶液 ③电解KOH溶液 ④电解NaCl溶液 A.电解进行一段时间后四份溶液的pH均增大 B.②中电解一段时间后,向溶液中加入适量的CuO固体可使溶液恢复电解前的情况 C.③中阳极消耗OH-,故溶液浓度变小 D.④中阴、阳两极上产物的物质的量之比为2∶1 解析:依据惰性电极电解规律,可知①为电解水型,②为放O2生酸型,③为电解水型,④为放H2生碱型。

2015届高考化学二轮复习专题训练:化学中常用计量1.山西省运城中学2015届高三上学期期末考试化学试题下列叙述中,正确的是()A.H2SO4的摩尔质量是98B.等质量的O2和O3中所含的氧原子数相同C.等质量的CO与CO2中所含碳原子数之比为11:7D.将98g H2SO4溶解于500mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L答案及解析:1.BC解析:A.H2SO4的摩尔质量是98g/mol,1molH2SO4的质量是98g,故A错误;B.O2和O3都由氧原子构成,二者质量相等含有的氧原子数目相等,故B正确;C.等质量的CO与CO2的物质的量之比为:=11:7,二者分子都含有1个C原子,二者所含碳原子数之比为11:7,故C正确;D.98g H2SO4的物质的量为1mol,溶于水配成500mL溶液,所得溶液中硫酸的物质的量浓度为2 mol/L,体积500mL是指溶液的体积,不是溶剂的体积,故D错误;故选BC.2.山西省运城中学2015届高三上学期期末考试化学试题在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl﹣各为1.5mol,Mg2+为0.5mol,则SO42﹣的物质的量为()A.0.1mol B.0.5mol C.0.15mol D.0.25mol答案及解析:2.B解析:因溶液中的离子有K+、Cl﹣、Mg2+、SO42,设SO42﹣物质的量为n,溶液不显电性,溶液中的阳离子带电的总电荷量与阴离子所带电的总电荷量相等,根据电荷守恒:1.5mol×1+0.5mol×2=1.5mol×1+n×2,解得n=0.5mol.故选B.3.河南省安阳一中等天一大联考2015届高三阶段测试(三)化学试题用N A表示阿伏加德罗常数的值。
下列叙述中不正确的是A. 16.9 g过氧化钡(BaO2)加入足量H2O中转移电子数目为0.1 N AB.常温常压下,28 g乙烯含有的电子数为16 N AC.标准状况下,ag某气体舍分子数为b,则cg该气体的体积为bc/a LD. 1 mol丙烷分子中含有的共用电子对数为8 N A答案及解析:3.D解析:A.16.9 g过氧化钡(BaO2)固体物质的量为0.1mol,与足量的水反应转移电子数为0.1N A,故A正确;B.28 g乙烯物质的量为1mol,含有的电子数为16 N A,故B正确;C.标准状况下,ag某气体的体积为bL,bL气体物质的量为b/22.4 mol,故该气体的摩尔质量为22.4a/b g/mol,则cg该气体的物质的量bc/22.4a mol,体积为bc/a L,故C 正确;D.1 mol丙烷分子中含有的共用电子对数为10N A,故D错误;故答案选D4.【】山东省烟台市福山格迈纳尔中学2015届高三上学期第一学段自主检测化学试题下列说法中(N代表阿伏加德罗常数的值),不正确的是AA.标准状况下,2.24LCO和CO2混合气体中含有的碳原子数目为0.1NAB.常温下,2. 3g Na完全与O2反应失去的电子数为0.1NAC.l00mL 18. 4mol1L-⋅的硫酸与足量铜反应,生成二氧化硫的分子数小于0.92NA D.在密闭容器中加入1. 5molH2和0.5molN2,充分反应后可得到NH3分子数为NA答案及解析:4.D解析:工业合成氨的反应是可逆反应,在密闭容器中加入1. 5molH2和0.5molN2,充分反应后可得到NH3分子数小于N,选D。
第三单元物质的量浓度及其溶液的配制一、选择题1.只给出下列甲和乙中对应的量,不能求出物质的量的是()。
解析固体的体积和固体的密度只能计算出固体的质量。
答案 C2.向100 mL的FeBr2溶液中通入标准状况下Cl2 3.36 L,所得溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为()。
A.2 mol·L-1B.1.5 mol·L-1C.1 mol·L-1D.0.75 mol·L-1解析FeBr2溶液中通入Cl2,则Cl2先氧化Fe2+,现在溶液中Cl-和Br-的物质的量浓度相等,表明溶液中无Fe2+,有FeBr3、FeCl3,n(Cl-)=(3.36 L÷22.4 L·mol-1)×2=0.3 mol =n(Br-),根据原子守恒n(Fe)=0.2 mol,则c(FeBr2)=0.2 mol÷0.1 L=2 mol·L-1,A正确。
答案 A3.使用容量瓶配制溶液时,由于操作不当,会引起误差,下列情况会使所配溶液浓度偏低的是()。
①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了②用滴定管量取液体时,开始时平视读数,结束时俯视读数③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤④转移溶液前容量瓶内有少量蒸馏水⑤定容时,仰视容量瓶的刻度线⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线A.①③⑤⑥B.①②⑤⑥C.②③④⑥D.③④⑤⑥解析①用天平(使用游码)称量时,被称量物与砝码的位置放颠倒了,溶质减少,所配溶液浓度偏低;③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤,溶质减少,所配溶液浓度偏低;⑤定容时,仰视容量瓶的刻度线,如图乙,溶剂增多,所配溶液浓度偏低;⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线,溶剂增多,所配溶液浓度偏低;②会引起所配溶液浓度偏高;④对所配溶液浓度无影响;综上所述,选项A正确。
1.(2013年广东学业水平考试)物( ) B.g·mol-1-1-1-1答案:用摩尔(mol)作为单位的物理量是( )长度 B.质量电流 D.物质的量解析:物质的量的单位是摩尔(mol)。
答案:D下列说法正确的是( )硫酸的摩尔质量是98 g的质量是32 g·mol-1氢气含有氢原子的物质的量是2 mol的物质的量是1 mol解析:2 g氢气的物质的量是1 mol含有2 mol氢原子。
答案:C下列叙述正确的是( )国际上规定碳所含碳原子的物质的量是1 mol的摩尔质量是64 g含有32 mol电子氧的质量是32 g解析:A项没有指明碳原子的核素是;B项摩尔质量的单位是g·mol-1;D项没有指明是氧分子还是氧原子;C项个SO分子中含有32个电子故1 mol SO含有电子。
答案:C(2013年广东学业水平考试)25 g CuSO物质的量为( )解析:n(CuSO)=25 g÷(250 g·mol-1)0.1 mol 。
答案:D 6.标准状况下的1.5 mol O的体积约为( )解析:标准状况下1 mol气体体积约为22.4 L=1.5 mol×22.4 L·mol-1=33.6 L。
答案:C(2013年广东学业水平考试改编)下列各组物质中所含分子数相同的是( )和10 g O2 B.7 g N2和11 g CO2 C.9 g H2O和0.9 mol Br2 D.224 mL H2(标准状况)和0.1 mol N2 解析:7 g N和11 g CO2的物质的量都是。
答案:B(2013年东莞学业水平考试模拟)氢的原子序数是1含2 mol氢原子的氢分子数是( )答案:(2013年梅州学业水平考试模拟)设N为阿伏加德罗常数的值下列说法不正确的是( )O2所含的原子数目为N含有的原子数目为1.5 N含有H分子数目为NNA个氯气分子的物质的量是0.5 mol解析:32 g O所含的原子数目为2 N。
高考化学专题复习:配制一定物质的量浓度一、单项选择题(共10小题)1.以下是精确配制一定物质的量浓度NaCl溶液的实验步骤,其中操作正确的有()A.1步B.2步C.3步D.4步2.用NaOH固体配制一定物质的量浓度的NaOH溶液,下列正确的是()A.将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中B.将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解C.称量时将固体NaOH放在称量纸上,放在托盘天平左盘上称量D.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分3.某班同学对一定物质的量浓度溶液配制进行实验。
甲组:用碳酸钠晶体(Na2CO3⋅10H2O)来配制1.0mol⋅L-1Na2CO3溶液480mL;乙组:用98%的浓硫酸配制0.5mol⋅L-1稀硫酸500mL。
假如其他操作都准确无误,下列说法正确的是()A.定容后,将容量瓶振荡摇匀、静置发现液面低于刻度线,又加少量水至刻度线B.甲组需称取空气中久置的碳酸钠143.0g;乙组需用量筒量取浓硫酸13.67mLC.使用前容量瓶中有水珠,需用烘箱烘干后使用D.甲组定容时仰视刻度线,配制浓度偏低;乙组量筒量取时俯视刻度线,配制浓度偏低4.下列实验操作中,正确的是()A.配制0.5mol/LNaCl溶液时,将溶解后的NaCl溶液用玻璃棒引流转移至容量瓶中,并洗涤烧杯和玻璃棒2~3次,将洗涤液全部转入容量瓶中B.配制1mol/LNaOH溶液时,将溶解后的NaOH溶液立即注入容量瓶C.配制0.1mol/L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释D.配制1mol/L的Na2CO3溶液500mL,将Na2CO3放在托盘天平右盘称量5.配制0.1mol•L-1NaCl溶液时,会导致溶液浓度偏高的是()A.溶解时有少量液体溅出B.洗涤液未全部转移到容量瓶中C.容量瓶使用前未干燥D.定容时俯视刻度线6.配制250mL2.00mol•L-1的NaCl溶液,需要哪些仪器()①胶头滴管;②烧杯;③电子天平;④锥形瓶;⑤250mL容量瓶;⑥玻璃棒A.③④⑤⑥B.②③④C.①②③⑤⑥D.①②③④⑤⑥7.配制100mL0.1mol•L-1的NaOH溶液,说法正确的是()A.将0.400gNaOH固体溶于100mL水中即可B.NaOH直接放在电子天平上称量C.固体溶解后,立即转移至容量瓶D.转移时应用玻璃棒引流8.下列配制溶液的叙述中错误的是()A.配制FeSO4溶液制备Fe(OH)2,需要把蒸馏水煮沸除去氧气后,再溶解配制FeSO4溶液B.容量瓶、滴定管、分液漏斗,使用前均需要检查是否漏液C.配制FeCl3溶液时,先把FeCl3固体溶于浓盐酸然后再加水稀释D.将16g胆矾溶于水配成1L溶液,物质的量浓度为0.1mol•L-19.下列说法正确的是()A.配制0.1mol•L-1的Na2CO3溶液480mL,则用托盘天平称量5.1gNa2CO3 B.配制一定物质的量浓度的溶液,在摇匀后,液面位于刻度线以下,应加水至刻度线C.用浓硫酸配制一定物质的量浓度的稀硫酸时,量取浓硫酸时仰视量筒,会使所配溶液浓度偏大D.配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容,会使所配溶液浓度偏小10.用质量分数为0.35、密度为0.88g/cm3的氨水配制9.0mol/L的氨水100mL,需要的定量仪器有()①100mL容量瓶;②10mL量筒;③50mL量筒;④电子天平;⑤烧杯;⑥胶头滴管A.①③④⑤⑥B.①②④⑤⑥C.①④⑤⑥D.①③二、综合题(共5小题)11.某小组同学在配制100mL0.5mol/LNa2CO3溶液时,进行如下操作:①在小烧杯中称量好Na2CO3固体,加适量蒸馏水溶解。
课时4 物质的量浓度及其溶液的配制(时间:45分钟 分值:100分)一、选择题(本题共7个小题,每题6分,共42分,每个小题只有一个选项符合题意。
) 1.设N A 为阿伏加德罗常数的值,下列关于0.2 mol·L -1 Ba(NO 3)2溶液的说法不正确的是 ( )。
A .2L 溶液中阴、阳离子总数为0.8N A B .500 mL 溶液中NO -3浓度为0.4 mol·L -1C .500 mL 溶液中Ba 2+浓度为0.2 mol·L -1D .500 mL 溶液中NO -3总数为0.2N A解析 2 L 0.2 mol·L -1 Ba(NO 3)2溶液中阴、阳离子总数为1.2N A ,A 错误。
答案 A2.(2013·太原月考)下列叙述正确的是( )。
A .1 L 0.1 mol·L-1碳酸钠溶液的阴离子总数等于0.1N AB .将1体积c mol·L -1硫酸用水稀释为5体积,得到0.2c mol·L-1硫酸C .将25 g 无水CuSO 4溶于水制成100 mL 溶液,其浓度为1 mol·L -1 D .将w g a %NaCl 溶液蒸发掉w2g 水,得到4a % NaCl 溶液解析 CO 2-3水解使阴离子的种类和数量均增加,A 项错误;C 项CuSO 4的物质的量大于0.1 mol ,则CuSO 4溶液的浓度大于1 mol·L -1错误;D 项若不析出晶体,得到2a %的NaCl 溶液错误。
答案 B3.V L 浓度为0.5 mol·L-1的盐酸,欲使其浓度增大1倍,采取的措施合理的是( )。
A .通入标准状况下的HCl 气体11.2V LB .加入10 mol·L-1的盐酸0.1V L ,再稀释至1.5V LC .将溶液加热浓缩到0.5V LD .加入V L 1.5 mol·L-1的盐酸混合均匀解析 A 项,通入HCl 气体后溶液的体积会发生变化,若溶液体积不变时所给数据是合理的,该项不合理;C 项,盐酸具有挥发性,加热浓缩会导致HCl 挥发,该项不合理;D 项,不同浓度盐酸混合时,混合后溶液的体积不能用两溶液的体积加和,该项不合理。
物质的量浓度及其溶液的配制1.血糖浓度(血液中葡萄糖的含量)是人体的重要生理指标,其值常以两种计量单位表示,即mmol·L-1和mg·dL-1(1 L=10 dL)。
以mmol·L-1表示时,人的血糖值在3.61~6.11 mmol·L-1之间为正常,下列血糖浓度属于正常值的是()A.2.88 mmol·L-1B.0.008 mol·L-1C.95 mg·dL-1D.52 mg·dL-1解析:A项,2.88 mmol·L-1<3.61 mmol·L-1,偏低;B项,0.008 mol·L-1=8 mmol·L-1>6.11 mmol·L-1,偏高;C项,95 mg180 g·mol-1×10.1 L≈5.28 mmol·L-1,这个值在正常范围内,符合要求;D项,52 mg180 g·mol-1×10.1 L≈2.89 mmol·L-1,偏低。
答案: C2.将下列溶液与1 L 0.1 mol·L-1 NaCl溶液混合,所得溶液中c(Cl-)最大的是()A.50 mL 1 mol·L-1 NaCl溶液B.20 mL 2 mol·L-1 AlCl3溶液C.30 mL 1 mol·L-1 MgCl2溶液D.100 mL 3 mol·L-1 NaClO3溶液答案: B3.下列溶液中溶质的物质的量浓度为1 mol·L-1的是()A.将58.5 g NaCl溶解于1 L水中配成的溶液B.将80 g SO3溶于水并配成1 L溶液C.将0. 5 mol·L-1的NaNO3溶液100 mL加热蒸发掉50 g水的溶液D.含K+为2 mol的K2SO4溶液解析:A中水的体积是1 L,溶液体积一定不是1 L;C中蒸发掉50 g水后,溶液的体积一定不是50 mL;D中未指明溶液体积。
2015届高三高考二模理综化学试题(含答案)可能用到的相对原子质量:H 1 C 12 O 16 Al 27 Si 28 S 32 Cl 35.5 K 39 Fe56一、选择题7.化学与社会、生活密切相关,下列说法中不正确...的是()A. 区别地沟油(加工过的餐饮废弃油)和矿物油(汽油、煤油、柴油等)的方法是加入足量氢氧化钠溶液共热,不分层的是地沟油B. 发泡塑料饭盒不适于盛放含油较多的食品C. 光化学烟雾的产生与汽车排放的尾气有关D. 将废电池深埋,可以避免其中的重金属污染8.设N A是阿伏加德罗常数的值,下列说法正确的是()A.1 L1mol·L-1的NaClO溶液中含有ClO-的数目为N AB.60g 二氧化硅含有的共价键数为2N AC.7.8g 钾与100mL 1mol·L-1盐酸充分反应生成气体分子数为0.1N AD.标准状况下,7.1g 氯气与足量的石灰乳充分反应,转移电子数为0.2N A9.甲苯的苯环上有5个氢原子,其中若有两个氢原子分别被羟基(—OH)和氯原子(—Cl)取代,则可形成的有机物同分异构体有()A.9种B.10种C.12种D.15种10.近年来,莽草酸因可以作为合成达菲(抗病毒和抗癌药)的中间体而受到重视,其结构简式如图:下列关于莽草酸的说法不正确...的是()A.莽草酸的相对分子质量为174 Array B.分子中含有两种含氧官能团C.可发生取代、加成反应及氧化反应D.在水溶液中羟基和羧基均能电离出氢离子11.下述实验能达到预期目的的是()溶液,又生成红12.下列各组离子在常温下一定能大量共存的是 ( )A .pH=0的无色溶液中:Cl -、Na +、SO 42-、Fe 2+B .加入铝粉能放出H 2的溶液中:Mg 2+、NH 4+、NO 3-、Cl -C .在c (H +)/c (OH -)=1012的溶液中:NH 4+、NO 3-、K +、Cl -D .含有大量Fe 3+的溶液中:Al 3+、SCN -、Br -、Na +13.硫化汞(HgS )难溶于水,在自然界中呈红褐色,常用于油画颜料、印泥及朱红雕刻漆器等。