2021届高三化学一轮复习自我强化练 高考模拟综合测试
- 格式:docx
- 大小:532.95 KB
- 文档页数:23
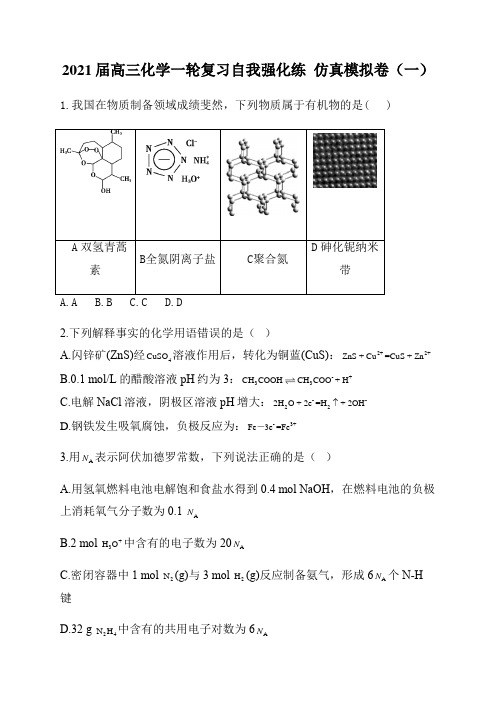
2021届高三化学一轮复习自我强化练 仿真模拟卷(一)1.我国在物质制备领域成绩斐然,下列物质属于有机物的是( )A 双氢青蒿D 砷化铌纳米2.下列解释事实的化学用语错误的是( )A.闪锌矿(ZnS)经4CuSO 溶液作用后,转化为铜蓝(CuS):2+2+ZnS + Cu =CuS + ZnB.0.1 mol/L 的醋酸溶液pH 约为3:-+33CH COOHCH COO + HC.电解NaCl 溶液,阴极区溶液pH 增大:--222H O + 2e =H + 2OHD.钢铁发生吸氧腐蚀,负极反应为:-3+Fe 3e =Fe - 3.用A N 表示阿伏加德罗常数,下列说法正确的是( )A.用氢氧燃料电池电解饱和食盐水得到0.4 mol NaOH ,在燃料电池的负极上消耗氧气分子数为0.1 A NB.2 mol +3H O 中含有的电子数为20A NC.密闭容器中1 mol 2N (g)与3 mol 2H (g)反应制备氨气,形成6A N 个N -H 键D.32 g 24N H 中含有的共用电子对数为6A N4.氮及其化合物的转化过程如下图所示。
下列分析合理的是( )A.催化剂a 表面发生了极性共价键的断裂和形成B. 2N 与2H 反应生成3NH 的原子利用率为100%C.在催化剂b 表面形成氮氧键时,不涉及电子转移D.催化剂a 、b 能提高反应的平衡转化率5.常温下,下列各组离子在指定溶液中一定能大量共存的是( ) A.遇苯酚显紫色的溶液:+2I K SCN Mg --+、、、B.pH =12 的溶液:+23K Na ClO SO -+-、、、C.水电离的131 OH 110mo ()l L c -⨯⋅--=的溶液中:2+K Cl CH3COO Cu +--、、、D.0.1 1mol L ⋅-的24K SO 溶液:33Na Al Cl NO ++--、、、6.在给定条件下,下列选项所示的物质间转化均能实现的是( )A.224H O H SO23243Fe Fe O Fe (SO )−−−−→−−−→高温 B.2H O 2Cl HClO O −−−→−−−→光照 C.HCl 22CuO CuCl (aq)CuCl −−−→−−→△无水 D.22O /H O 324S SO H SO −−−−→−−−→点燃7.短周期元素X 、Y 、Z 、W 原子序数依次增大,Y 与W 同族。

有机反应类型1、绿色化学的一个原则是“原子经济”,最理想的“原子经济”是全部反应物的原子嵌入期望的产物中。
在下列反应类型中,“原子经济”程度最低的是A .化合反应B .取代反应C .加成反应D .加聚反应 答案:B解析:取代反应的产物不止一种,所以一直利用率是最低的,其余一般都是只有一种,原子利用率高,答案选B 。
2、下列物质显示酸性,且能发生酯化反应和消去反应的是:A .B.CH 3CH 2=CHCOOHC. CH 3CH 2COOHD. CH 3CH 2COOH答案:C解析:A 、B 、D 中都不能发生消去反应,C 中含有醇羟基和羧基,所以符合条件,答案选C 。
3、下列属于消去反应的是( ) A 乙醇与浓硫酸共热至140℃ B 乙醇与硫酸、溴化钠共热—OHCOOHC 乙醇与浓硫酸共热至170℃D 乙醇与乙酸的反应 答案:C解析:有机化合物在一定条件下,从1个分子中脱去1个或几个小分子,而生成不饱和键化合物的反应属于消去反应,因此选项C 是正确的。
A 的生成物是乙醚,属于取代反应。
B 的生成物是溴乙烷,属于取代反应。
D 是酯化反应,所以答案是C 。
4、下列化合物中既易发生取代反应,也可发生加成反应,还能使KMnO 4酸性溶液退色的是( )A .乙烷B .乙醇C .丙烯D .苯 答案:C解析:乙烷属于烷烃,不能发生加成反应,也不能使酸性高锰酸钾溶液褪色。
乙醇不能发生加成反应,苯不能使酸性高锰酸钾溶液褪色。
丙烯中含有碳碳双键和1个甲基,符合题意。
所以正确的答案是C 。
5、下列反应中,属于加成反应的是 A .CH 4+Cl 2CH 3Cl+HClB .CH 2=CH 2+HCl 一定条件−−−−→ CH 3CH 2Cl C .2CH 3CH 2OH+O 2 2CH 3CHO +2H 2O D .答案:B解析:取代反应是指有机化合物受到某类试剂的进攻,致使分子中一光照Cu=个基(或原子)被这个试剂所取代的反应。

2021届高三化学一轮复习自我强化练 钠1.下列关于钠的说法中不正确的是( ) A.金属钠和氧气反应,条件不同,产物不同B.金属钠与()32Ca HCO 溶液反应时,既有白色沉淀生成又有气体逸出C.将一小块钠投入装有氯化镁溶液的试管中,钠熔成小球并在液面上游动D.将一小块钠投入装有硫酸铜溶液的试管中,试管底部有红色物质生成 2.22Na O 是呼吸面具中常用的供氧剂,下列关于22Na O 的叙述正确的是( ) A.22Na O 中阴、阳离子的个数比为1:1B.22Na O 分别与22H O CO 、反应,产生相同质量的2O 时,消耗2H O 和2CO 分子的数量相等C.在22Na O 与2CO 反应过程中,22Na O 只作氧化剂D.22Na O 能漂白所有的有色物质3.下列关于碳酸钠和碳酸氢钠的叙述,正确的是( ) A.常温时,在水中的溶解度:碳酸钠>碳酸氢钠 B.热稳定性:碳酸钠<碳酸氢钠C.质量相同时,分别与同体积、同浓度盐酸反应,产生气泡快慢:碳酸钠>碳酸氢钠D.质量相同时,分别与足量的盐酸反应,生成2CO 的质量:碳酸钠=碳酸氢钠 4.下列实验方法不能鉴别23Na CO 和3NaHCO 的是( ) A.分别与相同浓度的盐酸反应看反应剧烈程度B.分别配成溶液,分别逐滴加入相同浓度的稀盐酸观察现象C.分别配成溶液,加入澄清石灰水观察现象D.分别装入试管中加热,并将逸出的气体通入澄清石灰水观察现象5.下列实验操作正确的是( )6.下列对于Na2O、Na2O2的比较,正确的一项是( )A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物B.Na2O2、Na2O都是可溶于水(或能与水反应)的白色固体C.Na2O2在和CO2的反应中既是氧化剂又是还原剂D.Na2O2与水反应时,1mol Na2O2转移2mol电子7.由CO和H2组成的混合气体2. 4 g在足量的O2中充分燃烧后,将生成的所有产物通过足量的Na2O2固体,Na2O2固体增加的质量为( )A. 1. 2 gB. 2. 4 gC. 3. 6 gD.无法计算8.下列关于氯气的叙述不正确的是( )A.氧气是一种黄绿色、有毒的气体,而氯离子是无色的B.氯气和液氯是同一种物质,所含微粒完全相同C.氯气能与水发生反应,常温下也能与氢氧化钠溶液反应生成两种盐D.氯气通入石蕊试液,溶液先变红后褪色,说明氯气具有漂白作用9.在新制氯水中存在多种分子和离子,下列实验现象和结论一致且正确的是( )A.新制氯水使红玫瑰变为白玫瑰,说明有Cl2B.加入石蕊溶液,溶液变红,说明该溶液一定不含HClO固体加入新制的氯水中,有气泡产生,说明有HClOC.将KHCO3D.光照新制氯水有气泡逸出,该气体一定是O210.实验室制备Cl2的反应为MnO2+4HCl(浓)△ MnCl2+Cl2↑+2H2O。

2021年高三上学期化学一轮复习模拟题(五)含答案1.人类应以可持续发展的方式使用资源,以合理的方式对废物进行处理并循环使用,下列做法不利于环境保护的是A.回收并合理处理废电池B.将煤转化为水煤气作燃料C.发电厂的煤经脱硫处理D.富含重金属离子电镀废液直接排放2.用NA表示阿伏加德罗常数的数值,下列说法正确的是A.32gO2和32gO3所含原子数目都为2NAB.标准状况下,11.2 L水中含有的原子数是1.5NAC.0.1 mol Fe参与化学反应转移的电子数一定为0.3NAD.在同温同压下,相同体积的任何气体单质所含的原子数相等3.(xx•晋江市校级模拟)当光束通过下列分散系时,能观察到丁达尔效应的是()A.盐酸 B.Fe(OH)3胶体 C.NaCl溶液D.CuSO4溶液4.下列离子方程式书写正确的是()A.将碳与浓硫酸共热反应后的气体混合物通入过量氢氧化钠溶液中CO2+SO2+3OH-=HSO3-+CO32-+H2OB.向Ca(ClO)2溶液中通入二氧化硫 Ca2++2ClO-+SO2+H2O=2HClO+CaSO3↓C.向Fe(NO3)3溶液中加入过量的HI溶液 2NO3-+8H++6I-=3I2+2NO↑+4H2OD.将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合HCO3-+Ba2++OH-=BaCO3↓+H2O5.油条的做法是将矾、碱、盐按比例加入温水中,再加入面粉搅拌成面团;放置,使面团产生气体,形成孔洞。
放置过程发生反应:2KAl(SO4)2·12H2O + 3Na2CO3 = 2Al(OH)3↓ + 3Na2SO4 + K2SO4 + 3CO2↑ + 21H2O。
下列有关判断正确的是()A.从物质的分类角度来看,油条配方中的“矾、碱、盐”均为盐B.放置过程发生的反应为氧化还原反应C.放置过程发生的反应中,反应物和生成物均为电解质D.反应的离子方程式为2Al3++3CO32-=2Al(OH)3↓+3CO2↑6.水热法制备Fe(FeO2)2纳米颗粒的反应3Fe2++2S2O32-+O2+xOH-=Fe(FeO2)2+S4O62-+2H2O,下列说法中不正确的是A.每生成1molFe(FeO2)2转移4mol电子B.该反应中Fe2+和S2O32-都是还原剂C.3molFe2+被氧化时有1molO2被还原D.反应方程式中化学计量数x=47.X、Y、M、N四种金属,有如下相关信息,据此分析,这四种金属的活动性由强到弱的顺序是① X + Y(NO3)2 = X(NO3)2 + Y② X 与H2SO4(稀)不反应③ M + H2SO4(稀) =MSO4 + H2↑④ N + MSO4 = NSO4 + MA.N>M>X>Y B.Y>X>M>N C.X>Y>M>N D.N>M>Y>X8.下表各组物质中,不能通过一步反应实现如图所示转化的是9.下列各组物质相互混合后,既有气体生成又有白色沉淀生成的是①金属钠投入到FeCl3溶液中②过量的NaOH溶液和铝铵矾溶液混合③少量电石(CaC2)投入到过量的NaHCO3溶液中④Na2O2投入到FeCl2溶液中A.②④ B.③ c.②③ D.①④10.如图所示是一种综合处理SO2废气的工艺流程。

2021年高三化学第一次模拟测试试题(含解析)新人教版Ⅰ卷(选择题共 50 分)【试卷综析】本套试卷重点考查化学平衡、化学反应速率、化学反应能量、电化学知识,适用于一轮复习选修4阶段。
本套试卷虽考查知识面较窄,但涉及题型较广,如同是考查化学与能量,1题考查生活常识、2、9、14考查盖斯定律、11考查图像活化能,知识点考查全面且基础。
在使用时要注重相关知识进行拓展,达到将知识网络化的作用。
大多考点较为基础为脱离课本,但个别题型综合性较强,如20题。
可能用到的相对原子质量:C-12,H-1,O-16, -14,K-39一、选择题(20分)(每小题2分、共10小题,每道题只有一个最符合题意的选项。
)【题文】1.下列叙述正确的是A.生成物总能量一定低于反应物总能量B.酒精可用作燃料,说明酒精燃烧是放热反应C.硝酸铵溶于水温度降低,这个变化是吸热反应D.同温同压下,H2和Cl2在光照和点燃条件下的ΔH不同【知识点】化学反应与能量 F1【答案解析】B 解析:A、E生成物>E反应物吸热反应,E生成物<E反应物放热反应,故A错误;B、燃烧放热故B正确;C、硝酸铵溶于水是物理变化,故C错误;D、反应条件与△H无关,故D错误;【思路点拨】本题考查了化学反应与能量,难度不大,注意C选项:吸放热反应针对化学变化。
【题文】2.已知HCN(aq)与NaOH(aq)反应生成1 mol正盐的ΔH=-12.1 kJ/mol;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。
则HCN在水溶液中电离的ΔH等于A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1C.+69.4 kJ·mol-1 D.+45.2 kJ·mol-1【知识点】化学反应与能量 F1 F2【答案解析】D 解析:HCN(aq)+ NaOH(aq)= Na CN(aq)+H2O(l)ΔH1=-12.1 kJ/mol 强酸、强碱的稀溶液反应的中和热H+(aq)+OH-(aq)= H2O(l)ΔH2=-57.3 kJ·mol-1 ΔH1=HCN在水溶液中电离的ΔH+ΔH2 ,故ΔH=+45.2 kJ·mol-1故D正确。

2021届高三化学一轮复习自我强化练 弱电解质的综合应用1.电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如下表:3NaHCO ()CN c -______()3HCO c -(填“”“”“”><=、或)。
②常温下,物质的量浓度相同的三种溶液:A.3CH COONa B.NaCN C.23Na CO ,其pH 由大到小的顺序是______________(填编号)。
③将少量2CO 通入NaCN 溶液,反应的离子方程式是___________________________。
④室温下,-定浓度的3CH COONa 溶液pH=9,用离子方程式表示溶液呈碱性的原因是______,溶液中()()33CH COO /CH COOH c c -=________。
(写出准确数值)(2)某温度下, pH=3的盐酸中-9OH =10m l/(o L c -)。
该温度下, pH=2的24H SO 与pH=11的NaOH 混合后pH 变为9,则硫酸与氢氧化钠的体积比为_______。
(3)室温下,用0.100 mol/L 盐酸溶液滴定20.00mL 0.l00mol/L 的某氨水溶液,滴定曲线如图所示(横坐标为盐酸的体积)。
①d 点所示的溶液中离子浓度由大到小的顺序依次为_______________________。
②b 点所示的溶液中()()432NH NH H O -c c +⋅=_______________。
(4)已知()-10sp 4K BaSO =1.110⨯,其溶解度为__________g 。
(保留2位有效数字)(5)室温下,已知()()-38sp 3K Fe OH =110⨯,当3+Fe 完全沉淀时,其溶液的PH= _______。
2.传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS 数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH 等而在中和滴定的研究中应用越来越广泛深入。
2021年高三上学期化学一轮复习模拟题(四)含答案1.与实际化工生产流程相符的叙述是 ( )A.制备硝酸的工业中,理论上氨中的氮元素100%转化为了硝酸B.制备硫酸的工业尾气用氢氧化钠溶液吸收C.让Cl2在H2中燃烧制氯化氢,将氯化氢气体通入水中获得盐酸D.工业上用电解熔融氧化铝和冰晶石的混合物的方法得到铝2.下列说法中不正确的是()①由同一种元素组成的物质是单质②阴离子一定不含金属元素,阳离子一定含金属元素③金属氧化物一定是碱性氧化物④碱性氧化物一定是金属氧化物⑤非金属氧化物一定是酸性氧化物⑥酸性氧化物一定是非金属氧化物⑦酸的元数不一定等于酸中的H原子数A.①②④⑤⑦ B.①③⑤④ C.①②③⑤⑥ D.③④⑤⑦3.下列各组离子一定能大量共存的是()A.在无色溶液中:NH4+、Fe2+、SO42-、CO32-B.在含大量Ba2+的溶液中:NH4+、Na+、Cl-、OH-C.在强碱溶液中:Na+、K+、Cl-、SO32-D.在强酸性溶液中:K+、Fe2+、Cl-、CO32-4.根据如图的转化关系判断下列说法正确的是(反应条件已略去)A. 反应①②③④⑤均属于氧化反应和离子反应B.反应⑤说明该条件下铝的还原性强于锰C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1:1D.反应①中氧化剂与还原剂的物质的量之比为1:45.根据表中信息判断,下列选项不正确...的是( )序号反应物产物①KMnO4、H2O2、H2SO4K2SO4、MnSO4、……②Cl2、FeBr2FeCl3、FeBr3③MnO4-、……Cl2 、Mn2+、……A.第①组反应的其余产物为H2O和 O2B.第②组反应中Cl2 与 FeBr2的物质的量之比为1︰1C.第③组反应中生成1mol Cl2,转移电子2molD.氧化性由强到弱顺序为MnO4- > Cl2 > Br2 > Fe3+6.氮化钠和氢化钠分别与水反应的化学方程式如下:Na3N + 3H2O=3NaOH + NH3↑,NaH + H2O=NaOH + H2↑。
2021届高三化学一轮复习自我强化练 化学反应原理综合训练 1 •现有两个图像:下列反应中符合图像的是()B. 4NH 5(g)+5O,(g)^=±4NO(g)+6H,O(g)<0C. 2SO 3(g) ^=^2SO 2(g)+O 2(g) AH>0D. H 2(g)+co(g) ^=±C ⑸+H2(g) A^>0 2 •某同学设计如图所示实验,探究反应中的能量变化。
A. 由实验可知,(a )、(b )、(c )所涉及的反应都是放热反应B. 将实验(a )中的等质量的铝片换成铝粉后,释放出的热量有所增加C. 实验(c )中将环形玻璃搅拌棒改为铁质搅拌棒对实验结果没有影响D. 若用NaOH 固体测定中和热,则测定结果偏高3•下列关于热化学反应的描述正确的是()ifi 度计环形玻琥搅拥*泡沫那料板碎泡沫樂料(C )A. M(g)+3比(g)—』2NHs(g) 、H <0稀盐酸 下列判断正确的是()A.稀盐酸和稀NaOH溶液反应的中和热A27=-57.3kJ mol-1则含lmol H2SO4 的稀硫酸与足量氢氧化顿溶液反应放出的热量为114.6kJB.H2(g)的燃烧热为285.8kJ.mol1,则反应2H2O(l)=2H2(g)+O2(g)的A^+571.6kJmor,C.放热反应比吸热反应容易发生D.lmol丙烷燃烧生成水和二氧化碳所放出的热量是丙烷的燃烧热4.下列事实能用勒夏特列原理来解释的是()A.SO?被氧化为SO),往往需要使用催化剂:2SO,(g)+O,(g) 12SOj(g)B.500 °C温度比室温更有利于合成氨反应:N2(g)+3Hjg) =2N比(g) \H <0C.H r I r HI平衡混合气体加压后颜色加深:H2(g)+I:(g) =2HI(g)D.实验室采用排饱和食盐水的方法收集氯气:CI2+H2O =H++CI-+HCIO5.下表是几种弱酸在常温下的电离平衡常数:则下列说法不正确的是()A.碳酸的酸性强于氢硫酸B.多元弱酸的酸性主要由第一步电离决定C.反应HS- +COf =S2- + HCO;可以发生稀盐酸,电离D.向弱酸溶液中加少量常数不变6.常温下,下列各组离子在指定溶液中一定能大量共存的是()A.在水电离岀的c(H+) = 10-"mol/L: Na\ K\ S2\ SO;-B.在c(Fe3+) =lmol/L 的溶液中:K\ NH:、SCN\ IC.在0.1 mol/L 的NH4HCO3溶液中:Na\ Al"、Cl、NO;D.使甲基橙溶液变红的溶液中:Al*、Cu2\ SO/、NO;7.常温下某一元碱BOH溶液与0.01mol/L的一元强酸HA溶液等体积混合后所得溶液的pH为7.下列说法中正确的是()□反应前,O.Olmol/L的一元强酸HA溶液中水电离出的IT的浓度为IX1012mol/L□反应前,一元碱BOH其溶液中溶质物质的量浓度一定大于0.01mol/L□反应后,溶液中离子浓度大小排列顺序一定是c(B+) = c(A )>c(Hj =c(OH )□反应后,混合溶液中HA与M的浓度总和等于0.01mol/L・A.①②B.①③C.②④D.①②④&下列事实:①NaHSQ溶液呈酸性;②长期施用化肥(NH4)2SO4会使土壤酸性增强,发生板结;③配制eg,溶液时,用稀盐酸溶解CuCl,固体;®NaHS 溶液中C(H2S)>C(S2");⑤氯化镀溶液可去除金属制品表而的锈斑;⑥蒸干FC—溶液,往往得不到Fed,固体。
(新高考)2021届化学一轮总复习限时强化训练(强化):*有机化学基础* 时间:50分钟一、选择题(1~13为单选,14~18每小题有一个或两个选项符合题意)1.某药物中间体的合成路线如下。
下列说法正确的是( )。
对苯二酚2,5-二羟基苯乙酮中间体A.1 mol对苯二酚与足量H2加成,消耗3 mol H2B.2,5-二羟基苯乙酮不能使酸性KMnO4溶液褪色C.2,5-二羟基苯乙酮中所有碳原子一定处于同一平面D.中间体分子中含有的官能团之一是碳碳双键2.下列各组物质不.互为同分异构体的是( )。
..A.2,2-二甲基丙醇和2-甲基丁醇B.邻氯甲苯和对氯甲苯C.2-甲基丁烷和戊烷D.甲基丙烯酸和甲酸丙酯3.某有机物的结构简式为,下列关于该有机物的叙述正确的是( )。
A.不能使酸性KMnO4溶液褪色B.在加热条件和催化剂作用下,1 mol该有机物最多能和5 mol H2发生反应C.能使溴水褪色D.一定条件下,能和NaOH醇溶液反应4.有机化合物在食品、药物、材料等领域发挥着举足轻重的作用。
下列说法正确的是( ) A.2丁烯分子中的4个碳原子在同一直线上B.按系统命名法,化合物(CH3)2C(OH)C(CH3)3的名称为2,2,3三甲基3丁醇C.甲苯和间二甲苯的一溴代物均有4种D.乙酸甲酯分子的核磁共振氢谱中只能出现一组峰5.有机物的结构可用“键线式”表示,如CH3—CH===CH—CH3可简写为,有机物X的键线式为。
下列关于有机物X的说法正确的是( )A.X分子的不饱和度为4B.X与乙酸乙酯含有相同的官能团C.X因能与酸性KMnO4溶液发生加成反应而褪色D.有机物Y是X的同分异构体,能与碳酸氢钠溶液反应且遇FeCl3溶液显紫色,则Y的结构有3种6.据报道:清华大学的科学家将古老的养蚕技术与时兴的碳纳米管和石墨烯结合,发现通过给蚕宝宝喂食含有碳纳米管和石墨烯的桑叶,可以获得更加牢固的蚕丝纤维,延展性和抗拉强度显著提高。
2021届高三化学一轮复习自我强化练化学平衡转化率1.—定温度下,在固定体积的密闭容器中发生下列反应:222HI=H+I。
若()cHI 由0.1 mol/L降到0.07 mol/L时需要15s时间,那么c(HI)由0.07 mol/L降到0.05mol/L时,所需反应的时间( )A.等于5sB.等于10sC.大于10sD.小于10s2.在气体反应中,能使反应物中活化分子数和活化分子百分数同时增大的方法是( )①增大反应物的浓度②升高温度③增大压强④移去生成物⑤加入催化剂A.①③⑤B.②③⑤C.②⑤D.①③④3.对于可逆反应m A(s)+n B(g)e C(g)+f D(g),当其他条件不变时,C的体积分数[()]ϕ在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。
C下列叙述正确的是( )A.达到平衡后,若使用催化剂,C的体积分数将增大B.该反应的0∆<HC.化学方程式中,n>e+fD.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动4.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害,在恒容密闭容器中,将CO 和2H S 混合加热并达到下列平衡:()()22COS(g)+H (CO g +H 01S g)g .K =反应前CO 物质的量为10mol,平衡后CO 物质的量为8mol 。
下列说法正确的是( ) A.升高温度,2H S 浓度增加,表明该反应是吸热反应 B.通入CO 后,正反应速率逐渐增大 C.反应前2H S 物质的量为7mol D.CO 的平衡转化率为80%5.温度为T 时,向2.0L 恒容密闭容器中充入1.0mol PCl 5,反应PCl 5(g)PCl 3(g)+ Cl 2(g)经过一段时间后达到平衡。
反应过程中测定的部分数据见下表。
下列说法正确的是( )3L -1·s -1B.保持其他条件不变,升高温度,平衡时c(PCl 3) = 0.11mol·L -1,则反应的ΔH<0C.相同温度下,起始时向容器中充入1.0mol PCl 5、0.20mol PCl 3和0.20mol Cl 2,反应达到平衡前v(正)>v(逆)D.相同温度下,起始时向容器中充入2.0mol PCl 3和2.0mol Cl 2,达到平衡时,PCl 3的转化率小于80%6.在密闭容器中,一定量的混合气体发生反应:x A(g)+y B(g)z C(g),平衡时测得A 的浓度为0.50mol·L -1,保持温度不变,将容器的容积扩大到原来的两倍,再达到平衡时,测得A 的浓度为0.30mol·L -1。
2021届高三化学一轮复习自我强化练 高考模拟综合测试1.设A N 为阿伏加德罗常数的值,下列说法正确的是( ) A.1 mol —OH (羟基)与 l mol +4NH 中所含电子数均为10A NB.常温常压下,水蒸气通过过量的Na 2O 2使其增重2 g 时,反应中转移的电子数为A NC.0.lmol 苯与足量氢气反应后,破坏碳碳双键的数目为0.3A ND.10g KHCO 3和CaCO 3的固体混合物中含有的23CO -数目为0.1A N2.除去下列物质中少量杂质(括号内的物质为杂质)采用的方法中,正确的是( )A .己烷(己烯):溴水,分液B .FeCl 3溶液(3AlCl ):过量氨水,过滤C .乙醛(乙酸):NaOH 溶液,分液D .乙酸乙酯(乙酸):饱和碳酸钠溶液,分液3.下列各组溶液中的反应,不管反应物量的多少,都只能用同一离子方程式来表示的是( ) A.NaOH 与2CO B.2Ba(OH)与24H SO C.HCl 与23Na CO D.()32Ca HCO 与NaOH4.已知反应: ①22Cl 2KBr=2KCl Br ++,②322KClO 6HCl=3Cl KCl 3H O ↑+++, ③32232KBrO Cl =Br 2KClO ++。
下列说法正确的是( )A . 氧化性由强到弱的顺序为3322KBrO KClO Cl Br >>>B . ①中KCl 是氧化产物,KBr 发生还原反应C . ③中1 mol 氧化剂参加反应得到电子的物质的量为2 molD . 反应②中氧化剂与还原剂的物质的量之比为1∶6 5.下列化学反应对应的离子方程式表示正确的是( ) A.3FeCl 溶液与Cu 的反应:3+2+2+Cu+Fe Cu +Fe =B.43NH HCO 溶于过量的NaOH 溶液中:2332=HCO +OH CO +H O --﹣ C.少量()2Ca OH 和3NaHCO 反应:2332Ca OH HCO =CaCO H O -↓+-+++ D.2FeBr 溶液与等物质的量的2Cl 反应:2+3+22=2Fe +2Br +2Cl 2Fe +4Cl +Br ﹣﹣ 6.下列化学反应或离子反应方程式正确的是( ) A. 苯与溴水反应:B. 1一氯丙烷中加入氢氧化钠溶液并加热:322322CH CH CH Cl+NaOH CH CH=CH NaCl+H O −−→↑+水△C. 苯酚钠溶液中通入少量2CO :-6522653C H O +H O+CO C H OH+HCO -−−→D. 实验室制取乙炔的反应:22?CaC +H O CaO +CH CH →≡↑7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )A.与金属铝反应放出氢气的溶液:43NH Na Cl NO ++--、、、B.能使紫色石蕊试液变蓝色的溶液:2Ca Na ClO I ++--、、、C.-1430.1 mol L NH HCO ⋅溶液:23Ba K OH NO ++--、、、D.12(OH )10(H )c c --+=的溶液:244NH Na SO Cl ++--、、、8.下列反应中,反应后固体物质增重的是( ) A.氢气通过灼热的CuO 粉末 B.二氧化碳通过22Na O 粉末 C.铝与23Fe O 发生铝热反应D.将锌粒投入32Cu(NO )溶液9.为探究新制氯水的性质,某学生做了如下实验。
( )A.实验①说明新制氯水中含有H +、HClOB.实验②发生的反应为322HCO HClO=ClO CO H O -↑-+++C.实验③说明新制氯水中有Cl -,+Cl Ag =AgCl ↓-+D.实验④说明氯气具有强氧化性,232Cl 2Fe =2Cl 2Fe +-+++ 10.关于氮的变化关系图如图:则下列说法不正确的是( )A.路线①②③是工业生产硝酸的主要途径B.路线Ⅰ、Ⅱ、Ⅲ是雷电固氮生成硝酸的主要途径C.上述所有反应都是氧化还原反应D.上述反应中只有③属于氮的固定11.下列关于SO 2漂白性的说法正确的是( ) A. SO 2使酸性高锰酸钾溶液褪色体现了其漂白性 B. SO 2能使紫色石蕊试液先变红后褪色C. SO 2使品红溶液褪色后,加热可使溶液再次变红D. SO 2和Cl 2等体积混合后通入石蕊溶液,褪色效果比单独通入SO 2更好 12.四种短周期主族元素W 、X 、Y 、Z 的原子序数依次增大,W 、X 的简单离子具有相同电子层结构,X 的原子半径是短周期主族元素原子中最大的,W 与Y 同族,Z 与X 形成的离子化合物的水溶液呈中性。
下列说法正确的是( )A.简单离子半径:W<X<ZB.W与X形成的化合物溶于水后溶液呈碱性C.气态氢化物的热稳定性:W<YD.最高价氧化物的水化物的酸性:Y>Z13.肼(H NNH)是一种高能燃料,有关化学反应的能量变化如图所示。
已知22断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1mol N-H键所需的能量(kJ)是( )A.194B.391C.516D.65814.有机物的一氯代物种类有(不考虑立体异构)( )A.5种B.6种C.7种D.8种15.分枝酸可用于生化研究,其结构简式如图。
下列关于分枝酸叙述正确的是( )A.分子中含有2种官能团B.可与乙醇、乙酸反应,且反应类型相同C.1mol 分枝酸最多可与3mol NaOH 发生中和反应D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 16.下列说法不正确的是( )A.油脂皂化反应得到高级脂肪酸盐与甘油B.在一定条件下,苯分别与液溴、硝酸作用生成溴苯、硝基苯的反应都属于取代反应C.己烷有4种同分异构体,它们的熔点、沸点各不相同D.聚合物可由单体3CH CH 2CH 和2CH 2CH 加聚制得17.下列有关卤代烃的叙述正确的是( ) A.22CH Cl 有和两种结构B.氯乙烯只有一种结构,而1,2﹣二氯乙烯有两种结构(考虑立体异构)C.检验溴乙烷中的溴元素可将其与过量NaOH 水溶液共热充分反应后,再滴入3AgNO 溶液,可观察到浅黄色沉淀生成D.1﹣溴丙烷和2﹣溴丙烷分别与NaOH 的乙醇溶液共热,产物相同,反应类型不同18.自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(),杏仁含苯甲醛()。
下列说法错误的是( )A.肉桂醛能发生加成反应、取代反应和加聚反应B.可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团C.肉桂醛和苯甲醛互为同系物D.苯甲醛分子中所有原子可能位于同一平面内19.由溴乙烷制取乙二醇的过程中,依次发生的反应的反应类型可能为( )A.取代反应、加成反应、水解反应B.消去反应、加成反应、水解反应C.水解反应、消去反应、加成反应D.消去反应、水解反应、取代反应20.乙酸异丁香酚酯主要用于配制树莓、草莓、浆果和混合香辛料等香精。
其结构简式如图所示,下列说法正确的是( )A.异丁香酚的分子式是C10H12O2,分子中含有含氧官能团为羟基和醚键B.乙酸异丁香酚酯中的所有碳原子不可能在一个平面内C.乙酸异丁香酚酯能与溴水发生加成反应和取代反应D.1mol乙酸异丁香酚酯最多能与1mol NaOH发生反应21.某铁的氧化物粉末可能含有FeO、Fe O中的一种或两种。
某化学兴趣23小组为验证该氧化物粉末的组成,做了如下实验:(1)甲同学利用1mol/L的硫酸、KSCN溶液、酸性高锰酸钾溶液来确定其组成。
步骤一:将固体置于烧杯中,加入1mol/L的硫酸溶液将固体完全溶解;步骤二:往烧杯中先加入足量的氯水,充分反应后再放入足量的氢氧化钠溶液;步骤三:将步骤二所得的物质过滤洗涤后,灼烧至固体质量不再变化,得到32g红棕色固体。
①步骤二中加入氯水的目的是______________;②步骤三中洗涤沉淀的操作为______________;③原固体中FeO和Fe O的物质的量之比为______________。
2322.一定温度下,在2L的密闭容器中,M、N两种气体的物质的量随时间变化的曲线如图所示:(1)反应的化学方程式为_______________。
(2)反应达到最大限度的时间是____min,该时间内的平均反应速率v(N)=____。
(3)反应达到平衡状态时,放出80kJ的热量,当容器中充入1mol N时,反应放出的热量为( )(填序号)A.等于Q kJB.小于Q kJC.大于Q kJD.等于2Q kJ(4)判断该反应达到平衡状态的依据是( )(填序号)A.该条件下,正、逆反应速率都为零B.该条件下,混合气体的密度不再发生变化C.该条件下,混合气体的压强不再发生变化D.条件下,单位时间内消耗2mol N的同时,生成1mol M(5)能加快反应速率的措施是( )(填序号)A.升高温度B.容器容积不变,充入惰性气体ArC.容器压强不变,充入惰性气体ArD.使用催化剂23.依据氧化还原反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)设计的原电池如图所示.请回答下列问题:(1).电极X的材料是__________;电解质溶液Y是__________.(2).X电极上发生的电极反应式为__________.(3).针对上述原电池装置,下列说法中不正确的是( )A.原电池工作时的总反应:Cu2+(aq)+Fe(s)=Fe2+(aq)+Cu(s)为放热反应B.原电池工作时,X电极流出电子,发生氧化反应C.原电池工作时,银电极上发生氧化反应D.原电池工作时,盐桥中的阳离子不断移向左池的氯化钠溶液中(4).若Y为氯化钠溶液,则经过一段时间,发现X极上出现锈斑,则此过程中正极的电极反应式为__________.24.已知醛在一定条件下可以发生如下转化:物质H是一种可以作为药物的芳香化合物,请根据下图(所有无机产物均已略去)中各有机物的转化关系回答问题:(1).B的结构简式为__________.(2).G、D反应生成H的化学方程式是__________.(3).一定条件下,能够与1mol F发生反应的H2的最大用量是__________mol.(4).G有多种同分异构体,其中能与金属钠反应、苯环上只有一个取代基能被催化氧化的同分异构体的结构简式为__________.25.化合物M可用作消毒剂、抗氧化剂、医药中间体。
实验室由芳香烃A 制备M的一种合成路线如下:请回答:(1)B的化学名称为为;D中官能团的名称。
(2)由F生成G的反应类型为式为;F的分子式为。
(3)由E转化为F的第一步反应的化学方程式为。
(4)M的结构简式为。
(5)芳香化合物Q为C的同分异构体,Q能发生银镜反应,其核磁共振氢谱有4组吸收峰。