初中化学除杂质的方法ppt
- 格式:ppt
- 大小:353.50 KB
- 文档页数:7

人教版初中化学九年级下册《实验活动8 粗盐中难溶性杂质的去除》优质课公开课课件、教案第十一单元盐化肥实验活动8 粗盐中难溶性杂质的去除教学设计一、教学分析本实验活动是物质分离的实验,在实验步骤中已经学习过称量、量取、过滤的操作方法。
但由于练习操作不多且时间间隔较长,所以还应帮助学生回顾并加以演示,使学生在实验时心中有数,从而保证实验的顺利进行。
对于实验中出现的新仪器和操作技能,如“蒸发结晶”操作应作为本节课的重点加以指导。
实验结束后针对本实验中的误差分析及时引导学生总结提升。
二、教学目标1、知识与技能(1)学习蒸发操作技能,巩固溶解、过滤操作技能。
(2)理解过滤法分离混合物的原理。
(3)掌握粗盐中难溶性杂质去除的四个步骤以及每个步骤中玻璃棒的作用。
2、过程与方法(1)通过海水晒盐的实例引导学生探究出粗盐提纯的步骤。
(2)感受过滤和蒸发的实验过程,引导学生归纳出实验中的注意事项。
3、情感态度价值观通过参与溶解、过滤,观察蒸发的实验过程,学生逐渐养成细致、严谨的学习习惯,和利用所学知识解决实际问题的能力。
三、教学重难点重点:理解粗盐提纯的原理,掌握粗盐提纯的步骤,蒸发的操作过程及注意事项。
难点:精盐产率的计算,实验过程中的误差分析。
四、教学过程:(一)创设情景:播放视频《舌尖上的中国之相逢》此视频描述制得井盐的过程与本节课主题匹配,能够吸引学生注意力,激发学生的学习兴趣。
(二)探究新知:通过视频和老师的介绍,小组商讨粗盐提纯的步骤和所需用到的仪器。
(学生汇报结果,课件中展示答案)教师重点解释需要“计算产率”的原因,并说明计算方法。
(三)实验操作:1、溶解:演示实验并提示学生天平量筒的精确度;量筒读数方法及玻璃棒的作用;称量剩余固体质量算出溶解粗盐的质量。
2、过滤:回顾过滤的目的、仪器、注意事项并演示实验。
3、学生进行小组实验,感受溶解和过滤操作步骤。
4、教师演示蒸发结晶,并解释该步骤中的注意事项,引导学生总结蒸发的目的和适用范围。


化学除杂方法
化学除杂方法是指通过化学反应将杂质转化为可分离的物质,从而达到除杂的目的。
常用的化学除杂方法有:
1. 沉淀法:通过加入适当的沉淀剂,使杂质转化为沉淀,然后过滤分离。
2. 酸碱法:通过加入酸或碱,使杂质转化为可溶性盐或气体,然后分离。
3. 氧化还原法:通过加入氧化剂或还原剂,使杂质转化为气体或沉淀,然后分离。
4. 络合法:通过加入络合剂,将杂质转化为可溶性络合物,然后分离。
5. 吸附法:通过使用吸附剂吸附杂质,然后分离。
6. 分液法:通过将混合物中的液体和固体或两种不相溶的液体分开,达到除杂的目的。
7. 蒸馏法:通过将混合物中的不同组分在不同的温度下进行蒸馏,达到除杂的目的。
8. 结晶法:通过将混合物中的可溶性固体在溶剂中的溶解度随温度变化而分离,达到除杂的目的。
9. 磁铁法:通过磁铁将混合物中的磁性物质和无磁性物质分离。
10. 渗析法:通过使用半透膜袋将混有离子或分子杂质的胶体分离,达到除杂的目的。
不同的化学除杂方法适用于不同的杂质和物质,需要根据实际情况选择合适的方法。

将混合物中的几种物质分开而分别得到较纯净的物质,这种方法叫做混合物的分离。
将物质中混有的杂质除去而获得纯净物质,叫提纯或除杂。
一、常用的去除杂质的方法10种(1)杂质转化法欲除去苯中的苯酚,可加入氢氧化钠,使苯酚转化为酚钠,利用酚钠易溶于水,使之与苯分开。
欲除去Na2CO3中的NaHCO3可用加热的方法。
(2)吸收洗涤法欲除去二氧化碳中混有的少量氯化氢和水,可使混合气体先通过饱和碳酸氢钠的溶液后,再通过浓硫酸。
(3)沉淀过滤法欲除去硫酸亚铁溶液中混有的少量硫酸铜,加入过量铁粉,待充分反应后,过滤除去不溶物,达到目的。
(4)加热升华法欲除去碘中的沙子,可采用此法。
(5)溶剂萃取法。
欲除去水中含有的少量溴,可采用此法。
(6)溶液结晶法(结晶和重结晶)欲除去硝酸钠溶液中少量的氯化钠,可利用二者的溶解度不同,降低溶液温度,使硝酸钠结晶析出,得到硝酸钠纯品。
(7)分馏蒸馏法欲除去乙醚中少量的酒精,可采用多次蒸馏的方法。
(8)分馏法欲将密度不同且又互不相溶的液体混合物分离,可采用此法,如将苯和水分离。
(9)渗析法欲除去胶体中的离子,可采用此法。
如除去氢氧化铁胶体中的氯离子。
(10)综合法。
欲除去某物质中的杂质,可采用以上各种方法或多种方法综合运用。
另:物质中杂质的一般去除方法1.把杂质转化为沉淀除去,如NaN03(NaCl)加入硝酸银溶液2.把杂质转化为气体除去,如NaCl (NaN03)加入稀盐酸3.加热法:如CaO(CaC03)4.吸收法:如CO(C02)通过澄清石灰水而除去C02N2(02)通过灼热的铜网而除去025.置换法:FeS04(CuS0) 4 加入铁粉与(CuS0) 4反应而除去。
Ag粉(Cu粉) 中加AgN0 3溶液与Cu反应而除去。
6.溶解法:如Mn02(KCl03 )溶于水,过滤,得较纯的Mn02固体练习1、除去下列各组物质中的杂质,A、Na2C03溶液NaOH通入适量二氧化碳B、CO气体C02通过灼热的氧化铜C、HN03溶液HClAgN0 3溶液,过滤D、Cu(OH) 2固体CuCl 2加入适量稀盐酸2、用方程式表示除去下列物质中的杂质(括号里的物质是杂质)(1)KN03 (KCl)(2)NaOH(Na2C03)(3)NaCl(NH4 Cl)(4)HN03(H2SO4)二、常见物质分离提纯的10种方法(1)结晶和重结晶利用物质在溶液中溶解度随温度变化较大,如NaCl,KNO3。


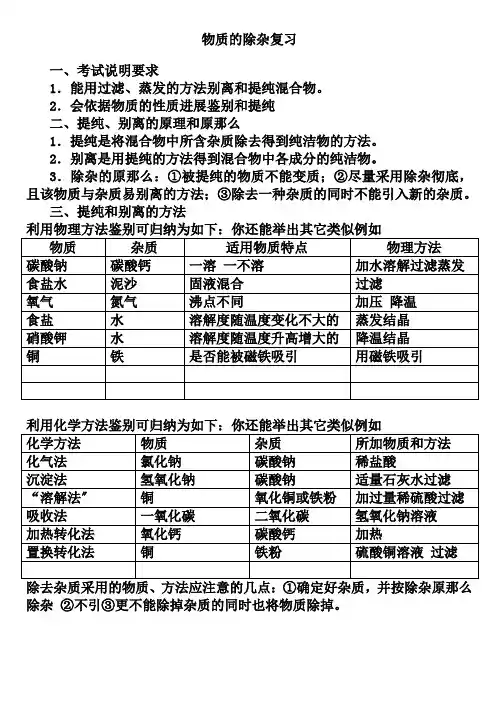
物质的除杂复习一、考试说明要求1.能用过滤、蒸发的方法别离和提纯混合物。
2.会依据物质的性质进展鉴别和提纯二、提纯、别离的原理和原那么1.提纯是将混合物中所含杂质除去得到纯洁物的方法。
2.别离是用提纯的方法得到混合物中各成分的纯洁物。
3.除杂的原那么:①被提纯的物质不能变质;②尽量采用除杂彻底,且该物质与杂质易别离的方法;③除去一种杂质的同时不能引入新的杂质。
三、提纯和别离的方法除杂②不引③更不能除掉杂质的同时也将物质除掉。
实际训练:请将以下除杂过程中所采用的方法和选用的药品不可行的原因写出。
1. 以下除去杂质的方法中,错误的选项是2.下表列出了除去物质中所含少量杂质的方法,其中错误的选项是3456.除去以下物质中含有的少量杂质〔括号内为杂质〕,所用试剂及主要操作均合理的是A.CO2 (CO):通氧气、点燃B.Cu粉(CuO):足量稀硫酸、过滤C.NaCl固体(KCl):水、过滤D.NaOH溶液(Na2CO3):稀盐酸、过滤78.除去下表物质中的杂质〔括号内为杂质〕,所选试剂及操作方法均正确的选项是9.......〔06西模一〕10.除去一氧化碳中混有少量二氧化碳的方法是A.将一氧化碳倒出B.将气体点燃C.将气体通过氢氧化钠溶液D.将气体通过灼热的氧化铜〔〔06石模一〕12. 以下括号中的物质是除去杂质所用的。
其中正确的选项是A. 二氧化碳气体中有杂质一氧化碳〔过量的氧气〕B. 二氧化硫气体中有杂质氯化氢〔过量的氢氧化钠溶液〕C. 氯化钠溶液中有杂质碳酸钠〔适量氯化钡溶液〕D. 氢氧化钠溶液中有杂质碳酸钠〔适量氯化钙溶液〕〔06海一模〕13.以下各项中,括号里的物质是除去杂质所用的药品,其中错误的选项是:〔提示:氯化银是沉淀〕A.NaOH中混有Na2CO3〔HCl〕B.CO中混有CO2〔石灰水〕C.H2中混有HCl〔NaOH溶液〕D.KNO3溶液中混有KCl〔AgNO3 溶液〕〔07丰一模〕14.除去以下物质中的杂质〔括号内为杂质〕,所选用的试剂及操作方法不能到达目的A.除去CO中混有少量的CO2:导出点燃B.粗盐提纯的步骤:溶解→过滤→蒸发C.除去H2中混有的HCl:将气体通过装有NaOH溶液的洗气瓶D.除去铜粉中混有的CuO:用足量的稀硫酸浸泡后过滤、洗涤〔07西一摸〕16.欲除去物质中的少量杂质〔括号内为杂质〕,所采取的方法和反响的根本反响类型〔07中考〕17.以下各组物质中的杂质〔括号内为杂质〕,只需参加适量稀硫酸就能除去的是A.NaCl〔Na2CO3〕B.Fe〔Cu〕C.Na2CO3〔CaCO3〕D.HCl〔BaCl2〕〔07房一模〕18、除去以下物质中的杂质所用的方法错误的选项是......A、一氧化碳气体中混有少量的二氧化碳--通过点燃的方法B、食盐溶液中混有少量的纯碱--参加适量的稀盐酸C、硫酸亚铁溶液中混有少量的硫酸铜--参加过量的铁粉D、盐酸溶液中混有少量的硫酸--参加适量氯化钡溶液〔07石一模〕19.以下除去杂质的方法中,错误的选项是......〔备注:括号内为杂质〕A.FeCl2溶液(CuCl2) 过量铁粉、过滤B.CH4 (H2O) 通过盛浓硫酸的洗气瓶C.CaCl2溶液〔HCl〕过量CaCO3、过滤D.NaOH溶液[Ca(OH) 2] 过量Na2CO3溶液、过滤〔08平一模〕20.除去一氧化碳中混有少量二氧化碳的方法是A.将一氧化碳倒出B.将气体点燃C.将气体通过足量澄清石灰水中D.在高温时,将气体通过氧化铁〔08东一〕21.欲将以下物质中所含杂质除去,所选用的试剂或方法正确的选项是〔09大兴一〕22. 除去以下物质中的杂质〔括号内为杂质〕,所选用的试剂及操作方法均正确的选项是选项待提纯的物质选用的试剂操作的方法A CaO(CaCO3) 水溶解、过滤、结晶B Cu(Fe) 稀盐酸溶解、过滤、洗涤、枯燥C CO2(H2O) 氢氧化钠固体将混合气通过盛氢氧化钠的装置D CO2(CO) 氧气点燃〔序号物质杂质选用的试剂①Fe Fe2O3稀盐酸②CO CO2NaOH溶液③CaO CaCO3H2O④NaCl溶液Na2CO3Ca(OH)2溶液A.②B.①②C.①③D.②③④〔09平一〕24. 以下除去杂质的方法中,错误的选项是选项物质杂质除杂质的方法A.稀硫酸铜过滤B.氯化钙溶液稀盐酸过量碳酸钙、过滤C.硫酸亚铁溶液硫酸铜过量铁粉、过滤D.二氧化碳一氧化碳点燃〔09.......选项物质〔括号内为杂质〕除杂方法A N2〔O2〕通过灼热的铜网B NaOH溶液〔Na2CO3〕参加适量的Ca(OH)2溶液,再过滤C CO(水蒸气) 通过浓硫酸〔09崇一〕26.除去以下物质中所含少量杂质,所用除杂试剂和提纯方法正确的选项是〔09〔09丰一〕28、要除去以下四种物质中的少量杂质〔括号内的物质为杂质〕甲:CaCO3 (Na2CO3) 乙:NaOH (Na2CO3) 丙:NaCl (NaHCO3) 丁:炭粉(CuO)可选用的试剂及操作方法有:①加适量盐酸,搅拌,过滤,洗涤;②加适量水,搅拌,过滤;③加适量盐酸,蒸发;④溶解,加适量石灰水,过滤,蒸发。


第一,要知道除杂质的原则,除掉杂质的同时,不能生成新的杂质。
第二,要背得物质的溶解性表,这样才能很好、很快的找到形成沉淀的离子例如氢氧化钠忠混有碳酸钠,阴离子不同,而碳酸根与很多的阳离子都能形成沉淀,常用的可以是氢氧化钙。
这样,反应后就将碳酸钠除掉,生成了氢氧化钠,也不生成新的杂质。
将混合物中的几种物质分开而分别得到较纯净的物质,这种方法叫做混合物的分离。
将物质中混有的杂质除去而获得纯净物质,叫提纯或除杂。
除杂题是初中化学的常见题,它灵活多变,可以综合考察学生的解题能力。
现列举几种方法:1 物理方法1.l 过滤法.原理:把不溶于液体的固体与液体通过过滤而分开的方法称为过滤法。
如:氯化钙中含有少量碳酸钙杂质,先将混合物加水溶解,由于氯化钙溶于水,而碳酸钙难溶于水,过滤除去杂质碳酸钙,然后蒸发滤液,得到固体氯化钙。
如果要获得杂质碳酸钙,可洗涤烘干。
练习1 下列混合物可以用溶解、过滤、蒸发操作来分离的是:()A.CaCO3 CaO B.NaCl KNO3 C.NaNO3 BaSO4 D.KCl KClO31.2 结晶法.原理:几种可溶性固态物质的混合物,根据它们在同一溶剂中的溶解度或溶解度随温度的变化趋势不同,可用结晶的方法分离。
例如:除去固体硝酸钾中混有的氯化钠杂质,先在较高温度下制成硝酸钾的饱和溶液,然后逐步冷却,由于硝酸钾的溶解度随温度的升高而显著增大,温度降低,大部分硝酸钾成为晶体析出,而氯化钠的溶解度随温度的升高而增大得不显著,所以大部分氯化钠仍留在母液中,通过过滤把硝酸钾和氨化钠溶液分开。
为进一步提纯硝酸钾,可再重复操作一次,叫重结晶或再结晶。
练习2 下列混合物适宜用结晶法分离的是:()A.NaNO3 Na2CO3 B.NaNO3 NaCl C.NaOH Mg(OH)2 D.NaCl BaSO42. 化学方法:原理(一)、加入的试剂只与杂质反应,不与原物反应。
(二)、反应后不能带入新的杂质。

初中化学除杂具体⽅法初中化学除杂具体⽅法1、CO2(CO):把⽓体通过灼热的氧化铜,2、CO(CO2):通过⾜量的氢氧化钠溶液3、H2(⽔蒸⽓):通过浓硫酸/通过氢氧化钠固体4、CuO(C):在空⽓中(在氧⽓流中)灼烧混合物5、Cu(Fe) :加⼊⾜量的稀硫酸6、Cu(CuO):加⼊⾜量的稀硫酸7、FeSO4(CuSO4): 加⼊⾜量的铁粉8、NaCl(Na2CO3):加⼊⾜量的盐酸9、NaCl(Na2SO4):加⼊⾜量的氯化钡溶液10、NaCl(NaOH):加⼊⾜量的盐酸11、NaOH(Na2CO3):加⼊⾜量的氢氧化钙溶液12、NaCl(CuSO4):加⼊⾜量的氢氧化钡溶液13、NaNO3(NaCl):加⼊⾜量的硝酸银溶液14、NaCl(KNO3):蒸发溶剂15、KNO3(NaCl):冷却热饱和溶液。
16、CO2(⽔蒸⽓):通过浓硫酸专题练习——除杂题1、下列各组离⼦在⽔溶液中能⼤量共存的是() A. H+、Ba2+、NO3-、OH- B. H+、K+、Cl-、CO32- C. Na+、Ag+、NO3-、CO32- D. Na+、K+、OH-、SO42-2、某NaNO3溶液中混有少量NaCl,Na2SO4和Na2CO3杂质,为除去这些杂质,仅提供3种药品:AgNO3溶液、BaCl2 溶液和稀HCl。
请设计合理的顺序将杂质逐⼀除去,并填写下⾯实验报告。
(简要回答)Ba+ OH- 实验步骤实验现象化学⽅程式(1)(2)(3)3、在分开盛放的A、B两溶液中,共含有Na+、Cu2+、Ba2+、Mg2+、OH-、NO3-、SO42-七种离⼦两溶液中所含离⼦各不相同,已知A溶液⾥含三种阳离⼦和两种阴离⼦,其余在B溶液⾥,则B溶液⾥所含离⼦应该是。
4、分离NaCl、FeCl3和BaSO4的混合物,应选⽤的⼀组试剂是() A. H2O、AgNO3、HNO3 B. H2O、NaOH、HNO3 C. H2O、NaOH、HCl D. H2O、KOH、HNO35、欲除去下列各物质中的少量杂质(括号内的物质为杂质),同时,⼜不能引⼊新的杂质,分别写出所加试剂和发⽣反应的化学⽅程式。

第三讲:物质的鉴别、除杂学生:杨梦莹知识要点:1. 除杂题:解答除杂质一类的题目时,要注意三原则;三要领;五种常用的方法。
三原则:①不引入新杂质;②不减少被提纯物质的质量;③杂质便于分离。
三要领:①根据物理性质或化学性质的差异;②确定除杂质方法;③选择适宜试剂。
除杂质思路分析方法:(1)沉淀法:加入一种试剂将被除去的杂质变为沉淀,再用过滤法除去。
(2)化气法:加热或加入一种试剂将杂质变为气体逸出。
(3)置换法:利用置换反应的原理将杂质除去。
(4)转纯法:将被除去的杂质变为提纯的物质。
(5)吸收法:常用于气体的提纯。
2. 混合物的分离:(1)可溶性与难溶性物质的混合物——常用溶解、过滤、蒸发三步操作加以分离,分别得到纯净物。
如:粗盐的提纯;BaSO4和Na2SO4的混合物。
(2)两种物质均溶于水,但两种物质的溶解度一种随温度变化大,另一种变化不大时,可考虑——结晶法。
即冷却热饱和溶液的方法加以分离。
如:NaCl和KNO3的混合物。
(3)两种物质均溶于水时,可考虑用化学方法分离。
如BaCl2和NaCl的混合物。
可将混合物先溶于水,加入适量Na2CO3溶液,得到BaCO3和NaCl溶液。
BaCl2+ Na2CO3=BaCO3↓+2NaCl。
将沉淀过滤出,洗净后在沉淀中加入适量盐酸溶液,又得到BaCl2溶液,CO2逸出。
BaCO3+2HCl =BaCl2+H2O+CO2↑。
最后分别将NaCl溶液和BaCl2溶液蒸发,分别得到纯净的NaCl固体和BaCl2固体。
注意:用化学方法或用物理方法进行混合物分离时,要区别除杂质与分离物质的不同点是:除杂质时只要求把杂质除掉、保留原物质即可;而混合物分离是几种物质用一定的方法分开,原混合物中各成分都必须保留经典例题解析:一、鉴别解题原则是:操作简便、现象明显、证据确凿、结论可靠。
(一)只加一种试剂鉴别1、写出鉴别下列各组物质所需的试剂或方法:①鉴别Na2CO3和CaCO3:②鉴别Na2SO4和NaCl:③鉴别Na2CO3和NaCl:2、鉴别下列三种固体粉末:碳酸钠、氯化铜、氢氧化镁,可用多种不同方法。
找到方程式比较难,这里有些资源。
除杂质的方法第一,要知道除杂质的原则,除掉杂质的同时,不能生成新的杂质。
第二,要背得物质的溶解性表,这样才能很好、很快的找到形成沉淀的离子例如氢氧化钠忠混有碳酸钠,阴离子不同,而碳酸根与很多的阳离子都能形成沉淀,常用的可以是氢氧化钙。
这样,反应后就将碳酸钠除掉,生成了氢氧化钠,也不生成新的杂质。
将混合物中的几种物质分开而分别得到较纯净的物质,这种方法叫做混合物的分离。
将物质中混有的杂质除去而获得纯净物质,叫提纯或除杂。
除杂题是初中化学的常见题,它灵活多变,可以综合考察学生的解题能力。
现列举几种方法:1 物理方法1.l 过滤法.原理:把不溶于液体的固体与液体通过过滤而分开的方法称为过滤法。
如:氯化钙中含有少量碳酸钙杂质,先将混合物加水溶解,由于氯化钙溶于水,而碳酸钙难溶于水,过滤除去杂质碳酸钙,然后蒸发滤液,得到固体氯化钙。
如果要获得杂质碳酸钙,可洗涤烘干。
练习1 下列混合物可以用溶解、过滤、蒸发操作来分离的是:()A.CaCO3 CaO B.NaCl KNO3 C.NaNO3 BaSO4 D.KCl KClO31.2 结晶法.原理:几种可溶性固态物质的混合物,根据它们在同一溶剂中的溶解度或溶解度随温度的变化趋势不同,可用结晶的方法分离。
例如:除去固体硝酸钾中混有的氯化钠杂质,先在较高温度下制成硝酸钾的饱和溶液,然后逐步冷却,由于硝酸钾的溶解度随温度的升高而显著增大,温度降低,大部分硝酸钾成为晶体析出,而氯化钠的溶解度随温度的升高而增大得不显著,所以大部分氯化钠仍留在母液中,通过过滤把硝酸钾和氨化钠溶液分开。
为进一步提纯硝酸钾,可再重复操作一次,叫重结晶或再结晶。
练习2 下列混合物适宜用结晶法分离的是:()A.NaNO3 Na2CO3 B.NaNO3 NaCl C.NaOH Mg(OH)2 D.NaCl BaSO42. 化学方法:原理(一)、加入的试剂只与杂质反应,不与原物反应。