元素的非金属性强弱比较
- 格式:ppt
- 大小:266.50 KB
- 文档页数:22

元素金属性、非金属性强弱的判断依据元素金属性、非金属性与其对应单质或离子的还原性、氧化性有着密不可分的关系,他们具有统一性,其实质就是对应原子得失电子的能力,那么,如何判断元素金属性、非金属性强弱呢?这主要应从参加反应的某元素的原子得失电子的难易上进行分析,切忌根据每个原子得失电子数目的多少进行判断.下面就针对元素金属性、非金属性强弱的判断方法做一简要分析和总结。
一、元素金属性强弱判断依据1、根据常见金属活动性顺序表判断金属元素的金属性与金属单质的活动性一般是一致的,即越靠前的金属活动性越强,其金属性越强。
. Na Mg Al Zn Fe 。
单质活动性增强,元素金属性也增强需说明的是这其中也有特殊情况,如Sn和Pb,金属活动性Sn﹥Pb,元素的金属性是Sn﹤Pb,如碰到这种不常见的元素一定要慎重,我们可采用第二种方法.2、根据元素周期表和元素周期律判断同周期元素从左到右金属性逐渐减弱,如第三周期Na ﹥Mg ﹥Al;同主族元素从上到下金属性增强,如1中所述,Sn和Pb同属Ⅳ主族,Sn在Pb的上方,所以金属性Sn﹥Pb.3、根据物质之间的置换反应判断通常失电子能力越强,其还原性越强,金属性也越强,对于置换反应,强还原剂和强氧化剂生成弱还原剂和弱氧化剂,因而可由此进行判断。
如:Fe + Cu2+ === Fe2+ + Cu 说明铁比铜金属性强。
这里需说明的是Fe对应的为Fe2+,如:Zn + Fe2+ === Zn2+ + Fe 说明金属性Zn﹥Fe,但Cu +2Fe3+ === Cu2+ + 2Fe2+,却不说明金属性Cu﹥Fe,而实为Fe ﹥Cu.4、根据金属单质与水或酸反应的剧烈程度或置换氢气的难易判断某元素的单质与水或酸反应越容易、越剧烈,其原子失电子能力越强,其金属性就越强。
如Na与冷水剧烈反应,Mg与热水缓慢反应,而Al与沸水也几乎不作用,所以金属性有强到弱为Na ﹥Mg ﹥Al;再如:Na、Fe、Cu分别投入到相同体积相同浓度的盐酸中,钠剧烈反应甚至爆炸,铁反应较快顺利产生氢气,而铜无任何现象,根本就不反应,故金属性强弱:Na ﹥Mg ﹥Al。

如何比较元素非金属性强弱元素的非金属性是指元素的原子得电子的能力,综合中学化学内容,比较元素非金属性强弱,可以从以下几种不同的方面予以分析、判断。
1.利用原子结构和元素周期表在元素周期表中,同一周期从左至右,元素的非金属性逐渐增强,同一主族从上至下,元素的非金属性逐渐减弱。
2.比较单质跟氢气反应的能力一般说来,非金属性强的元素其单质越容易跟氢气反应,反应现象越剧烈,生成的气态氢化物越稳定。
反之,则非金属性越弱。
根据这一原则,卤族元素中非金属性由强到弱的顺序依次为F、Cl、Br、I。
3.根据物质间置换反应判断一般说来,强氧化剂跟强还原剂反应生成较弱还原剂和较弱氧化剂。
如:Cl2+2NaBr=2NaCl+Br2非金属性Cl>BrBr2+H2S=2HBr+S↓非金属性Br>S4.比较跟金属反应的难易和化合价高低一般说来,越易跟金属反应且使金属呈高价化合物的元素,非金属性越强。
如:2Fe+2Cl2点燃2FeCl3Fe+S ∆FeS 非金属性Cl>S2Cu+S ∆Cu2S5.比较最高氧化物对应水化物酸性强弱一般说来,酸性越强,则该非金属元素的非金属性越强。
如:∵酸性HClO4>H2SO4>H3PO4>H2CO3>H2SiO3∴非金属性Cl>S>P>C>Si有水参加的化学变化水是一种重要的、常用的溶剂,又能参与多种化学变化,现归纳如下:(化学方程式从略)1.潮解作用如CaCl2、NaOH等物质,当与空气接触时,可从空气中吸收一些水分,在表面上形成该物质的浓溶液。
因此这些药品常用作干燥剂。
2.水合作用从水溶液制备无机盐,许多无机盐常以水合晶体存在而得不到无水盐,如:FeSO4·7H2O,CuSO4·5H2O,MgCl2·6H2O3.水作氧化剂活泼金属单如:钾、钙、钠等有强还原性,在常温下与水剧烈反应,放出氢气。
在这些氧化还原反应中水是氧化剂。
4.水作还原剂最活泼的非金属单质氟气,可把氧从水中置换出来,此反应中水是还原剂。

高中化学非金属性强弱判断口诀有很多的同学是非常想知道,高中化学非金属性强弱判断口诀是什幺,小编整理了相关信息,希望会对大家有所帮助!1 非金属性强弱判断口诀是什幺1、由单质的氧化性判断,一般情况下,氧化性越强,对应非金属性越强。
2、由单质和酸或者和水的反应程度来看,反应越剧烈,非金属性越强。
(比如F2 Cl2 Br2 和H2O 的反应剧烈程度依次减弱非金属依次减弱)3、由对应氢化物的稳定性判断。
氢化物越稳定,非金属性越强,4、由和氢气化合的难易程度判断。
化合反应越容易,非金属性越强。
5、由最高价氧化物对应水化物的酸性来判断,酸性越强,非金属越强;6、由对应最低价阴离子的还原性判断,还原性越强,对应非金属性越弱;7、由置换反应判断!非金属强的强制弱!1 非金属性强弱变化的规律元素的非金属性包括很多方面:元素的原子得电子的能力,氢化物的稳定性,最高价氧化物水化物酸性强弱等。
它包含了原子得电子的能力(氧化性),但比氧化性的含义更为广泛。
元素的非金属性实际按照其电负性的强弱。
对于元素来说,元素的电负性常数越大,则其非金属性越强,但电负性标度不只一个,不同元素在不同标度中的电负性强弱也有所不同,且相同元素在不同物质中的电负性也有所不同,因此具体情况仍需具体分析。
非金属元素非金属性强弱:F>O>N>Cl>Br>S,I>C>Se>At>H>P>As>Te>B>Si 对于主族元素来说,同周期元素随着原子序数的递增,原子核电荷数逐渐增大,而电子层数却没有变化,因此原子核对核外电子的引力逐渐增强,随。
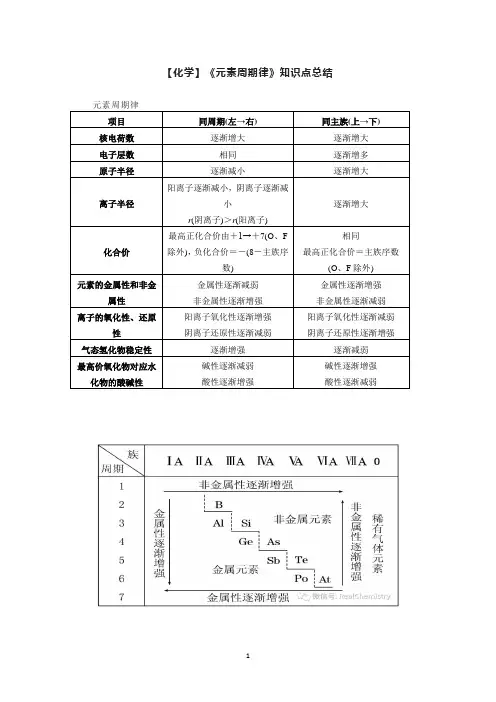
【化学】《元素周期律》知识点总结元素周期律项目同周期(左→右)同主族(上→下)核电荷数逐渐增大逐渐增大电子层数相同逐渐增多原子半径逐渐减小逐渐增大离子半径阳离子逐渐减小,阴离子逐渐减小r(阴离子)>r(阳离子)逐渐增大化合价最高正化合价由+1→+7(O、F除外),负化合价=-(8-主族序数)相同最高正化合价=主族序数(O、F除外)元素的金属性和非金属性金属性逐渐减弱非金属性逐渐增强金属性逐渐增强非金属性逐渐减弱离子的氧化性、还原性阳离子氧化性逐渐增强阴离子还原性逐渐减弱阳离子氧化性逐渐减弱阴离子还原性逐渐增强气态氢化物稳定性逐渐增强逐渐减弱最高价氧化物对应水化物的酸碱性碱性逐渐减弱酸性逐渐增强碱性逐渐增强酸性逐渐减弱重难突破一、元素金属性、非金属性比较1.元素金属性强弱的判断(1)比较元素的金属性强弱,其实质是看元素原子失去电子的难易程度,越容易失去电子,金属性越强。
(2)金属单质和水或非氧化性酸反应置换出氢越容易,金属性越强;最高价氧化物对应水化物的碱性越强,金属性越强。
2.元素非金属性强弱的判断(1)比较元素的非金属性强弱,其实质是看元素原子得到电子的难易程度,越容易得到电子,非金属性越强。
(2)单质越容易与氢气化合,生成的氢化物越稳定,非金属性越强;最高价氧化物对应水化物的酸性越强,说明其非金属性越强。
典例2X、Y为同周期元素,如果X的原子半径大于Y,则下列判断不正确的是()A.若X、Y均为金属元素,则X的金属性强于YB.若X、Y均为金属元素,则X的阳离子氧化性比Y的阳离子强C.若X、Y均为非金属元素,则Y的非金属性比X强D.若X、Y均为非金属元素,则最高价含氧酸的酸性Y强于X【答案】B典例1已知X、Y、Z是三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱的顺序是HXO4>H2YO4>H3ZO4,则下列判断正确的是()A.气态氢化物的稳定性:HX>H2Y>ZH3B.非金属活泼性:Y<X<ZC.原子半径:X>Y>ZD.原子最外层电子数:X<Y<Z【答案】A二、微粒半径大小的比较1. 同周期元素的微粒同周期元素的原子(稀有气体除外),从左到右原子半径或最高价阳离子的半径随核电荷数增大而逐渐减小。

金属性、非金属性强弱的判断原则及运用元素的金属性、非金属性强弱的判断是元素周期律学习的重点内容之一,也是元素与化合物的重点和难点,同时也是高考命题的热点。
元素的金属性是指元素原子失去电子的能力,元素的非金属是指元素原子得到电子的能力。
一、元素金属性、非金属性强弱的判断原则1. 根据元素周期表的知识进行判断在同一周期中,从左到右,随着原子序数的递增,元素的金属性逐渐减弱,非金属性逐渐增强。
最活泼的金属是Fr,天然存在的最活泼的金属是Cs;最活泼的非金属元素是F。
同一主族中,从上到下,随着原子序数的递增,元素的金属性逐渐增强,非金属性逐渐减弱。
元素周期表左边为活泼的金属元素,右边为活泼的非金属元素;中间的第VIA、VA族则是从非金属元素过渡到金属元素的完整的族,它们的同族相似性甚少,而具有十分明显的递变性。
当一种元素所在的周期序数与其所在的主族序数相等时,该元素为金属元素(H除外),但它既表现一定的金属性,也表现一定的非金属性。
2. 根据元素的单质及其化合物的性质进行判断。
(1)金属性强弱判断原则根据元素的单质与水或酸反应置换出氢的难易或反应的强烈程度进行判断:一般地,能与水反应产生氢气的金属元素的金属性比不能与水反应的金属元素强,与冷水反应产生氢气的金属元素的金属性比热水反应产生氢气的金属元素强。
根据元素的单质的还原性(或离子的氧化性)进行判断。
一般情况下,金属阳离子的氧化性越强,对应的金属单质的还原性越弱,金属性越弱。
根据元素的最高价氧化物对应水化物的碱性强弱进行判断:同周期由左至右元素最高价氧化物对应水化物的碱性渐弱(金属性渐弱),酸性渐强(非金属性渐强);同主族由上至下元素最高价氧化物对应水化物的碱性渐强(金属性渐强),酸性渐弱(非金属性渐弱)。
根据置换反应进行判断:一般是“强”置换“弱”。
根据原电池中正负极及金属腐蚀难易程度进行判断:一般地,负极为金属性强的元素的单质。
(2)非金属性强弱判断原则根据与H2反应生成气态氢化物的难易或反应的剧烈程度或生成的气态氢化物的稳定性强弱进行判断:同周期由左至右元素气态氢化物的稳定性渐强,元素的非金属性渐强;同主族由上至下元素气态氢化物的稳定性渐弱,元素的非金属性渐弱。

高考化学复习考点知识专题讲解专题十五、元素的金属性、非金属性强弱的比较考点知识元素的金属性、非金属性强弱的比较的知识年年必考,体现在六个方面:一是同周期的元素及化合物之间的转化关系;二是同主族的元素及化合物之间的转化关系;三是元素的氢化物的稳定性的比较,四是元素最高价氧化物对应的水化物的酸性(或碱性)的强弱比较。
五是单质与化合物之间的置换反应。
六是元素的金属性或非金属性的强弱比较。
主要题型为选择、计算、实验探究等。
以现代科技有关的问题,与社会生产生活紧密相连的问题为背景,考查Fe3+、Fe2+的氧化性、还原性。
饮用水的净化、FeCl3溶液腐蚀电路板等,也是热点之一。
重点、难点探源元素的金属性和非金属性的强弱的实质元素周期表中主族元素的递变规律主要化合价最高正价:+1→+7最低负价:主族序数-8 最高正价等于主族序数(O、F除外)最高价氧化物对应水化物的酸碱性酸性逐渐增强碱性逐渐减弱酸性逐渐减弱碱性逐渐增强非金属元素气态氢化物的形成及稳定性气态氢化物的形成越来越易,稳定性逐渐增强气态氢化物的形成越来越难,稳定性逐渐减弱追踪高考1.【2022江苏卷】短周期主族元素X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X 属于同一主族。
下列说法正确的是A.原子半径:r(W) > r(Z) > r(Y)B.由X、Y 组成的化合物中均不含共价键C.Y 的最高价氧化物的水化物的碱性比Z的弱D.X 的简单气态氢化物的热稳定性比W的强【答案】D【解析】短周期主族元素X、Y、Z、W原子序数依次增大;X是地壳中含量最多的元素,X为O元素;Y原子的最外层只有一个电子,Y为Na元素;Z位于元素周期表中IIIA 族,Z为Al元素;W与X属于同一主族,W为S元素。
A项,Na、Al、S都是第三周期元素,根据同周期从左到右主族元素的原子半径依次减小,原子半径:r(Y)r(Z)r(W),A项错误;B项,由X、Y组成的化合物有Na2O、Na2O2,Na2O 中只有离子键,Na2O2中既含离子键又含共价键,B项错误;C项,金属性:Na(Y)Al(Z),Y的最高价氧化物的水化物的碱性比Z的强,C项错误;D项,非金属性:O(X )S(W),X的简单气态氢化物的热稳定性比W的强,D项正确;答案选D。

元素金属性非金属性比较、简单微粒的半径比较及等电子体一、元素金属性非金属性强弱比较比较元素金属性强弱的依据:1、根据周期律进行比较;2、依据相同条件下金属单质与水或酸反应的剧烈程度进行比较。
与水或酸反应越容易、越剧烈,其金属性越强。
3、依据金属元素对应的最高价氧化物的水化物的碱性强弱进行比较。
碱性越强,其元素的金属性越强。
4、依据金属单质与盐溶液之间的置换反应进行比较。
较活泼金属置换出较不活泼金属。
注意:ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后生成的强碱再与盐发生复分解反应。
5、依据金属阳离子的放电(得电子,氧化性)顺序进行比较。
优先放电的阳离子,其元素的金属性弱。
比较元素非金属性强弱的依据:1、根据周期律进行比较;2、依据非金属单质与H2反应的难易程度、剧烈程度和生成气态氢化物的稳定性进行比较。
与氢气反应越容易、越剧烈,气态氢化物越稳定,其非金属性越强。
3、依据最高价氧化物的水化物的酸性强弱进行比较。
酸性越强,其元素的非金属性越强。
4、依据非金属单质与盐溶液中简单阴离子或非金属氢化物之间的置换反应进行比较。
非金属性较强的置换出非金属性较弱的。
5、根据非金属元素对应的简单阴离子的放电(失电子,还原性)顺序进行比较。
还原能力强的阴离子,其元素的非金属性弱。
例1、几种短周期元素的原子半径及主要化合价如下表:元素代号L M Q R T原子半径/nm 0.160 0.143 0.102 0.089 0.074主要化合价+2 +3 +6、-2 +2 -2下列叙述正确的是()A.T的氢化物的稳定性比Q的氢化物强 B.L、M的单质与稀盐酸反应速率:M > LC.T、Q的氢化物常态下均为无色气体 D.L、Q形成的简单离子核外电子数相等例2、下表是元素周期表的一部分,有关说法正确的是A.e的氢化物比d的氢化物稳定B.a、b、e三种元素的原子半径:e>b>aC.六种元素中,c元素单质的化学性质最活泼D.c、e、f的最高价氧化物对应的水化物的酸性依次增强二、简单微粒半径大小的比较方法1.根据元素周期律比较(包括同周期原子的半径比较规律、同主族原子及离子的半径比较规律);2.若几种微粒的核外电子排布相同(即电子数相同),则核电荷数越多,半径越小;写出2e-电子组、10电子组、18电子组简单微粒并比较半径大小:3.质子数相同时(即同一元素的原子与离子),电子数越多,半径越大;4.不满足上述三种情况时,依据“微粒的电子层数越多,半径越大”进行比较。

金属性与非金属性强弱的判断元素的金属性是指该元素的原子失电子能力的强弱,失电子能力越强,金属性越强,元素的非金属性是指该元素的原子得电子能力的强弱,得电子能力越强,非金属性越强。
一、元素金属性强弱的判断1、根据金属活动性顺序表判断:2、根据金属间的置换反应判断:金属甲能从金属乙的盐溶液里置换出乙,说明甲的金属性比乙强,例如:Cu+2Ag+ =Cu2++2Ag,可知铜的金属性强于银。
3、根据金属单质与水(或酸)反应生成氢气的难易判断:单质与水(或酸)反应放出氢气越容易,反应越剧烈,元素的金属性越强。
例如,碱金属元素随着原子序数的递增,单质与水反应越来越容易,反应越来越剧烈,元素的金属性越来越强。
4、根据最高价氧化物水化物的碱性强弱判断:最高价氧化物的水化物碱性越强,元素的金属性越强。
例如,氢氧化钠是强碱,氢氧化镁为中强碱,氢氧化铝为两性氢氧化物,则钠、镁、铝的金属性依次减弱。
5、根据阳离子氧化性的强弱判断:金属阳离子的氧化性越强,元素的金属性一般越弱。
例如,氧化性Fe2+>Zn2+,故锌的金属性比铁强。
6、根据金属原子失去电子的难易判断:金属原子失去电子转化为等电荷的阳离子时,吸收的热量越多,失电子越难,金属性就越弱。
二、元素非金属性强弱的判断1、根据非金属单质间置换反应判断:例如:Cl2+H2S=S↓+2HCl,可知氯的非金属性强于硫。
2、根据最高价氧化物的水化物的酸性强弱判断:最高价氧化物的水化物酸性越强,元素的非金属性越强。
例如,酸性HClO4> H2SO4>H3PO4>H2SiO3(HClO4是强酸,H3PO4是中强酸,H2SiO3弱酸),可判断出Cl,S,P,Si的非金属性依次减弱。
3、根据与氢气反应的难易程度或氢化物的稳定性判断:单质与氢气反应越容易,反应越剧烈,形成的氢化物越稳定,元素的非金属性越强。
例如,氟气与氢气在冷暗处就能剧烈化合并发生爆炸,氯气在光照下与氢气反应,溴单质在500℃与氢气反应,碘单质与氢气反应需要持续不断的加热,四种氢化物的稳定性顺序,故从氟到碘非金属性依次减弱。

元素金属性、非金属性强弱的判断依据元素金属性、非金属性与其对应单质或离子的还原性、氧化性有着密不可分的关系,他们具有统一性,其实质就是对应原子得失电子的能力,那么,如何判断元素金属性、非金属性强弱呢?这主要应从参加反应的某元素的原子得失电子的难易上进行分析,切忌根据每个原子得失电子数目的多少进行判断。
下面就针对元素金属性、非金属性强弱的判断方法做一简要分析和总结。
一、元素金属性强弱判断依据1、根据常见金属活动性顺序表判断金属元素的金属性与金属单质的活动性一般是一致的,即越靠前的金属活动性越强,其金属性越强。
Na Mg Al Zn Fe 。
单质活动性增强,元素金属性也增强需说明的是这其中也有特殊情况,如Sn和Pb,金属活动性Sn﹥Pb,元素的金属性是Sn﹤Pb,如碰到这种不常见的元素一定要慎重,我们可采用第二种方法。
2、根据元素周期表和元素周期律判断同周期元素从左到右金属性逐渐减弱,如第三周期Na ﹥Mg ﹥Al;同主族元素从上到下金属性增强,如1中所述,Sn和Pb同属Ⅳ主族,Sn在Pb的上方,所以金属性Sn﹥Pb。
3、根据物质之间的置换反应判断通常失电子能力越强,其还原性越强,金属性也越强,对于置换反应,强还原剂和强氧化剂生成弱还原剂和弱氧化剂,因而可由此进行判断。
如:Fe + Cu2+ === Fe2+ + Cu 说明铁比铜金属性强。
这里需说明的是Fe对应的为Fe2+,如:Zn + Fe2+ === Zn2+ + Fe 说明金属性Zn﹥Fe,但Cu +2Fe3+ === Cu2+ + 2Fe2+,却不说明金属性Cu﹥Fe,而实为Fe ﹥Cu。
4、根据金属单质与水或酸反应的剧烈程度或置换氢气的难易判断某元素的单质与水或酸反应越容易、越剧烈,其原子失电子能力越强,其金属性就越强。
如Na与冷水剧烈反应,Mg与热水缓慢反应,而Al与沸水也几乎不作用,所以金属性有强到弱为Na ﹥Mg ﹥Al;再如:Na、Fe、Cu分别投入到相同体积相同浓度的盐酸中,钠剧烈反应甚至爆炸,铁反应较快顺利产生氢气,而铜无任何现象,根本就不反应,故金属性强弱:Na ﹥Mg ﹥Al。

元素周期表金属性强弱顺序
【示例范文仅供参考】
---------------------------------------------------------------------- 元素周期表金属性强弱顺序为:
一、金属性:
1、同一周期,从左往右金属性逐渐减弱(如:Na>Mg)。
2、同一主族,从上往下金属性逐渐增强(如:K>Na)。
3、元素的金属性越强,它的单质的还原性(失电子能力)越强。
4、元素的金属性越强,它的单质与水或酸反应越剧烈,对应的碱的碱性也越强(如:Na>Mg,碱性NaOH>Mg(OH)2。
二、非金属性:
1、同一周期,从左往右非金属性逐渐增强(如:F>O)。
2、同一主族,从上往下非金属性逐渐减弱(如:F>Cl)。
3、元素的非金属性越强,它的单质的氧化性(得电子能力)越强、(如:非金属性最强的氟F不显正价)。
4、元素非金属性越强,元素最高价氧化物所对应的酸酸性越强。
5、元素非金属性越强,元素所对应的氢化物越稳定。

元素金属性及非金属性的比较方法一、元素金属性的比较方法1、用失去电子的难易比较:金属原子失去电子越容易,金属元素的金属性就越强;金属原子失去电子越不容易,金属元素的金属性就越弱。
例如:钠比镁更容易失去电子,钠金属性比镁强。
2、用与水反应产生氢气的能力比较:金属越容易和水反应产生氢气,金属性就越强;金属越难和水反应产生氢气,金属性就越弱。
例如:钠可以与冷水剧烈反应,而镁要与热水才反应,铝与热水不反应,要在氢氧化钠溶液中才与水反应,说明金属性Na>Mg>Al3、用与H+反应产生氢气的能力比较:金属与H+反应越容易,越剧烈,说明金属性越强。
金属与H+反应越难,越不反应,说明金属性越弱。
例如:镁、铝、锌和同浓度的盐酸反应,镁剧烈反应,铝比较缓慢,而锌就更缓慢,说明金属性Mg>Al>Zn4、用同一周期或同一主族最高价氧化物的水化物的碱性进行比较:同一周期或同一主族最高价氧化物的水化物碱性越强,该金属元素的金属性越强。
最高价氧化物的水化物碱性越弱,该金属元素的金属性越弱。
例如:碱性NaOH>Mg(OH)2>Al(OH)3说明金属性Na>Mg>Al碱性Be(OH)2<Mg(OH)2<Ca(OH)2<Sr(OH)2<Ba(OH)2说明金属性Be<Mg<Ca<Sr<Ba5、用原子结构特征进行比较:原子的核外电子排布中,电子层数越多,最外层电子数越少,元素的金属性就越强。
例如:K有3层,最外层1个电子,铍有2层,最外层2个电子,金属性K>Be6、通过元素周期表的位置进行比较:同一周期,自左而右,元素的金属性减弱;同一主族,自上而下,元素的金属性依次增强。
例如:金属性K>Ca>Ga Rb>K>Na>Li7、用彼此在水溶液中发生置换反应来比较:金属性强的金属能把金属性弱的金属从其可溶性盐溶液中置换出来。
高中化学非金属性强弱判断口诀1、由单质的氧化性判断,一般情况下,氧化性越强,对应非金属性越强。
2、由单质和酸或者和水的反应程度来看,反应越剧烈,非金属性越强。
(比如F2 Cl2 Br2 和H2O的反应剧烈程度依次减弱非金属依次减弱)3、由对应氢化物的稳定性判断。
氢化物越稳定,非金属性越强,4、由和氢气化合的难易程度判断。
化合反应越容易,非金属性越强。
5、由最高价氧化物对应水化物的酸性来判断,酸性越强,非金属越强;6、由对应最低价阴离子的还原性判断,还原性越强,对应非金属性越弱;7、由置换反应判断!非金属强的强制弱!元素的非金属性包括很多方面:元素的原子得电子的能力,氢化物的稳定性,最高价氧化物水化物酸性强弱等。
它包含了原子得电子的能力氧化性,但比氧化性的含义更为广泛。
元素的非金属性实际按照其电负性的强弱。
对于元素来说,元素的电负性常数越大,则其非金属性越强,但电负性标度不只一个,不同元素在不同标度中的电负性强弱也有所不同,且相同元素在不同物质中的电负性也有所不同,因此具体情况仍需具体分析。
非金属元素非金属性强弱:F>O>N>Cl>Br>S,I>C>Se>At>H>P>As>Te>B>Si对于主族元素来说,同周期元素随着原子序数的递增,原子核电荷数逐渐增大,而电子层数却没有变化,因此原子核对核外电子的引力逐渐增强,随原子半径逐渐减小,原子失电子能力减弱,原子得电子能力增加,元素非金属性逐渐增大。
1 . 根据元素周期表判断同周期从左到右,非金属性逐渐增强;同主族从上到下非金属性逐渐减弱。
2 . 从元素单质与氢气化合难易上比较非金属单质与H2化合越容易,则非金属性越强。
如:F2与H2可爆炸式的反应,Cl2与H2点燃或光照即可剧烈反应,Br2与H2需在200℃时才缓慢进行,而I2与H2的反应需在更高温度下才能缓慢进行且生成的HI很不稳定,同时发生分解,故非金属性F>Cl>Br>I。
元素金属性、非金属性强弱的判断依据元素金属性、非金属性与其对应单质或离子的还原性、氧化性有着密不可分的关系,他们具有统一性,其实质就是对应原子得失电子的能力,那么,如何判断元素金属性、非金属性强弱呢?这主要应从参加反应的某元素的原子得失电子的难易上进行分析,切忌根据每个原子得失电子数目的多少进行判断。
下面就针对元素金属性、非金属性强弱的判断方法做一简要分析和总结。
一、元素金属性强弱判断依据1、根据常见金属活动性顺序表判断金属元素的金属性与金属单质的活动性一般是一致的,即越靠前的金属活动性越强,其金属性越强。
Na Mg Al Zn Fe 。
单质活动性增强,元素金属性也增强Sn和Pb,金属活动性Sn>Pb,元素的金属性是Sn<需说明的是这其中也有特殊情况,如Pb,如碰到这种不常见的元素一定要慎重,我们可采用第二种方法。
2、根据元素周期表和元素周期律判断同周期元素从左到右金属性逐渐减弱,如第三周期Na > Mg > Al;同主族元素从上到下金属性增强,如1中所述,Sn和Pb同属R主族,Sn在Pb的上方,所以金属性Sn> Pb。
3、根据物质之间的置换反应判断通常失电子能力越强,其还原性越强,金属性也越强,对于置换反应, 强还原剂和强氧化剂生成弱还原剂和弱氧化剂,因而可由此进行判断。
女口:Fe + Cu2+=== Fe2++ Cu说明铁比铜金属性强。
这里需说明的是Fe对应的为Fe2+, 如: Zn + Fe2+=== Zn2++ Fe说明金属性Zn> Fe, 但Cu +2Fe3+=== Cu2+ + 2Fe2+却不说明金属性Cu > Fe,而实为Fe> Cu。
4、根据金属单质与水或酸反应的剧烈程度或置换氢气的难易判断某元素的单质与水或酸反应越容易、越剧烈,其原子失电子能力越强,其金属性就越强。
如Na 与冷水剧烈反应,Mg 与热水缓慢反应,而Al 与沸水也几乎不作用,所以金属性有强到弱为Na > Mg > Al;再如:Na、Fe、Cu分别投入到相同体积相同浓度的盐酸中,钠剧烈反应甚至爆炸,铁反应较快顺利产生氢气,而铜无任何现象,根本就不反应,故金属性强弱:Na > Mg > Al。
元素金属性、非金属性强弱的判断、微粒半径大小的比较元素金属性、非金属性与其对应单质或离子的还原性、氧化性有着密不可分的关系,他们具有统一性,其实质就是对应原子得失电子的能力,那么,如何判断元素金属性、非金属性强弱呢?这主要应从参加反应的某元素的原子得失电子的难易上进行分析,切忌根据每个原子得失电子数目的多少进行判断。
下面就针对元素金属性、非金属性强弱的判断方法做一简要分析和总结。
一、元素金属性强弱判断依据1、根据常见金属活动性顺序表判断金属元素的金属性与金属单质的活动性一般是一致的,即越靠前的金属活动性越强,其金属性越强。
Na Mg Al Zn Fe 。
单质活动性增强,元素金属性也增强需说明的是这其中也有特殊情况,如Sn和Pb,金属活动性Sn﹥Pb,元素的金属性是Sn ﹤Pb,如碰到这种不常见的元素一定要慎重,我们可采用第二种方法。
2、根据元素周期表和元素周期律判断同周期元素从左到右金属性逐渐减弱,如第三周期Na ﹥Mg ﹥Al;同主族元素从上到下金属性增强,如1中所述,Sn和Pb同属Ⅳ主族,Sn在Pb的上方,所以金属性Sn﹥Pb。
3、根据物质之间的置换反应判断通常失电子能力越强,其还原性越强,金属性也越强,对于置换反应,强还原剂和强氧化剂生成弱还原剂和弱氧化剂,因而可由此进行判断。
如:Fe + Cu2+ === Fe2+ + Cu 说明铁比铜金属性强。
这里需说明的是Fe对应的为Fe2+,如:Zn + Fe2+ === Zn2+ + Fe 说明金属性Zn﹥Fe,但Cu +2Fe3+ === Cu2+ + 2Fe2+,却不说明金属性Cu﹥Fe,而实为Fe﹥Cu。
4、根据金属单质与水或酸反应的剧烈程度或置换氢气的难易判断某元素的单质与水或酸反应越容易、越剧烈,其原子失电子能力越强,其金属性就越强。
如Na与冷水剧烈反应,Mg与热水缓慢反应,而Al与沸水也几乎不作用,所以金属性有强到弱为Na ﹥Mg ﹥Al;再如:Na、Fe、Cu分别投入到相同体积相同浓度的盐酸中,钠剧烈反应甚至爆炸,铁反应较快顺利产生氢气,而铜无任何现象,根本就不反应,故金属性强弱:Na ﹥Mg ﹥Al﹥Fe﹥Cu。
如何比较元素非金属性的相对强弱?黄明建一、原子得电子能力的强弱是元素非金属性强弱的本质反映原子..得电子能力的强弱与元素非金属性的强弱正相关,即:元素原子得电子的能力越强,元素的非金属性就越强。
而原子得电子能力的强弱是由原子结构决定的。
对于原子核外电子层数相同......的元素来说,核电荷数越大,原子半径越小,核对外层电子的吸引力越大,原子得电子的能力就越强,元素的非金属性越强;对于原子最外层电子数相同........(或外围电子层排布相似)的元素来说,核外电子层数越多,原子半径越大,核对外层电子的吸引力越小,原子得电子的能力就越弱,元素的非金属性越弱。
据此,“非金属单质与化合物间的置换反应”就常常成为判断元素非金属性强弱的一个重要依据。
二、以置换反应判断元素非金属性强弱需注意的问题以置换反应作为判断元素非金属强弱的依据,须有一个大前提——非金属单质.......在反应中是作...,这样才能保证据此判断的结果不与元素非金属性强弱的本质相悖。
....氧化剂例如,下面几个反应:Cl2 + 2NaBr =2NaCl + Br2………………①Cl2 + H2S =2HCl + S↓………………②Br2 + 2KI =2NaBr + I2………………③O2 + 2H2S =2H2O + 2S↓………………④反应①②均是Cl2作氧化剂,分别从NaBr溶液和氢硫酸中置换出Br2和S,表现出Cl比Br和S原子得电子能力都要强,所以元素的非金属性强弱次序是:Cl>Br Cl>S反应③是以Br2作氧化剂,从KI溶液中置换出I2;反应④是以O2作氧化剂,从氢硫酸中置换出S;表现出Br比I原子得电子能力强、O比S原子得电子能力强,所以元素的非金属性强弱次序是:Br>I O>S但是,有些置换反应就不宜用于判断元素非金属性的相对强弱。
例如:I2 + 2KClO3=Cl2 + 2KIO3………………⑤高温2C + SiO2 === 2CO + Si ………………⑥显然,我们不能因为反应⑤来判断碘元素比氯元素的非金属性强。
一、元素的金属性、非金属性强弱判断依据(1)元素的金属性强弱判断依据①单质与水(或酸)反应置换出氢的难易程度。
(反应置换H2越容易,元素的金属性越强。
)②元素的最高价氧化物对应的水化物——氢氧化物的碱性强弱。
(最高氧化物水化物的碱性越强,元素的金属性越强。
)③金属和金属阳离子的水溶液的置换反应判断。
一般情况下,金属在溶液中的活动性越强,其元素的金属性越强,但有特殊情况。
④金属阳离子的氧化性越强则对应金属元素的金属性越弱,如氧化性Na+ <Mg2+ <Al3+则元素金属性Na>Mg>Al(2)元素非金属性的强弱判断依据①单质H2化合的难易及其气态氢化物稳定性。
②元素最高价氧化物水化物——最高价含氧酸的酸性强弱。
(酸性越强,元素的非金属性就越强。
)③元素单质与其它非金属离子之间的置换反应。
非金属性强的元素的单质,将非金属性弱的单质从其盐溶液中置换出来(F2除外)。
④非金属阴离子的还原性越强则对应非金属元素的非金属性越弱,如还原性S2- > I- >Br-则元素非金属性S < I < Br【纠错矫正】【例1】元素X、Y是最外层电子数相同,Y原子比X原子多一个电子层,它们都可以形成气态氢化物HX和HY,则()A、X元素的非金属性比Y元素弱B、气态氢化物HX比HY稳定C、Y单质可将X从它的化合物中置换出来D、X、Y的单质都易溶于有机溶剂答案:B、D解析:X和HY可知,X和Y的最低价为-1价。
X和Y都是卤素;Y原子比X 原子多一层电子,则Y在X的下一周期。
同一主族的非金属元素,从上到下,非金属性逐渐减弱,即非金属性:X>Y,X的单质可以将Y从它的化合物中置换出来,故A、C错误,B、D正确。
【例2】下列叙述中能肯定金属A比金属B更活泼的是()A、A原子的最外层电子数比B原子的最外层电子数少B、A原子的电子层数比B原子的多C、1molA从酸中置换H+生成H2比1molB从酸中置换H+生成的H2多D、常温时,A能从水中置换出氢,而B不能答案:D解析:A项只指出A、B两种元素原子的最外层电子数的多少,因而不能确定A、B的金属性的强弱。