双黄连口服液生产工艺规程
- 格式:doc
- 大小:163.70 KB
- 文档页数:18

双黄连口服液工艺规程有限公司双黄连口服液工艺规程1 目的:建立双黄连口服液的生产工艺规程,形成双黄连口服液的生产总则,使生产能按规定的工艺程序进行。
2适用范围:适用于双黄连口服液的生产全过程。
3 责任者:口服溶液剂生产线生产人员负责实施,生产部及质保部负责监督。
4 正文:一、产品概述:通用名:双黄连口服液商品名:/// 剂型: 口服溶液剂规格: 250ml/ 瓶包装规格:250ml/瓶×30瓶/ 件批准文号:待批二、处方和依据处方:每批投料量(75000ml)处方依据:《中华人民共和国兽药典》2010 年版二部生产工艺流程及环境区域划分示意图提取部分:图示:般生产区100,000级制剂部分:反渗透离子交换配制贴标图示:般生产区100,000 级洁净区四、生产过程及工艺条件中药前处理过程:1. 依据配料单对药材进行验收,核对其品名、数量、规格、件数、批号、质量、日期等,确认后,开始下列步骤。
2. 投料量为处方量的整倍量,但不超过多功能提取罐80%的量。
批次划分以多功能提取罐一次为标准3.提取、浓缩:金银花、黄芩、连翘3 味,黄芩切片,加水煎煮3 次,第一次2 小时,第二、三次各1 小时,合并煎液,滤过,滤液浓缩并在80 ℃时加入2mol/L 盐酸溶液适量调节pH值1.0 ~2.0 ,加温1 小时,静止12小时,滤过,沉淀加6~8倍量水,用40%氢氧化钠溶液调pH值至7.0 ,再加等量乙醇,搅拌使溶解,滤过,滤液用2mol/L 盐酸溶液调pH值至2.0 ,60℃保温30 分钟,静置12 小时,滤过,沉淀用乙醇洗至pH值至7.0 ,挥尽乙醇备用。
金银花、连翘加水温浸0.5 小时后,煎煮二次,每次1.5 小时,合并煎液,滤过,滤液,滤液浓缩至相对密度为1.20~1.25(70~80℃测),冷至40℃时缓慢加入乙醇,使含醇量达75%,充分搅拌,静置12小时,滤取上清液,残渣加75%乙醇适量,搅匀,静置12 小时,滤过,合并乙醇液,回收乙醇至无醇味,加入黄芩提取物,并加水适量,以40%氢氧化钠溶液调节pH值至7.0 ,搅匀,冷藏(4~8℃)72小时,做好原始记录。

制药有限公司双黄连口服液生产工艺规程颁发单位:GMP办公室工艺规程批准程序目录1、剂型及规格 (3)2、处方和依据 (3)3、生产过程质控要点 (3)4、生产的工艺流程图 (4)5、操作过程及工艺条件 (4)6、工艺过程中所需SOP名称及要求 (8)7、工艺卫生及环境卫生 (8)8、工艺验证及具体要求 (9)9、设备一览表及主要设备生产能力 (9)10、物料平衡及经济技术指标计算 (9)11、技术安全及劳动保护 (10)12、劳动组织与岗位定员 (10)1.剂型及规格剂型:合剂。
2.处方和依据2005版《中华人民共和国兽药典》第二部。
3.生产过程质控要点:4.生产的工艺流程图5.操作过程及工艺条件5.1 生产前准备:5.1.1上一批次是否进行清场。
清场者、检查者是否签字,将“清场合格证”副件归入本批生产记录。
未取得清场合格证不得进行下一批次的生产。
5.1.2检查生产场所的环境、设施卫生是否符合该区域清洁卫生要求。
不得有上批生产遗留物。
5.1.3检查设备有“已清洁”标牌,并进行试运转,检查合格后,挂上“运行中”标牌后才能使用。
所有工具、容器、设备是否已按清洗规程完成并符合标准。
5.1.4对计量容器、衡器要进行检查、校正以后才能使用。
5.1.5检查与生产相适应的相关文件,记录等是否齐全。
5.1.6对所用物料、半成品核对品名、规格、批号、数量,准确无误后方可使用。
5.2 指令的下达:由生产部提前一天下达批生产指令单与批包装指令单,质管部审核后工艺员将批生产指令一份送中药原辅料仓库管理员,另一份送生产部口服液车间班长,准备生产。
5.3 备料仓库管理员根据批生产指令,按《原辅料备料、称量岗位操作规程》准备所需原料、辅料,按包装指令和《标签、包装、使用说明书管理制度》准备规定数量的包装材料。
并由质量监督员复核品名、数量、规格、编号、检验报告单,复核无误后,通知生产部领料。
5.4 领料5.4.1由领料员接收物料,领料时严格按《领料岗位操作规程》操作,并由质量监督员进行监督复核,复核物料的品名、规格、编号、数量、供货单位及检验合格证明,核对无误后由领料员在领料单及批生产指令单上签字。
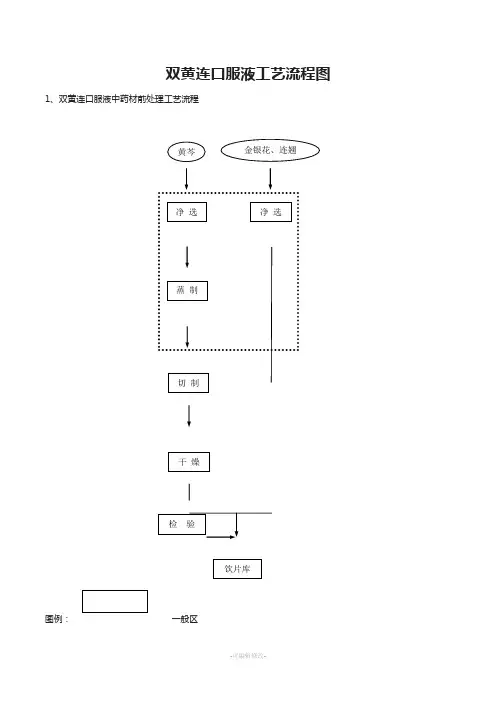
双黄连口服液工艺流程图
1、双黄连口服液中药材前处理工艺流程
图例: 一般区
备注:如果采购的中药材为中药饮片,那么虚线内的工序可以省略。
6000L)
小时
6倍量(约4500L)
1小时
倍量(约4500L)
煎煮1小时
弃去
12小时。
氢氧化钠调pH 值7.0,再加等量乙醇
2.0,60℃保温30分钟,静置12小时
图例: 图2黄芩提取物
3
加入与一次醇沉等量的75%
图例: 相对密度1.20~1.30(70~80
一般区 4 双黄连口服液制剂工艺流程图
图例: D 级洁净区
一般区
THANKS
致力为企业和个人提供合同协议,策划案计划书,学习课件等等
打造全网一站式需求
欢迎您的下载,资料仅供参考。

双黄连口服液工艺规程******* 有限公司文件名 : 双 黄连口服液工艺规 程 生效日 期:年月日颁 发部门: GMP 办 公室分发至 : 生 产部、 生产车 间、 质量保证部 变 修订号 修订人 批准 日期 生效 日期 原 因 及 目 的更记载双黄连口服液工艺规程制定人 : 日期: 年 月 日 文 件类 型: 技术 标准 审核人 : 日期: 年 月 日 版 次: 第一版 批准人 :日期:年 月 日 印数: 共 4 份1 目 的:建立双黄连口服液的生产工艺规程, 形成双黄连口服液的生产总则, 使生产能按规定的工艺程序进行。
2 适用范围:适用于双黄连口服液的生产全过程。
3 责 任 者:口服溶液剂生产线生产人员负责实施,生产部及质保部负责监督。
4 正文 :一、产品概述:通 用 名:双黄连口服液商 品 名: /// 剂 型: 口服溶液剂 规格: 250ml/ 瓶包装规格: 250ml/ 瓶× 30 瓶/ 件批准文号:待批 二、处方和依据处方:每批投料量(75000ml)原辅料名称每1000ml 用量每批生产用量黄芩375g 28.125 ㎏金银花375g 28.125 ㎏连翘750g 56.25kg蔗糖2g 150g苯甲酸钠4g 300g纯化水至1000ml 7,5000ml处方依据:《中华人民共和国兽药典》2010 年版二部生产工艺流程及环境区域划分示意图提取部分:图示:中药材配液煎煮一般生产区过滤100,000 级浓缩中间品检验醇沉过滤浓缩收膏室制剂部分:饮用水反渗透离子交换纯化水双黄连提取液沙星称量配制中间品检验过滤免洗瓶灌装瓶盖旋盖封图示:贴标一般生产区纸箱包装100,000 级洁净区成品检验入库四、生产过程及工艺条件中药前处理过程:1. 依据配料单对药材进行验收,核对其品名、数量、规格、件数、批号、质量、日期等,确认后,开始下列步骤。
2. 投料量为处方量的整倍量,但不超过多功能提取罐80%的量。

双黄连口服液的制备一、药品简介双黄连口服液是以金银花、黄芩、连翘为主要原料精制而成的抗菌抗病毒的纯中药制剂。
(1)处方:(1000ml)金银花380g 黄芩380g 连翘750g 蔗糖350g 香精适量(2)性状:本品为棕红色的澄清液体;味甜、微苦。
(3)主要功效;疏风解表、清热解毒之功效。
用于外感风热所致的感冒,症见发热,咳嗽,咽痛。
(4)药理作用:双黄连口服液对多种病菌抑制作用,如链球菌、肺炎双球菌、金葡萄菌、伤寒杆菌、副伤寒杆菌、大肠杆菌、绿脓杆菌、福氏杆菌、宋内氏杆菌、志贺氏杆菌、鲍氏杆菌、革兰氏阴性菌、小肠结肠炎耶氏菌等。
抑制病毒作用有流感病毒甲、乙型、上呼吸道合胞病毒、柯萨奇病毒、艾可病毒、流行性腮腺炎病毒、带状疱疹病毒等。
还具有消炎、解热、阵痛作用。
还具有提高细胞免疫作用,调节和增强机体的多种免疫功能。
二、制备步骤a、每1000mL口服液的原料组成为金银花350~400g、黄芩350~400g、连翘700~800g、蔗糖300~400g。
b、金银花加水温浸30分钟后,煎煮二次,每次2小时,合并煎液,滤过,滤液浓缩至70~80℃相对密度为1.20~1.25的清膏,冷却后缓缓加入乙醇使含醇量达60~80%,充分搅拌,静置12小时,滤取上清液,用氢氧化钠溶液调节pH值,残渣加75%乙醇适量,搅匀,静置12小时,滤过,合并乙醇液,回收乙醇至无醇味,加入5-10倍量水水沉,滤过,滤液浓缩,减压干燥,粉碎成细粉,得金银花提取物。
c、连翘加水温浸30分钟后,煎煮二次,第一次2小时,第二次1小时,合并煎液,滤过,滤液浓缩至70~80℃相对密度为1.20~1.25的清膏,冷却后缓缓加入乙醇使含醇量达60~80%,充分搅拌,静置12小时,滤取上清液,用氢氧化钠溶液调节pH值,残渣加75%乙醇适量,搅匀,静置12小时,滤过,合并乙醇液,回收乙醇至无醇味,加入5-10倍量水水沉,滤过,滤液浓缩,减压干燥,粉碎成细粉,得连翘提取物。

双黄连口服液工艺流程图双黄连口服液是一种广泛用于治疗感冒、发热等症状的中药制剂。
下面是双黄连口服液的工艺流程图,分为原料准备、制粉、煎煮、过滤、加工和包装等几个步骤。
1. 原料准备:首先要准备双黄连的原料,包括双黄连、黄连、黄芩、黄柏、金银花等药材。
这些药材要进行检验,确保其质量符合标准。
2. 制粉:将准备好的药材进行研磨,以便更好地释放药效。
采用粉碎机将药材研磨成粉末,并筛选出合适的颗粒大小。
3. 煎煮:将制粉好的药材放入煎煮锅中加水,按比例配好,加热至沸腾。
这个过程需要掌握好温度和时间,以充分提取药材中的有效成分。
4. 过滤:煮好的药液需要经过过滤,去除杂质和残渣。
使用滤纸或滤网进行过滤,得到纯净的药液。
5. 加工:将过滤好的药液放入加工机中加入适量的调味剂,如蜂蜜、蔗糖等,以改善口感和增加患者的服用欲望。
6. 浓缩:将加工好的药液进行浓缩,通过一定的温度和时间控制,将药液中的水分蒸发掉,使药液浓缩成口服液的浓度。
7. 冷却:将浓缩好的药液进行冷却,使其温度降到合适的范围,以便于包装和储存。
8. 包装:将冷却好的口服液倒入瓶子或袋子中,并进行封口,以防止口服液被污染。
可以根据需要进行分装,方便患者使用。
9. 检验:对包装好的口服液进行检验,包括外观、颜色、pH值等指标,确保质量符合标准。
10. 储存:将检验合格的口服液存放在干燥、阴凉的地方,避免阳光直射和高温,以保持其药效。
双黄连口服液的工艺流程如上所述,每个步骤都要进行严格的控制和检验,以确保生产出高质量的口服液。
这样制造出的双黄连口服液能够更好地发挥其治疗感冒、发热等症状的药效,为患者带来更好的疗效。

双黄连口服液工艺规程目的:建立本公司双黄连口服液生产的工艺流程、质量控制要求、工艺处方、质量标准、主要生产设备、产品包装及贮存条件、劳动定员等内容。
适用范围:本规程适用于本公司双黄连口服液的生产。
责任:车间主任负责组织本规程的起草与修订;车间各岗位负责实施本规程;生产管理部经理负责本规程的审核以及发放管理;质保部经理负责本规程的批准执行。
正文:一、产品名称、规格1 名称:双黄连口服液2 规格:200ml二、处方、依据金银花375g 黄芩375g 连翘750g 标准依据:《中国兽药典》2005版二部三、工艺流程示意图四、车间和设备要求1 车间的布局应符合工艺流程的要求,有足够的空间和场所,做到合理地安置设备和堆放物料。
2 生产车间设置在十万级洁净生产区内,各工序要有相对独立的生产操作间,足够的辅助用房,建筑设施符合十万级洁净生产区的要求。
3 必须具备与生产品种相适应的设备,如配液罐、灌装机等设备。
五、生产准备生产操作前,由专人对生产准备情况进行检查,并记录。
检查应包括以下内容: 1 检查确认该品种的生产指令单及相应配套文件,如工艺规程、岗位标准操作规程、清洁规程、口服液半成品质量监控要点及记录等是否准备齐全,并是现行文件。
2 检查确认本批生产的双黄连的原料、纯化水的数量是否与生产指令单相符并有合格证书。
现场是否有“清场合格证”。
3 对设备状况进行检查,挂有“完好”、“已清洁”状态标示牌的设备方可使用。
4 称量前,称量器必须每次调零,并定期由计量部门专人校验,做好记录。
六、生产过程1领料员在领取由生产管理部核算好原辅料使用量并已批准的生产指令单进行领料后,将料拉至车间。
第 4 页共 16 页2 称量2.1直接使用的物料,须清洁外包装。
2.2称量人认真校对金银花、黄芩、连翘的品名、规格、批号、数量等,应与生产指令单相符,确认无误后进行定额称量,记录并签名。
先将处方量的金银花150kg、黄苓150kg、连翘300kg以上3味,黄苓切片,加水煎煮三次,第一次2小时,第二、三次各1小时,合并煎液,滤过,滤液浓缩并在80℃时加入2mol/L盐酸溶液适量调节PH值至1.0~2.0保温1小时,静置12小时,滤过,沉淀加6~8倍量水,用40%氢氧化钠溶液调PH值至7.0。

双黄连口服液工艺规程*******有限公司双黄连口服液工艺规程1目的:建立双黄连口服液的生产工艺规程,形成双黄连口服液的生产总则,使生产能按规定的工艺程序进行。
2适用范围:适用于双黄连口服液的生产全过程。
3责任者:口服溶液剂生产线生产人员负责实施,生产部及质保部负责监督。
4正文:一、产品概述:通用名:双黄连口服液商品名:///剂型: 口服溶液剂规格: 250ml/瓶包装规格:250ml/瓶×30瓶/件批准文号:待批二、处方和依据处方:每批投料量(75000ml)处方依据:《中华人民共和国兽药典》2010年版二部生产工艺流程及环境区域划分示意图提取部分:图示:一般生产区100,000制剂部分:图示:一般生产区100,000级洁净区四、生产过程及工艺条件中药前处理过程:1. 依据配料单对药材进行验收,核对其品名、数量、规格、件数、批号、质量、日期等,确认后,开始下列步骤。
2. 投料量为处方量的整倍量,但不超过多功能提取罐80%的量。
批次划分以多功能提取罐一次为标准3.提取、浓缩:金银花、黄芩、连翘3味,黄芩切片,加水煎煮3次,第一次2小时,第二、三次各1小时,合并煎液,滤过,滤液浓缩并在80℃时加入2mol/L盐酸溶液适量调节pH值1.0~2.0,加温1小时,静止12小时,滤过,沉淀加6~8倍量水,用40%氢氧化钠溶液调pH值至7.0,再加等量乙醇,搅拌使溶解,滤过,滤液用2mol/L盐酸溶液调pH值至2.0,60℃保温30分钟,静置12小时,滤过,沉淀用乙醇洗至pH值至7.0,挥尽乙醇备用。
金银花、连翘加水温浸0.5小时后,煎煮二次,每次1.5小时,合并煎液,滤过,滤液,滤液浓缩至相对密度为1.20~1.25(70~80℃测),冷至40℃时缓慢加入乙醇,使含醇量达75%,充分搅拌,静置12小时,滤取上清液,残渣加75%乙醇适量,搅匀,静置12小时,滤过,合并乙醇液,回收乙醇至无醇味,加入黄芩提取物,并加水适量,以40%氢氧化钠溶液调节pH值至7.0,搅匀,冷藏(4~8℃)72小时,做好原始记录。

双黄莲口服液生产工艺
1 处方
以金银花、黄芩、连翘为主要原料,经提取、浓缩、配制、灌封、灭菌、精制加工制成的口服溶液食品。
组方;金银花375g、黄芩375g、连翘750g
2处方依据
依据xxxxxxx有限责任公司企业标准Q/JPXY 0xx-20xx制定
3生产工艺
3.1 粉碎
3.1.1 金银花洗净后干燥粉碎
3.1.2 黄芩洗净后干燥粉碎
3.1.3 连翘洗净后干燥粉碎
3.2 提取
3.2.1 将金银花粉在提取罐中提取3小时,连续提取3次,合并提取液
3.2.2 将黄芩粉在提取罐中提取3小时,连续提取3次,合并提取液
3.2.3 将连翘粉在提取罐中提取3小时,连续提取3次,合并提取液
3.3 浓缩
3.3.1 将金银花粉提取液煎煮2小时后收膏
3.3.2 将黄芩粉提取液煎煮2小时后收膏
3.3.3 将连翘粉粉提取液煎煮2小时后收膏
3.4 配制
将金银花膏、黄芩膏、连翘膏按一定的比例混合搅拌均匀
3.5 灌封
将配制好的口服液灌装进10ml小玻璃瓶中
3.6 灭菌
用高压蒸汽灭菌1小时
3.7 检验
按xxxxxxx有限责任公司企业标准Q/JPXY 0xx-20xx检验,合格后出厂。

双黄连口服液工艺规程目的:建立本公司双黄连口服液生产的工艺流程、质量控制要求、工艺处方、质量标准、主要生产设备、产品包装及贮存条件、劳动定员等内容。
适用范围:本规程适用于本公司双黄连口服液的生产。
责任:车间主任负责组织本规程的起草与修订;车间各岗位负责实施本规程;生产管理部经理负责本规程的审核以及发放管理;质保部经理负责本规程的批准执行。
正文:一、产品名称、规格1 名称:双黄连口服液2 规格:200ml二、处方、依据金银花375g 黄芩375g 连翘750g 标准依据:《中国兽药典》2005版二部三、工艺流程示意图四、车间和设备要求1 车间的布局应符合工艺流程的要求,有足够的空间和场所,做到合理地安置设备和堆放物料。
2 生产车间设置在十万级洁净生产区内,各工序要有相对独立的生产操作间,足够的辅助用房,建筑设施符合十万级洁净生产区的要求。
3 必须具备与生产品种相适应的设备,如配液罐、灌装机等设备。
五、生产准备生产操作前,由专人对生产准备情况进行检查,并记录。
检查应包括以下内容: 1 检查确认该品种的生产指令单及相应配套文件,如工艺规程、岗位标准操作规程、清洁规程、口服液半成品质量监控要点及记录等是否准备齐全,并是现行文件。
2 检查确认本批生产的双黄连的原料、纯化水的数量是否与生产指令单相符并有合格证书。
现场是否有“清场合格证”。
3 对设备状况进行检查,挂有“完好”、“已清洁”状态标示牌的设备方可使用。
4 称量前,称量器必须每次调零,并定期由计量部门专人校验,做好记录。
六、生产过程1领料员在领取由生产管理部核算好原辅料使用量并已批准的生产指令单进行领料后,将料拉至车间。
第 4 页共 16 页2 称量2.1直接使用的物料,须清洁外包装。
2.2称量人认真校对金银花、黄芩、连翘的品名、规格、批号、数量等,应与生产指令单相符,确认无误后进行定额称量,记录并签名。
先将处方量的金银花150kg、黄苓150kg、连翘300kg以上3味,黄苓切片,加水煎煮三次,第一次2小时,第二、三次各1小时,合并煎液,滤过,滤液浓缩并在80℃时加入2mol/L盐酸溶液适量调节PH值至1.0~2.0保温1小时,静置12小时,滤过,沉淀加6~8倍量水,用40%氢氧化钠溶液调PH值至7.0。

年产 3000 万支 10ml 双黄连口服液生产车间工艺设计说明书学校大学学院中药学院专业制药工程班级班组员日期2013/6/29目录一工艺概述 (1)二物料衡算 (2)三工艺设备选型说明 (4)四工艺主要设备一览表 (4)五车间工艺平面布置说明 (5)六车间技术要求 (5)一、工艺概述口服液大部分指的是中药口服液制剂,是在中药汤剂、注射剂基础上发展起来的新剂型。
是将中药汤剂进一步精制、浓缩、灌封、灭菌而得到的。
口服液具有服用剂量少、吸收较快、质量稳定、携带及服用方便、易保存等优点,尤其适合工业化生产。
有些品种可适于中医急症用药,如四逆汤口服液、银黄口服液,故近几年来多将片剂、颗粒剂、丸剂、汤剂、中药合剂、注射剂等改制成口服液,使之成为药物制剂中发展较快的机型之一。
但口服液的生产设备和工艺条件要求都较高,成本较昂贵。
应从主药含量、细菌检查、装量差异、澄明度及药液PH 等方面进行控制。
原辅料存放D 级称量配料过滤西林瓶口服液联动机组灭菌灯检外包待检成品入库口服液工艺流程及环境区域划分示意图二、物料衡算工作制度:年工作日: 250 天每天两班每班工作8 小时每班运转机器 6 小时年产量: 3000 万支日产量: 12 万支【药品名称】通用名称:双黄连口服液汉语拼音:Shuanghuanglian Koufuye【处方】( 1000ml )金银花 375g黄苓375g连翘750g蔗糖300g香精适量【制法】以上三味,黄芩加水煎煮三次,第一次 2 小时,第二、三次各 1 小时,合并煎液滤过,滤液浓縮并在 80° C 时加人 2mol/L 盐酸溶液适量调节 pH 值至 1. 0 ~2. 0 ,保温 1 小时,静置 12 小时,滤过,沉淀加 6~8 倍量水,用 40%氢氧化钠溶液调节 pH 值至 7.0,再加等量乙醇,搅拌使溶解,滤过,滤液用2mol/L 盐酸溶液调节 pH 值至 2.0,60° C 保温 30 分钟,静置 12 小时,滤过,沉淀用乙醇洗至 pH 值为 7.0,回收乙醇备用;金银花、连翘加水温浸30 分钟后,煎煮二次,每次 1.5 小时,合并煎液,滤过,滤液浓缩至相对密度为 1.20~1.25(70 ~80℃ )的清膏,冷至40℃时缓缓加入乙醇,使含醇量达 75%,充分搅拌,静置 12 小时,滤取上清液,残渣加75%乙醇适量,搅匀,静置12 小时,滤过,合并乙醇液,回收乙醇至无醇味,加人上述黄苓提取物,并加水适量,以40%氢氧化钠溶液调节 pH 值至 7. 0,搅匀,冷藏( 4~8℃ )72 小时,滤过,滤液加入蔗糖300g,搅拌使溶解,或再加人香精适量 ,调节 PH 值至 7. 0 ,加水制成 1000ml ,搅匀,静置12 小时,滤过,灌装,灭菌,即得。
年产3000万支10ml双黄连口服液生产车间工艺设计说明书学校大学学院中药学院专业制药工程班级班组员日期 2013/6/29目录一工艺概述 (1)二物料衡算 (2)三工艺设备选型说明 (4)四工艺主要设备一览表 (4)五车间工艺平面布置说明 (5)六车间技术要求 (5)一、工艺概述口服液大部分指的是中药口服液制剂,是在中药汤剂、注射剂基础上发展起来的新剂型。
是将中药汤剂进一步精制、浓缩、灌封、灭菌而得到的。
口服液具有服用剂量少、吸收较快、质量稳定、携带及服用方便、易保存等优点,尤其适合工业化生产。
有些品种可适于中医急症用药,如四逆汤口服液、银黄口服液,故近几年来多将片剂、颗粒剂、丸剂、汤剂、中药合剂、注射剂等改制成口服液,使之成为药物制剂中发展较快的机型之一。
但口服液的生产设备和工艺条件要求都较高,成本较昂贵。
应从主药含量、细菌检查、装量差异、澄明度及药液PH等方面进行控制。
口服液工艺流程及环境区域划分示意图二、物料衡算工作制度:年工作日:250天每天两班每班工作8小时每班运转机器6小时年产量:3000万支日产量:12万支【药品名称】通用名称:双黄连口服液汉语拼音:Shuanghuanglian Koufuye【处方】(1000ml)金银花375g 黄苓375g 连翘750g 蔗糖 300g 香精适量【制法】以上三味,黄芩加水煎煮三次,第一次2小时,第二、三次各1小时,合并煎液滤过,滤液浓縮并在80°C时加人2mol/L盐酸溶液适量调节pH值至1. 0~2. 0,保温1小时,静置12小时,滤过,沉淀加6~8倍量水,用40%氢氧化钠溶液调节pH值至7.0,再加等量乙醇,搅拌使溶解,滤过,滤液用2mol/L盐酸溶液调节pH值至2.0,60°C保温30分钟,静置12小时,滤过,沉淀用乙醇洗至pH值为7.0,回收乙醇备用;金银花、连翘加水温浸30分钟后,煎煮二次,每次1.5小时,合并煎液,滤过,滤液浓缩至相对密度为1.20~1.25(70~80℃)的清膏,冷至40℃时缓缓加入乙醇,使含醇量达75%,充分搅拌,静置12小时,滤取上清液,残渣加75%乙醇适量,搅匀,静置12小时,滤过,合并乙醇液,回收乙醇至无醇味,加人上述黄苓提取物,并加水适量,以40%氢氧化钠溶液调节pH值至7. 0,搅匀,冷藏(4~8℃)72小时,滤过,滤液加入蔗糖300g,搅拌使溶解,或再加人香精适量,调节PH值至7. 0,加水制成1000ml,搅匀,静置12小时,滤过,灌装,灭菌,即得。
双黄连口服液的制备一、药品简介双黄连口服液是以金银花、黄芩、连翘为主要原料精制而成的抗菌抗病毒的纯中药制剂。
(1)处方:(1000ml)金银花380g 黄芩380g 连翘750g 蔗糖350g 香精适量(2)性状:本品为棕红色的澄清液体;味甜、微苦。
(3)主要功效;疏风解表、清热解毒之功效。
用于外感风热所致的感冒,症见发热,咳嗽,咽痛。
(4)药理作用:双黄连口服液对多种病菌抑制作用,如链球菌、肺炎双球菌、金葡萄菌、伤寒杆菌、副伤寒杆菌、大肠杆菌、绿脓杆菌、福氏杆菌、宋内氏杆菌、志贺氏杆菌、鲍氏杆菌、革兰氏阴性菌、小肠结肠炎耶氏菌等.抑制病毒作用有流感病毒甲、乙型、上呼吸道合胞病毒、柯萨奇病毒、艾可病毒、流行性腮腺炎病毒、带状疱疹病毒等。
还具有消炎、解热、阵痛作用。
还具有提高细胞免疫作用,调节和增强机体的多种免疫功能.二、制备步骤a、每1000mL口服液的原料组成为金银花350~400g、黄芩350~400g、连翘700~800g、蔗糖300~400g。
b、金银花加水温浸30分钟后,煎煮二次,每次2小时,合并煎液,滤过,滤液浓缩至70~80℃相对密度为1.20~1。
25的清膏,冷却后缓缓加入乙醇使含醇量达60~80%,充分搅拌,静置12小时,滤取上清液,用氢氧化钠溶液调节pH值,残渣加75%乙醇适量,搅匀,静置12小时,滤过,合并乙醇液,回收乙醇至无醇味,加入5-10倍量水水沉,滤过,滤液浓缩,减压干燥,粉碎成细粉,得金银花提取物。
c、连翘加水温浸30分钟后,煎煮二次,第一次2小时,第二次1小时,合并煎液,滤过,滤液浓缩至70~80℃相对密度为1。
20~1。
25的清膏,冷却后缓缓加入乙醇使含醇量达60~80%,充分搅拌,静置12小时,滤取上清液,用氢氧化钠溶液调节pH值,残渣加75%乙醇适量,搅匀,静置12小时,滤过,合并乙醇液,回收乙醇至无醇味,加入5-10倍量水水沉,滤过,滤液浓缩,减压干燥,粉碎成细粉,得连翘提取物。
年产3000万支10ml双黄连口服液生产车间工艺设计说明书学大学校院学中药学院制药工程业专班级班员组期日2013/6/29目录一工艺概述 (1)二物料衡算 (2)三工艺设备选型说明 (4)四工艺主要设备一览表 (4)五车间工艺平面布置说明 (5)六车间技术要求 (5)一、工艺概述口服液大部分指的是中药口服液制剂,是在中药汤剂、注射剂基础上发展起来的新剂型。
是将中药汤剂进一步精制、浓缩、灌封、灭菌而得到的。
口服液具有服用剂量少、吸收较快、质量稳定、携带及服用方便、易保存等优点,尤其适合工业化生产。
有些品种可适于中医急症用药,如四逆汤口服液、银黄口服液,故近几年来多将片剂、颗粒剂、丸剂、汤剂、中药合剂、注射剂等改制成口服液,使之成为药物制剂中发展较快的机型之一。
但口服液的生产设备和工艺条件要求都较高,成本较昂贵。
应从主药含量、细菌检查、装量差异、澄明度及药液PH等方面进行控制。
原辅存称配过西林瓶口服液联动机组灭菌灯检外包待检成品入库口服液工艺流程及环境区域划分示意图二、物料衡算工作制度:年工作日:250天每天两班每班工作8小时每班运转机器6小时年产量:3000万支日产量:12万支【药品名称】通用名称:双黄连口服液汉语拼音:Shuanghuanglian Koufuye【处方】(1000ml)金银花375g 黄苓375g 连翘750g 蔗糖300g 香精适【制法】以上三味,黄芩加水煎煮三次,第一次2小时,第二、三次各1小时,合并煎液滤过,滤液浓縮并在80°C时加人2mol/L盐酸溶液适量调节pH值至1. 0~2. 0,保温1小时,静置12小时,滤过,沉淀加6~8倍量水,用40%氢氧化钠溶液调节pH值至7.0,再加等量乙醇,搅拌使溶解,滤过,滤液用2mol/L盐酸溶液调节pH值至2.0,60°C保温30分钟,静置12小时,滤过,沉淀用乙醇洗至pH值为7.0,回收乙醇备用;金银花、连翘加水温浸30分钟后,煎煮二次,每次1.5小时,合并煎液,滤过,滤液浓缩至相对密度为1.20~1.25(70~80℃)的清膏,冷至40℃时缓缓加入乙醇,使含醇量达75%,充分搅拌,静置12小时,滤取上清液,残渣加75%乙醇适量,搅匀,静置12小时,滤过,合并乙醇液,回收乙醇至无醇味,加人上述黄苓提取物,并加水适量,以40%氢氧化钠溶液调节pH值至7. 0,搅匀,冷藏(4~8℃)72小时,滤过,滤液加入蔗糖300g,搅拌使溶解,或再加人香精适量,调节PH值至7. 0,加水制成1000ml,搅匀,静置12小时,滤过,灌装,灭菌,即得。
年产3000万支10ml双黄连口服液生产车间工艺设计说明书学校大学学院中药学院专业制药工程班级班组员日期 2013/6/29目录一工艺概述 (1)二物料衡算 (2)三工艺设备选型说明 (4)四工艺主要设备一览表 (4)五车间工艺平面布置说明 (5)六车间技术要求 (5)一、工艺概述口服液大部分指的是中药口服液制剂,是在中药汤剂、注射剂基础上发展起来的新剂型。
是将中药汤剂进一步精制、浓缩、灌封、灭菌而得到的。
口服液具有服用剂量少、吸收较快、质量稳定、携带及服用方便、易保存等优点,尤其适合工业化生产。
有些品种可适于中医急症用药,如四逆汤口服液、银黄口服液,故近几年来多将片剂、颗粒剂、丸剂、汤剂、中药合剂、注射剂等改制成口服液,使之成为药物制剂中发展较快的机型之一。
但口服液的生产设备和工艺条件要求都较高,成本较昂贵。
应从主药含量、细菌检查、装量差异、澄明度及药液PH等方面进行控制。
口服液工艺流程及环境区域划分示意图二、物料衡算工作制度:年工作日:250天每天两班每班工作8小时每班运转机器6小时年产量:3000万支日产量:12万支【药品名称】通用名称:双黄连口服液汉语拼音:Shuanghuanglian Koufuye【处方】(1000ml)金银花375g 黄苓375g 连翘750g 蔗糖 300g 香精适量【制法】以上三味,黄芩加水煎煮三次,第一次2小时,第二、三次各1小时,合并煎液滤过,滤液浓縮并在80°C时加人2mol/L盐酸溶液适量调节pH值至1. 0~2. 0,保温1小时,静置12小时,滤过,沉淀加6~8倍量水,用40%氢氧化钠溶液调节pH值至7.0,再加等量乙醇,搅拌使溶解,滤过,滤液用2mol/L盐酸溶液调节pH值至2.0,60°C保温30分钟,静置12小时,滤过,沉淀用乙醇洗至pH值为7.0,回收乙醇备用;金银花、连翘加水温浸30分钟后,煎煮二次,每次1.5小时,合并煎液,滤过,滤液浓缩至相对密度为1.20~1.25(70~80℃)的清膏,冷至40℃时缓缓加入乙醇,使含醇量达75%,充分搅拌,静置12小时,滤取上清液,残渣加75%乙醇适量,搅匀,静置12小时,滤过,合并乙醇液,回收乙醇至无醇味,加人上述黄苓提取物,并加水适量,以40%氢氧化钠溶液调节pH值至7. 0,搅匀,冷藏(4~8℃)72小时,滤过,滤液加入蔗糖300g,搅拌使溶解,或再加人香精适量,调节PH值至7. 0,加水制成1000ml,搅匀,静置12小时,滤过,灌装,灭菌,即得。
双黄连口服液工艺规程*******有限公司双黄连口服液工艺规程1目的:建立双黄连口服液的生产工艺规程,形成双黄连口服液的生产总则,使生产能按规定的工艺程序进行。
2适用范围:适用于双黄连口服液的生产全过程。
3责任者:口服溶液剂生产线生产人员负责实施,生产部及质保部负责监督。
4正文:一、产品概述:通用名:双黄连口服液商品名:///剂型: 口服溶液剂规格: 250ml/瓶包装规格:250ml/瓶×30瓶/件批准文号:待批二、处方和依据处方:每批投料量(75000ml)处方依据:《中华人民共和国兽药典》2010年版二部生产工艺流程及环境区域划分示意图提取部分:图示:一般生产区100,000制剂部分:图示:一般生产区100,000级洁净区四、生产过程及工艺条件中药前处理过程:1. 依据配料单对药材进行验收,核对其品名、数量、规格、件数、批号、质量、日期等,确认后,开始下列步骤。
2. 投料量为处方量的整倍量,但不超过多功能提取罐80%的量。
批次划分以多功能提取罐一次为标准3.提取、浓缩:金银花、黄芩、连翘3味,黄芩切片,加水煎煮3次,第一次2小时,第二、三次各1小时,合并煎液,滤过,滤液浓缩并在80℃时加入2mol/L盐酸溶液适量调节pH值1.0~2.0,加温1小时,静止12小时,滤过,沉淀加6~8倍量水,用40%氢氧化钠溶液调pH值至7.0,再加等量乙醇,搅拌使溶解,滤过,滤液用2mol/L盐酸溶液调pH值至2.0,60℃保温30分钟,静置12小时,滤过,沉淀用乙醇洗至pH值至7.0,挥尽乙醇备用。
金银花、连翘加水温浸0.5小时后,煎煮二次,每次1.5小时,合并煎液,滤过,滤液,滤液浓缩至相对密度为1.20~1.25(70~80℃测),冷至40℃时缓慢加入乙醇,使含醇量达75%,充分搅拌,静置12小时,滤取上清液,残渣加75%乙醇适量,搅匀,静置12小时,滤过,合并乙醇液,回收乙醇至无醇味,加入黄芩提取物,并加水适量,以40%氢氧化钠溶液调节pH值至7.0,搅匀,冷藏(4~8℃)72小时,做好原始记录。
C2 × V1V = ---------C1 - C2V为需加入浓乙醇体积(ml);V1为浓缩药液的体积(ml);C1为加入乙醇的浓度(%);C2为所需达到的含醇量(%)。
制剂生产过程:4.1领料生产部根据批生产指令、按最小包装单位开据领料单,车间物料员凭领料单领取原辅料(超额领料时经车间主任签字批准领料),二人复核原辅料品种、规格、生产厂家、批号、厂内检验报告书号、数量无误后经物净室,外包装擦洗、消毒,装入带有状态标识的周转容器,送至原辅料暂存间,填写相关记录、台帐。
调换原辅料供应商及特殊品种需经小样试验或经验证。
4.2 配料配料员根据批投料量计算称料量,准确称量,二人复核原辅料品种、规格、生产厂家、批号、厂内检验报告书号、数量及原辅料外观质量无异常,装入经清洁、灭菌的带盖周转容器,传递至配制间,准备投料。
4.3配制、过滤先向配液罐内加1/2量的纯化水,将准确称取的黄芩提取液,投入配液罐,搅拌至溶解,再加入连翘、金银花提取液,搅拌至溶解,再加入蔗糖、苯甲酸钠进行搅拌,最后加纯化水至全量,搅拌20min。
调整PH值至5.0-7.0。
用过滤器过滤,取样检测,本品为红棕色的澄清液体,微苦。
4.4 灌封4.4.1半成品检验合格后,开始准备灌封。
按规定灌装,调试灌封装量,调整装量、灌封、轧盖,随时检查灌封后药液澄明度、装量及瓶盖的紧密度,免洗塑料瓶使用以先进先出为原则。
从配制到灌装结束不超过6小时。
每隔20分钟检验装量,随时检验封口的密封性和外观。
悬挂物料状态卡,标明品名、数量、批号,转入灯检间。
双方做好物料交接,填写相关记录。
4.4.2 工艺条件4.4.2.1 最低装量 245ml,装量范围245ml-255ml,平均装量不低于250ml4.4.2.2 生产环境:灌封间洁净度为10,0000级。
4.5 包装4.5.1包装规格:250ml/瓶。
4.5.2包装要求按批包装指令领用相应数量标签、箱签、合格证、纸箱及其它消耗品,所用外包装材料必须检验合格,专人领取计数发放。
打印批号、有效期至,贴标签、装盒、装大箱,包装过程中随时检查中间产品质量、贴标签质量、批号打印准确无误,产品无漏装、标签无漏贴,封箱。
成品检验,检验合格后,入库。
填写相关记录、台帐。
5 工艺卫生5.1 车间内为自流平地面,墙壁、顶棚、地面应平整、坚硬无缝隙,其交界处成弧形,以减少灰尘积聚和便于清洁;5.2 车间设外环走廊,操作间设观察窗,外来人员及非生产区操作人员不得擅自进入生产操作间;5.3 生产区必需定期清洁,洁净区应定期消毒,使用的消毒剂不得对设备、物料和成品产生污染,消毒剂品种应定期更换,防止产生耐药菌株;5.4 车间设备、工器具、周转容器、清洁工具定置存放;5.5 原辅料暂存间、标签、包装材料暂存间、车间中转站设专人管理,设置合格品区、不合格品区、待检区挂牌标明自然情况;5.6 工作服的选材、式样及穿戴方式应与生产操作和空气洁净度级别相适应,并不得混用;洁净工作服的质地应光滑、不产生静电、不脱落纤维和颗粒性物质;无菌工作服必须包盖全部头发、胡须及脚部,并能阻留人体脱落物;不同空气洁净度级别使用的工作服应分别清洗、整理必要时消毒或灭菌;工作服洗涤、灭菌时不应带入附加的颗粒物质;工作服应制定清洗周期。
5.7 与药品直接接触的设备、容器表面应光洁、平整、易清洗、消毒或灭菌,耐腐蚀,不与药品发生化学变化或吸附药品,设备所用的润滑剂、冷却剂等不得对药品或容器造成污染;与药品直接接触的容器、药液输液管线使用后应及时处理,周转容器应有醒目标识,标明内容物的品名、规格、批号、数量等自然情况。
5.8 与设备连接的主要固定管道应标明管内物料名称、流向。
5.9 生产中的废弃物应及时处理,领料途经物料通道应及时清理。
5.10 人员卫生5.10.1 药品生产人员应有健康档案,直接接触药品的生产人员每年至少体检一次,传染病、皮肤病患者和体表有伤口者不得从事直接接触药品的生产。
5.10.2 生产区不得存放非生产物品和个人杂物,进入洁净区的人员不得化妆和佩带饰物,不得裸手直接接触药品。
4.11工艺质量监控要点工艺质量监控要点4.12设备一览表4.13 所执行质量监控的操作规程:(五)工艺卫生和环境卫生5.1原辅料卫生5.1.1原辅料进入车间前,必须在脱包间去除外包装或对外包装清洁灭菌后,经传递窗进入车间。
5.2称量、配料必须在称量间,配料间进行,以防在称量配料过程中产生的粉尘等对周围环境和设备的污染。
5.3设备容器具卫生。
5.3.1凡与兽药接触的设备表面,应光洁、平整、易清洗、耐腐蚀,不与兽药发生化学反应或吸附作用。
5.3.2设备的传动部件和管道要密封良好,要防止润滑油对兽药的污染。
5.3.3严格按照设备清洁规程对生产设备进行清洁,杜绝跑、冒、滴、漏现象。
接触兽药部位应进行消毒。
5.3.4生产所用器具按其清洁规程进行清洁,并进行消毒,按规定存放、领取、使用。
5.4生产介质卫生:5.4.1空气净化:整个车间密封,进入洁净车间的空气经三级过滤净化,洁净级别达到相应标准,温度18℃~26℃,相对湿度30%~65%,并按规定对空气定期进行消毒。
5.4.2工艺用压缩空气经过滤器过滤,并定期检查。
5.4.3纯化水按有关规定定期检测。
5.4.4饮用水按《饮用水检验操作规程》规定定期检测。
5.5工艺卫生5.5.1中间产品应放在洁净容器内,以防止污染。
5.5.2各生产操作间应洁净,每天上班前用臭氧灭菌30分钟、局部用紫外线消毒30分钟。
5.6各关键工序的卫生:5.6.1物料程序:原辅料→中间产品→成品(单向顺流,无往返运动)。
5.6.2配料工序工艺用水为纯化水,清洁设备和容器的最后一遍洗涤用水必须是纯化水。
5.7人员卫生:5.7.1操作人员必须身体健康,在工作期间,每年体检一次,患有传染病、隐性传染病、精神病及皮肤病患者立即调离工作岗位,不得直接从事兽药生产。
5.7.2人员净化程序:a、进入一般生产区:人员→门厅→更拖鞋→换工作鞋→脱外衣→穿一般工作服→在缓冲间洗手→进入一般生产区b、进入10万级洁净区:人员→门厅→更拖鞋→换工作鞋→脱外衣→穿一般工作服→在缓冲间洗手→换洁净工作鞋→脱一般工作服→穿无菌服→在缓冲间洗手、消毒→万级(10万级)洁净区。
5.7.3非本车间生产人员不得进入生产车间。
5.7.4一切操作人员必须经人净程序进入车间,日常养成良好的卫生习惯,做到勤剪指甲、勤理发、勤换衣服,任何人不准在车间吃食物、吸烟、吐痰。
5.7.5人员净化标准5.7.6工作服标准(六)本产品工艺过程中所执行的设备操作规程和岗位操作规程双黄连口服液工艺过程主要操作规程目录以上标准操作规程已经批准生效。
(七)原辅料、中间产品和成品的质量标准和技术参数及储存注意事项1 原料质量标准引用《中华人民共和国兽药典》2010年版二部标准文件名称:双黄连提取液质量标准双黄连提取液检验操作规程(八)半成品检查方法及控制1、半成品的检查方法:按照双黄连口服液半成品、成品质量标准进行控制。
pH 值:5.0-7.0含量:本品每1ml 含黄芩以黄芩苷(C 21H 18O 11)计,不得少于10.2mg 。
本品每1ml 含金银花以绿原酸(C 16H 18O 9)计,不得少于0.70mg 。
本品每1ml 含连翘以连翘苷(C 27H 34O 11)计,不得少于0.40mg 。
装量:245.0 m l ~255.0ml 。
(九)需要进行验证关键工序及其工艺验证的具体要求(十)包装要求、标签、说明书(附样本)与产品贮存方法及有效期1 塑料瓶质量应符合国家标准。
2 包装:外观大方,箱体工正,字迹清晰,不缺项少字。
包装数量:准确无误,装箱单(代合格证)填写完全,与实物相符,并有装箱人,复核人签字。
3 标签:标签粘贴工整,高度适中,不歪斜、无挂损。
印刷应符合标签管理办法要求,样本附后,并打印生产日期,批号,有效期限。
4 说明书:内容包括:批准文号、商标、品名、成分、规格、批号、作用与用途、用法与用量、注意事项、禁忌、贮藏方法、生产单位等。
5 产品贮存方法:密闭,在凉暗干燥处保存。
6 有效期:从生产之日算起,向后顺延两年。
(十一)原辅料消耗定额、技术经济指标、物料平衡以及各项指标的计算方法。
1原辅材料消耗定额2 技术经济指标2.1 成品率:是指投入主药对成品入库数量与应生产的数量之比,应为98-100% 。
成品率%= 包装成品数量×100%理论产量2.2 单耗:是指主料每万支消耗量单耗=总投料量实际产量(万支)2.3 收率收率% = 实际值×100%理论值理论值:为按照所用的原料(包装材料)量,在生产中无任何损失或差错的情况下,得出的最大数量。