有机化学答案于跃芹版第五章
- 格式:doc
- 大小:265.50 KB
- 文档页数:3


第十二章羧酸P32-331.命名下列化合物或写出结构式:1 3-甲基丁酸2 3-对氯苯基丁酸3 间苯二甲酸4 9,12-十八碳二烯酸5 4-甲基己酸 CH3CH2CHCH3CH2CH2COOH6 2-羟基丁二酸 HOOCCHOHCH2COOH7 2-氯-4-甲基苯甲酸8 3,3,5-三甲基辛酸2.试以反应式表示乙酸与下列试剂的反应3.区别下列各组化合物:4.指出下列反应的主要产物:第四版保留4.完成下列转变:5、怎样由丁酸制备下列化合物6、解:7、指出下列反应中的酸和碱;按lewis酸碱理论:凡可接受电子对的分子、离子或基团称为酸,凡可给予电子对的分子、离子或基团成为碱;8.1按酸性降低的次序排列下列化合物:①酸性: 水>乙炔>氨;②酸性: 乙酸>环戊二烯>乙醇>乙炔2按碱性降低的次序排列下列离子:①碱性:CH3HC C CH3O>>②碱性:(CH3)3CO>(CH3)2CHO>CH3O9. 解:化合物A有一个不饱和度,而其氧化产物B含有两个不饱和度;产物DC5H 10有一个不饱和度;从题意可知:D的结构式可能为环戊烷;C的结构为环戊酮;B的结构为己二酸;A的结构式为环己醇;10.解:1由题意:该烃氧化成酸后,碳原子数不变,故为环烯烃,通式为CnH2n-2;2该烃有旋光性,氧化后成二元酸,所以分子量=662=132;故二元酸为CH3CHCH2COOHCOOH11.由题意:m/e=179,所以马尿酸的分子量为179,它易水解得化合物D和E,D 的IR 谱图:3200-2300cm-1为羟基中O-H键的伸缩振动;1680为共扼羧酸的>C=O的伸缩振动;1600-1500cm-1是由二聚体的O-H键的面内弯曲振动和C-O 键的伸缩振动之间偶合产生的两个吸收带;750cm -1和700cm-1是一取代苯的 C-H键的面外弯曲振动;再由化学性质知D为羟酸,其中和当量为121±1,故D的分子量为122,因此,又由题意:E为氨基酸,分子量为75,所以E的结构为H 2NCH2COOH;第十三章羧酸衍生物P77-781.说明下列名词:酯、油脂、皂化值、干性油、碘值、非离子型洗涤剂;酯:是羧酸分子和醇分子间脱水形成的产物;油脂:是高级脂肪酸的甘油醇酯;皂化值:是指完全皂化1克油脂所需的KOH的质量以mg为单位;干性油:是指那些在空气中放置后能逐渐变成有韧性的固态薄膜的油;碘值:是指100克油脂完全加成时所能吸收的碘的质量以克为单位;非离子型洗涤剂:此处实指非离子型表面活性剂,即在水溶液中不离解出正负离子的表面活性剂此处的非离子型表面活性剂起主要的洗涤去污作用;2.试用方程式表示下列化合物的合成路线:(1)由氯丙烷合成丁酰胺;2 由丁酰胺合成丙胺3 由邻氯苯酚、光气、甲胺合成农药“害扑威”或先醇解后氨解也可;3.用简单的反应来区别下列各组化合物:解:前一化合物与水几乎不反应,而后一化合物因水解而冒烟;2 丙酸乙酯与丙酰胺解:分别与氢氧化钠水溶液作用,并加热,有氨气放出使红色石蕊试纸变蓝色者为丙酰胺,否则为丙酸乙酯;3 CH3COOC2H5和 CH3CH2COCl解:前一化合物与水不反应,而后一化合物因水解而冒烟;4 CH3COONH4和CH3CONH2解:在常温下与氢氧化钠水溶液作用,有氨气放出使红色石蕊试纸变蓝色者为乙酸铵,否则为乙酰胺;注:此试验不需加热,否则乙酰胺因水解也有氨气放出;5 CH3CO2O 和 CH3COOC2H5解:用适量热水试之,乙酸酐因水解而溶解于水,乙酸乙酯因难以水解而不溶于水; 或用碱性水溶液彻底水解,再将水解液进行碘仿反应,呈阳性者为乙酸乙酯,呈阴性者为乙酸酐;4.由合成解:5.由丙酮合成 CH33CCOOH解:种用酮的双分子还原,片呐醇重排反应和碘仿反应进行合成;6.由五个碳原子以下的化合物合成:解:顺式烯烃,最常用的合成方法是炔烃的顺式还原,用Lindlar催化剂最好;7.由ω-十一烯酸CH2=CHCH28COOH合成H5C2OOCCH213COOC2H5;解:目标产物比原料增加了碳原子,为此必须选用合适的增长碳链方向;8、由己二酸合成解:从6个碳缩成为5个碳,正好是一个α位碳进攻酯基碳的结果,宜用酯缩合反应;目标分子中的乙基酮的α位,可以用卤代烃引入;9.由丙二酸二乙酯合成解:分析乙酸单元后可见,目标产物只需在丙二酸分子中引入亚乙基即可;合成路线如下10.由合成解:或11.由合成解:硝酸具有氧化性,易将酚类氧化,需先进行“保护”;12、由合成解:目标产物是在原甲基的邻位再导入烃基,显然要用上苯环上的烷基化反应或酰基化反应,即以Freidel-Crafts反应为主;13.由合成解:14.由苯合成解:15.某化合物A的熔点为85°C,MS分子离子峰在480m/e,A不含卤素、氮和硫;A的IR在1600cm-1以上只有3000~2900cm-1和1735cm-1°C,B和C的NMR证明它们都是直链化合物;B用铬酸氧化得到一个中和当量为242的羧酸,求A和B的结构; 解:1 MS分子离子峰在480m/e,说明化合物分子量为480;2 题目已知醇为直链醇,酸为直链酸;3 A能皂化,说明A为羧酸酯;4 B氧化后所得羧酸的分子量为242,则其式量符号下式关系:C n H2n+1COOH = 242,解得: n = 14所以B为: CH3CH214OH ,式量为228;5 C的分子量为480-227+17 = 270,则C的式量应符合:C n H2n+1COOH = 270,解得: n = 16所以C为: CH3CH215COOH ;综合起来,化合物A的结构为: CH3CH215COOCH214CH31735处为C=O伸缩振动吸收,3000~2900处为饱各C—H键伸缩振动吸收;注:此题有误,中和当量为242的羧酸改为中和当量为256A C15H31COOC16H33 B的结构为C16H33OH第十四章含氮有机化合物P125-1291.给出下列化合物的名称或写出结构式:1对硝基氯化苄21,4,6-三硝基萘 3苦味酸4 6 3-氨基戊烷72-氨基丙烷或异丙胺8二甲基乙基胺或N,N-二甲基乙胺9N-乙基苯胺10顺-4-甲基环己胺 11N-甲基间甲苯胺122,4-二羟基偶氮对硝基苯或对硝基偶氮-2,4-二羟基苯133-氰基-5-硝基氯化重氮苯2.按其碱性的强弱排列下列各组化合物,并说明理由:1 吸电子基使碱性降低,供电子基使碱性增强,所以有:2 吸电子基使碱性降低,供电子基使碱性增强,所以有:2.比较正丙醇、正丙胺、甲乙胺、三甲胺和正丁烷的沸点高低并说明理由:解:五种化合物中,按形成氢键的可能、能力可推知其沸点从高到低的次序是:正丙醇 > 正丙胺 > 甲乙胺 > 三甲胺 > 正丁烷4.如何完成下列转变:12345.完成下列反应,并指出最后产物的构型是R或S:解:反应的前两步都不涉及到手性碳,反应的第三步为Hofmann重排,转移基团在分子内转移,其构型保持不变;由于分子组成而变了,旋光性可能改变,也可能不变,此处测定结果为左旋;6.完成下列反应:1该题如果改换一下甲基的位置,则情况不同,如下:234或5利用Hofmann重排反应降级反应来完成缩碳:6利用卤代烃的氰解来增加一个碳原子:78芳环上的亲核取代反应,先加成后消去:9不对称酮形成烯胺后,再进行烃基化时,烃基化主要发生在取代基较少的α位;与普通碱催化反应正好相反;NOH:10含β-H的氧化叔胺在加热时发生顺式消除反应协同反应生成烯烃和R27.指出下列重排反应的产物:1碳正离子的形成及其重排:2碳正离子的形成及其重排:3碳正离子的形成及其重排:片呐醇重排反应:4碳正离子的形成及其重排:片呐醇重排反应:5碳正离子的形成及其重排:片呐醇重排反应:6Wolff重排:7Beckmann重排:8Baeyer-Villiger重排:8.解释下述实验现象:1对溴甲苯与NaOH在高温下反应,生成几乎等量的对和间甲苯酚;22,4-二硝基氯苯可以由氯苯硝化得到,但如果反应产物用NaHCO3水溶液洗涤除酸,则得不到产品;解:1溴苯一般不易发生亲核取代反应,该反应是经过苯炔中间体历程进行的,表示如下:解:2氯苯可以直接硝化生成2,4-二硝基氯苯,但2,4-二硝基氯苯因两个硝基的吸电子作用,使其很易水解,生成2,4-二硝基苯酚,所以得不到2,4-二硝基氯苯的产物;9.请判断下述霍夫曼重排反应能否实现,为什么原第四版解:该反应不能实现,因为仲胺分子中N原子上没有两个可被消去的基团,无法形成氮烯中间体.9. 完成下列反应的反应历程;3解:本题为Hofmann重排类型的题目;只是反应体系发生了变化,NaOH水溶液改变了CH3ONa的甲醇溶液,所以最后形成的是较稳定的氨基甲酸甲酯,,而不是易分解的氨基甲酸;10.从指定原料合成:1从环戊酮和HCN制备环己酮;2从1,3-丁二烯合成尼龙-66的两个单体-己二酸和己二胺;3由乙醇、甲苯及其他无机试剂合成普鲁卡因4由简单的开链化合物合成(1)解:2解:3解:4解:11.选择适当的原料经偶联反应合成:12,2′-二甲基-4-硝基-4′-氨基偶氮苯第四版第五版: 2,2′-二甲基-4′-氨基偶氮苯2解:12.从甲苯或苯开始合成下列化合物:1间氨基苯乙酮2邻硝基苯胺3间硝基苯甲酸41,2,3-三溴苯5613.试分离下列各组化合物1PhNH2、PhNHCH3和PhNCH32的混合物:214.试剂丙胺甲基乙基胺三甲胺1对甲基苯环磺酰氯生成白色固体生成白色固体不反应15.892C,C用HNO 2处理,再与H 3PO 2反应生成3,3-二乙基联苯D;试写出A 、B 、C 和D 的结构式; 解:16.某化合物A,分子式为C 8H 17N,其核磁共振谱无双重峰,它与2mol 碘甲烷反应,然后与Ag 2O 湿作用,接着加热,则生成一个中间体B,其分子式为C 10H 21N;B 进一步甲基化后与湿的Ag 2O 作用,转变为氢氧化物,加热则生成三甲胺、1,5-辛二烯和1,4-辛二烯混合物;写出A 和B 的结构式;解:能与两摩尔碘甲烷反应,说明为一个仲胺;根据产物烯的位置可推知: NMR 无双重峰,说明其旁没有单个H;这句话排除了如下结构式的可能:16.化合物A 分子式为C 15H 17N,用苯磺酰氯和KOH 溶液处它没有作用,酸化该化合物得到一清晰的溶液,化合物A 的核磁共振谱如下图所示,试推导出化合物A 的结构式; 解:化合物分子式为,C 15H 17N,不饱和度为8,分子中可能含2个苯环;结合NMR 谱图可得:18.请用概念图或思维导图的形式总结芳香烃衍生物的合成方法;第十五章 含硫和含磷有机化合物 P 163-1651.写出下列化合物的结构式:(1) 硫酸二乙酯 2甲磺酰氯 3对硝基苯磺酸甲酯 4磷酸三苯酯 5对氨基苯磺酰胺 62,2’-二氯代乙硫醚 7二苯砜 8环丁砜 9苯基亚膦酸乙酯 10苯基亚膦酰氯 119-BBN 9-硼双环3,3,1-壬烷 9-BBN 2.命名下列化物:2-羟基乙硫醇 巯基乙酸 对磺酸基苯甲酸 对甲苯磺酸甲酯 羟甲基乙基硫醚或乙硫基甲醇 碘化二甲基环己基锍 氯化四羟甲基鏻 N -甲基-对甲苯磺酰胺 苯基膦酸二乙酯或O,O -二乙基苯膦酸酯 甲基乙基亚膦酰氯 11C 6H 53SiOH 12 CH 33O-SiCH 33三苯基硅醇三甲基叔丁氧基硅烷3.用化学方法区别下列化合物:1234解:1乙硫醇能溶于稀的氢氧化钠溶液中,而二甲硫醚不溶;2分别加入碳酸钠溶液,有二氧化碳气体逸出的为乙磺酸,无则为甲磺酸甲酯;3硫醇可溶于稀的氢氧化钠溶液中,而醇不溶;4前者不易水解,后者更易水解,后者不潮湿的空气中会水解冒烟;4.试写出下列反应的主要产物:解:1 23 4 55.完成下列转化:123456786.使用有机硫试剂或有机磷试剂,以及其他有关试剂,完成下列合成:123解:123第十七章周环反应1.推测下列合物电环化时产物的结构:2.推测下列环加成反应的产物的结构:3.马来酸酐和环庚三烯反应,给出的产物如下;试说明这个产物的合理性;环庚三烯的π电子是4n+2体系,加热是进行对旋电环化,然后再与马来酸酐进行4+2环加成反应,由于环状二烯的LUMO相互作用,可产生对称性允许的次级效应,有利于形成内型过渡态,最后生成内型产物;4.指出下列反应过程所需条件:5.试说明下列反应从反应物到产物的过程:该反应是反应经过两次碳的1,5同面迁移,且C构型保持;6.自选材料通过环加成反应合成下列化合物;7.自选材料通过环加成反应合成下列化合物;8.下面的反应按光化学进行时,反应产物可得到哪一种I或II解:1反应物π电子数属4n体系,光照下对旋是允许的,产物是I;2反应物中起电环化反应的π电子数属4n+2体系,光照下顺旋是允许的;产物是II;9.通过怎样的过程和条件,下列反应能得到给出的结果;10.通过什么办法反-9,10-二氢萘转化为顺-9,10-二氢萘11.确定下列反应在加热反应时所涉及的电子数;6个π电子电环化反应4个π电子电环化反应4+2环加成反应4+2环加成反应12.解释下列现象:1 在狄尔斯-阿尔德反应时,2-叔丁基-1,3-丁二烯反应速率比1,3-丁二烯快;2 在-78℃时,下面反应b的反应速率比a快1022倍;3解:1在狄尔斯-阿尔德反应中,双烯体是用其HOMO轨道提供电子的,属亲核部分,双烯体上有供电子叔丁基的存在时,使反应速率加快;2 a2+2环加成反应的逆反应,b 4+2环加成反应的逆反应,温度有利于4+2反应,光照有利于2+2环加成反应;3化合物是一个π-π共轭体系,本身有一定的稳定性,但它不是芳香环,而甲苯是一个芳香环,,从非芳香环重排成芳香环因芳香体系的形成将放出大量的热量;第十八章杂环化合物P2321.命名下列化合物:2.为什么呋喃能与顺丁烯二酸酐进行双烯合成,而噻吩及吡咯则不能试解释之;解:五元杂环的芳香性比较是:苯>噻吩>吡咯>呋喃;由于杂原子的电负性不同,呋喃分子中氧原子的电负性较大,π电子共轭减弱,而显现出共轭二烯的性质,易发生双烯合成反应,而噻吩和吡咯中由于硫和氮原子的电负性较小分别为和3,芳香性较强,是闭合共轭体系,难显现共轭二烯的性质,不能发生双烯合成反应;3.为什么呋喃、噻吩及吡咯容易进行亲电取代反应,试解释之;解:呋喃、噻吩和吡咯的环状结构,是闭合共轭体系,同时在杂原子的P轨道上有一对电子参加共轭,属富电子芳环,使整个环的π电子密度比苯大,因此,它们比苯容易进行亲电取代反应;4.吡咯可发生一系列与苯酚相似的反应,例如可与重氮盐偶合,试写出反应式;5、比较吡咯与吡啶两种杂环;从酸碱性、环对氧化剂的稳定性、取代反应及受酸聚合性等角度加以讨论;解:吡咯与吡啶性质有所不同,与环上电荷密度差异有关;它们与苯的相对密度比较如下:6、写出斯克劳普合成喹啉的反应;如要合成6-甲氧基喹啉,需用哪些原料4-甲氧基苯胺、甘油、浓硫酸、硝基苯7、写出下列反应的主要产物:8、解决下列问题:1 区别吡啶和喹啉;2 除去混在苯中的少量噻吩;3 除去混在甲苯中的少量吡啶;4 除去混在吡啶中的六氢吡啶;解:1吡啶溶于水,喹啉在水中的溶解度很小这是由于多了一个疏水性苯基的结果;2噻吩溶于浓H2SO4,苯不溶;用分液漏斗振荡后分液;3吡啶溶于水,甲苯不溶;4苯磺酰氯与六氢吡啶生成酰胺,蒸出吡啶;或根据六氢吡啶的碱性比吡啶的碱性强得多,将混合物先溶于乙醚等有机溶剂,再向溶液中加入适量的酸,将六氢吡啶和酸生成的盐沉淀出来;9、合成下列化合物:解:1210.杂环化合物C5H4O2经氧化后生成羧酸C5H4O3,把此羧酸的钠盐与碱石灰作用,转变为C 4H4O,后者与钠不起反应,也不具有醛和酮的性质,原来的C5H4O2是什么11. 写出下列Friedlnder反应机理;Friedl nder合成Friedl nder synthesis,又称Friedl nder喹啉合成或和任何含有-CH2CO-的或生成;反应以德国化学家 Paul Friedl nder 1857-1923 的名字命名;反应可用、、或其他;反应机理如下:反应有两种可行的机理;一是邻氨基苯甲醛或酮 1与羰基化合物 2发生生成 3,然后水生成4并再次失水化,得喹啉 7;另一种是 1 先与 2 缩合成,然后再发生分子内羟醛并失水,生成 7;注:R1:-H,R2:-CH3 R3:-COOC2H512.用浓硫酸将喹啉在220~230°C时磺化,得喹啉磺酸A,把A与碱共熔,得喹啉的羟基衍生物B;B与应用斯克劳普法从邻氨基苯酚制得的喹啉衍生物完全相同,A和B是什么磺化时苯环活泼还是吡啶环活泼解:磺化时苯环比吡啶环更活泼;A、B的结构如下:13.α、β-吡啶二甲酸脱羧生成β-吡啶甲酸烟酸,为什么脱羧在α-位解:脱羧是以偶离子的形式进行的,可表示如下:脱羧时涉及到碳-碳键的异裂,吡啶环持有负电荷;碳-碳键断裂时联想一下该决定速率步骤的过渡态,负电荷处在α-位能被电负性大的氮所分散,负电荷处在β-位则不能被有效的分散;因此,脱羧发生在α-位;14.毒品有哪几类,它的危害是什么解:一种类1.兴奋剂如:肾上腺素、安非他明、甲基安非他明、3,4-亚甲二氧基-N-甲基-1-苯基丙胺、咖啡因、尼古丁、柯卡因2.幻觉剂:麦角二乙酰胺、大麻3.抑制剂:巴比土酸盐、阿普唑仑、维利眠、鸦片制剂海洛因、可待因、吗啡二危害:略;第十八章糖类化合物p257-2581. 解释概念1还原糖p232:凡能被托伦试剂或菲林试剂等若氧化剂氧化的糖类,都称为还原糖; 2非还原性糖p232:凡不能被托伦试剂或菲林试剂等若氧化剂氧化的糖类,都称为非还原糖;3醛糖的递升和递降p236:醛糖经与HCN发生亲核加成增加一个碳原子后,再经水解,还原可生成多一个碳原子的醛糖,这个方法称为递升;反之去掉一个碳原子而生成低一级的糖的过程称为递降;4糖的变旋现象p240:在水溶液中糖的比旋光度发生变化的现象,称为变旋现象;5糖苷p240:糖的半缩醛羟基苷羟基与另一羟基化合物失水而生成的缩醛均称为“配糖物”简称为“苷”2.写出D-+-甘露糖与下列化合物的反应、产物及其名称:解:D-+-甘露糖在溶液中存在开链式与氧环式α型和β型的平衡体系,与下列 物质反应时有的可用开链式表示,有的必须用环氧式表示,在用环氧式表示时,为简单起见,仅写α-型;3. D-+-半乳糖怎样转化成下列化合物的 写出其反应式;4.果糖是酮糖,为什么也可像醛糖一样和托伦试剂或斐林试剂反应,可是又不与溴水反应 解:在碱性条件下,果糖可是通过差向异构化转化为醛糖葡萄糖和甘露糖,与托伦试剂或斐林试剂反应;在酸性条件下,不能发生异构化,转化为醛糖,所以不能与溴水反应; 5. 解 推导过程:1 戊糖与胲反应生成肟,说明有羰基存在;2 戊糖与4NaBH 反应生成C 5H 12O 4说明是一个手性分子;3C 5H 12O 4与乙酐反应得四乙酸酯说明是四元醇有一个碳原子上不连有羟基;4C 5H 12O 4与CH 3OH 、HCl 反应得糖苷C 6H 12O 4,说明有一个半缩醛羟基与之反应;糖苷被HIO4氧化得C 5H 10O 4,碳数不变,只氧化断链,说明糖苷中只有两个相邻的羟基,为环状化合物,水解得和,说明甲基在分子末端,氧环式是呋喃型;递推反应如下:C 5H 10O 4可能的结构式为:6.解:推导过程:1蜜二糖是还原性双糖,说明它有游离的半缩醛羟基;2蜜二糖是+-乳糖的异构物,能被麦芽糖酶水解,说明它是由半乳糖和葡萄糖以α-苷键结合的双糖;37.解:1糖水杨苷用苦杏仁酶水解得D-葡萄糖和水杨醇,说明葡萄糖以β-苷键与水杨醇结合;(CH)SO和NaOH处理得五甲基水杨苷,说明糖水杨苷有五个羟基,产物2水杨苷用324酸化水解得2,3,4,6-四甲基-D-葡萄糖和邻甲氧基甲酚邻羟基苄甲醚,说明葡萄糖以吡喃式存在并以苷羟基与水杨醇的酚羟基结合;此糖水杨苷的结构如下:8.推导过程:1茜根酸不与拖伦试剂反应,说明无游离半缩醛羟基存在;可见茜根酸的结构未肯定之处在于:1D-木糖和葡萄糖的构型α,β型;2樱草糖是否是还原糖,因此,樱草糖出现两种结构式;9.解:可见,I是D-型还原性单糖,不成脎说明α-位上无羟基,I经氧化,甲基化,酸的α-溴代,水解生成四羟基正戊酸说明了此点,I经Ruff降解得内消旋的酒石酸,证明3,4-位上羟基同侧,由题意,可推出II~VII的结构10.解:成脎反应发生在C1和C2上,这三种糖都能生成同一种脎D-葡萄糖脎,则可证明它们的C3,C4,C5具有相同的构型:11.解:推导过程:A的可能结构如下:B的可能结构如下:。


《有机化学》习题参考答案引 言这本参考答案是普通高等教育“十二五”规划教材《有机化学》(周莹、赖桂春主编,化学工业出版社出版)中的习题配套的。
我们认为做练习是训练学生各种能力的有效途径之一,是对自己所学内容是否掌握的一种测验。
因此,要求同学们在学习、消化和归纳总结所学相关知识的基础上完成练习,即使有些可能做错也没有关系,只要尽心去做就行,因为本参考答案可为读者完成相关练习后及时核对提供方便,尽管我们的有些参考答案(如合成题、鉴别题)不是唯一的。
北京大学邢其毅教授在他主编的《基础有机化学习题解答与解题示例》一书的前言中写道:“解题有点像解谜,重在思考、推理和分析,一旦揭开了谜底,就难以得到很好的训练。
” 这句话很符合有机化学解题的特点,特摘录下来奉献给同学们。
我们以为,吃透并消化了本参考答案,将会受益匪浅,对于报考研究生的同学,也基本够用。
第一章 绪论1-1解:(1)C 1和C 2的杂化类型由sp 3杂化改变为sp 2杂化;C 3杂化类型不变。
(2)C 1和C 2的杂化类型由sp 杂化改变为sp 3杂化。
(3)C 1和C 2的杂化类型由sp 2杂化改变为sp 3杂化;C 3杂化类型不变。
1-2解:(1) Lewis 酸 H + , R + ,R -C +=O ,Br + , AlCl 3, BF 3, Li + 这些物质都有空轨道,可以结合孤对电子,是Lewis 酸。
(2)Lewis 碱 x -, RO -, HS -, NH 2, RNH 2, ROH , RSH这些物质都有多于的孤对电子,是Lewis 碱。
1-3解:硫原子个数 n=5734 3.4%6.0832..07⨯=1-4解:甲胺、二甲胺和三甲胺都能与水形成氢键,都能溶于水。
综合考虑烷基的疏水作用,以及能形成氢键的数目(N 原子上H 越多,形成的氢键数目越多),以及空间位阻,三者的溶解性大小为:CH 3NH 2 >(CH 3)2NH >(CH 3)3N1-5解:32751.4%1412.0C n ⨯==,327 4.3%141.0H n ⨯==,32712.8%314.0N n ⨯==,3279.8%132.0S n ⨯==, 32714.7%316.0O n ⨯==, 3277.0%123.0Na n ⨯==甲基橙的实验试:C 14H 14N 3SO 3Na 1-6解: CO 2:5.7mg H 2O :2.9mg第二章 有机化合物的分类和命名2-1解:(1) 碳链异构(2)位置异构(3)官能团异构(4)互变异构2-2解:(1)2,2,5,5-四甲基己烷(2 ) 2,4-二甲基己烷(3)1-丁烯-3-炔(4)2-甲基-3-氯丁烷(5)2-丁胺(6)1-丙胺(7)(E)-3,4-二甲基-3-己烯(8)(3E,5E)-3-甲基-4,5-二氯-3,5-辛二烯(9)2,5-二甲基-2,4-己二烯(10)甲苯(11)硝基苯(12)苯甲醛(13)1-硝基-3-溴甲苯(14)苯甲酰胺(15)2-氨基-4-溴甲苯(16)2,2,4-三甲基-1-戊醇(17)5-甲基-2-己醇(18)乙醚(19)苯甲醚(20) 甲乙醚(21) 3-戊酮(22 ) 3-甲基-戊醛(23)2,4-戊二酮(24)邻苯二甲酸酐(25)苯乙酸甲酯(26)N,N-二甲基苯甲酰胺(27)3-甲基吡咯(28)2-乙基噻吩(29)α-呋喃甲酸(30)4-甲基-吡喃(31)4-乙基-吡喃(32)硬脂酸(33)反-1,3-二氯环己烷(34)顺-1-甲基-2-乙基环戊烷(35)顺-1,2-二甲基环丙烷2-3解:(1)CH3CHCH3CH3CH3CHCH3CH3C(2)CH3CHCH3CH2CH2CH2CH3C2H5(3)CH3CHCH3HCH22CH3C2H525(4)C2H5HCH3H(5) H2252CH2CH3(6)(7)HCH3HCH3HH(8)3(9)52H5(10)(11) CH3NO2NO2(12)H3(13) (14)OHCOOHBr(15) BrCHOCH3CH3(16)CH3CH2OH(17) OH(18)OH BrBr(19)OHSO3HNO2(20)OO O(21) O(22)O(23)HCH3HCHO(24)H33(25)NHCH3O(26)NH2NH(27)NHO(28)S(29)NCH2H5OCH2H5(30) CH3(CH2)7CH=CH(CH2)7COOH(31)NH2ONH2(32)H2N-CONH-C-NH2(33) OOO(34)OCHO2-4解:(1)C H3CH2CH3CH3CHCH3CH3C命名更正为:2,3,3-三甲基戊烷(2)C H3CH2CHCHCH3CH3CH3(3)(4)(5)(6)(7)(8)2-5解:可能的结构式.. 2-6解:(1)(2)CH3C2H5CH2CH2CH3CH2CH2CH2CH3(3)CH3CH3CH2CH2CH3CH3C2H5C2H5C2H5CH2CH2CH3 2-7解:1,3-戊二烯1,4-戊二烯H2CH2CH32CH3H31-戊炔2-戊炔H2C2H5CH3CH CH31,2-戊二烯2,3-戊二烯H2333-甲基-1,2-丁二烯第三章饱和烃3-1解:(1) 2,3,3,4-二甲基戊烷(2) 3-甲基-4-异丙基庚烷(3) 3,3-二甲基戊烷(4) 2,6-二甲基-3,6-二乙基辛烷(5) 2,5-二甲基庚烷(6) 2-甲基-3-乙基己烷(7)2-甲基-4-环丙基自己烷(8)1-甲基-3-乙基环戊烷3-2解:(1)H3332CH3(2)(3) H333(4)(5) (6)3-3解:(1) 有误,更正为:3-甲基戊烷(2) 正确(3) 有误,更正为:3-甲基十二烷(4) 有误,更正为:4-异丙基辛烷(5) 4,4-二甲基辛烷(6) 有误,更正为:2,2,4-三甲基己烷3-4解:(3) > (2) > (5) > (1) > (4)3-5解:BrHH HHBr BrHHHHBrBrHHBrHHBrHB rHH(A)对位交叉式(B)部分重叠式(C)邻位交叉式(D)全重叠式A>C>B>D3-6解:(1)相同(2)构造异构(3)相同(4)相同(5)构造异构体(6)相同3-7解:由于烷烃氯代是经历自由基历程,而乙基自由基的稳定性大于甲基自由基,故一氯甲烷的含量要比一氯乙烷的含量要少。

第五章 酸碱滴定法3、写出(NH 4)2CO 3溶液的MBE 、CBE 和PBE ,浓度为c (mol ·L -1)。
解:MBE :[NH 3]+[NH 4+]=2c, [H 2CO 3]+[HCO 3-]+[CO 32-]= c注意:要考虑弱酸(碱)在水溶液中可能存在的各种型体;要注意平衡浓度与分析浓度的关系;CBE :[NH 4+]+[H +] = [OH -]+[HCO 3-]+2[CO 32-]要点:需考虑水的离解,离子的电荷数,中性分子不包括在其中; PBE :[H +]+[HCO 3-]+2[H 2CO 3]= [OH -]+[NH 3]要点:需考虑水的得失质子,得失质子的个数,不得失质子的物质不包括在内。
4、(2).写出NaNH 4HPO 4的MBE 和CEB ,浓度为c (mol ·L -1)。
解:MBE :[Na +] = [NH 4+]+[NH 3] = c[H 3PO 4]+[H 2PO 4-]+[HPO 42-]+[PO 43-] = cCBE :[Na +]+[NH 4+]+[H +] = [H 2PO 4-]+2[HPO 42-]+3[PO 43-]+[OH -] 8、可用酚酞作指示剂,)(== 可近似为一元弱碱处理因为)为二元弱到计量点生成物为直接准确滴定可作为酸被作碱式解离因是两性物质作酸式解离解:-∴⋅⨯∴>>>==∴<⋅>-- 9.06 = pH 4.94 = pOH L mol 1010050.0 = ][OH 400/, 20, 40 10 碱(P NaOH 10,10 = , ; )L 0.050mol = (10,10 = KHP 2)( 1-11121212222 4.948.59b sp -b w b a b 59.8a w b -28-b sp 11.05-b -1sp -8a sp -5.41a K c K c K cK K cK K K K KHP K C K C K C K[]可选用酚酞作指示剂 一元弱碱计量点生成物为直接准确进行滴定,到可采用 的共轭酸,其)为(∴==⋅⨯=⨯⨯==>⨯=⨯=>⨯=⨯⨯=∴>⨯=⨯⨯=⨯=⨯⨯==⋅-- 8.92pOH 5.08pOH )L mol (104.8104.1050.0cK OH 400103.6 101.40.050 K c 20Kw 107.0 101.40.050 cK )(N )(CH 标准溶液NaOH10103.6107.10.050K C 10.17/101.0101.0 K K K N CH HCl N )(CH (7) 1-69b -7-9-b11-9-b462-87-6-a SP 6-9-14-b w a 462462 10、解 作为滴定剂,其提供(解离)的H +(OH -)的准确浓度是进行定量计算的依据,必须已 知。


5章思考题5.1 在不饱和卤代烃中,根据卤原子与不饱和键的相对位置,可以分为哪几类,请举例说明。
5.2 试比较S N2和S N1历程的区别。
5.3 什么叫溶剂化效应?5.4 说明温度对消除反应有何影响?5.5 卤代芳烃在结构上有何特点?5.6 为什么对二卤代苯比相应的邻或间二卤代苯具有较高的熔点和较低的溶解度?5.7 芳卤中哪种卤原子最能使苯环电子离域,为什么?解答5.1 答:可分为三类:(1)丙烯基卤代烃,如CH3CH=CHX(2)烯丙基卤代烃,如CH2=CH-CH2X(3)孤立式卤代烃,如CH2=CHCH2CH2X5.2 答:(略)5.3 答:在溶剂中,分子或离子都可以通过静电力与溶剂分子相互作用,称为溶剂化效应。
5.4 答:增加温度可提高消除反应的比例。
5.5 答:在卤代芳烃分子中,卤素连在sp2杂化的碳原子上。
卤原子中具有弧电子对的p轨道与苯环的π轨道形成p-π共轭体系。
由于这种共轭作用,使得卤代芳烃的碳卤键与卤代脂环烃比较,明显缩短。
5.6 答:对二卤代苯的对称性好,分子排列紧密,分子间作用力较大,故熔点较大。
由于对二卤代苯的偶极矩为零,为非极性分子,在极性分子水中的溶解度更低。
5.7 答:(略)习题5.15.1命名下列化合物。
5.25.2写出下列化合物的构造式。
(1)烯丙基溴(2)苄氯(3)4-甲基-5-溴-2-戊炔(4)偏二氟乙浠(5)二氟二氯甲烷(6)碘仿(7)一溴环戊烷(环戊基溴) (8)1-苯基-2-氯乙烷(9)1,1-二氯-3-溴-7-乙基-2,4-壬二烯(10)对溴苯基溴甲烷(11)(1R,2S,3S)-1-甲基-3-氟-2-氯环己烷(12)(2S,3S)-2-氯-3-溴丁烷5.3 完成下列反应式。
5.4用方程式表示CH3CH2CH2Br与下列化合物反应的主要产物。
(1)KOH(水)(2)KOH(醇)(3)(A)Mg ,乙醚;(B) (A)的产物+HC≡CH (4)NaI/丙酮(5)NH3 (6)NaCN (7)CH3C≡CNa(8)AgNO3(醇) (9) Na (10) HN(CH3)25.5用化学方法区别下列各组化合物。

目录第一章绪论0第二章饱和烃1第三章不饱和烃6第四章环烃16第五章旋光异构27第六章卤代烃32第七章波谱法在有机化学中的应用38第八章醇酚醚51第九章醛、酮、醌62第十章羧酸及其衍生物76第十一章取代酸85第十二章含氮化合物92第十三章含硫和含磷有机化合物102第十四章碳水化合物105第十五章氨基酸、多肽与蛋白质119第十六章类脂化合物125第十七章杂环化合物136第一章 绪论1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2 NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液是否相同?如将CH4及CCl4各1mol 混在一起,与CHCl3及CH3Cl 各1mol 的混合物是否相同?为什么? 答案:NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na+,K+,Br -, Cl -离子各1mol 。
由于CH4与CCl4及CHCl3与CH3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624HCCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4写出下列化合物的Lewis 电子式。
a.C2H4b.CH3Clc.NH3d.H2Se.HNO3f.HCHOg.H3PO4 h.C2H6 i.C2H2 j.H2SO4答案:a.C C H H CC HH HH 或 b.H C H c.H N H Hd.H S H e.H O NOf.OC H Hg.O P O O H H h.H C C HHH H HO P O O H H或i.H C C Hj.O S O HH OS H H或1.5下列各化合物哪个有偶极矩?画出其方向。

高考化学第三节羧酸酯1.了解羧酸和酯的组成和结构特点。
2.了解羧酸的分类、酯的物理性质及存在。
3.掌握乙酸和乙酸乙酯的结构特点和主要性质,理解乙酸的酯化反应和乙酸乙酯水解反应的基本规律。
(重点)4.掌握羧酸和酯之间的相互转化,学会它们在有机合成与推断中的应用。
(重点)羧酸1.羧酸(1)概念羧酸是由烃基与羧基相连构成的有机化合物。
通式为R—COOH,官能团名称为羧基。
(2)分类(3)通性都具有酸性,都能发生酯化反应。
2.甲酸(1)结构特点结构简式,官能团:—CHO和—COOH。
(2)化学性质①具有羧酸的通性:酸性、能发生酯化反应。
②具有醛类的某些性质:能发生银镜反应,能与新制Cu(OH)2悬浊液反应。
3.乙酸(1)组成和结构(2)物理性质(3)化学性质①酸的通性乙酸的电离方程式为CH 3COOH CH3COO-+H+。
②酯化反应反应规律:羧酸脱去羟基,醇脱去羟基氢原子。
反应实例(乙酸与乙醇反应):CH3COOH+H—18OC2H5 CH3CO18OC2H5+H2O1.用什么方法证明乙酸发生酯化反应时是C—O断键?【提示】使用同位素示踪法探究乙酸酯化反应中可能的脱水方式。
是“酸脱羟基,醇脱氢”。
2.两分子脱去两分子水生成的环状化合物的结构简式是什么?【提示】。
1.酯化反应的反应机理羧酸与醇发生酯化反应时,一般是羧酸分子中的羟基与醇分子中羟基上的氢原子结合生成水,其余部分结合生成酯,用示踪原子法可以证明。
+H2O2.酯化反应的基本类型(1)一元醇与一元羧酸之间的酯化反应。
CH3COOH+C2H5OH CH3COOC2H5+H2O(2)二元羧酸与一元醇之间的酯化反应。
HOOC—COOH+2C2H5OH C2H5OOC—COOC2H5+2H2O(3)一元羧酸与二元醇之间的酯化反应。
2CH3COOH+HOCH2CH2OH CH3COOCH2CH2OOCCH3+2H2O(4)二元羧酸与二元醇之间的酯化反应。
此时反应有两种情况:①HOOCCOOCH2CH2OH+H2O②+2H2O(5)羟基酸的自身酯化反应。

有机化学第五版课后习题答案有机化学是化学科学中的一个重要分支,研究有机化合物的结构、性质、合成和反应机理等。
在学习有机化学的过程中,课后习题是检验学习效果和提高理解能力的重要手段。
本文将针对《有机化学第五版》的课后习题,给出一些答案和解析,帮助读者更好地理解和掌握有机化学知识。
一、反应机理和结构分析题1. 以下化合物的分子式为C5H12O,请给出它们的结构式。
答案:(1)2-甲基丁醇;(2)异戊醇;(3)2-甲基-2-丁醇。
解析:根据分子式C5H12O,可以推测出这是一个醇类化合物。
醇的通式为CnH2n+2O,根据这个规律,我们可以确定它们的结构式。
2. 以下反应中,哪一个是亲核取代反应,哪一个是亲电取代反应?请给出反应机理。
答案:(1)亲核取代反应;(2)亲电取代反应。
解析:亲核取代反应是指亲核试剂攻击亲电中心,形成新的化学键。
亲电取代反应是指亲电试剂攻击亲核中心,形成新的化学键。
根据反应机理和试剂的性质,可以判断出哪个是亲核取代反应,哪个是亲电取代反应。
二、合成题1. 请用适当的试剂合成以下化合物。
答案:(1)苯甲醛:苯基甲醇经过氧化反应得到苯甲醛;(2)苯甲酸:苯基甲醇经过氧化反应得到苯甲酸;(3)苯甲醚:苯基甲醇和H2SO4反应得到苯甲醚。
解析:根据目标化合物的结构和反应条件,可以选择合适的试剂和反应条件进行合成。
合成的关键在于选择适当的反应,根据反应机理进行推导。
三、解析题1. 以下化合物的IR光谱图中,哪一个峰代表羟基的伸缩振动?答案:(2)。
解析:根据IR光谱图的特征峰和波数范围,可以判断出哪个峰代表羟基的伸缩振动。
羟基的伸缩振动一般在3200-3600 cm-1的波数范围内。
2. 以下化合物的NMR光谱图中,哪一个峰代表甲基的化学位移?答案:(3)。
解析:根据NMR光谱图的特征峰和化学位移范围,可以判断出哪个峰代表甲基的化学位移。
甲基的化学位移一般在0-2 ppm的范围内。
四、机理题1. 以下反应的机理是什么?请给出反应步骤和中间体。
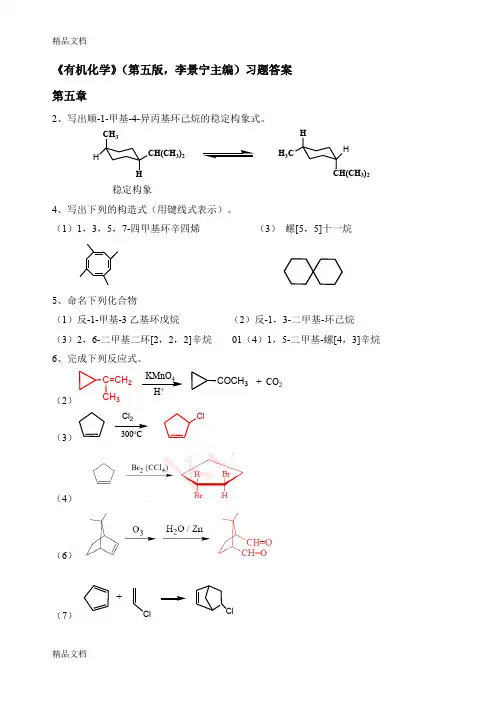
《有机化学》(第五版,李景宁主编)习题答案 第五章2、写出顺-1-甲基-4-异丙基环己烷的稳定构象式。
CH 3HCH(CH 3)23)2H HH 3C稳定构象4、写出下列的构造式(用键线式表示)。
(1)1,3,5,7-四甲基环辛四烯 (3) 螺[5,5]十一烷5、命名下列化合物(1)反-1-甲基-3乙基环戊烷 (2)反-1,3-二甲基-环己烷 (3)2,6-二甲基二环[2,2,2]辛烷 01(4)1,5-二甲基-螺[4,3]辛烷 6、完成下列反应式。
(2)C=CH 2CH 3KMnO 4COCH3+ CO 2(3)Cl 300CCl(4)(6)(7)+ClCl(10)(11)Br2/CCl4CH2CH2CHCH38、化合物物A分子式为C4H8,它能是溴溶液褪色,但不能使烯的高锰酸钾溶液褪色。
1mol (A)与1molHBr作用生成(B),(B)也可以从(A)的同分异构体(C)与HBr作用得到。
化合物物(C)能使溴溶液褪色,也能使烯的高锰酸钾溶液褪色。
试推论化合物(A)、(B)、(C)的构造式,并写出各步的反应式。
答:根据化合物的分子式,判定A是烯烃或单环烷烃9、写出下列化合物最稳定的构象式。
(1)反-1-甲基-3-异丙基环己烷HH 3)2|CH 3(2) 顺-1-氯-2-溴环己烷第六章 对映异构2、判断下列化合物哪些具有手性碳原子(用 * 表示手性碳原子)。
哪些没有手性碳原子但有手性。
(1)BrCH 2-C *HDCH 2Cl 有手性碳原子(3)**Br OH有手性碳原子(8)CH=CH-CH=CH 2无手性碳原子,无手性(10没有手性碳原子,但有手性5、指出下列构型式是R 或S 。
6、画出下列化合物所有可能的光学异构体的构型式,标明成对的对映体和内消旋体,以R 、S 标定它们的构型。
(2)CH 3CHBrCHOHCH 3Br Cl(5)H2C CHCl H27、写出下列各化合物的费歇尔投影式。
第五章检测试题(时间:45分钟满分:100分)一、选择题(每小题4分,共48分,每小题只有一个选项符合题意)1.以节能减排为基础的低碳经济是保持社会可持续发展的战略举措。
下列做法违背发展低碳经济的是( D )A.发展氢能和太阳能B.限制塑料制品的使用C.提高原子利用率,发展绿色化学D.尽量用纯液态有机物代替水作溶剂解析:节能、减排(CO2),特别是降低化石燃料(原料)的利用。
A不使用“碳”;B减少“碳”的应用;C提高原子利用率,发展绿色化学,相当于减少了“碳”的使用;D增加了“碳”的使用。
2.2010年上海世博会的主题是“城市,让生活更美好”。
下列叙述中不正确的是( C )A.世博会前期,处理废水时加入明矾可作为混凝剂以吸附水中的杂质B.世博会期间,利用可降解的“玉米塑料”替代一次性饭盒,可防止产生白色污染C.世博会中国馆——“东方之冠”使用的钢筋混凝土属于高分子化合物D.世博停车场安装催化光解设施,可将汽车尾气中CO和NO x反应生成无毒气体解析:钢筋混凝土是硅酸盐和钢筋构成的复合材料,不是高分子化合物。
3.为了使城市生活垃圾得到合理利用,近年来逐步实施了生活垃圾分类投放的办法。
其中塑料袋、废纸、旧橡胶制品等属于( B )A.无机物B.有机物C.盐类D.非金属单质解析:塑料、纸(纤维素)、橡胶都属于有机物。
4.2012年4月22日是第43个世界地球日,主题为:“共担绿色责任&展示绿色中国”。
旨在引导全社会积极参与节约利用资源、减少碳排放,促进经济发展方式转变的实践。
你认为下列行为中与之相悖的是( D )A.利用太阳能,减少化石燃料的开采使用B.大力发展农村沼气,将废弃的秸秆转化为清洁高效的能源C.研制开发以水代替有机溶剂的化工涂料D.加快采油速度,大力发展石油化工解析:加速开采石油与“珍惜地球资源,转变发展方式”相悖。
5.据统计,40%的飞机失事时机舱内壁和座椅的塑料会着火冒烟,从而导致舱内人员窒息死亡。
解答一1、有机化合物就是碳化合物。
典型有机化合物的一般特性是:容易燃烧;熔点低,多数固体有机物的熔点在室温和400℃之间;有机化合物通常难溶于水,易溶于有机溶剂;有机化合物的反应速度比较慢,并且常有副反应发生,因而收率低。
2、电子云分布对键轴呈圆柱形对称的轨道δ轨道,由它生成都的轨道,称为π轨道,由它生成的键称为π键。
3、(1)HF4、分解1mol 乙醇所需要的热能为:△H=(5×413.8C-H )+346.9C-C +359.5C-O +464.0O-H =3239.4kJ ·mol -1生成H 2C=CH 2和H 2O 所放出的热能为:△H=(4×413.8C-H )+610.3C=C +(2×64.0O-H )=3193.5kJ ·mol -1总的反应热变化是:△H=3239.4-3193.5=45.9kJ ·mol -1所以是吸热反应。
5、(1)H-F >H-O >H-N >H-C (2)C-F >C-O >C-Cl >C-N6、分子的偶极矩是键矩的向量和(它还包括中心原子由于存大孤对电子而产生的偶极矩)。
对称分子的偶极矩为零。
(μ=O)(3)CH 3CH 2Cl(4)CH 3CH 2NH 2(5)CH 3CN(6)CH3CH(7)(8)ICl(1)CH 3CH 3Cl(2)CH 3Cl CH 3(9)(μ=O)7、C :H=121.927.67:19.77.67=1:102所以实验式为CH 因为(CH )n=78,n(12+1)=78所以n=6即该有机物的分子式是C 6H 68、每一个分了中可能的硫原子数为:5734×0.034÷32=69、(1)双键,烯烃;(2)醚键,醚(3)羟基,醇(4)卤素,氯代烷(5)羧基,醛(6)羰基,铜(7)羰基,醛(8)烷基,芳烃(9)氨基,苯胺(10)硝基,硝基苯(11)巯基,硫醇10、根据共振结构彼此仅在电子排列一不同,而原子核的排列是完全相同的。
《有机化学》(第五版,李景宁主编)习题答案 第一章3、指出下列各化合物所含官能团的名称。
(1) CH 3CH=CHCH 3 答:碳碳双键 (2) CH 3CH 2Cl 答:卤素(氯) (3) CH 3CHCH 3OH 答:羟基(4) CH 3CH 2 C=O 答:羰基 (醛基)H(5)CH 3CCH 3O答:羰基 (酮基)(6) CH 3CH 2COOH 答:羧基 (7)NH 2答:氨基(8) CH 3-C ≡C-CH 3 答:碳碳叁键4、根据电负性数据,用和标明下列键或分子中带部分正电荷和负电荷的原子。
答:6、下列各化合物哪个有偶极矩?画出其方向(1)Br 2 (2) CH 2Cl 2 (3)HI (4) CHCl 3 (5)CH 3OH (6)CH 3OCH 3 答:以上化合物中(2)、(3)、(4)、(5)、(6)均有偶极矩(2)H 2C Cl (3)I (4) Cl 3 (5)H3COH(6)H3CCH 37、一种化合物,在燃烧分析中发现含有84%的碳[Ar (C )=12.0]和16的氢[Ar (H )=1.0],这个化合物的分子式可能是(1)CH 4O (2)C 6H 14O 2 (3)C 7H 16 (4)C 6H 10 (5)C 14H 22 答:根据分析结果,化合物中没有氧元素,因而不可能是化合物(1)和(2); 在化合物(3)、(4)、(5)中根据碳、氢的比例计算(计算略)可判断这个化合物的分子式可能是(3)。
第二章习题解答1、用系统命名法命名下列化合物 (1)2,5-二甲基-3-乙基己烷 (3)3,4,4,6-四甲基辛烷 (5)3,3,6,7-四甲基癸烷(6)4-甲基-3,3-二乙基-5-异丙基辛烷2、写出下列化合物的构造式和键线式,并用系统命名法命名之。
(3)仅含有伯氢和仲氢的C 5H 12答:符合条件的构造式为CH 3CH 2CH 2CH 2CH 3;键线式为; 命名:戊烷。
2第五章酸碱滴定法【习题解答】1写出下列溶液的质子条件:1 1a. G(mol L )NH 3 C 2(mol L )NH 4CI直接参考水准:HCI,NH3和H2OPBE:[H ] [NH 4] [OH ] C 21 1b. C i (mol L )NaOH C 2(mol L )H 3BO 3直接取参考水准: NaOH , H 3BO 3, H 2OPBE :[ H ] c [OH ] [H 2BO 3]C i (mol L 屮3卩。
4 C 2(mol L 1)HCOOHc •直接取参考水准:H 3PO 4 , HCOOH , H 2O23PBE :[H ] [OH ] [H 2PO 4] 2[HPO 4 ] 3[PO 4 ] [HCOO ] d. O.imol L i FeCl 3直接取参考水准:Fe 3+,H 2OPBE:[H ] [OH ] [Fe(OH)2 ] 2[Fe(OH)2 ] 3[Fe(OH)3]2•计算下列各溶液的pH 。
a. 0.10 mol L -!H 3BO 3; c • 0.10mol L -l三乙醇胺e . 0.20 mol L -J H 3PO 4。
10-10, cK a =0.10 5.8 10 10 5.8 10 1110K wE 100所以可以用最简式进行计算。
[H +]= ci<0.10 5.8 10 10 7.6 10 6mol LpH=5.121.0 10 2, 一级离解完全。
溶液的质子条件式为整理后得:[H +]2 K a2[H ] c[H ] 2cK a2 0(C K a2) .(C K a2)2 8cK a22(0.10 0.01) (0.10 0.01)2 8 0.10 0.01 pH 0.96b. 0.10 mol L -1 H 2SO 4; d. 5.0 W -8 mol l_T HCl+ 2- ・[H ]=[SC 4 ]+[OH ]+c2-[SQ ]+c=cK a2 K a2 [H ]解:a.已知H 3BC 3的K a =5.8 b.已知H 2SQ 的K a2[H ]0.11mol Lc. 已知三乙醇胺的K a =5.8 10-7, cK b =0.10 5.8 10 7 5.8 10 8 10K w[H +]= .cKf0.050 5.5 10 10 5.24 10 6mol LpH=5.28c. NH 4+ Ka' = 5.6 10-10, HCN Ka = 6.2 M 0-10cK a ' > 10K w , c > 10 K a 由近似公式可以得到: 「K a K a62 5.6 1020 5.89 10 10mol Lc 0.10K b 5.8 10 100,所以可以用最简式进行计算[OH -]=「cK b0.10 5.8 10 7 2.4 10 4mol L pH=10.38d. 由于HCI 浓度过低,因此不能忽略水离解产生的H整理后得:[H + ]2 c[H ] K 0+,溶液的质子条件式为:[H + ]=[OH -]+c25.0 10 8.(5.0 10 8)2 4 10 141.3 10 7mol L 1pH6.89e 已知H 3PQ 的K a1=7.6 10-3, K a2=6.3 cK a1=0.207.6 10 10K w,K a210-13 -80.20 7.6 10 3,K ; pH=1.463•计算下列各溶液的 pH 。
有机化学答案、于跃芹版第四章第4章习题答案4-1(1)反-2,4-二甲基-3-乙基-3-己烯(2)(Z )-3-甲基-4-氯-3-庚烯(3)4-甲基-2-乙基-1-戊烯(4)(E )-3,3,4,7-四甲基-4-辛烯4-2(1)(2)(3)(4)C FClC (CH 3)2CH H CCH 3CH 2CH 3C HCH 34-3(1)顺式 > 反式(2)顺式 < 反式(3)顺式 > 反式(4)顺式 > 反式(5)顺式 < 反式4-4(1)(2)(3)(4)333CH 3CHCH 2CH CH 3CH 3ClCH 3CH 2CCHCH 3OHCH 3CH 3BrOH(5)(6)CH 2BrCH CH 2C(CH 3)3OH H 3CC 253)3(7)(8)CH 3H 3C COOH + CH 3COCH 3(CH 3)2CHC CH 3+ CH 3CHO O (9)(10)(11)H 3CBrCH 3ClCH CH CH 3CH CH 2(12)(13)(14)CH 3CH CH 3CH CH 2Cl33H 34-5(1)A > C > B > D(2)D > C > B > A (3)B > C > A > D (4)D > C > B > A 4-6(1)(2)(3)(4)(+)( )Br 2(+)( )丙烷环丙烷丙烯正丁烷1-丁烯1-丁炔1-戊炔2-戊炔1,3-戊二烯1,4-戊二烯(+)KMnO 42(+)( )(+)(+)( )Ag(NH 3)2NO 3(+)( )Ag(NH 3)2NO 3马来酸酐(+)( )4-7(1)(2)(3)(4)C 2H 4 (CH 3)2CHCH=CHCH 3 (CH 3)2C=CHCH 2CH 2CH=CH 2CH 3 4-8(1)(2)CH 3(CH 3)2C=CHCH 2CH=CH 24-9(2)(1)CH 3CH 2CHCH 22CH 3CH 2CH CH 2Br3CH 2CH CH 2BrBrCH 3CH 2CHCH 2BrH -H +CH 3CH 2CH CH 2Br OCH 3H 3CCH CH2CH 3OHCH 3+H 2OCH 3CH3H 3C CH CH 3CH 3CH 2CHCH 2BrC CH 3OHCH 3(3)H 3C H 3C3H 3C C H 3CCH CCH 3CH 3H 2OC CH 3CH 3CH 3CH 34-10HC CH HC CHNa NH 3(液)HC C NaH 2CH 3CH 2Br CH 3CH 2BrHC C CH 2CH 3H 2HBr+H 2C CH 2(1)(2)(3)(4)CH 3CH 2CH 2CH 3(CH 3)2C CH 2CCH 2OCH 3ClCH 2CH CHCH 2CH 2CH 3CH 2ClCH CHNaNH 2CHCNaCH CCH 2CH 3CH 2CHCH 2CH 3CH 3CH 2CH 2CH 2BrLindlarLindlar2H HBr 过氧化物Lindlar2CH 3C CHCH 3CH 2CH 2OHCH 3CH CH 226(CH 3CH 2CH 2)3BH O OH /H 2OCl 2C CH 2CH 32AgClCH 2h4-11 CH 3CH 2CH 2CH=CHCH 2CH 2CH 3 4-12 C CH 2C CH 33CH 3CH 34-13CH 2=C C=CH 2CH 3CH 34-14CH C CHO O OCH 3C 2H 5AB C2H 5CHCH 3CH CH C 2H 5CH CH 3CH 2 4-15ABC C CH CH CH 3CH 3DEC C CH CH 3CH 3CH 2CH 2CH 3COOH CH CH 3CH 3CH 3CH 2CH 2COOHC CH 3CH3CH 3O4-16CH 2Cl+H 3C CHO CHO + H 3C CNH 3C (1)(2)(3)++(4)。