第14章取代反应和缩合反应1
- 格式:ppt
- 大小:4.99 MB
- 文档页数:48

有机化学基础知识点整理胺的亲电取代反应与缩合反应有机化学基础知识点整理——胺的亲电取代反应与缩合反应胺是有机化合物中含有氨基(NH2)基团的一类化合物。
胺的亲电取代反应以及缩合反应是有机化学中重要的反应类型。
我们将在本文中对胺的亲电取代反应和缩合反应进行详细的整理和讨论。
一、胺的亲电取代反应亲电取代反应是有机化学中常见的反应类型,它涉及到一个亲电子试剂与胺发生反应,产生新的化学键。
胺的亲电取代反应的机理主要有两个:亲核取代和电子转移。
1. 亲核取代亲核取代是指亲电子试剂中的亲核试剂攻击胺分子中的亲电子中心,并与之形成新的化学键。
常见的亲电取代试剂包括卤素、醇、水和卤代烷等。
以卤代烷为例,当卤代烷与胺反应时,胺中的氮原子亲电子性强,易被卤代烷中的卤素攻击,形成适当的胺盐。
此时,胺盐可以通过加热、浓碱等条件来回复到相应的胺。
2. 电子转移电子转移是指亲电子试剂中的亲电子离子或亲电子原子与胺分子中的电子对发生重新分配,形成新的化学键。
常见的电子转移试剂包括亚硝酸、叔丁基过氧化物等。
以亚硝酸为例,亚硝酸在反应中会发生电子转移,并与胺分子中的氨基发生作用,形成相应的亚硝基化合物。
这种反应常用于合成具有特定化学活性的化合物。
二、胺的缩合反应胺的缩合反应是指两个或更多胺分子之间发生的反应,其中一个分子失去一个氨基(NH2)基团,而另一个分子失去一个氢原子,形成一个新的分子。
1. 胺与醛/酮的缩合反应胺与醛或酮的缩合反应又称为Mannich反应。
在反应中,胺中的亲电子中心攻击醛分子中的羰基,生成一个中间体,然后中间体失去一个氨基和一个氢原子,形成缩合产物。
Mannich反应在有机合成中广泛应用,可以合成多种具有生物活性的化合物,如药物和天然产物。
2. 胺与羧酸的缩合反应胺与羧酸的缩合反应通常需要在酸性条件下进行。
胺中的亲电子攻击羧酸中的羰基,形成酰胺化合物。
此反应也被称为酰胺合成反应。
酰胺化合物是有机化学中重要的结构单元,广泛存在于药物和生命体系中。

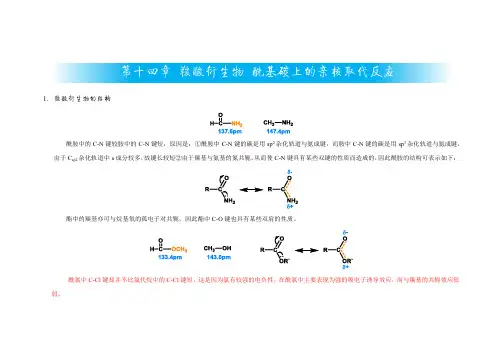
第十四章羧酸衍生物酰基碳上的亲核取代反应1.羧酸衍生物的结构酰胺中的C-N键较胺中的C-N键短,原因是:①酰胺中C-N键的碳是用sp2杂化轨道与氮成键,而胺中C-N键的碳是用sp3杂化轨道与氮成键,由于C sp2杂化轨道中s成分较多,故键长较短②由于羰基与氨基的氮共轭,从而使C-N键具有某些双键的性质而造成的,因此酰胺的结构可表示如下:酯中的羰基亦可与烷基氧的孤电子对共轭,因此酯中C-O键也具有某些双肩的性质。
酰氯中C-Cl键却并不比氯代烷中的C-Cl键短,这是因为氯有较强的电负性,在酰氯中主要表现为强的吸电子诱导效应,而与羰基的共轭效应很弱。
酰胺、酯、酰氯的共振式如下:在酰胺中具有相反电荷的偶系结构是主要的,酯中次之,而在酰氯中这种偶极结构很少。
2.羧酸衍生物的物理性质低级酰氯与酸酐是有刺激气味的液体。
高级的为固体。
低级酯具有芳香的气味,存在于水果中,可用作香料。
十四碳以下的甲酯/乙酯均为液体。
酰胺除甲酰胺外,均是固体,只是因为分子中形成氢键,如果氮上的氢逐个被取代,则氢键缔合减少,因此脂肪族的N-取代酰胺常为液体。
酰氯和酯的沸点因分子中没有缔合,比相应的羧酸低,酸酐与酰胺的沸点,比相应的羧酸高。
(乙酰氯bp:51℃乙酸酐bp:140℃乙酸乙酯bp:77℃乙酰胺bp:222℃)酰氯和酸酐不溶于水,低级的遇水分解;酯在水中的溶解度很小;低级的酰胺可溶于水,N,N-二甲基甲酰胺和N,N-二甲基乙酰胺是很好的非质子性溶剂,可与水以任何比例混合。
乙酸乙酯是很好的有机溶剂,大量用于油漆工业。
3.羧酸衍生物的反应1)酰基碳上的亲核取代反应①酰基碳上的亲核取代反应概述基团离去能力的次序是:I- > Br- > Cl- > -OCOOR > -OR > -OH > -NH2(氨基的碱性比氢氧根强)不管是酸催化还是碱催化的机理,羧酸衍生物亲核取代反应性顺序都是:卤酐醛酮(活泼)酯酸胺腈(较稳定)②羧酸衍生物的水解——形成羧酸a)酰卤的水解在羧酸衍生物中,酰卤的水解速率很快,低分子酰卤水解很猛烈,如乙酰氯在湿空气中会发烟,这是因为乙酰氯水解产生盐酸。

有机化学第二版(高占先)(全14章答案完整版)_第8-14章史上最全的《有机化学第二版(高占先)》全14章答案完整版!!其中包括各种判断题、推断题、思考题以及合成题的答案!!Ps:亲!给好评,有送财富值哦! #^_^!!第8章卤代烃8-2 完成下列各反应式。
(CH3)3CBr C2H5OH(CH3)2C=CH2+CH3CH=CH2HBr+O OCH3CH2CH2CH3CH2CH2CNNaCN(1)(2)(CH3)2CHCH=CH2Br+500℃(CH3)2CCH=CH2Br H2O(CH3)2C=CHCH2Br +(CH3)2CCH=CH2OH(CH3)2C=CHCH2OH +(3)NaCNKOH25(4)(5)(6)ClCH=CHCH2Cl CH3+ClCH=CHCH23OBrBrBrCNCH2CHCH3BrCH=CHCH3CH3 Br2NH3(l)CH3NH2CH32+ClCl NO2NaOH-H2OOHClNO2ZnCl2(HCHO + HCl)+CH2ClMgCH2MgCl CH2COOH ClCH2CHCH2CH2CH3PhCH2MgClCH3+PhCH2CH2CHCH2CH2CH3CH3(7)(8)(9)(10)3RC CLi(11)RC CR'RC CCOOHRC CCH2CH2OHCHBr3BrBr(12)8-3写出下列反应主要产物的构型式。
C2H5CH 3NaI+CC2H5CH3NaSCH3+(S N2)(S N2)(S N2)CH3I2(CH2)4CH3HH2OCH3HCH2(CH2)4CH3HOCBrCH2CH2CH3CCH2CH3H2Lindar催化剂CHCCH2CH2CH3H(1)(2)(3)(4)3KOH253H3t-BuOKt-BuOH, △H3CPh PhHC6H5H3C H6H5H BrC6H5H C6H5CH32525Br(H3C)2HCCH3(H3C)2HCCH3CH3H BrCH2CH3H BrC2H5CH325Znt-BuOK(E2反式消除)(E2反式消除)(E2反式消除)(顺式消除)(E2反式消除,但很慢)(5)(6)(7)(8)(9)8-4比较下列每对亲核取代反应,哪一个更快,为什么(1)B>A (亲核性C2H5O->C2H5OH)(2)A>B (烯丙型卤代烃活泼)(3)B>A (极性非质子溶剂有利于S N2反应)(4)A>B (亲核性-SH>-OH)(5)A>B (亲核性硫比氮强)(6)B>A (离去能力I->Cl-)8-5卤代烷与NaOH在H2O-C2H5OH溶液中进行反应,指出哪些是S N2机理的特点,哪些是S N1机理的特点(1)产物发生Walden转化; S N2(2)增加溶剂的含水量反应明显加快; S N1(3)有重排反应产物; S N1(4)反应速率明显地与试剂的亲核性有关; S N2(5)反应速率与离去基的性质有关; S N2和S N1(6)叔卤代烷反应速度大于仲卤代烷。

![第14章_β-二羰基化合物和有机_[1]...](https://uimg.taocdn.com/489a41b68762caaedd33d446.webp)


有机化学基础知识点取代反应的机理和规律有机化学是研究有机物(含碳元素)的合成、性质和结构等方面的科学。
在有机化学中,取代反应是一种常见的反应类型,它涉及到一个原子或基团取代另一个原子或基团的过程。
了解取代反应的机理和规律是掌握有机化学基础知识的重要一环。
一、取代反应的机理1. 亲核取代反应机理亲核取代反应是指一个亲核试剂(如NH3、Br-等)攻击一个有机化合物中的亲电中心,使其离开并被亲核试剂取代的反应。
亲核试剂中的亲核部分在反应中发挥了重要作用。
亲核取代反应机理主要包括以下几个步骤:(1)亲核试剂攻击:亲核试剂中的亲核部分与有机化合物中的亲电中心发生攻击反应,形成一个中间体。
(2)中间体重排:中间体发生重排反应,使得取代基得以稳定排列。
(3)离去基离去:离去基离开中间体,并与溶剂或离去基之间形成新的化学键。
(4)生成产物:最后生成的产物是一个被亲核试剂取代了一个原有基团的化合物。
2. 亲电取代反应机制亲电取代反应是指一个亲电试剂(如H+, Br+, AlCl3等)攻击一个有机化合物中的亲核中心,使其离开并被亲电试剂取代的反应。
亲电试剂中的亲电部分在反应中发挥了重要作用。
亲电取代反应机制主要包括以下几个步骤:(1)亲电试剂攻击:亲电试剂中的亲电部分与有机化合物中的亲核中心发生攻击反应,形成一个中间体。
(2)中间体重排:中间体发生重排反应,使得取代基得以稳定排列。
(3)离去基离去:离去基离开中间体,并与溶剂或离去基之间形成新的化学键。
(4)生成产物:最后生成的产物是一个被亲电试剂取代了一个原有基团的化合物。
二、取代反应的规律1. Sn1和Sn2反应Sn1反应和Sn2反应是亲核取代反应中的两种常见机制。
Sn1反应是典型的两步反应,第一步是亲电离子形成,第二步是亲核试剂攻击。
Sn2反应是典型的一步反应,在反应中,亲核试剂直接攻击有机化合物中的亲电中心,并与离去基同时发生。
Sn1反应适用于三级卤化合物等离子体生成较容易的化合物;Sn2反应适用于一级卤化合物等亲电离子形成较困难的化合物。



1第十四章 β-二羰基化合物【重点难点】1.乙酰乙酸乙酯(1) 熟练掌握乙酰乙酸乙酯的制备 Claisen 酯缩合法。
CH 3C O CH 2OOC 2H 53+25CH 3COOC 2H 52①②注意:①反应条件:强碱性条件(如RONa );②反应发生在α-碳原子上,原料为碳原子数>3的一元酸生成的酯时, 产物有支链;RCH 2C O CH C OOC 2H 5RCH 2C OOC 2H 53+252①③分子内酯缩合——Dieckmann 反应。
①②OC OOC 2H 5CH 2CH 2CH 2CH 2C OOC 2H 5C OOC 2H 53+C 2H 5ONa(2) 熟练掌握乙酰乙酸乙酯在合成上的应用主要用于合成甲基酮、二酮、酮酸、环酮等。
②①①CH 3C OCH RR'CH 3C OCH 2RCH 3C O C R'COOH CH 3C OCH COOH 稀H +OH -+-CH 3C O C R'C OOC 2H 5C 2H 5ONa (or NaH)C 2H 5ONaCH 3C O CH C O OC 2H 5CH 3C O CH 2OOC 2H 5RXR'X①①②②2.丙二酸二乙酯(1) 熟练掌握丙二酸二乙酯的制备2CH 3COOH 2CH 2COOH -CH 2COO -NaCNCH 2COO-24CH 3CH 2OH CH 2(COOC 2H 5)2(2) 熟练掌握丙二酸二乙酯在合成上的应用主要用于制备乙酸的α-烷基或 -二烷基取代物,二元羧酸、环烷酸。
①②RXC 2H 5ONa R'X-+OH -+稀C 2H 5ONa CH(COOH)2R R CH 2COOHC(COOC 2H 5)2R R'C(COOH)2R R'CHCOOHRR'CH 2(COOC 2H 5)2①①①②②②R CH(COOC 2H 5)2▲3.Michael 加成掌握Michael 加成规律,能写出产物的结构。