第八章热力学基础
- 格式:pptx
- 大小:1.22 MB
- 文档页数:17


第八章热力学定律本章学习提要1.理解热力学第一定律,知道热力学第一定律反映了系统内能的变化和系统通过做功及传热过程与外界交换的能量之间的关系。
初步会用热力学第一定律分析理想气体的一些过程,以及生活和生产中的实际问题。
2.知道热力学第二定律的表述。
知道熵是描写系统无序程度的物理量。
热力学的两个基本定律是能量守恒定律和热力学第一定律。
热力学第二定律表述了热力学过程的不可逆性,即孤立系统自发地朝着热力学平衡方向——最大熵状态——演化。
这两个定律都是通过对自然界和生活、生产实际的观察、思考、分析、实验而得到的,这也是我们学习这两条基本定律应采取的方法。
人类的进步是与对蕴藏在物质内部能量的认识和利用密切相关的。
热力学定律为更好地设计和制造热机、更好地开发和利用能源指明了方向。
随着生产和科学实践的发展,人们逐步领悟到有效利用能源的意义,懂得遵循科学规律的重要性,从而更自觉地抵制违背科学规律的行为。
A 热力学第一定律一、学习要求理解热力学第一定律。
初步会用热力学第一定律分析理想气体的一些过程,以及生活和生产中的实际问题。
我们应聚焦于热力学第一定律的构建过程,理解它既包括内能的转换,也遵循能量守恒定律。
这一定律是通过对自然界以及生活和生产实际的深入观察、思考、分析和实验而得出的自然界中最基本、最普遍的定律之一。
通过学习热力学第一定律,我们能体会到它在科学史上的重要地位,并感受到它对技术进步和社会发展的巨大影响。
二、要点辨析1.热力学第一定律的含义和表式热力学第一定律涉及到能量的转化和能量守恒两个方面。
内能是物质内部大量微观粒子无序热运动所具有的能量形式。
一个物质系统的内能变化是由它与外部环境进行能量交换的结果,而这种能量交换可以通过两种方式实现:做功和热传递。
热力学第一定律揭示了系统内能变化(ΔU)与系统与外部环境交换的功(W)和热量(Q)之间的定量关系。
ΔU=Q+W。
2.应用热力学第一定律解题时,要注意各物理量正、负号的含义当热力学第一定律表示为ΔU=Q+W时,ΔU为正值,表示系统内能增加;负值表示系统内能减小。





第8章 热力学基础8.1基本要求1.理解准静态过程、功、热量的概念,并掌握功的计算方法。
2.掌握热力学第一定律及其在理想气体各等值过程中的应用。
3.掌握理想气体定体和定压摩尔热容及比热容比的概念及计算方法。
4.理解绝热过程,能熟练地分析、计算理想气体在此过程的功、热量和内能的增量。
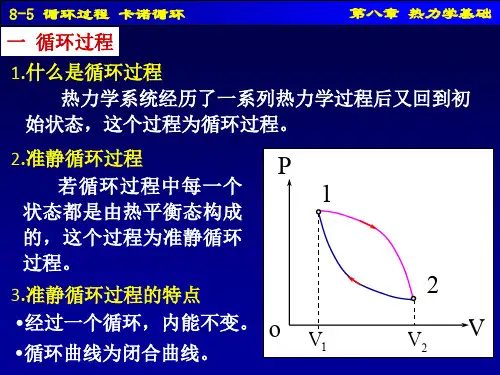
5.理解循环过程的基本特征,理解热机循环和致冷循环的物理意义,理解热机效率的计算方法。
掌握卡诺循环及其特点,能熟练地分析、计算卡诺循环的效率。
6.理解热力学第二定律的两种表述及其等效性,了解可逆过程、不可逆过程及卡诺定理。
7.理解热力学第二定律的本质,了解熵的概念和熵增加原理。
8.2基本概念1 准静态过程系统经历的每一个中间状态都无限地接近平衡态的状态变化过程。
2 功热力学系统与外界交换能量的一种方式,准静态过程中系统对外界做的功为21V V V W pdV pdV ==⎰⎰3 热量传热过程中传递的能量,热力学系统与外界交换能量的另一种方式。
4 摩尔热容当一个系统温度升高(或降低)dT 时,吸收(或放出)的热量如果为dQ ,则系统的热容定义为:dQ C dT= 5 定体摩尔热容若1mol 的理想气体在等体过程中温度改变dT 时所传递的热量为V dQ ,则定体摩尔热容为:,2V V m dQ i C R dT ==,等体过程中内能的增量可表示为:21,21()V m E E C T T ν-=- 6 定压摩尔热容若1mol 的理想气体在等压过程中温度改变dT 时传递的热量为p dQ ,则气体的定压摩尔热容为:,pp m dQ C dT =,与定体摩尔热容的关系为,,p m V m C C R =+,等压过程所吸收的热量可表示为:,21()p p m Q C T T ν=-7 比热容比定压摩尔热容,p m C 与定体摩尔热容,V m C 的比值,用γ表示,,2p m V m C i C iγ+== 8 循环过程 系统经过一系列的状态变化过程以后又回到原来状态的过程,循环过程的重要特征是内能的增量0E ∆=9 正循环及热机的效率过程进行的方向在p V -图上按顺时针方向进行的循环过程叫正循环,工质作正循环的热机效率为:1221111Q Q Q W Q Q Q η-===- 10 逆循环及致冷机的效率 过程进行的方向在p V -图上按逆时针方向进行的循环过程叫逆循环,工质作逆循环的致冷机效率为:2212Q Q e W Q Q ==- 11 可逆和不可逆过程 系统逆过程能重复正过程的每一状态且不引起外界任何变化的状态变化过程称为可逆过程,一切与热现象有关的实际宏观过程都是不可逆的,可逆过程是从实际过程中抽象出来的一种理想过程。

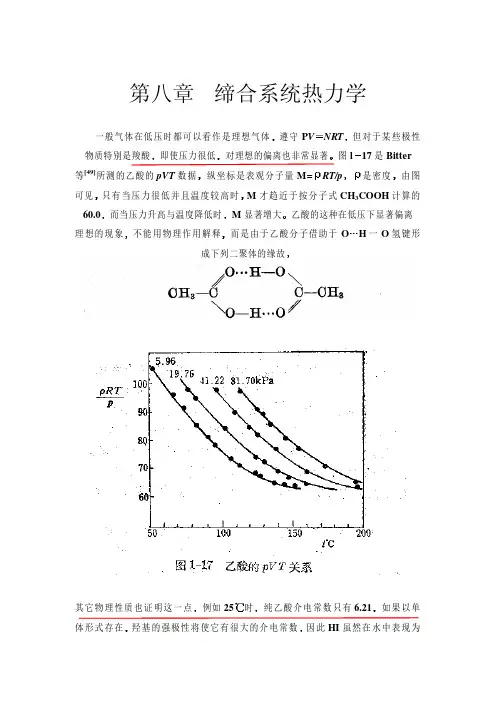

习题及参考答案第八章 热力学 参考答案思考题8-1 “功、热量和内能都是系统状态的单值函数”这种说法对吗?如有错请改正。
8-2 质量为M 的氦气(视为理想气体),由同一初态经历下列两种过程:(1)等体过程;(2)等压过程。
温度升高了ΔT ,要比较这两种过程中气体内能的改变,有一种解答如下:(1) 等体过程T C ME V V ∆∆μ= (2) 等压过程T C ME p p ∆∆μ=∵V p C C ,∴Vp E E ∆∆以上解答是否正确?如有错误请改正。
8-3 摩尔数相同的氦气和氮气(视为理想气体),从相同的初状态(即p 、V 、T 相同)开始作等压膨胀到同一末状态,下列有关说法有无错误?如有错误请改正。
(1)对外所作的功相同; (2)从外界吸收的热量相同; (3)气体分子平均速率的增量相同。
8-4 一定量的理想气体,从p-V 图上同一初态A 开始,分别经历三种不同的过程过渡到不同的末态,但末态的温度相同,如图所示,其中A →C 是绝热过程,问:(1)在A →B 过程中气体是吸热还是放热?为什么? (2)在A →D 过程中气体是吸热还是放热?为什么?8-5 在下列理想气体各种过程中,哪些过程可能发生?哪些过程不可能发生?为什么?(1)等体加热时,内能减少,同时压强升高; (2)等温压缩时,压强升高,同时吸热; (3)等压压缩时,内能增加,同时吸热; (4)绝热压缩时,压强升高,同时内能增加。
8-6 甲说:“系统经过一个正的卡诺循环后,系统本身没有任何变化。
”乙说:“系统经过一个正的卡诺循环后,不但系统本身没有任何变化,而且外界也没有任何变化。
”甲和乙谁的说法正确?为什么?8-7 从理论上讲,提高卡诺热机的效率有哪些途径?在实际中采用什么办法? 8-8 关于热力学第二定律,下列说法如有错误请改正: (1)热量不能从低温物体传向高温物体;(2)功可以全部转变为热量,但热量不能全部转变为功。
8-9 理想气体经历如图所示的abc 平衡过程,则该系统对外作功A ,从外界吸收的热量Q 和内能的增量ΔE 的正负情况为(A )ΔE >0,Q >0,A <0; (B )ΔE >0,Q >0,A >0; (C )ΔE >0,Q <0,A <0; (D )ΔE <0,Q <0,A >0。
第八章 实际气体的热力性质与过程本章主要阐明如何根据热力微分方程,得到利用状态方程及比热容关系计算热力性质和热力过程的方法。
将介绍热工计算中常用到得内能、焓、熵、定压比热容及定容比热容,以至焦汤系数和逸度的计算方法,以及声速、等熵指数等热力性质的计算法。
至于目前热工分析中有很有用的 火用 参数,它根据已知焓、熵等的计算式可以按 火用 的定义式计算。
8—1 导出热力性质关系式的条件和基本方法1、利用由热力学第一、第二定律关联的热力状态参数的基本热力学方程,以及根据状态参数的微分在数学上是恰当微分的特性而得出的一般数学推论,可以导出热力性质一般关系式。
2、单项简单可压缩系统:在大多数场合下我们遇到的,单相纯质或混合物的化学成分不变的系统,其作功方式是通过容积膨胀。
我们称这种系统为单项简单可压缩系统。
“简单”二字表示系统只有一种作功方式。
“可压缩”指系统只能通过体积改变来作功。
根据状态公理,这种系统只要有两个独立变量,即确定任意两个热力性质后,系统的状态就确定。
3、本章讨论的热力性质关系式,仅限于分析定成分单相简单可压缩闭口系统的热力性质的函数关系式。
4、单相简单可压缩闭口系统关联不同热力性质的四个基本热力学方程⎭⎬⎫+=-=vdp Tds dh pdv Tds du 不受过程性质及物质性质的限制。
pdv sdT da --= (表示摩尔自由能a ) vdp sdT dg +-= (表示摩尔自由焓g ) 5、任意状态参数的微分是恰当微分a 、1221z z dz -=⎰ (任意热力性质z 只决定与状态,与到达这个状态所经历的过程性质无关。
)b 、Ndy Mdx dz += 即 y x xNy M )()(∂∂=∂∂ 结合四个基本热力学方程,可得麦克斯韦关系式:(可用可测状态参数间的关系,来表示不可测状态参数间的关系)v s sp v T )()(∂∂-=∂∂p s sv p T )()(∂∂=∂∂v T T p v s )()(∂∂=∂∂ p T Tv p s )()(∂∂-=∂∂ c 、进行热力偏导数的变换时:0),,(=z y x f ⇒⎪⎪⎩⎪⎪⎨⎧∂∂+∂∂=∂∂+∂∂=dzz y dx x y dy dz z x dy y x dx x z y z )()()()(⇒dz zxz y y x dx x y y x y x z z z ])()()[(])()(1[∂∂+∂∂∂∂=∂∂∂∂- (选x 、z 为独立变量) 1)、若dz=0,dx ≠0 就得 1)()(=∂∂∂∂z z x y y x 即 z z xy y x )(1)(∂∂=∂∂ (倒数关系)2)、若dx=0,dz ≠0 就得 0])()()[(=∂∂+∂∂∂∂y x z zxz y y x 即 1)()()(-=∂∂∂∂∂∂y x z x z z y y x (循环关系)8—2 热力性质的一般表达式一、内能的一般表达式1、若状态方程以p 为显函数,即p=f(T,v),则可以利用下面导出的关系式来求内能变化。
第八章 热力学基础一、选择题[ A ]1.(基础训练4)一定量理想气体从体积V 1,膨胀到体积V 2分别经历的过程是:A →B 等压过程,A →C 等温过程;A →D 绝热过程,其中吸热量最多的过程(A)是A →B. (B)是A →C. (C)是A →D.(D)既是A →B 也是A →C , 两过程吸热一样多。
【提示】功即过程曲线下的面积,由图可知AD AC AB A A A >>; 根据热力学第一定律:E A Q ∆+= AD 绝热过程:0=Q ; AC 等温过程:AC A Q =;AB 等压过程:AB AB E A Q ∆+=,且0>∆AB E[ B ]2.(基础训练6)如图所示,一绝热密闭的容器,用隔板分成相等的两部分,左边盛有一定量的理想气体,压强为p 0,右边为真空.今将隔板抽去,气体自由膨胀,当气体达到平衡时,气体的压强是(A) p 0. (B) p 0 / 2. (C) 2γp 0. (D) p 0 / 2γ. 【提示】该过程是绝热自由膨胀:Q=0,A=0;根据热力学第一定律Q A E =+∆得 0E ∆=,∴0T T =;根据状态方程pV RT ν=得00p V pV =;已知02V V =,∴0/2p p =.[ D ]3.(基础训练10)一定量的气体作绝热自由膨胀,设其热力学能增量为E ∆,熵增量为S ∆,则应有 (A) 0......0=∆<∆S E (B) 0......0>∆<∆S E . (C) 0......0=∆=∆S E . (D) 0......0>∆=∆S E【提示】由上题分析知:0=∆E ;而绝热自由膨胀过程是孤立系统中的不可逆过程,故熵增加。
[ D ]4.(自测提高1)质量一定的理想气体,从相同状态出发,分别经历等温过程、等压过程和绝热过程,使其体积增加1倍.那么气体温度的改变(绝对值)在 (A) 绝热过程中最大,等压过程中最小. (B) 绝热过程中最大,等温过程中最小. (C) 等压过程中最大,绝热过程中最小.(D) 等压过程中最大,等温过程中最小. 【提示】如图。