2-甲基-2-丁醇的制备
- 格式:doc
- 大小:111.50 KB
- 文档页数:6

叔丁醇钾反应机理引言叔丁醇(又称2-甲基-2-丁醇)是一种重要的有机化合物,在有机合成和工业生产中广泛应用。
它可以通过苄基钠与乙酸乙酯反应得到,其中反应机理尚不清楚。
本文将探讨叔丁醇钾反应的机理,并详细介绍其反应的步骤和可能的中间产物。
叔丁醇钾反应的步骤叔丁醇钾反应的步骤可以分为四个阶段,具体如下:1.生成叔丁基盐首先,乙酸钾(CH3COOK)与叔丁醇(C4H10O)在甲醇(CH3OH)溶剂中反应生成叔丁基盐(C4H9K)和乙酸(CH3COOH)。
反应的化学方程式如下所示:CH3COOK + C4H10O -> C4H9K + CH3COOH2.脱醇反应在第二个步骤中,生成的叔丁基盐会继续与甲醇反应,发生脱醇反应。
这个反应会生成叔丁烯(C4H8)和甲醇钾(CH3OK)。
反应的化学方程式如下所示:C4H9K + CH3OH -> C4H8 + CH3OK3.分解反应第三个步骤是分解反应,叔丁烯会继续分解为丁烯(C4H6)和丙烯(C3H4)。
此反应需要高温和加热条件。
反应的化学方程式如下所示:C4H8 -> C4H6 + C3H44.热解反应在最后一个步骤中,丙烯会发生热解反应,产生苯乙烯(C8H8)。
这个反应需要高温和加热条件。
反应的化学方程式如下所示:C3H4 -> C8H8叔丁醇钾反应的中间产物在叔丁醇钾反应过程中,存在着一些可能的中间产物。
下面列出了可能的中间产物和相应的反应步骤:1.叔丁烯 (C4H8):在脱醇反应后生成的中间产物,它可以通过分解反应进一步转化为丁烯和丙烯。
2.丁烯 (C4H6):由叔丁烯分解得到的中间产物,它可以进一步热解为苯乙烯。
3.丙烯 (C3H4):由叔丁烯分解得到的中间产物,它经过热解反应生成苯乙烯。
叔丁醇钾反应的应用叔丁醇钾反应具有重要的应用价值,主要体现在以下几个方面:1.有机合成:叔丁醇钾反应是合成有机化合物的重要步骤。
通过控制反应条件和中间产物的选择,可以合成出多种有机化合物,如丁烯和苯乙烯等。

实验实验 12--3 1-溴丁烷的制备-溴丁烷的制备 1.加料时,如不按实验操作中的加料顺序,先使溴化钠与浓硫酸混合,然后再加正丁醇和水,将会出现何现象? 会有 Br2 产生 2.从反应混合物中分离出粗产品1-溴丁烷时,为何用蒸馏分离,而不直接用分液漏斗分离? 反应完毕,除得到主产物 1-溴丁烷外,还可能含有未反应的正丁醇和副反应物正丁醚。
另外还有无机产物硫酸氢钠,用通常的分液方法不易除去,故在反应完毕再进行粗蒸馏,一方面使生成的 1-溴丁烷分离出来,另一方面粗蒸馏过程可进一步使醇与氢溴酸的反应趋于完全。
3.本实验有哪些副反应发生?采取什么措施加以抑制?副反应: H SO (浓)2 4CH CH CH CH OH CH CH CH=CH + H O3 2 2 2 3 2 2 2H SO (浓)2 42CH CH CH CH OH CH CH CH CH OCH CH CH CH + H O3 2 2 2 3 2 2 2 2 2 2 3 2控制反应温度不要过高4 .后处理时,各步洗涤的目的何在?为什么要用浓硫酸洗一次?为什么在用饱和碳酸氢钠水溶液洗涤前,首先要用水洗一次? 用等体积的浓硫酸洗涤除去粗产物中未反应的原料丁醇或溶解的副产物烯等。
有机相依次用等体积的水(除硫酸)、饱和碳酸氢钠溶液(中和未除尽的硫酸)和水(除残留的碱) 5.回流在有机制备中有何优点? 为什么在回流装置中要用球形冷凝管? 有机反应很多情况下是在溶剂、原料的沸腾温度或较高温度下进行的,为了防止溶剂、原料或产物逸出反应体系引起损失、带来污染及不安全因素,常需要采用回流装置。
因为球型冷凝管冷凝面积大,各处截面积不同,冷凝物易回流下来。
实验实验 12-7 2-甲基甲基-2-丁醇的制备丁醇的制备1.本实验为什么使用的药品仪器均需绝对干燥?为此应采取什么措施? Grignard 反应必须在无水和无氧条件下进行,所用仪器和试剂均需干燥,因为微量水分的存在不但阻碍卤代烃和镁之间的反应,而且会破坏形成的 Grignard 试剂而影响产率。

实验12-7 2-甲基-2-丁醇的制备
1.本实验为什么使用的药品仪器均需绝对干燥?为此应采取什么措施? Grignard 反应必须在无水和无氧条件下进行,所用仪器和试剂均需干燥,因为微量水分的存在不但阻碍卤代烃和镁之间的反应,而且会破坏形成的Grignard 试剂而影响产率。
本实验所用的合成反应的试剂在实验前必须进行无水处理,溴乙烷用无水氯化钙干燥,蒸馏纯化;丙酮用无水碳酸钾干燥,蒸馏纯化;无水乙醚若为市售,需用压钠机向瓶内压入钠丝,瓶口用带有无水氯化钙干燥管的橡皮塞塞紧,放置24 h (放在远离火源的阴凉黑暗处保存),直至无氢气泡放出。
2.如反应未开始前,加入大量溴乙烷有什么不好?
反应未开始前,加入大量溴乙烷会发生卤代烃的偶联反应,增加副产物。
3.乙醚在本实验各步骤中的作用是什么?使用乙醚应注意哪些安全问题? 进行反应时乙醚作溶剂,后处理是乙醚作萃取剂。
4.为什么碘能促使反应发生?卤代烷与格氏试剂反应的活性顺序如何? 加入一小粒碘起催化作用,反应开始后,碘的颜色立即褪去。
碘催化过程可用下列方程式表示:
Mg + I 2
MgI 2Mg 2Mg I ··Mg I ·+ RX
R + MgXI MgXI + Mg
·Mg X ·Mg I +R ··Mg X +RMgX
5.本实验有哪些可能的副反应,如何避免?
用活泼的卤代烃制备Grignard 试剂时,偶合反应是主要的副反应,可以采取搅拌、控制卤代烃的滴加速度和降低溶液浓度等措施减少副反应的发生。
6.为什么本实验得到的粗产物不用无水氯化钙干燥。
醇与氯化钙干燥可以反应生成醇合物。
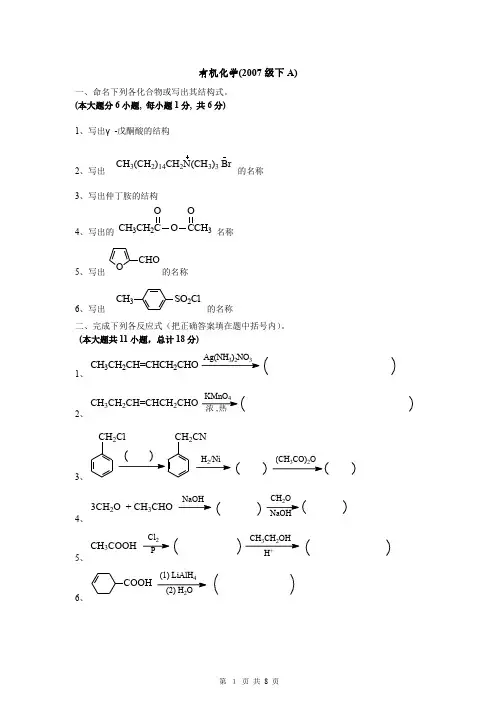
有机化学(2007级下A)一、命名下列各化合物或写出其结构式。
(本大题分6小题, 每小题1分, 共6分)1、写出γ-戊酮酸的结构2、写出 CH 3(CH 2)14CH 2N(CH 3)3 Br的名称3、写出仲丁胺的结构4、写出的 CH 3CH 2O 3OO名称5、写出OCHO的名称6、写出SO 2ClCH 3 的名称二、完成下列各反应式(把正确答案填在题中括号内)。
(本大题共11小题,总计18分)1、CH 3CH 2CH=CHCH 2CHO3232、浓 ,热4CH 3CH 2CH=CHCH 2CHO3、CH2Cl CH 2CN2(CH CO)O4、3CH2O + CH 3CHOCH O NaOH5、CH 3COOH32Cl P6、COOH(1) LiAlH (2) H 2O7、CH2CHO2COOH4H2O300℃8、(1) C H ONa+CH32)32H5O O9、CH33OH OH+ BrZnCH2COOC2H510、H2O, HO-N KOCH(CH)Br三、基本概念题(根据题目要求回答下列各题)。
(本大题共4小题,总计10分)1、指出下列化合物中,哪个能发生碘仿反应。
(1) CH3CH2CHCH2CH3(2)CHCH3OH(3) ICH2CHO(4)CH3CH2CH2CHO2、下列化合物哪些能进行银镜反应?(1) CH3COCH2CH3(2)CHOHOOHOHCH2OHHO(3)CH3CHCHO33、下列各对化合物,那些是互变异构体?那些是共振杂化体?(1) CH3CO-OH3C CO-O和(2)和O OH4、下列羧酸酯中,那些能进行酯缩合反应?写出其反应式。
(1) 甲酸乙酯(2) 乙酸甲酯(3) 丙酸乙酯(4) 苯甲酸乙酯四、理化性质比较题(根据题目要求解答下列各题)。
(本大题共6小题,每小题3分,总计18分)1、将下列化合物按羰基上亲核加成反应活性大小排列成序:2、试比较下列化合物的碱性大小:(A) 环己胺 (B) 六氢吡啶 (C) N-甲基六氢吡啶 (D) 苯胺 (E) 氨3、试将下列化合物按烯醇式含量大小排列: (A) CH 3COCH 2COCH 3(B) CH 3COCH 2COOCH 2CH 3(C)CH 3COCH 2COC 6H 5(D)CH 2(COOC 2H 5)24、把下列化合物按进行醇解或氨解反应活性大小排列成序: (A) CH 3CONH 2 (B)CH 3COOC 2H 5 (C)(CH 3CO)2O(D)CH 3COCl(E)CH 3COOH5、试将下列化合物按芳香性大小排列:(A) 呋喃 (B) 噻吩 (C) 吡咯 (D) 苯6、试比较下列化合物的酸性大小:(A) 三氯乙酸 (B) 氯乙酸 (C) 乙酸 (D) 羟基乙酸 五、鉴别及分离提纯 (本大题共3小题,总计9分)(1) 用简单的化学方法区别下列化合物:(A) 2-己醇 (B) 3-己醇 (C) 环己酮 (D) 环己烯(2) 用简单的化学方法区别下列化合物:(A) 正丁醛 (B) 苯甲醛 (C) 2-丁酮 (D) 苯乙酮 (E) 环己酮(3) 除去混在苯中的少量噻吩 六、反应机理(本大题共2小题,总计10分)1、指出下列反应机理所属的类型:(1)N 2OH 2OH- N 2- H +(2)N 2N=N OHOHNaOH,pH=90~5C+(3)CH 33O C CH 3CH OH CHHCN -2、写出下列反应的机理:OCH 2COOCH 332DON-CH 3+ CH 3OH七、合成题本大题共5小题,每小题4分,总计20分)1、以苯为原料(无机试剂任选)合成间溴苯甲酸 。
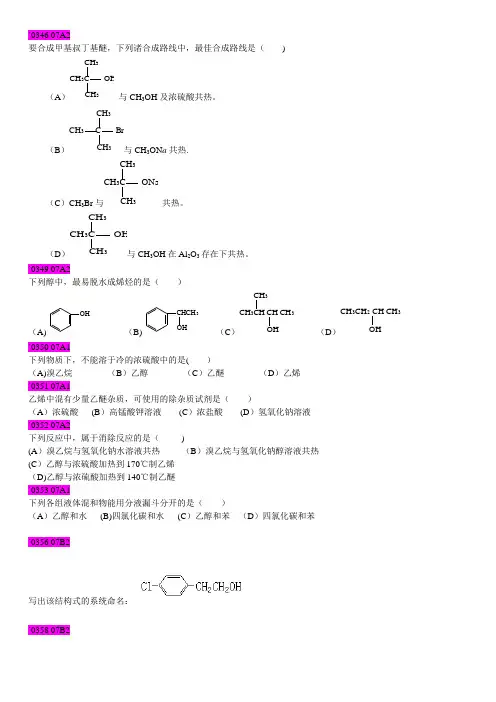
`0346 07A2要合成甲基叔丁基醚,下列诸合成路线中,最佳合成路线是( )(A )CH 3C OHCH 3CH 3与CH 3OH 及浓硫酸共热。
(B )CH 3 C BrCH 3CH 3与CH 3ON a 共热.(C )CH 3Br 与CH 3CH 3CH 3C ONa共热。
(D )CH 3C OHCH 3CH 3与CH 3OH 在Al 2O 3存在下共热。
`0349 07A2下列醇中,最易脱水成烯烃的是( )(A)OH(B)CHCH 3OH(C )CH 3CH CH CH 3CH 3OH(D )CH 3CH 2 CH CH 3OH`0350 07A1下列物质下,不能溶于冷的浓硫酸中的是( )(A)溴乙烷 (B )乙醇 (C )乙醚 (D )乙烯 `0351 07A1乙烯中混有少量乙醚杂质,可使用的除杂质试剂是( )(A )浓硫酸 (B )高锰酸钾溶液 (C )浓盐酸 (D )氢氧化钠溶液 `0352 07A2下列反应中,属于消除反应的是( )(A )溴乙烷与氢氧化钠水溶液共热 (B )溴乙烷与氢氧化钠醇溶液共热 (C )乙醇与浓硫酸加热到170℃制乙烯 (D)乙醇与浓硫酸加热到140℃制乙醚 `0353 07A1下列各组液体混和物能用分液漏斗分开的是( )(A )乙醇和水 (B)四氯化碳和水 (C )乙醇和苯 (D )四氯化碳和苯`0356 07B2写出该结构式的系统命名:`0358 07B2写出该结构式的系统命名:`0360 07B2写出该化合物的构造式:对硝基苄基苯甲醚`0362 07B2写出该化合物的构造式:2,3-二甲氧基丁烷`0364 07C1用简便且有明显现象的方法鉴别下列各组化合物CH2OH OHCH3`0365 07C2用简便且有明显现象的方法鉴别下列各组化合物CH3CH2OCH2CH3 , CH3CH2CH2CH2OH , CH3(CH2)4CH3 `0366 07C1`0370 07C1完成下列各反应:`0371 07C1用简单的化学方法区别以下各组化合物正丁醇,甲丙醚,环已烷.`0372 07C2用简单的化学方法区别以下各组化合物乙苯,苯乙醚,苯酚,1-苯基乙醇。


2-甲基-2-丁醇的合成摘要:本文研究了以溴乙烷与镁为原料,无水乙醚作溶剂,在无水无氧条件下反应,生成Grignard试剂。
利用Grignard和丙酮加成反应生成醇盐,经水解来制备2-甲基-2-丁醇的过程,探讨了反应原理。
反应中,要求反应体系干燥无水,采用在冷凝管上装氯化钙干燥管。
Grignard反应中,贮存过久的金属镁条容易氧化,形成一层氧化薄膜,反应前需去掉表层。
2-甲基-2-丁醇的能与水形成共沸物,因此粗产物必须很好的干燥,否则前馏分将大大的增加,降低产率。
试验表明,本法与其他方法相比,具有流程短,收率高,产品质量稳定的持点。
关键词: 2-甲基-2-丁醇、Grignard反应、合成、乙基溴化镁、叔戊醇2-甲基-2-丁醇又名叔戊醇,它作为一种基本有机化工原料有着相当广泛的用途,广泛应用于频呐酮、彩色胶片成色剂、佳乐麝香和粉檀麝香、叔戊基过氧化物、N一苯基氨基甲酸叔戊醇、酰氟基对氧萘酮的制备等行业,同时还可用于回收石油的溶液添加剂与氯化物清洗剂的稳定剂[1]。
七十年代中叶,日本研究以2-甲基-2-丁醇为原料合成中间体频那酮获得成功,使一批高附加值的延伸产品问世,将2-甲基-2-丁醇的深度加工推向一个新的高度。
2-甲基-2-丁醇的合成是有机合成实验中比较经典的传统实验。
2-甲基-2-丁醇合成方法有多种,包括以乙炔和丙酮为原料,固体氢氧化钾为催化剂,在液氨介质中,采用釜式反应器合成甲基丁炔醇,还对甲基丁炔醇选用釜式反应器进行液相加氢合成2-甲基-2-丁醇;异戊烯法采用直接水合法和硫酸水台法两种流程,原料是2-甲基-1-丁烯和2-甲基-2-丁烯。
但硫酸水合法,对设备腐蚀严重,废酸较难处理是其缺点,有被直接水合法取代的趋势。
直接水台法是用酸性阳离子交换树脂催化剂、在超临界条件下进行的水合反应。
反应温度和压力等操作条件与生产仲丁醇的方法相似[2];此外还有乙烯和丙烯共聚法、丙烯和异丁烯歧化法、异戊二烯选择性加氧法、3-甲基-1一丁烯异构化法等众多合成方法[3]。

有机化学综合练习五化合物的转化或合成(用反应式表示)1. 用乙烯和乙炔为原料合成1-丁炔。
2. 由乙炔转化为3-己炔。
3.由溴乙烷和异丙醇制备2-甲基-2-丁醇。
4.从甲苯转化为苄醇。
5.以硝基苯为原料,制备间二碘苯。
6.从苯转化为正丙苯。
7.从丙烯转化为丙酮。
8.以丙烯和丙醛为原料,制备2-甲基-3—戊醇9.从甲苯转化为1-苯基2-丙醇。
10.由转化为。
11.由1-溴丙烷转化为2-溴丙烷12. 由2-甲基-3-戊醇转化为2-溴-2-甲基戊烷。
13.由异丙醇转化为正丙醇。
14.由乙醛转化为2-丁烯醛。
15.由苯酚转化为苯甲醚。
解题提示或答案1.乙烯转化为卤代烷,乙炔转化为乙炔钠,再由卤代烷与乙炔钠反应。
H 2C=CH 2 + HBr CH 3CH 2BrHC CH HC CNa HC C-CH 2CH 32.乙炔转化为乙炔二钠,再与卤代乙烷反应。
3.异丙醇氧化成丙酮,溴乙烷转化为格氏试剂与丙酮加成后酸性水解。
4.甲苯在光照条件下 氯代后再水解。
5.硝基苯与发烟硝酸、硫酸在加热条件下制得间二硝基苯,用铁屑和盐酸在加热条件下还原成间二苯胺,将氨基转化为重氮盐后被碘取代。
6.苯与丙酰氯进行付氏酰基化反应,然后将羰基还原成亚甲基。
7.丙烯水合得到2-丙醇,再氧化为丙酮。
2 NaNH 2 CH 3CH 2Br CH 3 Cl 2 ,光照 CH 2Cl H 2O/OH - CH 2OH H 2SO 4 H 2O OSO 3H OOHK 2Cr 2O 7 H 2SO 4 CH 3CHCH 3 CH 3CHCH 3 CH 3CH=CH 2 CH 3C-CH 38.丙烯加氯化氢再制成格氏试剂与丙醛加成后酸性水解。
9.甲苯在光照条件下 氯代后制成格氏试剂与乙醛加成后酸性水解。
10、邻氯硝基苯用铁屑和盐酸在加热条件下还原成邻氯苯胺,将氨基转化为重氮盐后再被氯取代。
11.1-溴丙烷在氢氧化钾的乙醇溶液中加热发生消除生成丙烯,再与溴化氢加成。


实验七 2-甲基-2-丁醇的制备一、实验目的:通过2-甲基-2-丁醇的制备学习并掌握使用格利雅试剂和醛酮反应制备醇。
熟悉并基本掌握憎水和低沸点试剂的实验。
学会格利雅试剂的制备,格利雅试剂与醛酮的反应,如何进行憎水性实验。
二、试剂:1、无水乙醚25mL2、镁 1.8g(0.73mol)3、无水丙酮5mL(3.95g,0.68mol)4、溴乙烷10mL(14.4g,0.13mol)5、乙醚30mL6、碘少许7、10%硫酸8、10%碳酸钠水溶液15mL9、无水碳酸钾三、反应原理:产物数据:2-甲基-2-丁醇 2-methyl-2-butanolMF: C5H12O MW: 88.15 vapor pressure: 12mmHg(20℃) bp: 102℃ n20/D:1.405,mp:-12℃, d: 0.805g/ml(25℃)四、实验仪器及实验装置图:250mL圆底三口烧瓶、100mL圆底单口烧瓶球、球形冷凝管、干燥管、分液漏斗、锥形瓶、蒸馏头、温度计、直形冷凝管、接受弯头、调压器、加热套。
反应装置图蒸馏装置图五、操作步骤:在装有平衡加料漏斗和球形冷凝管(上端装干燥管)的250mL三口烧瓶(另一个口用塞子塞上)中加入10mL无水乙醚、1.8g镁、少许碘。
滴液漏斗中加入10mL无水乙醚和10mL溴乙烷,轻轻摇动平衡加料漏斗,使其混合均匀。
自滴液漏斗中先放出~三分之一溴乙烷乙醚溶液,立即用手加热烧瓶使反应开始,反应变缓后再滴加溴乙烷乙醚溶液,保持反应比较激烈的进行。
当反应变慢后轻轻摇动反应装置,使反应加速,再变慢时加入溴乙烷乙醚溶液,控制加入速度,即要反应比较激烈进行,又不要使反应过于激烈而造成反应过快,乙醚来不及冷凝而逸出。
全部加完后开始小心加热回流直至金属镁基本消失为止。
取下加热套,用冰水冷却烧瓶至室温。
关闭平衡加料漏斗,向其中加入5mL 丙酮和5mL无水乙醚,轻轻摇动反应装置,使丙酮与无水乙醚混合均匀。

2甲基2丁醇的反应原理
2甲基2丁醇的反应原理是指2甲基2丁醇在一定条件下与其他化合物发生化学反应的原理。
以下是2甲基2丁醇的几种常见反应原理:
1. 氧化反应:2甲基2丁醇可以被氧化剂如氧气、过氧化氢等氧化为2-丁酮或2-丁醛。
反应条件下,氧化剂与2甲基2丁醇接触并提供足够的能量,使2甲基2丁醇中的碳氢键被氧化剂氧化断裂,生成相应的氧化产物。
2. 脱水反应:2甲基2丁醇在脱水条件下,如高温、浓硫酸等催化剂的存在下,丢失一个水分子,生成2-丁烯。
3. 酯化反应:2甲基2丁醇与酸反应时,酸中的羧基与2甲基2丁醇中的羟基反应,生成相应的酯。
此反应常用于有机合成中的酯类产物的制备。
4. 烷基化反应:2甲基2丁醇与碱金属如钾反应,钾金属催化下,醇中的羟基被去质子化,生成烷基金属中间体,再与其他化合物反应,生成相应的烷基化产物。
5. 脱氢反应:2甲基2丁醇在高温条件下,可发生脱氢反应,生成丁烯和乙醛。
这些反应原理可以根据具体的条件和反应物进行调节,以制备所需的化合物或开展有机合成反应。
11级有机基础实验下教案实验一己二酸的制备实验目的1. 学习用环己醇氧化制备己二酸的原理和方法;2. 掌握电动搅拌(或磁力搅拌)、浓缩、过滤及重结晶等操作技能实验原理OH+ 8 KMnO4 + H2O32)4COOH +8MnO2 + KOH实验药品及仪器药品:1.3mL环己醇,1.9g碳酸钠,6g高锰酸钾,浓硫酸仪器:电动搅拌器(或磁力搅拌器)、循环水泵、电热套、标准磨口仪实验步骤1.在三颈瓶中加入高锰酸钾固体6g和碳酸钠(1.9 g碳酸钠溶于17.5 mL水中,可多加一点水),温水加热使反应物的温度为40℃,并不断搅拌,使固体几乎全部溶解。
2.移去水浴,在搅拌下,从恒压漏斗中滴入4~5D环己醇,反应开始,然后慢慢滴入剩余的环己醇,控制滴加速度,使瓶内温度维持40~45℃,温度过高时则用冷水浴冷却,温度低于40℃时则用温水浴加热。
3.环己醇加完后,继续搅拌10分钟,然后在60~70℃的水浴中加热约20分钟,高锰酸钾紫色完全褪去,同时有大量的褐色二氧化锰生成,再继续加热搅拌10分钟。
4.冷却后抽滤,滤渣用60~70℃的热水洗涤三次(每一次2 mL),将滤液浓缩至10 mL 左右,在搅拌下慢慢滴入浓硫酸至PH=2,冷却、抽滤、洗涤、烘干、称重、计算产率。
注意事项1.该反应为放热反应,反应一当开始,则会放出大量的热,开始时温度不能超过40℃,否则不易控制。
2.滴加环己醇的速度必须控制1~2D/秒,否则反应速度太快不易控制。
3.酸化必须充分PH=2,且加浓硫酸速度不要太快。
思考题1. 如果反应很久高锰酸钾的紫色也不退去,可能是什么原因,怎样处理?2. 反应中加入碳酸钠有什么作用?3. 还有哪些方法可以制备己二酸?4. 请列举一些常见的氧化体系,并说明环己醇被氧化后,主要生成什么产物?(因环己醇量少,可不用滴液漏斗,直接用滴管加样)带滴加和电动搅拌的回流装置实验二环己酮的制备实验目的1. 掌握铬酸氧化法制备环己酮的原理和方法。
英文回答:The synthesis of 2-methyl-3-buten-2-ol involves a series of essential steps. Initially, isobutylene serves as the starting material, and it undergoes a catalytic hydration reaction to yield tert-butyl alcohol. Subsequently, the tert-butyl alcohol undergoes dehydration to regenerate isobutylene, which is then subjected to a hydroformylation reaction to produce 2-methyl-2-butenal. Finally, the 2-methyl-2-butenal undergoes a hydrogenation reaction to yield the final desired product, 2-methyl-3-buten-2-ol.2—甲基—3—丁二醇的合成涉及一系列基本步骤。
最初,异丁烯作为起始材料,经过催化水合反应生成三丁醇。
随后,三丁基醇发生脱水再生成异丁基苯,再经过水成化反应生成2—甲基—2—丁基苯。
2—甲基—2—丁醇发生氢化反应,生成最终理想产物2—甲基—3—丁醇。
The whole process of making the stuff is done in a controlled way to make sure we get lots of it and that it's nice and pure. Each step in the making involves using the right stuff to help change the starting materials into the thing we want. And then we use methods like distillation and chromatography to grabthe 2-methyl-3-buten-2-ol out of the mix and make sure it'ssuper pure.制作这些东西的整个过程都是以控制的方式完成的,以确保我们得到很多东西,并确保这些东西是美好而纯洁的。
2-甲基丁醇的合成与应用研究进展
崔文峰;徐森
【期刊名称】《精细石油化工》
【年(卷),期】2000(000)005
【摘要】综述了2-甲基丁醇的合成技术研究现状及制备方法,该产品具有良好的旋光活性,可作为合成旋光液晶的原料,并可用于增塑剂、粘合剂、除草剂及香料的合成,具有较高的附加值,开发应用前景广泛。
【总页数】2页(P44-45)
【作者】崔文峰;徐森
【作者单位】中国石油兰州炼化公司,7300600;中国石油兰州炼化公司,7300600
【正文语种】中文
【中图分类】TQ2
【相关文献】
1.2-甲基-4-(对甲氧基苯基)-2-丁醇及其乙酸酯的合成 [J], 覃彩芹;马雪兵
2.2-甲基-3-乙酰基-5-(2'-氯-D-半乳糖-丁醇基)呋喃的合成及晶体结构 [J], 严琳;王强;刘宏民
3.微量、半微量法合成2-甲基-2-丁醇 [J], 张洪权;郑平;金文娟
4.4-氨基-2-甲基-1-丁醇的合成 [J], 李问鼎;冯薇伟;王军营;杨海涛;奚强
5.CDK抑制剂2-(6-(苄基氨基)-9-环丙甲基-9H-嘌呤-2-氨基)-1-丁醇的合成及抗肿瘤活性研究 [J], 侯学会;张京玉;王国庆;吕全建
因版权原因,仅展示原文概要,查看原文内容请购买。
Grignard反应制备2-甲基-2-丁醇一、 实验项目简介本实验在无水乙醚中将溴乙烷与金属镁反应,制备格氏试剂--乙基溴化镁。
将格氏试剂与丙酮反应,得到亲核加成产物,然后将其用稀硫酸分解,得到目标分子2-甲基-2-丁醇。
(详见教案)二、 实验项目的综合性本实验是在学生掌握有机实验的基本单元操作的基础上设立的一个综合性较大的项目,要求学生能够把各方面的知识综合联系起来,使其在实验技能与技巧方面能够得到更好的训练,以提高他们的实践能力与创新能力。
1) 实验操作的综合性a) 实验的前期处理内容较多:需要学生将仪器洗涤洁净并充分干燥;将所有反应物进行无水处理;镁条需打磨或酸洗以去除表面氧化物。
b) 因为各个单元反应均较为剧烈,要让学生掌握缓慢滴加反应物的技巧,培养学生认真观察反应现象的能力与耐心。
c) 反应中使用低沸点的溶剂和反应物,要求学生进一步熟悉回流操作,掌握缓和均匀回流的技巧。
d) 粗产物采用乙醚萃取,因其极低的沸点,要求学生进一步正确熟练掌握萃取的操作要点。
e) 目标分子与水形成恒沸物,要求学生掌握干燥剂“适量”的标准以及干燥的基本操作。
f) 进一步熟悉蒸馏操作。
g) 了解无水操作处理的基本要素,了解常见溶剂的无水处理的方法。
2)实验目的的综合性a) Grignard试剂是有机化学基本理论学习中的重点,本项目要求学生在实验之前回顾Grignard试剂的有关知识。
通过本次实验既要让学生实实在在的了解其制备过程的复杂性,又要让学生真实感受到其在有机合成中应用的广泛性。
b) 羰基是一类非常活泼的基团,自然界有大量的含羰基的化合物。
本项目也要求回顾各种羰基参与的反应以及羰基的制备方法。
通过本次实验要求学生进一步掌握亲核加成反应的机理及其应用。
三、 实验操作要点1) 安装好回流滴加装置。
2) 将15mL无水乙醚和20mL干燥的溴乙烷放入滴液漏斗中,然后缓慢滴加到盛有3.5克镁屑和20mL无水乙醚的干燥的250mL三口烧瓶中,保持反应物正常平稳的回流与沸腾。
北京石油化工学院
综合性有机化学实验报告
题目名称:2-甲基-2-丁醇的制备学生姓名:XXX
专业:化学工程与工艺
学院:化学工程学院
年级:20XX级
指导教师:XXX
20XX 年 12 月 1 日
2-甲基-2-丁醇的制备
XXX
(北京石油化工学院化学工程学院,北京102600)
摘要:2-甲基-2-丁醇是常用的有机溶剂与有机原料,可用于生产药物、香料、增塑剂、浮选剂等。
本实验首先利用溴乙烷与镁合成Grignard试剂[1],再用Grignard试剂与丙酮反应,经酸化得到2-甲基-2-丁醇,最后用Lucas试剂检验产物。
本实验是常量实验,实验共使用1.8g(0.073mol)镁、10mL(4.4g,0.13mol)溴乙烷、5mL(3.95g,0.068mol)丙酮,得到产物2.7g,产率45%,产率适中,适合实验室少量制备醇类化合物使用。
关键词:2-甲基-2丁醇;制备;Grignard试剂
1 前言
2-甲基-2-丁醇,俗称“叔戊醇”,结构式如右图。
常
温下为无色液体,沸点102℃,相对密度20
d为0.805,折
4
射率20
n为1.4052,有类似樟脑气味。
微溶于水,与乙醇、
D
乙醚、苯、氯仿、甘油互溶。
易燃,易发生消除反应。
实验室中常用Grignard试剂合成。
工业上由丙酮与乙炔加成得乙炔基异丙醇后镍催化加氢制得,也可用2-甲基-2-丁烯在硫酸中水化制取。
用作溶剂和有机原料,生产药物、香料、增塑剂、浮选剂等。
2 实验部分[2]
2.1实验仪器及药品
仪器:电子天平PL601-S,梅特勒-托利多仪器(上海)有限公司;调温电热套DZH10,北京市光明医疗仪器厂;250mL圆底三口烧瓶,扬州市信谊玻璃仪器有限公司;100mL单口烧瓶,扬州市信谊玻璃仪器有限公司;恒压滴液漏斗,扬州市信谊玻璃仪器有限公司;球形冷凝管,扬州市信谊玻璃仪器有限公司;干燥管,扬州市信谊玻璃仪器有限公司;分液漏斗,扬州市信谊玻璃仪器有限公司;
锥形瓶,扬州市信谊玻璃仪器有限公司;蒸馏头,扬州市信谊玻璃仪器有限公司;温度计(150℃),扬州市信谊玻璃仪器有限公司;直形冷凝管,扬州市信谊玻璃仪器有限公司;接受弯头,扬州市信谊玻璃仪器有限公司。
药品:溴乙烷,分析纯,天津市化学试剂三厂;丙酮,分析纯,北京化工厂;无水乙醚,分析纯,北京化工厂;镁屑,分析纯,北京恒业中远化工有限公司;无水碳酸钾,分析纯,北京化工厂;硫酸,分析纯,北京化工厂。
2.2实验装置图:
2.3反应原理:
实验首先用溴乙烷与镁在无水乙醚中反应制备Grignard试剂,然后将Grignard试剂与丙酮在无水乙醚中反应,将产物酸化,得到2-甲基-2-丁醇。
具体操作步骤如下:
1、按装置图组装仪器。
2、向三口烧瓶中加入10mL无水乙醚、1.8g(0.073mol)镁。
恒压滴液漏斗中加入10mL无水乙醚和10mL(4.4g,0.13mol)溴乙烷,轻摇反应装置,使其混合均匀。
冷凝管通冷凝水。
3、恒压滴液漏斗先放出约1/3溴乙烷乙醚溶液,立即用手加热反应烧瓶使反应开始,反应变缓后再滴加溴乙烷乙醚溶液,保持反应微沸状态。
反应中要不时摇动反应装置,控制反应速度,既要使反应激烈进行,又不要使反应过于激烈造成反应过快使乙醚来不及冷凝而逸出。
全部加完后小心加热回流至镁基本消失为止。
反应开始后反应液逐渐变浑浊,呈灰色。
反应比较剧烈,放热,冷凝管中不时有液滴滴下。
4、用冰水浴冷却烧瓶至室温。
关闭恒压滴液漏斗,向其中加入5mL(3.95g,0.068mol)丙酮和5ml无水乙醚,轻摇反应装置,使其混合均匀。
5、在冰水浴下将恒压滴液漏斗中的丙酮乙醚溶液小心滴加到反应瓶中,边加边摇动反应装置,全部加完后取下冰水浴,将反应液在室温下放置15min。
该反应剧烈,随着丙酮乙醚溶液的加入反应瓶内出现白色固体。
反应放热,冷凝管中不时有液滴滴下。
6、将反应烧瓶再置于冰水浴上。
关闭恒压滴液漏斗活塞,向其中加入50mL 的10%硫酸。
将恒压滴液漏斗中的硫酸小心的加入反应烧瓶中,边加边摇动,使烧瓶充分冷却。
该反应剧烈,随着硫酸的加入反应瓶内的白色固体逐渐溶解。
反应放热,冷凝管中不时有液滴滴下。
反应结束后反应液呈无色透明状,分层,底部有少量白色固体。
7、将反应液分液,有机相转移至原反应烧瓶内,水相用10mL乙醚萃取两次,每次的萃取液转移至原反应烧瓶内。
有机相用10mL的10%碳酸钠水溶液洗一次,分液,然后有机相用无水碳酸钾干燥。
干燥过程中可以观察到无水碳酸钾变得膨胀蓬松。
8、在100mL烧瓶中蒸馏所得混合液,乙醚回收,收集100~102℃馏分。
收集到的液体呈无色透明状,有类似樟脑气味。
用Lucas试剂检验,溶液浑浊分层。
3 实验结果
实验共获得产品2.7g,产品呈无色透明状,有类似樟脑气味。
理论产量:6.0g。
产率:2.7/6.0*100%=45%。
4实验结果分析及讨论
实验产率45%,产率一般。
本实验采用Grignard试剂合成法,在Grignard试剂的使用中要避免含活性氢物质存在,这是保证实验成功的基本条件之一。
实验中要控制反应的激烈程度,既要使反应激烈进行,又要防止反应过于激烈使低沸点物质逸出。
有机化学反应反应速率一般较慢,因此保证反应的时间格外重要,不能操之过急,但也不能长时间反应,有可能会导致副反应发生,应严格按照规定的时间控制实验节奏。
实验使用的镁屑可能部分已被氧化,导致无法反应;实验还进行了多次酸化、碱洗操作,2-甲基-2-丁醇微溶于水,虽然进行了两次萃取,但仍无法避免部分产物随废液被丢弃。
这些都是造成实验产率一般的原因。
5思考
本实验中最应该注意的问题:Grignard试剂是憎水试剂,因此在Grignard 试剂的制备与反应过程中要避免活性氢物质的存在;乙醚沸点较低并且该反应放热,反应时要注意控制反应的激烈程度,防止反应过于激烈导致乙醚逸出;实验所用的镁最好先预处理一下,去掉表面的氧化层。
参考文献
[1]高鸿宾.有机化学.北京:高等教育出版社,2005.245~248
[2]胡应喜.基础化学实验.北京:石油工业出版社,2009.276~277。