铬-锰及其化合物
- 格式:doc
- 大小:53.00 KB
- 文档页数:3

实验9 铬、锰及其化合物的性质一、实验目的掌握铬、锰主要氧化态化合物的性质。
二、实验原理1、铬及其化合物的性质Cr 价电子构型:3d 54s 1 ,VIB 族,常见的氧化态为+6,+3,+2Cr 2O 72-Cr 3+Cr 2+Cr 1.33-0.41-0.91-0.74E A 0/VE B 0/VCrO 42-Cr(OH)3Cr(OH)2Cr-0.13-1.1-1.4在酸性介质中,+2氧化态具有强的还原性,+6氧化态具有氧化性,Cr 3+的还原性都较弱,只有用强氧化剂才能将它们分别氧化为Cr 2O 72-;在碱性介质中,+6氧化态稳定(CrO 42-)。
Cr 2O 3和Cr (OH )3显两性。
Cr 3+Cr(OH)34]-((绿色)--铬(VI )最重要的化合物为K 2Cr 2O 7,在水溶液中Cr 2O 72-和CrO 42-存在下列平衡:Cr 2O 72-CrO 42-+2H 2OH+2+(橙红色)(黄色)在碱性溶液中,[Cr(OH)4]-可以被过氧化氢氧化为CrO 42-。
在酸性溶液中CrO 42-转变为Cr 2O 72-。
Cr 2O 72-与过氧化氢反应能生成深蓝色的CrO 5,由此可以鉴定Cr 3+。
2、Mn价电子结构3d 54s 3 ,VIIB 族,常见的氧化态为+6,+7,+4,+3,+2 Mn 2+在酸性溶液中的稳定性大于在碱性溶液中:酸性介质:只有很强的氧化剂(铋酸钠、二氧化铅)才能氧化Mn 2+H 2O7Mn2+NaBiO 3H+Na +Bi 3+MnO 4-25145+++5+2+碱性介质:Mn 2+2+OH -Mn(OH)2(白色沉淀)O 2MnO(OH)2(棕色)Mn (IV )化合物重要的是MnO 2,在酸性溶液中具有氧化性。
Mn (VI )化合物重要的是MnO 42-,Mn (VII )化合物重要的是MnO 4-E A 0/VE B 0/VMnO 4-MnO 42-MnO 2MnO 4-MnO 42-MnO20.562.260.560.60MnO 42-存在于强碱溶液中,在酸性,中性环境中均发生歧化。

一、实验目的1. 了解铬和锰的物理性质、化学性质及反应特点;2. 掌握铬和锰在酸、碱、盐溶液中的反应规律;3. 分析铬和锰在工业生产中的应用。
二、实验原理1. 铬(Cr):铬是一种银白色金属,具有光泽,熔点高,硬度大。
铬在常温下不与氧气、水反应,但在高温下能与氧气反应生成Cr2O3。
铬具有多种氧化态,其中+3价和+6价较为稳定。
铬的氧化还原反应如下:(1)氧化反应:Cr + 2H2O2 + 4H+ = Cr2O72- + 4H2O(2)还原反应:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O2. 锰(Mn):锰是一种银白色金属,具有光泽,熔点高,硬度大。
锰在常温下不与氧气、水反应,但在高温下能与氧气反应生成MnO2。
锰具有多种氧化态,其中+2价和+4价较为稳定。
锰的氧化还原反应如下:(1)氧化反应:Mn + 2H2O2 + 2H+ = MnO2 + 2H2O(2)还原反应:MnO2 + 4H+ + 2e- = Mn2+ + 2H2O三、实验仪器与药品1. 仪器:试管、烧杯、酒精灯、滴管、试管夹、铁架台、滤纸、蒸馏水等。
2. 药品:铬粉、锰粉、硫酸、盐酸、氢氧化钠、氯化钠、氯化钾、硫酸铜、硫酸铁、硫酸亚铁、硫酸锰、硫酸钾等。
四、实验步骤1. 铬的氧化还原反应实验:(1)取一支试管,加入少量铬粉;(2)加入少量硫酸,搅拌至铬粉溶解;(3)滴加少量氢氧化钠溶液,观察溶液颜色变化;(4)滴加少量硫酸,观察溶液颜色变化。
2. 锰的氧化还原反应实验:(1)取一支试管,加入少量锰粉;(2)加入少量硫酸,搅拌至锰粉溶解;(3)滴加少量氢氧化钠溶液,观察溶液颜色变化;(4)滴加少量硫酸,观察溶液颜色变化。
3. 铬和锰的置换反应实验:(1)取一支试管,加入少量铬粉;(2)加入少量硫酸铜溶液,观察溶液颜色变化;(3)取一支试管,加入少量锰粉;(4)加入少量硫酸铜溶液,观察溶液颜色变化。

铬锰氮耐热钢化学成分
铬锰氮耐热钢是一种具有优异耐热性能的特种钢材,其化学成分对其性能具有重要影响。
本文将从铬、锰和氮三个方面介绍铬锰氮耐热钢的化学成分。
一、铬的作用
铬是铬锰氮耐热钢中的主要合金元素之一,其含量通常在10%到30%之间。
在铬锰氮耐热钢中,铬的主要作用是增加钢的耐热性能和耐腐蚀性能。
铬能够与钢中的其他元素形成稳定的氧化膜,提高钢的耐腐蚀性能。
此外,铬还能够在高温下形成稳定的碳化物,增加钢的耐热性能。
二、锰的作用
锰是铬锰氮耐热钢中的另一个重要合金元素,其含量通常在0.5%到2%之间。
锰的主要作用是增强钢的强度和韧性。
锰能够与铁形成固溶体,强化钢的晶格结构,提高钢的强度。
此外,锰还能够与硫形成硫化锰,抑制钢中的硫脆性,提高钢的韧性。
三、氮的作用
氮是铬锰氮耐热钢中的一个重要合金元素,其含量通常在0.05%到0.3%之间。
氮的主要作用是增加钢的强度和硬度。
氮能够与铁形成固溶体,强化钢的晶格结构,提高钢的强度和硬度。
此外,氮还能够与铬形成氮化铬,增加钢的耐热性能。
铬锰氮耐热钢的化学成分对其性能具有重要影响。
铬能够增加钢的耐热性能和耐腐蚀性能,锰能够增强钢的强度和韧性,氮能够增加钢的强度和硬度。
因此,在铬锰氮耐热钢的制备过程中,合理控制化学成分的含量是至关重要的。
只有合理调配这三个元素的含量,才能获得具有优异耐热性能的铬锰氮耐热钢。
附:铬锰氮耐热钢的化学成分示意表
元素含量
铬 10%-30%
锰 0.5%-2%。

铬,锰及其化合物的相关性质的实验报告铬、锰及其化合物的相关性质1。
了解铬和锰的各种常见化合物的形成和性质2.掌握铬和锰的各种氧化态之间的转化条件。
3。
了解铬和锰化合物的氧化还原以及介质对氧化还原产物的影响1.Cr用于还原Cr3+或Cr2O72-,天蓝色Cr2+2 Cr+Zn = 2cr+znCr2O 72-+4zn+14h+= 2cr 2+4zn 2++3+2+2++7h 20灰绿色由于+cr2s3在水中完全水解:2cr 3+3s 2-+6h2o = 2cr(OH)3++3 H2S在碱性溶液中,[铬(OH) 4]-具有很强的还原性,可被氧化成CrO 42-: 2[铬(OH)4]-+33在酸性溶液中,只有强氧化剂如K2S2O8+或高锰酸钾才能将Cr3氧化成Cr2O 3 72-:+2CR 3+3S2O 82-+7H2O = Cr2O 3 72-++6 so42-+14h+,Cr2O72-是强氧化剂。
例如:k2cr2o7+14hcl(浓缩)= 2c rcl 3+3c L2+2kcl+7h2o重铬酸盐的溶解度大于铬酸盐。
因此,当向重铬酸盐溶液中加入银离子、铅离子、钡离子等离子体时,通常会产生铬酸盐沉淀。
例如: Cr2O72-+4ag ++ H2O = 2ag 2 cro 4(砖红色)+2h+Cr2O 72-+2ba 2 ++ H2O = 2bacro 4(黄色)+2h+在酸性溶液中,Cr2O 72-和H2O2可以生成深蓝色加合物CrO5,但它不稳定,会迅速分解为铬和氧如果提取到乙醚或戊醇中,它会更加稳定。
主要反应为:3+cr2o 72-+4h 202+2h+= 2cro(O2)(深蓝)+5h 20cro(O2)2+(C2 H5)2O = cro(O2)2(C2 H5)2O(深蓝)4 cro(O2)2+12h+= 4c R3+7o 2+9 cr2o 72-+4h 202+2h+= 2cro(O2)(深蓝)2.锰锰(氢氧化物)2在浓硫酸中易被氧化。


铬、锰及其化合物的性质一、实验目的掌握铬、锰主要氧化态化合物的性质。
二、实验原理1、铬及其化合物的性质Cr 价电子构型:3d 54s 1 ,VIB 族,常见的氧化态为+6,+3,+2Cr 2O 72-Cr 3+Cr 2+Cr1.33-0.41-0.91-0.74E A 0/VE B 0/VCrO 42-Cr(OH)3Cr(OH)2Cr-0.13-1.1-1.4在酸性介质中,+2氧化态具有强的还原性,+6氧化态具有氧化性,Cr 3+的还原性都较弱,只有用强氧化剂才能将它们分别氧化为Cr 2O 72-;在碱性介质中,+6氧化态稳定(CrO 42-)。
Cr 2O 3和Cr(OH )3显两性。
Cr 3+Cr(OH)34]-((绿色)--铬(VI )最重要的化合物为K 2Cr 2O 7,在水溶液中Cr 2O 72-和CrO 42-存在下列平衡:Cr 2O 72-CrO 42-+2H 2O H +2+(橙红色)(黄色)在碱性溶液中,[Cr(OH )4]—可以被过氧化氢氧化为CrO 42-。
在酸性溶液中CrO 42-转变为Cr 2O 72-。
Cr 2O 72-与过氧化氢反应能生成深蓝色的CrO 5,由此可以鉴定Cr 3+。
2、Mn价电子结构3d 54s 3 ,VIIB 族,常见的氧化态为+6,+7,+4,+3,+2 Mn 2+在酸性溶液中的稳定性大于在碱性溶液中:酸性介质:只有很强的氧化剂(铋酸钠、二氧化铅)才能氧化Mn 2+H 2O7Mn2+NaBiO 3H+Na +Bi 3+MnO 4-25145+++5+2+碱性介质:Mn 2+2+OH -Mn(OH)2(白色沉淀)O 2MnO(OH)2(棕色)Mn (IV )化合物重要的是MnO 2,在酸性溶液中具有氧化性。
Mn(VI )化合物重要的是MnO 42-,Mn (VII )化合物重要的是MnO 4-E A 0/VE B 0/VMnO 4-MnO 42-MnO 2MnO 4-MnO 42-MnO20.562.260.560.60MnO 42-存在于强碱溶液中,在酸性,中性环境中均发生歧化。
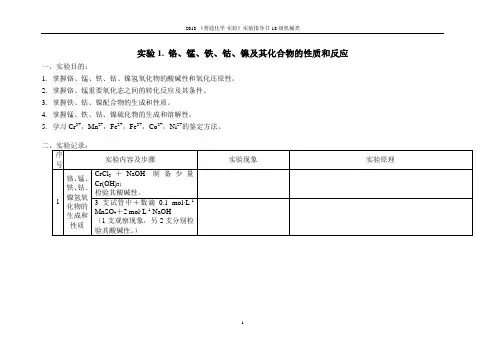
实验1. 铬、锰、铁、钴、镍及其化合物的性质和反应
一、实验目的:
1.掌握铬、锰、铁、钴、镍氢氧化物的酸碱性和氧化还原性。
2.掌握铬、锰重要氧化态之间的转化反应及其条件。
3.掌握铁、钴、镍配合物的生成和性质。
4.掌握锰、铁、钴、镍硫化物的生成和溶解性。
5.学习Cr3+,Mn2+,Fe2+,Fe3+,Co2+,Ni2+的鉴定方法。
三、注意事项:
1.在制备Mn(OH)2沉淀时,一定要用长滴管深入到溶液底部,将NaOH溶液挤出。
2.Cr(OH)3的颜色是灰绿色,容易被Cr3+的颜色掩盖,要注意观察。
加入NaOH溶液的速度不能太快,否则难以观察到沉淀
的生成。
3.在检验Ni(OH)2沉淀酸碱性时,要用比较强的氧化剂将其氧化。
四、思考题
1. 在Co(OH)3 中加入浓HCl,有时会生成蓝色溶液,加水稀释后变为粉红色,试解释之。
2. K2Cr2O7溶液中加入Pb(NO3)2和AgNO3溶液会发生什么反应?
五、实验体会和建议。


实验四铬锰化合物性质实验一、实验目的1.了解铬、锰各种重要价态化合物的生成和性质。
2.了解铬、锰各种价态之间的转化。
3.了解铬、锰化合物的氧化还原性以及介质对氧化还原反应的影响。
二、实验提要铬和锰分别为周期系ⅦB族元素。
它们都具有可变的氧化数。
铬的化合物中氧化数为+3,+6的最常见,而+2的不稳定;锰的化合物中氧化数为+2,+4,+7的最常见,而+3,+5的化合物不稳定。
铬和锰的各种氧化数的化合物有不同的颜色。
(一)铬Cr3+的氢氧化物具有两性,溶液中的酸碱平衡可表示如下:Cr3+ + 3OH- Cr(OH)3 HCrO2+ H2O H2O + H+ + CrO2-Cr3+ 的盐容易水解,pH值小于4时,溶液中才有[Cr(H2O)6]2-离子存在。
根据Ф0(Cr2O72-/Cr3+) = 1.33V, Ф0(CrO42-/CrO2-) = -0.23V。
可知Cr2O72-在酸性溶液中为强氧化剂,易被还原成Cr3+ ,而在碱性溶液中CrO2- 为一较强的还原剂,易被氧化为CrO42- ,例如: Cr(OH)3 + OH-= CrO2- + H2O2CrO2- + 3H2O2+ 2OH-=2CrO42- + 4H2O铬酸盐和重铬酸盐在水溶液中存在这下列平衡:2CrO4- + 2H+= Cr2O72- + H2O上述平衡在酸性介质中向右移动,而在碱性介质中向左移动。
酸性溶液中,Cr2O72- 与H2O2反应时,产生蓝色的过氧化铬CrO(O)2:Cr2O72- + 4H2O2+ 2H+= 2CrO(O)2+ 5H2O蓝色CrO(O)2在有机试剂乙醚中较稳定。
这一反应常用来鉴定Cr3+、CrO42- 和Cr2O72-。
(二)锰Mn(Ⅱ)在碱性溶液中易被空气氧化生成棕色MnO2的水合物[MnO(OH)2],但在酸性溶液中相当稳定,必须用强氧化剂如:PbO2、NaBiO3才能氧化为MnO4-。
2MnSO4+5NaBiO3(s)+16HNO3=2HMnO4(紫红)+NaNO3+5Bi(NO3)3+2Na2SO4 +7H2O在中性或弱碱性溶液中MnO4- 和Mn2+ 反应生成棕色MnO2沉淀。

无机化学实验二十四铬、锰实验二十四铬、锰[实验目的]了解铬、锰主要氧化态化合物的重要性质以及它们之间相互转化的条件。
[实验用品]仪器:离心机、试管、离心试管、烧杯、酒精灯等固体药品:MnO2、KMnO4、KOH*、KClO3*液体药品:H2SO4(1mol・L-1,浓)、HCl(2mol・L-1,浓)、NaOH(2mol・L-1,6mol・L-1,40%)、HAc(2mol.L-1)、K2Cr2O7(0.1mol・L-1,饱和*)、K2CrO4(0.1mol・L-1)、KMnO4(0.01mol・L-1)、KI(0.1mol・L-1)、NaNO2(0.1mol・L-1)、MnSO4(0.1mol・L-1)、NH4Cl(2mol.L-1)、Na2SO3(0.1mol・L-1)、Na2S(0.1mol・L-1)、H2S(饱和)、BaCl2(0.1mol・L-1)、Pb(NO3)2(0.1mol・L-1)、AgNO3(0.1mol・L-1)、3%H2O2、乙醇、材料:木条、冰 [实验内容]一、合物的重要性质1.铬(VI)的氧化性Cr2O72-(橙红色)离子转变为Cr3+(紫色)离子在少量(5mL)重铬酸钾溶液中,加入少量你选择的还原剂,观察溶液颜色的变化(如果现象不明显,该怎么办?)写出反应方程式(保留溶液供下面实验3用)。
思考题:(1)转化反应须在何种介质(酸性或碱性)中进行?为什么?(H2SO4介质)(2)从电势值和还原剂被氧化后产物的颜色考虑,应选择哪些还原剂为宜?(Na2SO3、3%H2O2、Sn2+等)如果选择亚硝酸钠溶液,可以吗?(可以)现象及解释:Cr2O72-(橙红色)离子转变为Cr3+(紫色)离子。
Cr2O72-+2H++4H2O2==2CrO5+5H2O 4CrO5+12H+==4Cr3++7O2↑+6H2OCr2O72-+8H++3NO2==2Cr3++3NO3+4H2O--2.铬(VI)的缩合平衡Cr2O72-(橙红色)离子与CrO42-(黄色)离子的相互转化。

对“铬、锰及其化合物的性质与转化(归纳与扩展)"的检测暨较复杂方程式的强化训练1.交警常用“酒精检测仪”(含CrO 3 )检查司机是否酒后驾车,现象是由红色变为绿色(Cr 3+),试写出对应的化学方程式:____________________________________________2.用三氧化铬除去Ba 2+的原理是生成难溶于水的铬酸钡(BaCrO 4),对应的离子方程式为: ____________________________________________________________3。
铬酸钡溶于硝酸和盐酸,在硫酸中发生沉淀转化,对应的离子方程式为:____________________________________________________________4。
铬酸(H 2CrO 4,其酸酐为___________)仅存在于溶液中,是二元中强酸,其电离方程式为:_____________________________________________________________________5。
在酸性条件下,-24CrO 转化为-272O Cr (黄色变橙色)的原理是:__________________________________________________________________________6。
分析化学中,用酸性重铬酸钾溶液来测定铁(+2Fe )的含量,对应的离子方程式为: ________________________________________________________________________7.在酸性溶液中,-272O Cr 可以将溴化氢、碘化氢、硫化氢、亚硫酸等氧化,试写出与硫化氢反应的离子方程式:______________________________________________________8.重铬酸钾与浓盐酸在加热时可发生反应产生氯气,对应的离子方程式为:_________________________________________________________9.重铬酸盐的溶解度较铬酸盐的溶解度大,因此,向重铬酸盐溶液中加Ag +、Pb 2+、Ba 2+等离子时,通常生成铬酸盐沉淀,试以Ag +为例,写出对应的离子方程式:________________________________________________________10.如果是含 272O Cr 的废水,可以在酸性介质中加入亚硫酸氢钠将其还原为Cr 3+,再用熟石灰调节pH 至8左右,将Cr 3+转化为Cr (OH )3沉淀,灼烧得到氧化物(三氧化二铬)回收。
锰铬合金钢具体参数表锰铬合金钢是一种常用的合金钢,其具有优异的机械性能和耐磨性能,在工业领域中广泛应用。
下面是锰铬合金钢的具体参数表。
1. 化学成分锰铬合金钢的化学成分主要包括以下几个元素:- 铁(Fe):基本元素,占比最高。
- 碳(C):提高硬度和强度的关键元素,一般在0.15%~0.35%之间。
- 锰(Mn):增加抗磨性和韧性的重要元素,一般在1.2%~1.6%之间。
- 铬(Cr):提高硬度、耐蚀性和耐磨性的关键元素,一般在0.5%~1.2%之间。
- 硅(Si):提高强度和硬度的辅助元素,一般在0.2%~0.5%之间。
2. 机械性能锰铬合金钢具有出色的机械性能,以下是其主要参数:- 屈服强度:通常在600 MPa到800 MPa之间。
- 抗拉强度:通常在800 MPa到1000 MPa之间。
- 延伸率:通常在10%到15%之间。
- 冲击韧性:通常在20 J/cm^2到40 J/cm^2之间。
- 硬度:通常在HB200到HB300之间。
3. 热处理锰铬合金钢可以通过热处理来改善其机械性能和耐磨性能。
常用的热处理方法包括正火、淬火和回火。
正火可以提高钢材的硬度和强度,淬火可以增加其耐磨性,而回火可以提高其韧性和冲击韧性。
4. 应用领域锰铬合金钢由于其优异的机械性能和耐磨性能,在各个工业领域中得到广泛应用。
以下是一些典型的应用领域:- 制造业:锰铬合金钢常用于制造机械零件、工具、模具等。
- 汽车工业:锰铬合金钢常用于制造汽车发动机零件、传动系统零件等。
- 石油化工:锰铬合金钢常用于制造石油化工设备、管道等。
- 采矿业:锰铬合金钢常用于制造采矿设备、破碎机零件等。
5. 注意事项在使用锰铬合金钢时,需要注意以下几点:- 确保材料的质量和成分符合要求,以避免因材料问题导致的失效。
- 在热处理过程中,严格控制温度和时间,以确保获得理想的机械性能。
- 在使用过程中,避免超载和过度磨损,以延长材料的使用寿命。
【考必备·清单】1.锰元素的常见价态有+7、+6、+4、+3、+2,Mn 2+在酸性溶液中的稳定性强于在碱性溶液中的稳定性。
(1)Mn 2+的性质(2)Mn(Ⅵ)化合物的性质MnO 2-4存在于强碱性溶液中,在酸性、中性环境均发生歧化。
3MnO 2-4+2H 2O===2MnO -4+MnO 2↓+4OH -3MnO 2-4+4H +===2MnO -4+MnO 2↓+2H 2O (3)KMnO 4的性质热稳定性差,通常保存在棕色试剂瓶中:4KMnO 4+2H 2O=====光照4MnO 2↓+3O 2↑+4KOH①在酸性介质中,MnO -4具有强氧化性,本身被还原为Mn 2+。
MnO -4+5Fe 2++8H +===Mn 2++5Fe 3++4H 2O 2MnO -4+16H ++10Cl -===2Mn 2++5Cl 2↑+8H 2O 2MnO -4+6H ++5H 2C 2O 4===2Mn 2++10CO 2↑+8H 2O 2MnO -4+6H ++5H 2O 2===2Mn 2++5O 2↑+8H 2O②在碱性、中性或微弱酸性溶液中,MnO -4仍旧是氧化剂,本身被还原为MnO 2。
2MnO -4+I -+H 2O===2MnO 2↓+IO -3+2OH -③在强碱性溶液中,当MnO -4过量时,还原产物是MnO 2-4。
2MnO -4+SO 2-3+2OH -===2MnO 2-4+SO 2-4+H 2O 。
2.铬元素的常见价态有+6、+3、+2。
在酸性介质中,Cr 2+具有强的还原性,+6价铬(Cr2O2-7、CrO2-4)具有强氧化性,Cr3+的还原性较弱,只有用强氧化剂才能将Cr3+氧化成Cr2O2-7,在碱性介质中,CrO2-4的稳定性强。
(1)Cr2O3和Cr(OH)3的两性Cr3+(紫色)①OH-④H+Cr(OH)3(灰蓝色)②OH-③H+[Cr(OH)4]-(绿色)相关反应的离子方程式:①Cr3++3OH-===Cr(OH)3↓②Cr(OH)3+OH-===[Cr(OH)4]-③[Cr(OH)4]-+H+===Cr(OH)3↓+H2O④Cr(OH)3+3H+===Cr3++3H2O(2)铬(Ⅵ)的离子平衡在水溶液中Cr2O2-7和CrO2-4存在下列平衡:2CrO2-4+2H+Cr2O2-7+H2O(黄色)(橙红色)在碱性溶液中,[Cr(OH)4]-可以被H2O2氧化为CrO2-4,在酸性溶液中CrO2-4转变为Cr2O2-7。
铬,锰及其化合物
1. 铬
在酸性条件下,用锌还原Cr3+或Cr2O72-,均可得到天蓝色的Cr2+
2Cr3++Zn =2Cr2++Zn2+
Cr2O72-+4Zn +14H+=2Cr2++4Zn2++7H2O 灰绿色的Cr(OH)3呈两性:
Cr(OH)3+3H+=Cr3++3H2O
Cr(OH)3+OH-=[Cr(OH)4]-(亮绿色)
向含有Cr3+的溶液中加入Na2S并不生成Cr2S3,因为Cr2S3在水中完全水解:
2Cr3++3S2-+6H2O =2Cr(OH)3+3H2S
在碱性溶液中,[Cr(OH)4]-具有较强的还原性,可被H2O2氧化为CrO42-:2[Cr(OH)4]-+3H2O2+2OH-=2CrO42-+8H2O 但在酸性溶液中,Cr3+的还原性较弱,只有象K2S2O8或KMnO4等强氧化剂才能将Cr3+氧化为Cr2O72-:
2Cr3++3S2O82-+7H2O=Cr2O72-+6SO42-+14H+在酸性溶液中,Cr2O72-是强氧化剂,例如:
K2Cr2O7 +14HCl(浓)=2CrCl3+3Cl2+2KCl +7H2O 重铬酸盐的溶解度较铬酸盐的溶解度大,因此,向重铬酸盐溶液中加Ag+、Pb+、Ba2+等离子时,通常生成铬酸盐沉淀,例如:
Cr2O72-+4Ag++H2O =2Ag2CrO4(砖红色)+2H+
Cr2O72-+2Ba2++H2O =2BaCrO4(黄色)+2H+
在酸性溶液中,Cr2O72-与H2O2能生成深蓝色的加合物CrO5,但它不稳定,会很快分解为Cr3+和O2。
若被萃取到乙醚或戊醇中则稳定得多。
主要反应为:Cr2O72-+4H2O2+2H+=2CrO(O2)2(深蓝)+5H2O
CrO(O2)2+(C2H5)2O =CrO(O2)2(C2H5)2O(深蓝)
4CrO(O2)2+12H+=4Cr3++7O2+6H2O
此反应用来鉴定Cr(Ⅵ)或Cr(Ⅲ)。
2. 锰
Mn(OH)2易被氧化
Mn2++2OH-=Mn(OH)2(s)(白色)
2Mn(OH)2+O2=2MnO(OH)2(s)(棕色)在浓硫酸中,MnSO4与KMnO4反应可生成深红色的Mn3+(实际是硫酸根的配合物):
MnO4-+4Mn2++8H+=5Mn3++4H2O
Mn3+可存在于浓硫酸中,若酸度降低,则Mn3+歧化为Mn2+和MnO2:2Mn3++2H2O =Mn2++MnO2(s)+4H+
在中性或近中性的溶液中,MnO4-与Mn2+反应生成MnO2:
2MnO4-+3Mn2++2H2O =5MnO2(s)+4H+在酸性介质中,MnO2是较强的氧化剂,本身被还原为Mn2+:
2MnO2+2H2SO4(浓)== 2MnSO4+O2+2H2O
MnO2+4HCl(浓)== MnCl2+Cl2+2H2O
后一反应用于实验室中制取少量氯气。
在强碱性溶液中,MnO4-能发生下列反应,生成浅蓝色的不稳定的MnO3-,
并放出氧气:
2MnO4-=2MnO3-+O2
MnO3-进一步歧化反应:
2MnO3-=MnO42-+MnO2
在强碱条件下,强氧化剂能把MnO2氧化成绿色的MnO42-
2MnO4-+MnO2+4OH-=3MnO42-+2H2O
MnO42-只在强碱性(pH>13.5)溶液中才能稳定存在,在中性或酸性介质中,MnO42-发生歧化反应:
3MnO42-+4H+=2MnO4-+MnO2+2H2O
在有硝酸存在下,Mn2+可被NaBiO3或PbO2氧化成MnO4-,例如:
5NaBiO3+2Mn2++14H+=2MnO4-+5Bi3++5Na+ + 7H2O。