GUS酶活检测方法
- 格式:docx
- 大小:18.90 KB
- 文档页数:4

gus染色原理
Gus染色原理。
Gus染色是一种用于检测β-葡萄糖苷酶活性的方法,它是以β-葡萄糖苷酶的
底物5-氯-4-溴-3-吲哚基葡萄糖(X-葡萄糖)为基础的染色方法。
在染色过程中,
X-葡萄糖会被β-葡萄糖苷酶水解,产生游离的5-氯-4-溴-3-吲哚基(X-吲哚),然后X-吲哚会与染色底物中的氧化剂氧化反应,生成可见的蓝色产物,从而实现对
β-葡萄糖苷酶活性的检测。
Gus染色的原理可以分为以下几个步骤:
1. 底物水解,X-葡萄糖是β-葡萄糖苷酶的底物,当β-葡萄糖苷酶存在时,它
会催化X-葡萄糖的水解反应,将其分解为X-吲哚和葡萄糖。
2. 氧化反应,X-吲哚与染色底物中的氧化剂(如溴化4-溴-3-吲哚苯)发生氧
化反应,生成可见的蓝色产物。
3. 结果观察,通过观察样品的颜色变化,可以判断β-葡萄糖苷酶的活性水平。
活性高的样品会呈现深蓝色,活性低的样品则会呈现浅蓝色或无色。
Gus染色方法具有操作简便、结果直观、灵敏度高的特点,因此被广泛应用于
细菌、植物和动物细胞等生物体系中对β-葡萄糖苷酶活性的检测。
同时,Gus染
色还可以在组织学研究中用于检测β-葡萄糖苷酶的表达情况,为研究者提供重要
的实验数据。
总的来说,Gus染色是一种简单而有效的β-葡萄糖苷酶活性检测方法,其原理清晰,操作方便,结果可靠。
在生物学研究中具有重要的应用价值,为科研工作者提供了有力的实验手段。
通过对Gus染色原理的深入了解,可以更好地应用和优
化这一方法,为科学研究提供更加可靠的数据支持。

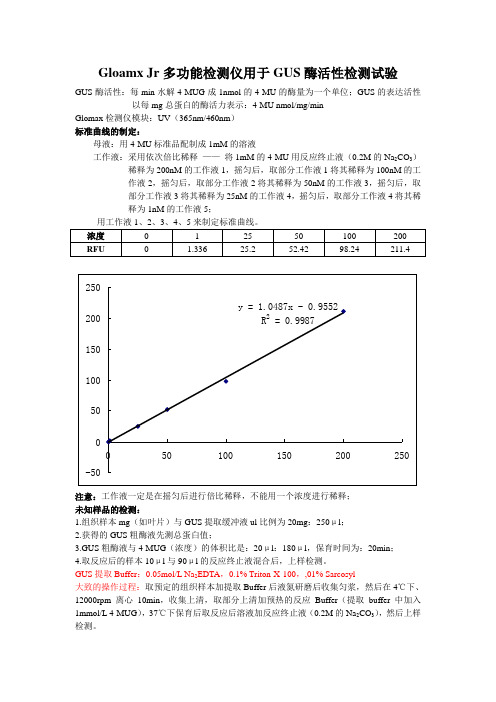
Gloamx Jr多功能检测仪用于GUS酶活性检测试验
GUS酶活性:每min水解4-MUG成1nmol的4-MU的酶量为一个单位;GUS的表达活性以每mg总蛋白的酶活力表示:4-MU nmol/mg/min
Glomax检测仪模块:UV(365nm/460nm)
标准曲线的制定:
母液:用4-MU标准品配制成1mM的溶液
工作液:采用依次倍比稀释——将1mM的4-MU用反应终止液(0.2M的Na2CO3)稀释为200nM的工作液1,摇匀后,取部分工作液1将其稀释为100nM的工
作液2,摇匀后,取部分工作液2将其稀释为50nM的工作液3,摇匀后,取
部分工作液3将其稀释为25nM的工作液4,摇匀后,取部分工作液4将其稀
释为1nM的工作液5;
注意:工作液一定是在摇匀后进行倍比稀释,不能用一个浓度进行稀释;
未知样品的检测:
1.组织样本mg(如叶片)与GUS提取缓冲液ul比例为20mg:250μl;
2.获得的GUS粗酶液先测总蛋白值;
3.GUS粗酶液与4-MUG(浓度)的体积比是:20μl:180μl,保育时间为:20min;
4.取反应后的样本10μl与90μl的反应终止液混合后,上样检测。
GUS提取Buffer:0.05mol/L Na2EDTA,0.1% Triton-X-100,,01% Sarcosyl
大致的操作过程:取预定的组织样本加提取Buffer后液氮研磨后收集匀浆,然后在4℃下、12000rpm离心10min,收集上清,取部分上清加预热的反应Buffer(提取buffer中加入1mmol/L 4-MUG),37℃下保育后取反应后溶液加反应终止液(0.2M的Na2CO3),然后上样检测。

gus染色原理Gus染色原理及应用引言:Gus染色原理是一种常用的实验方法,主要用于检测和定位β-葡萄糖苷酶的活性。
本文将介绍Gus染色原理的基本概念、实验步骤以及其在生物学研究中的应用。
一、Gus染色原理的基本概念Gus染色原理,即β-葡萄糖苷酶染色原理,是通过Gus染色剂对β-葡萄糖苷酶进行染色,从而观察其活性和分布情况。
Gus染色剂是一种人工合成的染料,它能与β-葡萄糖苷酶发生化学反应,形成蓝色沉淀物。
这种染色剂在染色过程中是无色的,但在与酶反应后会产生明显的颜色变化。
二、Gus染色的实验步骤1. 制备Gus染色剂:将Gus染色剂溶解于适当的缓冲液中,制备成一定浓度的染色溶液。
2. 取样:选择待检测的生物组织或细胞,进行取样。
3. 固定:将取样的生物组织或细胞进行固定处理,以保持其形态结构的完整性。
4. 染色:将固定的生物组织或细胞浸泡于Gus染色溶液中,进行染色反应。
5. 观察:观察染色结果,通过显微镜对染色的生物组织或细胞进行观察和记录。
三、Gus染色在生物学研究中的应用1. 植物生物学研究:Gus染色可以用于检测植物中β-葡萄糖苷酶的活性和分布情况,帮助研究植物生长和发育过程中的基因调控机制。
2. 动物生物学研究:Gus染色可用于检测动物组织和细胞中β-葡萄糖苷酶的表达情况,有助于研究动物发育、疾病发生和治疗等方面的问题。
3. 微生物学研究:Gus染色可以用于检测细菌和真菌中β-葡萄糖苷酶的活性和分布情况,对于研究微生物代谢途径和菌种鉴定等具有重要意义。
4. 分子生物学研究:Gus染色可以与基因表达报告载体结合,用于检测基因的活性和表达水平,为分子生物学研究提供了一个简便、直观的方法。
结论:Gus染色原理是一种常用的实验方法,通过对β-葡萄糖苷酶的染色反应,可以检测和定位其活性和分布情况。
该方法在植物学、动物学、微生物学和分子生物学等领域具有广泛的应用。
通过对Gus染色原理的了解和掌握,我们可以更好地开展生物学研究,揭示生物体内重要酶的功能和调控机制,为相关领域的研究提供有力的支持。

gus酶活测定原理Gus酶活测定原理,是一种常用的生物化学实验方法,用于测定酶的活性水平。
在这个实验中,Gus酶(β-葡萄糖苷酶)被用作一个模型酶,用于测定其活性。
Gus酶是一种常见的酶类,广泛存在于植物和微生物中。
测定Gus酶活性的原理是基于Gus酶对底物X-葡萄糖苷(X-Gluc)的催化作用。
在催化作用下,X-Gluc被Gus酶水解成葡萄糖和X,同时释放出一种蓝色化合物。
这种蓝色化合物可以通过光谱分析或比色法进行定量测定。
根据生成的蓝色产物的浓度,可以确定Gus 酶的活性水平。
为了进行Gus酶活性测定,首先需要提取样品中的Gus酶。
提取方法根据不同样品的性质而有所不同,但一般包括细胞破碎、离心、超声处理等步骤。
提取得到的酶溶液需要保持在一定的温度和pH 条件下,以确保酶的活性不受到影响。
接下来,将提取得到的酶溶液与底物X-Gluc混合,在一定的反应时间内进行反应。
反应结束后,将反应液离心并收集上清液。
上清液中的蓝色产物的浓度与Gus酶活性相关,可以通过光谱分析或比色法进行定量测定。
需要注意的是,为了准确测定Gus酶的活性,需要进行对照实验和标准曲线的建立。
对照实验可以用热处理或添加抑制剂等方法来验证测定结果的可靠性。
标准曲线则是通过测定一系列已知Gus酶活性水平的样品来建立的,用于将测定结果转化为Gus酶活性的数值。
Gus酶活测定原理的应用非常广泛。
它可以用于研究酶的功能和调控机制,评估酶的活性变化,以及筛选酶抑制剂或激活剂等。
此外,Gus酶活测定原理也可以应用于生物工程、医药研发和农业科学等领域。
总的来说,Gus酶活测定原理是一种简单、快速、可靠的酶活性测定方法。
通过测定Gus酶催化反应产生的蓝色产物的浓度,可以确定酶的活性水平。
这个实验方法在生物化学研究和应用中发挥着重要作用,为我们理解酶的功能和调控提供了有力的工具。

GUS活性的荧光检测(protocal)(2007-12-12 11:52:05)转载分类:核酸技术3.4.25.2 GUS活性的荧光检测3.4.25.2.1蛋白的提取及浓度测定(1)取100mg植物样品在液氮中研磨成粉末,加入3倍体积的GUS提取缓冲液,再研磨2min,将粉末装入1.5m1离心管,摇动5min, 12,000rpm, 40C离心10min,取上清4℃保存备用。
(2)蛋白标准曲线的制作取配制的25ugfmIBSA母液,按下表进行BSA梯度稀释:从中取4ml加入lml考马斯亮蓝染液,混匀,室温放置2min,测定595nm的光吸收值,制作标准曲线。
(3)样品蛋白含量测定取蛋白上清Sul,加水至4ml,加入I ml考马斯亮蓝染液,混匀,室温放置2min,测定595nm的光吸收值,根据蛋白标准曲线计算样品蛋白含量。
3.4.25.2.2 GUS荧光检测(1)制作4-MU标准:配制4-MU梯度浓度液(由反应终止液配制)l0umol/I,2.5umol/I, lumol/I,500nmol/I, 100nmol/l, 10nmol/I:在激发光365nm,发射光455nm,狭缝3nm条件下,测定各样品的荧光值,绘制标准曲线。
(2)酶反应:取40u1蛋白上清,加入400ul反应缓冲液里(37℃预热),立即取100u1加入到900u1反应终止液(0时的空白对照),37'C温浴,严格定时,10min, 30min和60min 各取100ul,加入900u1反应终止液。
测定荧光值。
根据标准曲线,计算各样品酶活。
GUS提取缓冲液:50mM磷酸钠缓冲液(PH7.0), lOmMEDTA, 0.1% Triton X-100, O.I%SDS,l Ommp一疏基乙醇,4℃保存。
反应缓冲液:GUS提取缓冲液,加入1MM MUG, 40C避光保存,可保存2周。
反应终止液:0.2M Na2CO3,考马斯亮蓝G250溶液:考马斯亮蓝G250 10mg, 95%乙醇5m1, H3PO4IOml,定容至l00ml,过滤后4℃保存。
谷胱甘肽S-转移酶(GST)活性检测试剂盒说明书微量法谷胱甘肽S-转移酶(GST)活性检测试剂盒说明书微量法注意:正式测定前务必取2-3个预期差异较大的样本做预测定。
货号:BC0355规格:100T/96S产品内容:试剂一:液体100mL×1瓶,4℃保存。
试剂二:液体22mL×1瓶,4℃保存。
试剂三:粉剂×1瓶,4℃保存。
临用前加2mL蒸馏水溶解。
产品说明:GST是一种具有多种生理功能的蛋白质家族,主要存在于细胞质内。
GST是体内解毒酶系统的重要组成部分,主要催化各种化学物质及其代谢产物与GSH的巯基共价结合,使亲电化合物变为亲水物质,易于从胆汁或尿液中排泄,达到将体内各种潜在或具备毒性的物质降解并排出体外的目的。
因此,GST在保护细胞免受亲电子化合物的损伤中发挥着重要的生物学功能。
此外,因为GST具有GSH-Px活性,亦称为non-Se GSH-Px,具有修复氧化破坏的大分子如DNA、蛋白质等的功能。
注意,GST催化的反应减少GSH含量,但是不增加GSSG含量。
GST催化GSH与CDNB结合,其结合产物的光吸收峰波长为340nm;通过测定340nm波长处吸光度上升速率,即可计算出GST 活性。
自备仪器和用品:低温离心机、水浴锅、可调节移液器、紫外-可见分光光度计/酶标仪、微量石英比色皿/96孔UV板和蒸馏水。
操作步骤:一、粗酶液提取:1.组织:按照组织质量(g):试剂一体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL试剂一)进行冰浴匀浆。
8000g,4℃离心10min,取上清置冰上待测。
2.细菌、真菌:按照细胞数量(104个):试剂一体积(mL)为500~1000:1的比例(建议500万细胞加入1mL试剂一),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后8000g,4℃,离心10min,取上清置于冰上待测。
3.血清等液体:直接测定。
GUS 活性检测目的:通过Gus活性测定了解或研究Gus基因是否转化进入植物细胞;Gus基因在植物组织、细胞内的表达部位;Gus基因在植物细胞内瞬时表达量及稳定表达量;外源基因在植物细胞内的表达调控。
材料:转化的植物组织、器官、原生质体、种子的胚及萌发的幼苗等。
一、组织化学染色法试剂:(1)200mmol/L 磷酸钠缓冲液(pH7.0)制备方法:A液:称取NaH2PO4·2H2O3.12g溶于蒸馏水,定容至100ml。
B液:称取Na2HPO4·12H2O7.17g溶于蒸馏水,定容至100ml。
取100ml B液与40ml A液混合(混合后pH值约7.03),用NaH2PO4·2H2O 调至7.0。
(2)*说明:GUS活性的精确定位需要有亚铁离。
GUS酶水解其底物X-Gluc产生可溶性无色的吲哚基衍生物,它可扩散到其他部位,必须经氧化缩合成二聚体,才能形成不溶性的蓝色沉淀,二聚体化由氧化催化剂(如亚铁氰化钾、过氧化物酶或过氧化氢酶等)催化,若不加Fe2-,则仅形成可溶性中间产物而扩散,加亚铁氰化钾后因吲哚基二聚体化而不扩散,不溶性蓝色沉淀形成越快,GUS酶的定位越精确。
(3)FAA固定脱色液:5%甲醛,5%乙酸,5%乙醇。
材料准备:(1) 瞬时表达检测取浸染后1-5天的材料,稳定表达取转化后处理6周后的材料。
(2) 叶片、幼根等制成徒手切片(或剪成小块、小片)。
(3) 悬浮细胞、原生质体低速离收集,无菌等渗液洗涤。
(4) 清洁的愈伤组织可以直接使用直接染色法(1)将准备好的材料浸泡在染液中,于25-37℃保温1小时至过夜。
(2)叶片等绿色材料转入70%乙醇中脱色2-3次,到阴性对照材料呈白色。
(3)肉眼或显微镜下观察,白色背景上的蓝色小点即为Gus表达位点。
固定染色法(1)将材料浸入固定液中,必要时可抽真空1分钟,室温下轻摇30-60分钟。
(2)取出材料,用磷酸钠缓冲液漂洗3-4次。
转基因植物中报告基因GUS组织化学定位检测一、实验目的1、掌握基因GUS的表达的检测方法2、了解GUS基因的应用二、实验原理GUS基因就是转β-葡糖醛酸酶基因,它存在于E.coli等一些细菌基因组内,编码β-葡萄糖苷酸酶。
β-葡萄糖苷酸酶是一个水解酶,以β-葡萄糖苷酸酯类物质为底物,其分解产物呈蓝色。
由于绝大多数植物没有检测到葡萄糖苷酸酶的背景活性,因此这个基因被广泛应用于基因调控的研究中。
根据地gus基因检测所用的底物不同,可以选择三种检测方法:组织化学法、分光光度法和荧光法(灵感度为分光光度检测法最高),其中最为常用的是组织化学法。
组织化学法检测:以5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯(X-Gluc)作为反应底物。
将被检材料用含有底物的缓冲液浸泡,若组织细胞被转入了GUS基因,并表达出Gus,在适宜的条件下,该酶就可将X-Gluc水解生成蓝色产物,这是由其初始产物经氧化二聚作用于形成的靛蓝染料,它使具Gus活性的部位或位点呈现蓝色,用肉眼或在显微镜下可看到,且在一定程度下根据染色深浅可反映出Gus活性。
因此利用该方法可观察到外源基因在特定器官、组织,甚至单个细胞内的表达情况。
三、实验材料、试剂拟南芥AK12-pro、GUS工作液四、实验步骤1、取2支1.5ml离心管,各加入0.3ml 1mol/L GUS染色液;2、用镊子夹取转基因和野生型拟南芥幼苗各1根,分别放入上述离心管中;3、37℃浸泡过夜。
4、倒掉染色液,加入75%乙醇脱色;30min后换一次75%乙醇脱色;肉眼下观察染色情况;拍照。
如果有GUS基因表达产物,则出现蓝色。
五、实验结果从上述照片中科一看出,将野生型和转基因型拟南芥用含有底物的缓冲液浸泡,转β-葡糖醛酸酶基因将X-Gluc水解生成蓝色产物,说明组织细胞被转入了GUS基因,并表达出GUS,这是由其初始产物经氧化二聚作用于形成的靛蓝染料,在一定程度下根据染色深浅可反映出Gus活性,图中拉瑟比较深,说明Gus活性相对较高。
GUS 报告基因定量检测试剂盒GUS定量试剂盒储存:-20℃保存,一年有效。
华越洋GUS定量试剂盒组成:提取液50 mL 100 mL4-MU(1mM) 1 mL 1 mLx24-MUG 底物液10 mL 10 mLx2终止液100 mLx2 100 mLx4GUS定量试剂盒说明:GUS 能与4-MUG 反应产生荧光物质4-MU。
4-MU 的激发波长为365 nm,发射波长为456nm。
其含量可由荧光分光光度计测出。
因此,我们可以根据单位质量的植物总蛋自在单位时间内产生的荧光物质的多少来定量的检测GUS 的含量。
荧光分光光度计测定的是相对值,因此用荧光分光光度计测定时必须用标准物4-MU 进行校准。
GUS定量试剂盒使用方法:一、植物总蛋白提取1.取新鲜的植物组织100 mg 左右,用液氮将材料急速冷冻,然后采用液氮研磨的方式在研钵里磨碎组织。
如果无法立即研磨,可以先将液氮冷冻处理的植物组织储存于-80 ℃冰箱。
2.将研磨破碎的组织转到EP 管里,并竟即加入1mL的提取演,充分混匀。
3. 12 000 rpm,4 ℃离心10 min。
4.将上清转至另一洁净的EP 管,12,000 rpm,4℃离心10 min.5.所得上清即为蛋白提取物,可以置于冰上待用,或者-80 ℃保存。
二、蛋白浓度的测定(Bradford 法)参照本公司产品Bradford 蛋白浓度测定试剂盒(华越洋右手)使用说明书。
三、标准溶液配制用终止液稀释4-MU,建议稀释至浓度1-10uM,即为标准液(避光放置)。
用于标准曲线绘制。
四、GUS 表达水平的定量测定1.在3个1mL的离心管中分别加入900 uL 的终止液,置于37 ℃温浴。
2. 取150 uL 蛋白提取物,加入150 uL 4-MUG 底物液,37 ℃温浴,即为反应液。
3.分别在10 min,20 min,30 min 时,从上述反应体系中,取100uL加入步骤1中温浴的900 uL终止液中,避光放置直至测量结束。
荧光光度计定量分析转化植株GUS基因稳定表达活性
试剂准备:
1.GUS提取缓冲液:
50mmol 磷酸钠(PH7.0)
10mmol EDTA
O.1% Triton X-100
0.1% Sarcosyl
10mmol/l β-巯基乙醇
2.1mmol/1 4-MU(4-甲基伞形酮):
称取19.82mg4-MU钠盐,用1ml乙醇溶解,dH2O定容至100ml。
4℃暗处可以贮存一个月。
贮存中有可能发生结晶。
3.反应缓冲液:
GUS提取缓冲液中加入1mmol/l MUG(100ml 加入35.23mg),4℃可以保存2周。
4.考马新亮旒G250溶液:
lOOmg考马斯亮蓝G250溶于50m1 95%乙醇中,加lOOml磷酸,dH2O定容至1L过滤后于4℃贮存。
操作步骤:
新鲜的植物组织6US蛋白的提取:
1.取0.1g叶片样品,用液氮研磨成粉。
2.加入3倍体积的提取缓冲液,研成匀浆。
3.4000rpm离心lOmin,收集上清液,于-20℃冰箱中保存备用。
GUS蛋白提取液蛋白含量测定:
1.制作标准曲线:
BSA母液(ml)H2O(ml)BSA浓度(ug/ml)
0.25 4.75 1.25
0.5 4.5 2.5
1.0 4.0 5.0
1.5 3.5 7.5
2.0
3.0 10.0
2.5 2.5 12.5
5.0 0.0 25.0
配制25ug/ml BSA母液:称取2.5mgBSA,加入0.5ml提取缓冲液,用H2O定容至lOOml。
按上表制作BSA梯度液。
从中取4ml加入lml考马斯亮蓝G-250溶液,混匀,室温下放置2min,测定595nm 的吸收值。
吸收值对蛋白浓度作图绘制标准曲线。
取植物材料GUS蛋白提取液20ul,加H2O至4ml,加入lml考马斯亮蓝,混匀,室温下放置2min。
测定595nm光吸收值根据标准曲线计算蛋白质含量。
GUS酶活反应:
1. 将反应缓冲液于37℃预热。
2.取6支1.5ml离心管,各加入900ul反应终止液,编号。
3.取1支1.5ml离心管,加入1ml预热的反应缓冲液,再加入200ul的提取缓冲液(具体用量根据材料而定),混匀,立即取出lOOul
加入到l号管中,此为反应0时的样品(荧光测定时以此为空白),并开始严格计时。
4.将反应管放入37℃水浴中进行酶反应,分别于5、10、15、30、60min时的样品,供荧光测定用。
4荧光测定
1.制作标准曲线
配置4-MU梯度浓度液:
lOOumol/l 4-MU:取lOOul 1mmol/L MU与0.9ml反应终止液混合。
lOumol/l 4-MU:取lOOul 1mmol/L MU与9.9ml反应终止液混合。
1umol/l 4-MU:取lOOul 1Oumol/L Mu与0.9ml反应终止液混台。
lOOnmol/l 4-MU:取lOOul lOumol/L Mu与9.9ml反应终止液混台。
在激发光365nm,发射455nm,狭缝lOnm条件下测各样品的荧光,以反应终止液为空白溶液,绘制标准曲线。
2.以l号管为空白,在上述条件下测定2~6号管的荧光强度。
从标准曲线上查出2~6号管中的4-MU。
酶活力的计算:
1.以酶反应时间对4-MU含量作图,直线部分的斜率即为酶反应初始阶段的速度。
2。
酶活力单位定义为:每分钟水解4-MUG生成1nmol或1mg、lug、1ng 4-MU的酶量为一个活力单位。
根据定义求出各样品的酶活力。
3.GUS基因表达活性以每毫克蛋白的酶活力表示,将样品酶活力除以上述测得的样品蛋自含量。