第二章第三节课时1
- 格式:ppt
- 大小:11.01 MB
- 文档页数:23

《物质的量》教学设计——联系宏观与微观的桥梁一、教材分析在系统学习“物质分类及其变化”之后,本章从常见无机物及应用入手,既进一步补充了丰富的感性认知材料,又可为后面继续学习其它元素及其化合物、建构物质结构、元素周期律、了解化学反应与能量等理论知识打下基础。
在宏观定性研究物质的基础上,引入一个新的物理量—物质的量,从定量的角度再认识物质的性质和物质之间发生的反应,教材在内容编排上注重了宏观与微观相结合,引导学生建立可称量的宏观物质与不可称量的微观粒子间的联系,初步建构“宏观辨识与微观探析”的学科核心素养,为后面进一步研究分子、原子及离子间的相互作用打下基础。
二、学情分析学生在初中学习了原子、分子、电子等微观粒子,学习了化学方程式的意义和常用的物理量及其对应的单位,这是学习本节课的知识基础。
但是本节课的概念抽象,具象思维和抽象思维的转化难度高,新旧知识会产生认知冲突,而且学生对知识的归纳、整理和迁移能力尚还欠缺,这些需要教师善于引导,巧妙地设置问题引导学生自主阅读并与同学交流,从学生认识基础出发,加强直观性教学,采用设问、类比启发、重点讲解并辅以讨论的方法,引导学生去联想,运用迁移规律,使学生在轻松的环境中掌握新知。
三、素养目标【教学目标】1.认识化学科学研究需要实证与推理,注重宏观与微观的联系。
2.了解物质的量及其相关物理量的含义和应用,体会定量研究对化学科学的重要作用。
3.能基于物质的量认识物质组成及其化学变化,知道从定量的角度认识宏观物质和微观粒子的相互关系是研究化学问题的科学的化学方法之一。
【评价目标】1.通过了解生产生活、科研中的多重计量方法,认识化学计量方法的选择取决于实际需要,发展定量研究的意识。
2.通过对比、类比、归纳、演绎等多种思维活动,了解物质的量及其单位(摩尔)的含义和应用。
3.能基于物质的量认识物质组成及其化学变化,实现物质的量、粒子总数、质量之间转化,落实“微观-宏观-符号”的三重表征。

第三节物质的量第1课时物质的量的单位——摩尔课后·训练提升1.科学家发现了一种化学式为H3的氢分子。
1 mol H3和1 mol H2具有相同的()。
A.分子数B.原子数C.质子数D.电子数答案:A解析:1 mol H3和1 mol H2的分子数均为N A,原子数、质子数、电子数均分别为3N A和2N A。
2.下列关于2 mol二氧化碳的叙述中,正确的是()。
A.质量为44 gB.有4 mol原子C.分子数约为6.02×1023D.摩尔质量为44 g·mol-1答案:D解析:二氧化碳气体质量=M×n=44 g·mol-1×2 mol=88 g,A项错误。
2 mol CO2含有6 mol原子,B项错误。
2 mol二氧化碳约含有分子数为2mol×6.02×1023=1.204×1024,C项错误。
二氧化碳的摩尔质量为44 g·mol-1,D项正确。
3.下列表示错误的是()。
A.1 mol N2B.1 mol FeC.1 mol N H4+D.1 mol小米答案:D解析:物质的量不适用于表示宏观物质。
4.下列物质的摩尔质量最大的是()。
A.10 mL H2OB.0.8 mol H2SO4C.54 g AlD.1 g CaCO3答案:D5.下列物质中含有的分子数相等的是()。
①0.1 mol CO②9.8 g H2SO4③1 g H2O④1.6 g O2A.①③B.②④C.①②D.③④答案:C解析:统一用各物质的物质的量进行比较,分别为①0.1 mol CO,②0.1 mol H2SO4,③0.056 mol H2O,④0.05 mol O2,故含有的分子数相等的为①②,答案选C。
6.偏二甲肼(C2H8N2)是一种高能燃料,燃烧产生的巨大能量可为航天运载火箭提供推动力。
下列叙述正确的是()。
A.偏二甲肼的摩尔质量为60 gB.6.02×1023个偏二甲肼分子的质量约为60 gC.1 mol偏二甲肼的质量为60 g·mol-1D.6 g偏二甲肼含有N A个偏二甲肼分子(设N A为阿伏加德罗常数的值)答案:B解析:偏二甲肼的摩尔质量应为60 g·mol-1,A项中单位错误。

化钝市安居阳光实验学校第1课时核糖体、内质网、高尔基体及线粒体的结构与功能基础巩固1.下列细胞结构中没有磷脂成分的是( )A.内质网B.细胞膜C.核糖体D.高尔基体2.植物细胞壁的形成与高尔基体有关,这说明了高尔基体具有( )A.合成蛋白质的能力B.合成油脂的能力C.合成多糖的能力D.合成核酸的能力3.下图是四种细胞器的亚显微结构模型。
其中在真核细胞中分布最广、可联系多种膜结构的细胞器是( )4.根据细胞器的功能推测,下列叙述错误的是( )A.汗腺细胞比肠腺细胞具有更多的核糖体B.心肌细胞比骨骼肌细胞具有更多的线粒体C.胰腺细胞比心肌细胞具有更多的高尔基体D.生命活动旺盛的细胞比衰老细胞具有更多的线粒体5.细胞色素c是动、植物细胞中普遍存在的一种由104个氨基酸组成的化合物,在细胞呼吸中起着重要作用。
细胞色素c合成与发挥生理作用的场所分别是( )A.核糖体和叶绿体 B.细胞核和核糖体C.核糖体和线粒体D.细胞核和高尔基体6.内质网与核膜、细胞膜相连,这种结构特点表明内质网的重要功能之一是( )A.参与细胞内某些反应B.提供核糖体附着的支架C.提供细胞内物质运输的通道D.增大细胞内膜面积,有利于酶的附着7.下列关于图示细胞器的叙述,正确的是( )A.蛋白质合成的场所B.对蛋白质进行分类C.遗传物质储存和复制的场所D.其上有氧化酒精的酶8.牛奶中含有乳球蛋白和奶酪蛋白等物质,在奶牛的乳腺细胞中,与乳汁的合成与分泌功能有密切关系的细胞器有( )A.核糖体、线粒体、内质网和高尔基体B.线粒体、内质网、高尔基体和中心体C.溶酶体、线粒体、核糖体和高尔基体D.核糖体、叶绿体、高尔基体和内质网9.(2020浙江之江教育联盟高一期中)下列有关内质网结构和功能的叙述中,错误的是( )A.通过内质网使细胞膜和核膜连成一个整体B.人肝脏细胞中的粗面内质网上具有氧化酒精的酶C.内质网是由一系列片状的膜囊和管状的腔组成的D.经内质网加工的某些蛋白质被送到高尔基体及细胞的其他部位10.下图为某分泌蛋白运输到细胞外的示意图,下列说法正确的是( )A.该分泌蛋白在粗面内质网上合成B.该过程需要线粒体提供能量C.与该过程直接相关的细胞器有核糖体、内质网、高尔基体、细胞膜D.该蛋白可能为膜蛋白能力提升11.下图表示细胞中的细胞器结构,下列叙述正确的是( )A.①为粗面内质网,具有双层膜结构B.②可在光学显微镜下观察到,是蛋白质合成的场所C.②可存于细胞溶胶、高尔基体、线粒体中D.唾液腺细胞中相应细胞器的含量多,体积大12.用35S标记一定量的氨基酸,并用来培养哺乳动物的乳腺细胞,测得核糖体、内质网、高尔基体上放射性强度的变化曲线,则下列分析不正确的是( )A.图中的a、b、c三条曲线所指代的细胞器分别是核糖体、内质网和高尔基体B.与乳腺分泌蛋白的合成和分泌密切相关的具膜细胞器是内质网、高尔基体和线粒体C.乳腺分泌蛋白的合成过程不能体现膜在结构上的联系D.35S在细胞各个结构间移动的先后顺序是核糖体→内质网→高尔基体→细胞膜13.线粒体是细胞呼吸和能量代谢的中心,德国科学家华尔柏在研究线粒体时,统计了某种动物部分细胞中线粒体的数量(见下表)。

第三节物质的量第1课时物质的量摩尔质量一、物质的量的单位——摩尔1.物质的量(1)物质的量是表示含有的集合体的物理量,用符号n表示。
(2)物质的量的单位——摩尔(3)书写方法及含义表述微观粒子的物质的量时,必须指明微观粒子的种类:如1 mol H指1 mol氢原子,1 mol H2指1 mol氢分子。
2.阿伏加德罗常数3.物质的量、阿伏加德罗常数与粒子数之间的关系(1)关系式:n=NN A。
(2)结论:微粒之间的物质的量之比等于微粒的之比。
(1)物质的量可以理解为物质的数量() (2)1 mol任何粒子所含有的粒子数相等()(3)物质的量描述的对象是分子、原子等微观粒子() (4)摩尔是国际单位制中七个基本物理量之一() (5)阿伏加德罗常数就是6.02×1023()1.1个CO2分子中有1个C原子、2个O原子。
那么1 mol CO2中有mol C和2 mol O,0.5 mol CO2中有mol C和mol O。
含有0.5 mol O的CO2的物质的量为mol。
2.(1)1 mol Na2SO4中含有Na+的数目是,与其含有相同Na+数目的NaCl的物质的量为。
(2)若测得某Na2SO4溶液中含有0.5 mol SO2-4,则溶液中含有mol Na+。
(3) mol NH3与0.3 mol H2O中所含H原子一样多。
(4)0.3 mol H2O中含mol原子,含个电子。
3.通过下图可进一步认识水的组成,请完成图中空格。
物质的量的理解——“四化”二、摩尔质量1.摩尔质量2.物质的量、质量和摩尔质量之间的关系:n =m M。
3.以物质的量(n )为桥梁联系宏观物质质量(m )与微观微粒数(N )之间的关系:m M =n =N N A。
1.摩尔质量与相对分子质量(或相对原子质量)是否等同?提示 不等同。
摩尔质量与相对分子质量(或相对原子质量)是两个不同的概念。
当摩尔质量以“g·mol -1”为单位时,两者在数值上相等,但前者单位是g·mol -1,后者单位是1,故两者不等同。
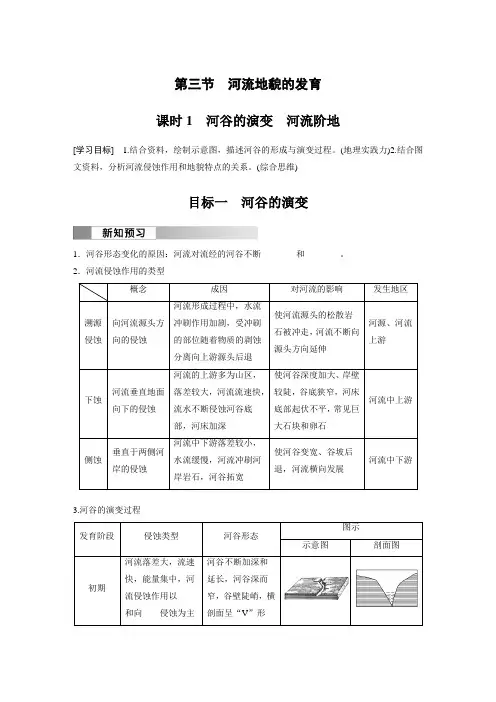
第三节河流地貌的发育课时1河谷的演变河流阶地[学习目标] 1.结合资料,绘制示意图,描述河谷的形成与演变过程。
(地理实践力)2.结合图文资料,分析河流侵蚀作用和地貌特点的关系。
(综合思维)目标一河谷的演变1.河谷形态变化的原因:河流对流经的河谷不断________和________。
2.河流侵蚀作用的类型概念成因对河流的影响发生地区溯源侵蚀向河流源头方向的侵蚀河流形成过程中,水流冲刷作用加剧,受冲刷的部位随着物质的剥蚀分离向上游源头后退使河流源头的松散岩石被冲走,河流不断向源头方向延伸河源、河流上游下蚀河流垂直地面向下的侵蚀河流的上游多为山区,落差较大,河流流速快,流水不断侵蚀河谷底部,河床加深使河谷深度加大、岸壁较陡,谷底狭窄,河床底部起伏不平,常见巨大石块和卵石河流中上游侧蚀垂直于两侧河岸的侵蚀河流中下游落差较小,水流缓慢,河流冲刷河岸岩石,河谷拓宽使河谷变宽、谷坡后退,河流横向发展河流中下游3.河谷的演变过程发育阶段侵蚀类型河谷形态图示示意图剖面图初期河流落差大,流速快,能量集中,河流侵蚀作用以____和向____侵蚀为主河谷不断加深和延长,河谷深而窄,谷壁陡峭,横剖面呈“V”形中期河流落差____,河流向下的侵蚀作用减弱,向河谷两岸的侵蚀作用加强河道开始变得弯曲,河流在凹岸____,在凸岸____,使得河道更为弯曲,河谷拓宽成熟期以向河谷两岸的侵蚀作用为主河谷展宽,横剖面呈宽而浅的____河流的凹岸侵蚀与凸岸堆积的原因和过程在分析侧蚀时应该分以下两种情况:(1)在河道比较平直时,一般可以从地转偏向力的作用角度来解释。
北半球河道右岸侵蚀,左岸堆积;南半球河道左岸侵蚀,右岸堆积。
(2)如果是弯曲的河道,应该根据凹岸与凸岸的情形来判断。
凹岸侵蚀、凸岸堆积(不需考虑南北半球)。
其成因解释如下:河流流经弯道时,水流做曲线运动,表层水流趋向凹岸,冲刷凹岸,使凹岸水面略高于凸岸,因此,底部水流在压力作用下由凹岸流向凸岸,形成弯道环流,在弯道环流作用下,凹岸发生侵蚀,凸岸发生堆积,如下图所示:下图①②③示意河谷发育的不同阶段。



第三节分子的性质第1课时键的极性和分子的极性范德华力和氢键1.了解共价键的极性和分子的极性及产生极性的原因。
2.知道范德华力、氢键对物质性质的影响。
3.能应用分子结构的知识判断分子的极性。
键的极性和分子的极性[学生用书P28]1.键的极性2.分子的极性3.键的极性和分子的极性的关系(1)一般只含非极性键的分子是非极性分子。
(2)含有极性键的分子,若分子结构是空间对称的,则为非极性分子,否则是极性分子。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)极性分子中不可能含有非极性键。
( )(2)离子化合物中不可能含有非极性键。
( )(3)非极性分子中不可能含有极性键。
( )(4)一般极性分子中含有极性键。
( )(5)H2O、CO2、CH4都是非极性分子。
( )答案:(1)×(2)×(3)×(4)√(5)×2.下列各组物质中,都是由极性键形成极性分子的一组是( )A.CH4和Br2B.NH3和H2OC.H2S和CCl4D.CO2和HCl解析:选B。
CH4、CCl4、CO2都是由极性键形成的非极性分子,NH3、H2O、H2S都是由极性键形成的极性分子,Br2是由非极性键形成的非极性分子。
分子极性的判定1.判断分子极性的一般思路2.判断AB n型分子极性的方法(1)化合价法:AB n型分子中,中心原子的化合价的绝对值等于该原子的价电子数时,该分子为非极性分子,此时分子的空间结构对称;若中心原子的化合价的绝对值不等于其价电子数,则分子的空间结构不对称,该分子为极性分子。
具体实例如下:分子BF3CO2SO3(g) H2O NH3SO2中心原子的化合价的绝对值3 4 6 2 3 4中心原子的价电子数3 4 6 6 5 6分子极性非极性非极性非极性极性极性极性类型实例键的极性立体构型分子极性X2H2、N2非极性键直线形非极性分子XY HCl、NO 极性键直线形极性分子XY2 (X2Y) CO2、CS2极性键直线形非极性分子SO2极性键V形极性分子H2O、H2S 极性键V形极性分子XY3BF3极性键平面三角形非极性分子NH3极性键三角锥形极性分子XY4CH4、CCl4极性键正四面体形非极性分子下列叙述中正确的是( )A.NH3、CO、CO2都是极性分子B.CH4、CCl4都是含有极性键的非极性分子C.HF、HCl、HBr、HI的稳定性依次增强D.CS2、H2O、C2H2都是直线形分子[解析] CO2是非极性分子,A项错误。


第三节 氧化还原反应 第1课时 氧化还原反应的基本概念1.了解氧化反应、还原反应的概念。
2.从化合价升降、电子转移角度认识氧化还原反应。
3.明确氧化还原反应与四种基本反应类型的关系。
氧化还原反应的概念1.从得氧、失氧的角度 (1)反应特点分析2CuO +C=====高温2Cu +CO 2↑反应中,CuO 失氧,发生了还原反应,被C 还原,得到Cu 。
C 得氧,发生了氧化反应,被CuO 氧化,得到CO 2。
(2)结论:得到氧的物质发生氧化反应,失去氧的物质发生还原反应;过程中有得失氧的反应叫氧化还原反应。
2.从元素化合价升降的角度 (1)反应特点分析①CuO +H 2=====△Cu +H 2O 反应中,CuO 中铜元素化合价降低,发生还原反应,被H 2还原,得到Cu 。
H 2中氢元素化合价升高,发生氧化反应,被CuO 氧化,得到H 2O 。
②2Na +Cl 2=====点燃2NaCl 反应中,氯元素化合价降低,发生还原反应,被Na 还原。
钠元素化合价升高,发生氧化反应,被Cl 2氧化。
(2)结论:物质所含元素化合价升高的反应叫氧化反应,物质所含元素化合价降低的反应叫还原反应;反应前后有元素化合价升降的反应叫氧化还原反应。
3.从电子转移的角度 (1)反应特点分析①2Na +Cl 2=====点燃2NaCl 反应中,氯元素化合价降低,氯原子得到电子,发生还原反应,被Na 还原。
钠元素化合价升高,钠原子失去电子,发生氧化反应,被Cl 2氧化。
②H 2+Cl 2=====点燃2HCl 反应中,氯元素化合价降低,共用电子对偏向氯原子,发生还原反应,被H 2还原。
氢元素化合价升高,共用电子对偏离氢原子,发生氧化反应,被Cl 2氧化。
(2)结论:物质中元素的原子失去(或偏离)电子的反应叫氧化反应,物质中元素的原子得到(或偏向)电子的反应叫还原反应;反应中凡有电子转移(得失或偏移)的反应叫氧化还原反应。
氧化还原反应的特征是有元素化合价的变化,实质是有电子转移(得失或偏移)。

第二章细胞的结构和生命活动第三节物质进出细胞的运输方式第1课时探究植物细胞的吸水和失水课后篇巩固提升合格考达标练1.下图是某同学在用紫色洋葱鳞片叶的外表皮做“观察植物细胞的质壁分离和复原现象”实验中所观察到的细胞图,下列叙述正确的是()A.图中1、2、6组成了细胞的原生质层B.图中细胞处于质壁分离状态,此时6处的浓度一定大于7处的浓度C.图中1是细胞壁,6中充满了蔗糖溶液D.图中7是细胞液,在细胞发生质壁分离过程中,其颜色逐渐变浅2细胞质膜和4液泡膜以及两层膜之间的5细胞质构成原生质层,A项错误。
图中细胞存在三种可能:6处的浓度大于7处的浓度,细胞发生质壁分离;6处的浓度小于7处的浓度,细胞发生质壁分离的复原;6处的浓度等于7处的浓度,细胞吸水和失水处于动态平衡,B项错误。
图中1是细胞壁,由纤维素和果胶组成,具有全透性,则6中充满了蔗糖溶液,C项正确。
图中7是细胞液,在细胞发生质壁分离过程中,细胞失水,其颜色逐渐加深,D项错误。
2.植物体内有三个相邻的细胞a、b、c,已知它们的细胞液浓度大小关系是a>b>c,那么它们三者之间水分渗透的方向表示正确的是()的细胞液浓度最大,所以水分子由b和c渗透进入a;b的细胞液浓度比c大,水分子由c渗透进入b。
3.下图为两个大小相同的萝卜,分别在上面挖一个大小相同的洞,并在洞内各插入一支口径与洞口相同的玻璃管,甲玻璃管内注入3 mL清水,乙玻璃管内注入3 mL 浓盐水,一段时间后,两玻璃管中液面变动情况是()A.甲中升高,乙中降低B.甲中降低,乙中先升高后降低C.甲、乙中均降低D.甲、乙中均升高,甲玻璃管下部细胞吸水,使液面下降;乙玻璃管下部细胞失水,使液面升高。
细胞可以吸收钠离子和氯离子,乙玻璃管下部细胞细胞液浓度高于盐水浓度时,细胞吸水,液面又下降。
4.将洋葱细胞放入大于细胞液浓度的KNO3溶液中,一段时间后用显微镜观察,发现该细胞未发生质壁分离,其原因可能是该细胞()①是死细胞②大量吸水③是根尖分生区细胞④大量失水⑤质壁分离后又自动复原A.①②③B.①③⑤C.②③⑤D.②④⑤,①正确;由于外界溶液浓度大于细胞液浓度,所以细胞不可能大量吸水,②错误;根尖分生区细胞没有大液泡,不能发生质壁分离,③正确;若细胞大量失水,则在显微镜下可以观察到质壁分离,④错误;一段时间后观察,细胞可能发生质壁分离后又复原,⑤正确。