高中化学 烃类物质比较
- 格式:doc
- 大小:34.00 KB
- 文档页数:1
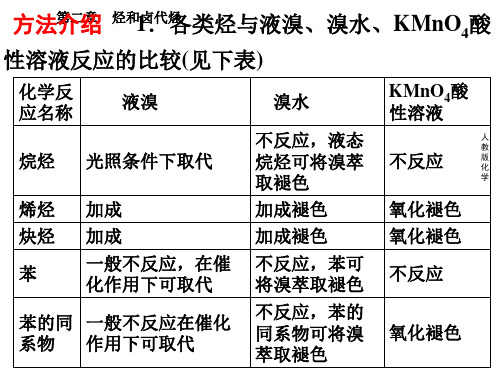

2020-2021学年高一化学重难点探究(人教版2019必修第二册)重难点09 烃的代表物分子结构及其性质比较方法探究一、烃的代表物分子结构及其性质比较二、烃的代表物性质与结构的关系烷烃分子中各原子均以单键结合,性质稳定,不与强酸、强碱、强氧化剂等反应。
烯烃、炔烃分子中含有或— C=C—,因而易发生加成、氧化和加聚反应等。
而苯分子中碳碳键是介于单键与双键之间的独特键,因而既能发生取代反应又能发生加成反应,但不能与溴水和酸性KMnO4溶液发生化学反应而使其褪色。
在苯环的影响下,苯的同系物侧链易被氧化而使酸性KMnO4溶液褪色。
三、烃分子的共面、共线判断(1)明确三类结构模板(2)抓住题目关键词。
关键词:可能”“一定”“最多”“最少”“共面”“共线”等,以免出错。
典例剖析例1 (2020·都昌县三汊港中学高一月考)将1 mol甲烷与一定量的氯气混合于一量筒中,倒立于盛有饱和食盐水的水槽(如图所示),对于此反应,有关叙述不正确的是()A.该反应属于取代反应B.该反应的生成物只有四种C.该反应的条件是光照D.该反应现象有量筒内气体颜色变浅,器壁上有油状液滴【答案】B【解析】A. 甲烷与Cl2在光照条件下发生取代反应,产生CH3Cl、CH2Cl2、CHCl3、CCl4及HCl,A正确;B. 甲烷与Cl2在光照条件下发生取代反应,产生四种有机物,包括CH3Cl、CH2Cl2、CHCl3、CCl4,同时还有HCl,共五种生成物,B错误;C. 甲烷与Cl2发生取代反应条件是光照,C正确;D. 甲烷与氯气发生取代反应,不断消耗氯气,使气体颜色逐渐变浅,同时产生的CH2Cl2、CHCl3、CCl4是液态有机物,难溶于水,因此发生反应后会看到在量筒内气体颜色变浅,器壁上有油状液滴,D正确;故合理选项是B。
例2 (2020·山西省平遥中学校高一月考)既可以用来鉴别乙烷与乙烯,又可以用来除去乙烷中的乙烯以得到纯净乙烷的方法是()A.通过足量的NaOH溶液B.通过足量的溴水C.在Ni催化、加热条件下通入H2D.通过足量的酸性KMnO4溶液【答案】B【解析】A.乙烷与乙烯通过足量的NaOH溶液,不发生反应,不能提纯物质,故A错误;B.乙烷性质稳定,与溴水不反应,乙烯含有C=C官能团,能与溴水发生加成反应生成二溴乙烷而使溴水褪色,故B正确;C.通入氢气不能鉴别乙烷和乙烯,且能引入新的杂质,故C错误;D.通过高锰酸钾溶液,乙烯被氧化为二氧化碳和水,能用来鉴别乙烷和乙烯,但不能用来除去乙烷中的乙烯,故D错误;故选B。

高一有机化学烃的知识点有机化学是化学中的一个重要分支,研究的是碳及其化合物。
烃是无氧化合物,由碳和氢组成。
作为有机化学的基础,烃具有重要的理论和应用价值。
在高一有机化学学习中,烃是重要的知识点之一。
下面将对高一有机化学烃的知识点进行概述。
一、烃的分类根据碳原子间的键的不同,烃可以分为以下两类:1. 脂肪烃:由单键构成的烃,包括烷烃和环烷烃两种。
- 烷烃:碳原子之间只有单键,分子式为CnH2n+2。
- 环烷烃:由碳原子构成的环状结构,分子式为CnH2n。
2. 烯烃:由双键构成的烃,包括烯烃和环烯烃两种。
- 烯烃:分子中有一个或多个碳原子之间有双键,分子式为CnH2n。
- 环烯烃:由碳原子构成的环状结构,分子中有一个或多个碳原子之间有双键,分子式为CnH2n-2。
二、烃的命名为了方便研究和交流,烃都有统一的命名方法。
下面介绍几种常见的烃的命名方法:1. 烷烃的命名:烷烃的命名方法是根据其含有的碳原子数进行命名。
以直链烷烃为例,根据碳原子数的不同,分别命名为甲烷、乙烷、丙烷、丁烷等。
2. 烯烃的命名:烯烃的命名需要标明双键所在的位置。
以1-丁烯为例,表示双键在碳链的第一个碳原子与第二个碳原子之间。
3. 炔烃的命名:炔烃的命名也需要标明三键所在的位置。
以1-戊炔为例,表示三键在碳链的第一个碳原子与第二个碳原子之间。
三、烃的性质1. 密度和沸点:随着碳链长度的增加,烃的密度和沸点逐渐增加。
这是因为长碳链的分子量较大,分子间的相互作用力也相应增加。
2. 饱和度和反应性:饱和烃不含双键或三键,相对稳定,反应性较低;而不饱和烃含有双键或三键,容易发生加成反应。
3. 燃烧性:烃在氧气供应充足的条件下能发生完全燃烧,产生二氧化碳和水,并释放大量的热能。
四、烃的应用烃在日常生活和工业生产中有广泛的应用。
以下是几个常见的应用领域:1. 燃料:烃作为化石燃料的主要成分之一,广泛应用于汽车、航空、发电等领域。
2. 塑料:烃是合成塑料的原料之一,在日常生活中被广泛使用。
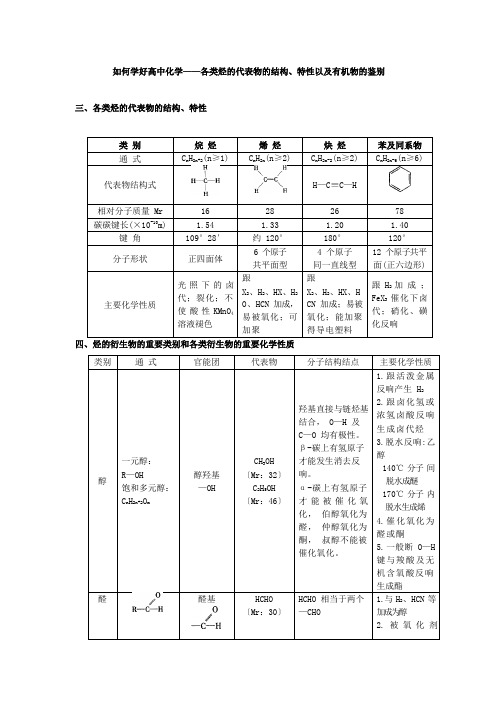
如何学好高中化学——各类烃的代表物的结构、特性以及有机物的鉴别三、各类烃的代表物的结构、特性C H(n≥1)C H(n≥2)C H(n≥6)四、烃的衍生物的重要类别和各类衍生物的重要化学性质醛基有极性、能加成。
(O 2 、多伦试剂、斐林试剂、酸性高锰〔Mr:44〕酸钾等)氧化为羧酸受羰基影响,O—H 能电离出H+ ,受羟基影响不能被加成。
1. 具有酸的通性2. 酯化反响时羧酸羧基〔Mr:60〕一般断羧基中的碳氧单键,不能被 H2 加成3.能与含— NH2物质缩去水生成酰胺(肽键) 酯酯基HCOOCH3〔Mr:60〕〔Mr:88〕酯基中的碳氧单键易断裂1.发生水解反响生成羧酸和醇2.也可发生醇解反响生成新酯和新醇氨基酸RCH(NH2)COOH氨基—NH2羧基—COOHH2NCH2COOH〔Mr:75〕—NH2 能以配位键结合 H+ ;—COOH能局部电离出 H+两性化合物能形成肽键蛋白质结构复杂不可用通式表示肽键氨基—NH2羧基—COOH酶多肽链间有四级结构1.两性2.水解3.变性4.颜色反响〔生物催化剂〕 5.灼烧分解糖多数可用以下通式表示:C n(H2O)m羟基—OH醛基—CHO羰基葡萄糖CH2OH(CHOH)4CHO淀粉(C6H10O5)n纤维素[C6H7O2(OH)3]多羟基醛或多羟基酮或它们的缩合物1.氧化反响(复原性糖)2.加氢复原3.酯化反响4.多糖水解5. 葡萄糖发酵分解生成乙醇n油脂酯基酯基中的碳氧单键易断裂烃基中碳碳双键1.水解反响〔皂化反响〕2.硬化反响五、有机物的鉴别鉴别有机物,必须熟悉有机物的性质〔物理性质、化学性质〕,要抓住某些有机物的特征反响,选用适宜的试剂,一一鉴别它们。
12.二糖或多糖水解产物的检验假设二糖或多糖是在稀硫酸作用下水解的,那么先向冷却后的水解液中参加足量的NaOH 溶液,中和稀硫酸,然后再参加银氨溶液或新制的氢氧化铜悬浊液,〔水浴〕加热,观察现象,作出判断。

一、实验目的1. 熟悉烃类物质的性质及其鉴别方法。
2. 培养学生运用化学知识解决实际问题的能力。
3. 增强学生的实验操作技能,提高实验观察和分析能力。
二、实验原理烃类物质是一类只含碳和氢元素的有机化合物,根据分子中碳原子间键合方式的不同,可分为烷烃、烯烃、炔烃等。
本实验通过以下几种方法对烃类物质进行鉴别:1. 溶解度:烃类物质在水中的溶解度极低,而在有机溶剂(如苯、四氯化碳等)中溶解度较高。
2. 碱性高锰酸钾溶液:烯烃和炔烃可以使碱性高锰酸钾溶液褪色,而烷烃则无此现象。
3. 溴水:烯烃和炔烃可以使溴水褪色,而烷烃则无此现象。
4. 酸性高锰酸钾溶液:烯烃和炔烃可以使酸性高锰酸钾溶液褪色,而烷烃则无此现象。
三、实验仪器与试剂1. 仪器:试管、酒精灯、滴管、镊子、试管架、试管夹等。
2. 试剂:烃类物质样品(烷烃、烯烃、炔烃)、水、苯、四氯化碳、碱性高锰酸钾溶液、溴水、酸性高锰酸钾溶液等。
四、实验步骤1. 取少量烷烃、烯烃、炔烃样品分别置于试管中。
2. 向各试管中加入适量水,观察溶解情况。
3. 向各试管中加入少量苯或四氯化碳,观察溶解情况。
4. 向各试管中加入少量碱性高锰酸钾溶液,观察颜色变化。
5. 向各试管中加入少量溴水,观察颜色变化。
6. 向各试管中加入少量酸性高锰酸钾溶液,观察颜色变化。
五、实验现象与结果1. 烷烃样品:在水中几乎不溶解,在苯或四氯化碳中溶解,碱性高锰酸钾溶液、溴水、酸性高锰酸钾溶液均无颜色变化。
2. 烯烃样品:在水中几乎不溶解,在苯或四氯化碳中溶解,碱性高锰酸钾溶液、溴水、酸性高锰酸钾溶液均褪色。
3. 炔烃样品:在水中几乎不溶解,在苯或四氯化碳中溶解,碱性高锰酸钾溶液、溴水、酸性高锰酸钾溶液均褪色。
六、实验结论1. 通过溶解度实验,可以初步判断样品是否为烃类物质。
2. 通过碱性高锰酸钾溶液、溴水、酸性高锰酸钾溶液的褪色实验,可以进一步判断样品的烃类类别。
3. 本实验成功实现了对烷烃、烯烃、炔烃的鉴别。
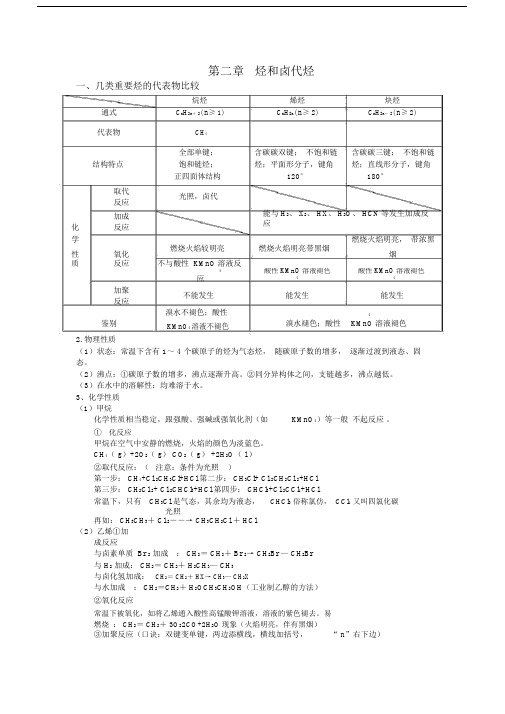
第二章烃和卤代烃一、几类重要烃的代表物比较烷烃烯烃炔烃通式C n H2n+2( n≥ 1) C n H2n( n≥ 2) C n H2n-2( n≥ 2)代表物CH4全部单键;含碳碳双键;不饱和链含碳碳三键;不饱和链结构特点饱和链烃;烃;平面形分子,键角烃;直线形分子,键角正四面体结构120°180°取代光照,卤代反应加成能与 H2、 X2、 HX、 H2O、 HCN等发生加成反应化反应学燃烧火焰较明亮燃烧火焰明亮带黑烟燃烧火焰明亮,带浓黑性氧化烟质反应不与酸性 KMnO溶液反4 酸性 KMnO溶液褪色酸性 KMnO溶液褪色应 4 4加聚不能发生能发生能发生反应鉴别溴水不褪色;酸性溴水褪色;酸性4KMnO4溶液不褪色KMnO溶液褪色2.物理性质(1)状态:常温下含有 1~ 4 个碳原子的烃为气态烃,随碳原子数的增多,逐渐过渡到液态、固态。
(2)沸点:①碳原子数的增多,沸点逐渐升高。
②同分异构体之间,支链越多,沸点越低。
(3)在水中的溶解性:均难溶于水。
3、化学性质(1)甲烷化学性质相当稳定,跟强酸、强碱或强氧化剂(如KMnO4)等一般不起反应。
①化反应甲烷在空气中安静的燃烧,火焰的颜色为淡蓝色。
CH4( g)+2O2( g) CO2( g) +2H2O( l )②取代反应:(注意:条件为光照)第一步: CH4+Cl 2CH3Cl+HCl 第二步: CH3Cl+ Cl 2CH2Cl 2+HCl第三步: CH2Cl 2+ Cl 2CHCl3+HCl 第四步: CHCl3+Cl 2CCl4+HCl常温下,只有CH3Cl 是气态,其余均为液态,CHCl3俗称氯仿, CCl4又叫四氯化碳光照再如: CH3CH3+ Cl 2――→ CH3CH2Cl + HCl(2)乙烯①加成反应与卤素单质 Br 2加成: CH2= CH2+ Br 2→ CH2Br — CH2Br与 H2加成: CH2= CH2+ H2CH3— CH3与卤化氢加成:CH2= CH2+ HX→ CH3— CH2X与水加成: CH2=CH2+ H2OCH3CH2OH(工业制乙醇的方法)②氧化反应常温下被氧化,如将乙烯通入酸性高锰酸钾溶液,溶液的紫色褪去。
烃类知识点归纳总结高中一、脂肪烃1.1 饱和脂肪烃饱和脂肪烃的分子式为CnH2n+2,是碳原子间是单键相连的烃类化合物。
常见的饱和脂肪烃包括甲烷、乙烷、丙烷等。
这些烃具有较高的稳定性和化学惰性。
1.2 不饱和脂肪烃不饱和脂肪烃的分子式为CnH2n,是碳原子间存在双键或三键结构的烃类化合物。
常见的不饱和脂肪烃包括乙烯、丙烯等。
这些烃具有较高的反应性和化学活性。
1.3 烃的物理性质烃的物理性质包括密度、沸点、熔点等。
不同种类的烃具有不同的物理性质,这些性质对于烃的生产和应用具有重要的意义。
1.4 烃的化学性质烃的化学性质包括燃烧、氧化、加成反应等。
这些化学性质决定了烃在化工生产中的应用。
二、芳香烃2.1 芳香烃的结构芳香烃的结构特点是由芳香环组成,其中的碳原子间存在特殊的共轭结构。
常见的芳香烃包括苯、甲苯、苯乙烯等。
2.2 芳香烃的物理性质芳香烃的物理性质包括密度、沸点、熔点等。
与脂肪烃不同,芳香烃具有特殊的物理性质,这些性质对于芳香烃的生产和应用具有重要的意义。
2.3 芳香烃的化学性质芳香烃的化学性质包括亲电取代反应、亲核取代反应、加成反应等。
芳香烃的化学性质与脂肪烃有所不同,但同样决定了芳香烃在化工生产中的应用。
三、烃在生产中的应用3.1 烃的燃料应用烃是重要的燃料,可以用于生产汽油、柴油、天然气等。
这些燃料在交通运输、工业生产等领域具有广泛的应用。
3.2 烃的化工原料应用烃是化工生产中重要的原料,可以用于生产乙烯、丙烯、丙烷等化工产品。
这些化工产品在日常生活、医药、农药等方面都有重要的应用。
3.3 烃的医药应用烃可以用于生产各种医药原料,如麻醉剂、抗生素、激素等。
这些医药原料在医疗保健领域具有重要的应用价值。
3.4 烃的农药应用烃可以用于生产各种农药原料,如杀虫剂、杀菌剂等。
这些农药原料在农业生产中起到了重要的作用。
综上所述,烃是一类重要的有机化合物,在生产和应用中具有广泛的应用价值。
对于高中生物和化学学习者而言,掌握烃的相关知识点,有助于理解有机化合物的特性和应用,提高化学素养,促进科学素养的发展。
高一化学知识点各类烃之间的区别烃是一个广泛的化学类别,包括了许多不同类型的有机化合物。
它们根据其分子结构和化学性质的不同可以进一步分为脂肪烃、环烃、烯烃和炔烃等。
本文将重点讨论这些不同类型的烃之间的区别。
1. 脂肪烃(烷烃):脂肪烃是一类所有碳—碳化学键都是单键的烃。
它们的分子式通常为CnH2n+2。
最简单的脂肪烃是甲烷,其分子式为CH4。
其他一些常见的脂肪烃包括乙烷(C2H6)、丙烷(C3H8)和丁烷(C4H10)等。
脂肪烃都是饱和烃,因为它们不含任何双键或三键。
脂肪烃是烃中最简单的一类,由于只含有单键,所以相比于其他烃来说化学稳定性较高。
脂肪烃通常是无色、无味、无毒的,常见于石油和天然气中。
由于其分子结构简单,脂肪烃通常不具有太多的化学反应性。
2. 环烃:环烃是由环状结构的碳原子组成的烃类化合物。
它们的分子中至少含有一个碳—碳双键或三键。
最简单的环烃是环丙烷,其分子式为C3H6。
其他常见的环烃包括环己烷(C6H12)、苯(C6H6)和萘(C10H8)等。
相对于脂肪烃,环烃的分子结构更加复杂,由于含有双键或三键,环烃具有较高的反应活性。
环烃中的双键将使其成为不饱和烃,因此它们可能会参与加成反应或发生其他类型的化学反应。
3. 烯烃:烯烃是一类具有一个或多个碳—碳双键的烃类化合物。
它们的分子式通常为CnH2n。
最简单的烯烃是乙烯,其分子式为C2H4。
其他常见的烯烃包括丙烯(C3H6)、丁二烯(C4H6)和己烯(C6H10)等。
烯烃相对于其他烃类来说,具有更高的反应性。
由于含有双键,烯烃易于发生加成反应、聚合反应等。
此外,烯烃也可以进行反应生成环烃,从而形成环烃和烷烃等其他类型的烃。
4. 炔烃:炔烃是一类具有一个或多个碳—碳三键的烃类化合物。
它们的分子式通常为CnH2n-2。
最简单的炔烃是乙炔,其分子式为C2H2。
其他常见的炔烃包括丙炔(C3H4)、丁炔(C4H6)和己炔(C6H8)等。
炔烃相对于其他烃类而言,分子结构更加复杂,具有较高的反应活性。
高中化学“烷烃、烯烃和炔烃的比较”
关键词:高中化学、“烷烃、烯烃和炔烃的比较”、知识归纳
进入有机化学的世界后,我们就陆续地学习了烷烃、烯烃和炔烃。
有同学就要抱怨啦,老师我们无机还没吃透呢,这又来有机,快噎死了!别着急,先长吁一口气缓缓。
今天这期我们就来PK一下“烷烃、烯烃和炔烃”。
给你屡出有机的头绪。
1、比较烷烃、烯烃和炔烃的通式、结构特点和代表物:
2、以烷烃、烯烃和炔烃的代表物甲烷、乙烯和乙炔为例,进行比较:
先比较甲烷、乙烯和乙炔的分子式、结构式、结构简式、电子式、球棍模型、比例模型及空间构型。
再接着比较甲烷、乙烯和乙炔的化学性质。
分别从氧化反应、取代反应、加成反应和加聚反应来比较。
从这里(上图)我们可以得出结论:
从这里(上图)我们可以得出结论:
化学中我们常说“结构决定性质”,放在这里就很有说服力。
因为烷烃是饱和烃,只有碳碳单键,所以只能发生取代反应;而烯烃和炔烃是不饱和的烃,分别有碳碳双键和碳碳三键,所以可以发生加成反应和加聚反应。
以后在有机物的学习中,慢慢融合“结构决定性质”的思想。
分析一个新的有机物,就可以从结构到性质,抽丝剥茧,一条一条屡清楚了。
好了,就说这么多,赶紧消化一下吧!。
高二化学烃和卤代烃知识点烃是由碳和氢组成的化合物,根据碳原子之间的连接方式,可以分为饱和烃和不饱和烃两大类。
而卤代烃是在烃的分子中,一个或多个氢原子被卤素原子取代的化合物。
本文将重点介绍高二化学中有关烃和卤代烃的重要知识点。
一、烃的分类1.饱和烃饱和烃的分子中只有碳-碳单键,不包含任何碳-碳双键或三键。
常见的饱和烃包括甲烷、乙烷、丙烷等。
它们的命名方法是根据碳原子数目加上后缀“烷”来表示。
2.不饱和烃不饱和烃的分子中含有至少一个碳-碳双键或三键。
不饱和烃又可分为烯烃和炔烃两类。
(1)烯烃烯烃是含有碳-碳双键的不饱和烃。
根据碳-碳双键的位置,烯烃可分为顺式烯烃和反式烯烃。
常见的烯烃有乙烯、丙烯等。
(2)炔烃炔烃是含有碳-碳三键的不饱和烃。
常见的炔烃包括乙炔、丙炔等。
二、烃的命名方法烃的命名方法主要有两种:通用命名法和系统命名法。
1.通用命名法通用命名法是根据烃的物理性质或化学性质进行命名。
例如甲烷、乙烯等。
通用命名法简单直观,但在命名较长的烃分子时会显得繁琐。
2.系统命名法系统命名法是根据烃分子结构进行命名,它通过标记碳原子的编号和指定连接方式来命名烃。
系统命名法较为常用,它包括:直链烷烃、支链烷烃、环烷烃、烯烃和炔烃的命名方法。
例如2-甲基丁烷、环己烷等。
三、卤代烃的命名方法卤代烃是在烃分子中,一个或多个氢原子被卤素原子取代的化合物。
卤代烃的命名方法主要有两种:通用命名法和系统命名法。
1.通用命名法通用命名法是根据卤素与碳的相对位置进行命名。
例如氯甲烷、溴乙烷等。
2.系统命名法系统命名法是根据卤代烃分子结构进行命名,它通过标记碳原子的编号和指定连接方式来命名卤代烃。
系统命名法包括:直链卤代烷、支链卤代烷、环卤代烷等的命名方法。
例如2-氯丙烷、3-溴-2-甲基己烷等。
四、烃和卤代烃的性质1.物理性质烃和卤代烃是无色无味的液体、固体或气体。
它们的密度低,不溶于水,可与有机溶剂混溶。
2.化学性质烃和卤代烃易发生燃烧反应,放出大量的热能。