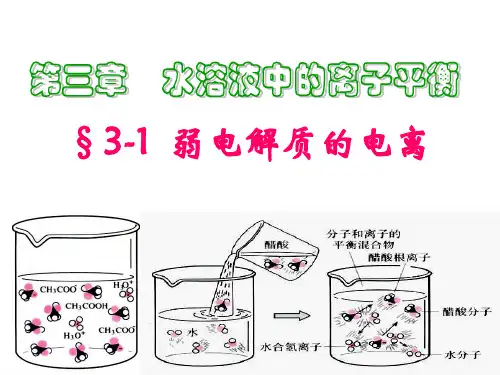
相同点
化合物类型
物质类别
不 溶质微粒
同 点
电离程度
表示方法
实例
电离方程式
【小结】
强电解质
弱电解质
都是电解质,在水溶液中都能电离,与溶解度无关
离子化合物,共价化合物
共价化合物
强酸、强碱、大多数盐
弱酸、弱碱、水
离子
分子(多)、离子
完全电离(不可逆)
部分电离(可逆)
电离方程式用“ = ”
电离方程式用“⇌”
不同温度下0.05 mol/L 醋酸的pH: 温度 20 ℃
pH 3.05
24 ℃ 3.03
CH3COOH
温度升高,pH减小,c(H+)增大
CH3COO- + H+ ΔH >0
(1)电离是一个吸热过程,温度升高, 平衡正向移动,电离程度增大 (2)达到平衡时分子、离子共存
(3)弱电解质的电离都是微弱的过程,一般来说,绝大数以分子 的形式存在。如0.1mol/L的醋酸溶液中,c(H⁺)在0.001mol/L左右
1.定义:在一定条件(如温度、浓度)下,当电解质分子电离成离子的速 率和离子重新结合成分子的速率相等时, 电离过程就达到了平衡状态 ― 电离平衡
逆:弱电解质的电离是可逆过程
等:V电离 = V结合≠0
2.特征
动:动态平衡
定:溶液中各分子、离子的浓度不变 变:条件改变时,电离平衡发生移动
3.弱电解质电离的特点
点拨:对强电解质和弱电解质的正确理解 (1)区分电解质强弱的唯一依据是电解质在水溶液中能否完全电离,即电离 程度。 (2)电解质的强弱与溶液导电性的强弱无必然联系。相同条件下溶液中离 子浓度大的导电能力强,离子电荷越高,导电能力越强。 (3)电解质的强弱与物质的溶解性无必然联系。即使溶解度很小,只要溶于 水的部分完全电离就是强电解质,所以不能根据溶解度大小进行判断。 (4) 强弱电解质与化学键的关系:离子化合物一定是强电解质,共价化合 物不一定(如硫酸是强电解质,醋酸是弱电解质,蔗糖是非电解质)。