原子结构示意图和元素周期表专项训练
- 格式:doc
- 大小:285.00 KB
- 文档页数:7

原子结构示意图和元素周期表专项训练原子结构示意图1. (2015成都)两种微粒的结构示意图是Na 和Na+,其中相同的是( )A. 电子数B. 质子数C. 电子层数D. 所带电荷数2. (2015桂林)Cl的原子结构示意图为,下列关于Cl的说法错误的是()A. 电子层数是3B. 核内质子数是17C. 最外层电子数是7D. 在化学反应中易失电子3. (2015济南)以下是四种微粒的结构示意图,下列有关各微粒的说法中,错误的是( )第3题图A. ①的化学性质比较稳定B. ③④属于同种元素C. ④是一种阴离子D. ②容易得到电子4. (2015眉山)元素周期表中某些元素的原子结构示意图如下:第4题图(1)上述结构图中的X=_______。
(2)硅原子的结构示意图为,上图中与其化学性质相似的元素是_______(填元素符号)。
(3)根据图示信息,确定一个水分子中所含电子总数为________。
1. (2015洛阳模拟)砷化镓(GaAs)是一种“LED”绿色节能光源材料。
根据镓元素的相关信息图得到有关镓元素的说法错误的是()A. 原子的核电荷数是31B. 元素符号是GaC. 属于金属元素D. 相对原子质量为69.72 g 第1题图2. (2015平顶山模拟)如图是元素周期表中硫元素的信息示意图,其中A表示_____________;B表示___________。
第2题图第3题图3. (2015聊城)规范书写是我们学习中必须遵循的原则。
小明在元素周期表中查找到如图所示的一格后,明白了不能把一氧化碳写成“Co”的原因。
(1)“Co”表示________元素(填名称)。
(2)“CO”是由_________两种元素(填名称)组成的_________(填“单质”或“化合物”)。
4. (2015恩施)元素周期表是学习和研究化学的重要工具。
A、B、C为周期表1-18号中的元素,在周期表中的位置如图所示。
已知A的核电荷数为8,三种元素的核电荷数之和为34。

化学原子结构与元素周期表的专项培优易错难题练习题附详细答案一、原子结构与元素周期表练习题(含详细答案解析)1.如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,元素⑦位于周期表的___区。
(2)写出元素③与元素⑤形成的稳定化合物的结构式______。
(3)②、⑥两元素形成的化合物其中心原子的杂化轨道类型为___。
(4)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于____晶体(填晶体类型)。
(5)元素⑨的离子的氢氧化物不溶于水,但可溶于氨水,该离子与NH3间结合的作用力为____。
(6)将①、⑥形成的化合物溶于水,其与水间可能存在的氢键表示为____________(写一种即可)。
(7)金属⑦有δ、γ、α三种同素异形体,各晶胞如下图,则δ和α中原子的配位数之比为________。
【答案】d O=C=O sp2杂化分子配位键 F-H…F、F-H…O、O-H…F、O-H…O 4:3【解析】【分析】根据元素周期表可知①为H元素、②为B元素、③为C元素、④为N元素、⑤为O元素、⑥为F元素、⑦为Fe元素、⑧为Cu元素、⑨为Zn元素。
【详解】(1)元素⑦为Fe元素,位于周期表的d区,故答案为:d;(2)元素③为C元素、元素⑤为O元素,其形成的稳定化合物为二氧化碳,结构式为:O=C=O,故答案为:O=C=O;(3)②为B元素、⑥为F元素,两元素形成的化合物为BF3,中心原子是B,价层电子对个数=σ键+孤电子对个数=3+0=3,杂化轨道类型为:sp2杂化,故答案为:sp2杂化;(4)元素⑦为Fe元素、与CO可形成Fe(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断该化合物晶体属于分子晶体,故答案为:分子;(5)元素⑨Zn元素,氢氧化物为Zn(OH)2不溶于水,但可溶于氨水,Zn2+离子与NH3间结合的作用力为配位键,故答案为:配位键;(6)①为H元素、⑥为F元素,形成的化合物为HF,溶于水,与水分子间可能存在的氢键表示为:F-H…F、F-H…O、O-H…F、O-H…O,故答案为:F-H…F、F-H…O、O -H…F、O-H…O;(7)金属⑦为Fe,有δ、γ、α三种同素异形体,δ为体心立方,α为简单立方,原子的配位数之比为8:6=4:3,故答案为:4:3。
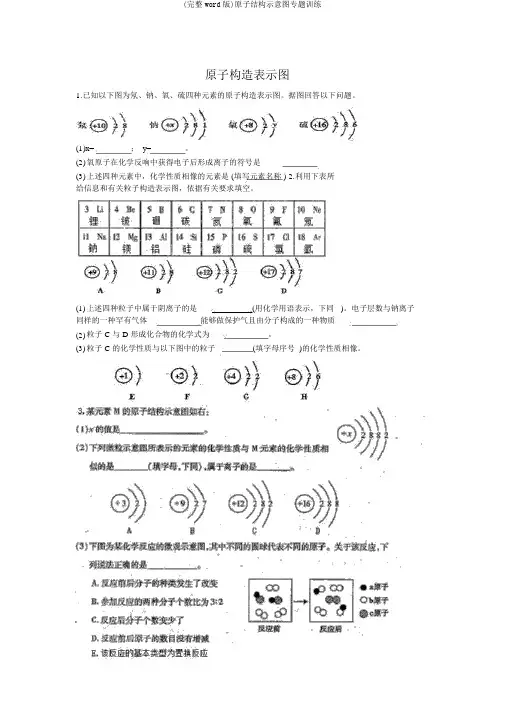
原子构造表示图1.已知以下图为氖、钠、氧、硫四种元素的原子构造表示图。
据图回答以下问题。
(1)x=;y=。
(2)氧原子在化学反响中获得电子后形成离子的符号是(3)上述四种元素中,化学性质相像的元素是 (填写元素名称 ) 2.利用下表所给信息和有关粒子构造表示图,依据有关要求填空。
(1) 上述四种粒子中属于阴离子的是(用化学用语表示,下同 )。
电子层数与钠离子同样的一种罕有气体能够做保护气且由分子构成的一种物质(2) 粒子 C 与 D 形成化合物的化学式为。
(3) 粒子 C 的化学性质与以下图中的粒子(填字母序号 )的化学性质相像。
4.溴元素的粒子构造和有关信息以以下图所示。
(1) 溴属于元素 ( 金属/非金属 ) 。
(2) 溴元素的原子序数为,相对原子质量为。
(3) 图 30 一 2 所表示的粒子的化学符号是。
5. 碘是人体一定的一种微量元素。
碘元素的符号为I,右图是一I (碘离子 )的构造表示图。
,( 1)右图中 x= ;( 2)碘属于元素 (填“金属”或“非金属” )。
( 3)以下图表示的微粒中,与I 化学性质相像的是(填字母序号 );属于相对稳固构造的是(填字母序号 )6. 以下图 A 是镁元素在元素周期表中的有关信息,图 B 是该元素形成的一种粒子的构造表示图。
(1)镁元素的相对原子质量为(2)B 图中 X =,该粒子的符号是。
(3)图 2 是镁在点燃条件下与某物质发生化学反响的微观表示图。
该反响的化学方程式为7.图甲是两种元素在周期表中的信息,图乙是氟原子的原子构造表示图。
请达成以下问题:( 1)图甲方框的横线上填的是,图乙方框横线上的数字是;( 2)钙元素的原子序数为氟元素的相对原子质量为图甲所示两种元素形成化合物的化学式为。
( 3)图丙中化学性质相像的是;属于同种元素的粒子是。
8.下边是钠元素和氯元素在元素周期表中的信息和 3 种粒子的构造表示图。
请回答以下问题:(1) 氯原子的核电荷数是;钠原子与氯原子的最实质差别是。
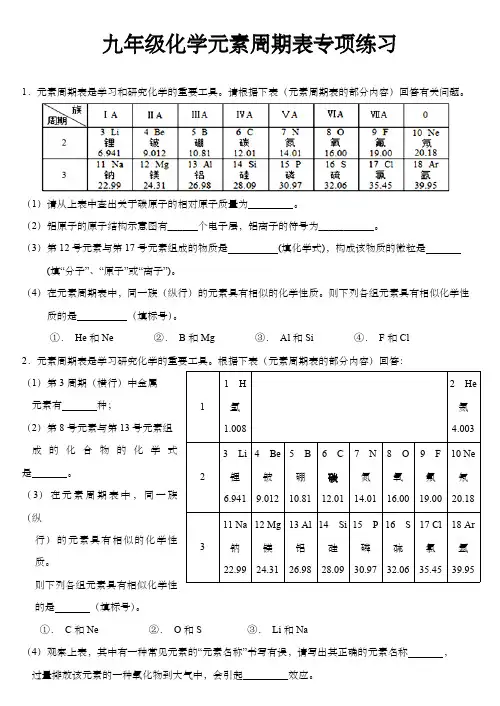
九年级化学元素周期表专项练习1.元素周期表是学习和研究化学的重要工具。
请根据下表(元素周期表的部分内容)回答有关问题。
(1)请从上表中查出关于碳原子的相对原子质量为 。
(2)铝原子的原子结构示意图有______个电子层,铝离子的符号为___________。
(3)第12号元素与第17号元素组成的物质是 (填化学式),构成该物质的微粒是 (填“分子”、“原子”或“离子”)。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。
则下列各组元素具有相似化学性质的是 (填标号)。
①. He 和Ne②. B 和Mg③. Al 和Si④. F 和Cl2.元素周期表是学习研究化学的重要工具。
根据下表(元素周期表的部分内容)回答:(1)第3周期(横行)中金属元素有 种;(2)第8号元素与第13号元素组成的化合物的化学式是 。
(3)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。
则下列各组元素具有相似化学性的是 (填标号)。
①. C 和Ne②. O 和S③. Li 和Na(4)观察上表,其中有一种常见元素的“元素名称”书写有误,请写出其正确的元素名称 ,过量排放该元素的一种氧化物到大气中,会引起 效应。
11 H 氢1.0082 He 氦4.00323 Li 锂6.941 4 Be 铍9.012 5 B 硼10.81 6 C 碳12.017 N 氮14.018 O 氧16.009 F 氟19.0010 Ne 氖20.18311 Na 钠22.9912 Mg 镁24.3113 Al 铝26.9814 Si 硅28.0915 P 磷30.9716 S 硫32.0617 Cl 氯35.4518 Ar 氩39.95(5)聚合物锂离子电池被誉为“21世纪的电池”,根据上图元素周期表中锂元素的相关信息,回答下列问题:锂元素在化学反应中容易 (填“得到”或“失去”)电子;锂元素与第17号元素组成的化合物的化学式是 。

原子结构与元素周期表基础题一、选择题1.下列用四个量子数标记某基态原子的电子在原子轨道上的运动状态,其中合理的是 A. 2,2,1,+21 B. 2,1,2,-21 C. 3,2,-2,+21 D. 3,-2,2,-212.基态原子的核外电子在原子轨道上的能量大小关系不正确的是( ) A. 3s >2s B. 3p >3s C. 4s >3d D. 3d >3s 3.下列符合泡利不相容原理的是( )4.下列哪个选项可以更贴切地展现洪特规则的内容( )5.关于价电子的描述正确的是( )A.价电子就是元素原子最外层的电子B.元素的物理性质与价电子的数目密切相关C.从价电子中可以研究并推测出元素可能具有的价态D.价电子能量都比较低,较稳定 6.根据鲍林近似能级图,理解正确的是( ) A.从能级组中我们可以推测对应周期包含元素的种数B.相邻能级组之间的能量差较小,不相邻的能级组之间的能量差才较大C.归为一组的能级用线框框在一起,表示其中能级的能量由于相互影响形成能量相同的能级D.每个能级组中所示的能级,其主量子数都相同 7.下列关于核外电子排布的说法不合理的是( ) A.族的划分与原子的价电子数目和价电子的排布密切相关 B.周期中元素的种数与原子的能级组最多容纳的电子有关C.稀有气体元素原子的最外层电子排布ns 2np 6的全充满结构,所以具有特殊稳定性D.同一副族内不同元素原子的电子层数不同,其价电子排布一定也完全不同8.指定化合物中两个相邻原子的核间距为两个原子的半径之和,再通过实验来测定分子或固体中原子的核间距,从而求得相关原子的原子半径。
不属于这种方法测得的半径是( )A.玻尔半径B.金属半径C.共价半径D.范德华半径 9.下列关于原子半径的周期性变化描述不严谨的是( ) A.元素的原子半径随元素原子序数的递增呈周期性变化B.同周期元素随着原子序数的递增,元素的原子半径自左到右逐渐减小C.同主族元素随着原子序数的递增,元素的原子半径自上而下逐渐增大D.电子层数相同时,有效核电荷数越大,对外层电子的吸引作用越强 10、假定有下列电子的各套量子数,指出可能存在的是( )A 、13222,,,+B 、13012,,,-- C 、2222,,, D 、1000,,,11、下列各组元素,按照原子半径依次减小、第一电离能依次增大的顺序排列的是 A 、K 、Na 、Li B 、Al 、Mg 、Na C 、N 、O 、C D 、P 、S 、Cl12、已知某原子的各级电离能数值如下:1112I 588kJ mol ,I 1817kJ mol ,--=⋅=⋅1134I 2745kJ mol ,I 11578kJ mol --=⋅=⋅,则该原子形成离子的化合价为( )A 、+1B 、+2C 、+3D 、+4 13、下列说法中正确的是A 、所有的电子在同一区域里运动B 、能量低的电子在离核远的区域运动,能量高的电子在离核近的区域运动C 、处于最低能量的原子叫基态原子D 、同一原子中,1s 、2s 、3s 所能容纳的电子数越来越多14、元素X 、Y 、Z 均为主族元素,已知元素X 、Y 的正离子与元素Z 的负离子具有相同的电子层结构,且Y 的原子半径大于X 的原子半径,则此三元素原子序数的大小关系是: A X >Y >Z B Y >X >Z C Y >Z >X D Z >Y >X15、下列各原子或离子的电子排列式错误的是()A. Na+1s22s22p6B. F¯ 1s22s22p6 C N3+ 1s22s22p6 D. O2¯ 1s22s22p616、一个价电子构型为2s22p5的元素,下列有关它的描述正确的有:A 原子序数为8B 电负性最大C 原子半径最大D 第一电离能最大17、下列有关认识正确的是()A.各能级的原子轨道数按s、p、d、f的顺序分别为1、3、5、7B.各能层的能级都是从s能级开始至f能级结束C.各能层含有的能级数为n—1 D.各能层含有的电子数为2n218、短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个,则这三种元素所组成的化合物的分子式不可能是A.X2YZ4B.XYZ3C.X3YZ4D.X4Y2Z719、以下能级符号不正确的是()A. 3sB. 3p C . 3d D. 3f20、下列关于氢原子电子云图的说法正确的是()A. 通常用小黑点来表示电子的多少,黑点密度大,电子数目大。

专题三原子结构及其示意图元素及元素周期表【考点一】原子结构及其示意图1.(2019聊城中考)下列关于微观粒子说法不正确的是()A.分子的质量一定比原子的质量大B.同种原子可以构成不同种分子C.所有原子都由原子核和核外电子构成D.原子得到或失去电子变成离子【答案】A【解答】解:A.分子和原子不能比较质量大小,有的分子质量比有的原子的质量大,有的分子的质量比有的原子的质量小,故A错误;B.同种原子可以构成不同种分子,如氧原子可以构成O2和O3两种不同的分子,故B正确;C.原子核和核外电子可以构成原子,因此原子都由原子核和核外电子构成的,故C正确;D.离子是带电的原子,所以原子得到或失去电子就变成离子,故D正确。
故选:A。
2.(2019威海中考)下列对分子、原子、离子的认识正确的是()A. 同种分子排列方式不同,化学性质不同B. 在干冰中,分子因相互作用而静止不动C. 同种原子按不同方式结合,可以构成不同的物质D. 原子得失电子形成离子后,原子核发生了变化【答案】C【解析】解:A、同种分子排列方式不同,但分子的种类不变,化学性质相同,故选项说法错误。
B、在干冰中,分子总是在不断的运动的,故选项说法错误。
C、同种原子按不同方式结合,可以构成不同的物质,如水和过氧化氢,故选项说法正确。
D、原子得失电子形成离子后,原子核不变,故选项说法错误。
故选:C。
A、根据分子的概念,进行分析判断。
B、根据分子的基本性质,进行分析判断。
C、根据原子和分子的关系,进行分析判断。
D、根据原子得失电子形成离子,进行分析判断。
本题难度不大,掌握原子和离子的相互转化、分子的基本性质等是正确解答本题的关键。
3.(2019潍坊中考)下列有关元素、原子、分子和离子的说法正确的是()A.决定元素化学性质的是原子的最外层电子数B.原子可以构成分子,不能直接构成物质C.分子是化学变化中的最小微粒D.微粒得到或失去电子变成离子【答案】A【解答】解:A、决定元素化学性质的是原子的最外层电子数,故选项说法正确。
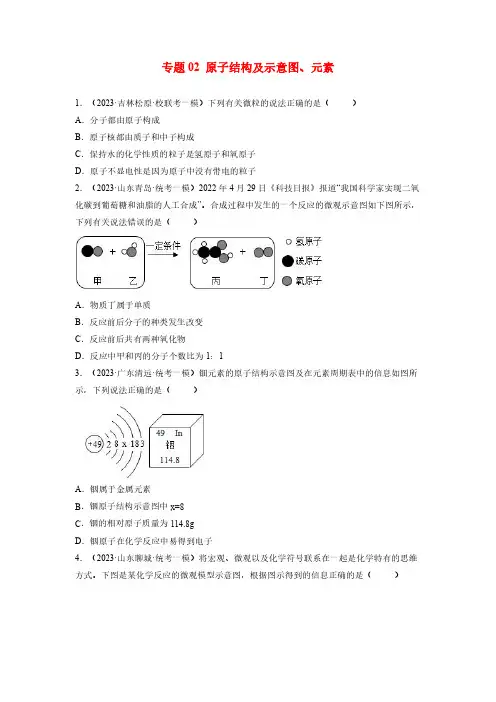
专题02原子结构及示意图、元素1.(2023·吉林松原·校联考一模)下列有关微粒的说法正确的是()A.分子都由原子构成B.原子核都由质子和中子构成C.保持水的化学性质的粒子是氢原子和氧原子D.原子不显电性是因为原子中没有带电的粒子2.(2023·山东青岛·统考一模)2022年4月29日《科技日报》报道“我国科学家实现二氧化碳到葡萄糖和油脂的人工合成”。
合成过程中发生的一个反应的微观示意图如下图所示,下列有关说法错误的是()A.物质丁属于单质B.反应前后分子的种类发生改变C.反应前后共有两种氧化物D.反应中甲和丙的分子个数比为1:13.(2023·广东清远·统考一模)钿元素的原子结构示意图及在元素周期表中的信息如图所示,下列说法正确的是()A.铟属于金属元素B.铟原子结构示意图中x=8C.铟的相对原子质量为114.8gD.铟原子在化学反应中易得到电子4.(2023·山东聊城·统考一模)将宏观、微观以及化学符号联系在一起是化学特有的思维方式。
下图是某化学反应的微观模型示意图,根据图示得到的信息正确的是()A.参加反应的甲、乙两物质的质量之和一定等于生成丙和丁的质量之和B.该反应类型属于置换反应C.反应前后原子的种类和数目发生了改变D.参加反应的甲、乙两物质的分子个数比为1:15.(2023·山东聊城·统考一模)2023年3月4日聊城市人民医院成功完成我市首例“人工心脏”植入术,“人工心脏”是由纯钛制作。
钛的原子结构示意图和钛元素在元素周期表中的信息如图所示,下列说法不正确的是()A.钛属于金属元素B.钛排列在元素周期表中第四周期C.钛的相对原子质量为47.87D.钛原子的化学性质与氦原子的化学性质相似6.(2023·新疆克拉玛依·统考一模)在“宏观一微观一符号”之间建立联系是化学学科特有的思维方式。

专题(二)原子结构示意图及元素周期表1.2【2018山东泰安】全球近140个国家将根据签署的《国际防治汞污染公约》,在2020年前禁止生产和出口含汞产品,如电池、荧光灯、化妆品、温度计、血压计等。
汞元素部分信息如图所示,下列说法不正确的是(A)A.汞为非金属元素B.汞原子的核外电子数是80C.汞原子的质子数为80D.汞的相对原子质量为200.63 4 56.【2018年广州市】下图为某粒子的结构示意图,下列说法正确的是( A )A.该粒子有12个质子B.该粒子有2个电子层C.该粒子属于非金属元素D.该粒子已达到相对稳定结构7..如图是某元素的原子结构示意图和该元素在元素周期表中的单元格,下列说法不正确的是(D)A.该元素属于金属元素B.该原子在化学变化中容易失去电子C.该原子的大小主要决定于核外电子的运动空间D.该原子的质量由构成其原子的质子和电子决定8有一种粒子的结构示意图为,下列说法不正确的是(D)A.该粒子具有稳定结构B.该元素是一种金属元素C.该粒子是一种阳离子D.该元素的原子核外有两个电子层9从如图所示的两种微粒结构示意图中,所获取信息不正确的是(A)A.它们属于同种元素B.它们的核外电子层数相同C.它们的核外电子数相同D.①表示阴离子,②表示原子第9题图10.根据右表判断,下列说法正确的是(C)A.铝的相对原子质量是13B.钠离子核外有三个电子层C.第二、三周期元素的原子从左至右最外层电子数逐渐增多D.在化学变化中镁元素容易失去最外层2个电子形成镁离子1112.13.1415.【2018四川巴中】根据下列粒子结构示意图,回答问题:(1)A、B、C、D所示粒子共表示三种元素。
(2)D所示粒子在化学反应中容易_得到(选填“得到”或“失去”)电子。
16【2018年四川省乐山市】元素周期表是学习和研究化学的重要工具。
下面是元素周期表的部分信息:认真分析信息,回答:(1)地壳中含量最多的元素的原子序数是___8__;(2)分析上表规律可推知,表中X=__17_;(3)表示的是(写粒子符号)__ Ca2+_;17.【2018年四川省达州市】图甲是铝元素在元素周期表中的相关信息,图乙是几种微粒的结构示意图,仔细分析答题:(1)图甲中,铝元素的信息有处错误,请加以改正_Al;(2)铝原子的相对原子质量_ 26.98 _ ;(3)图乙中,属于稳定结构的原子是_AD___(填序号,下同);(4)图乙中,与铝不属于同一周期元素的是___A__。

化学原子结构与元素周期表的专项培优练习题(含答案)一、原子结构与元素周期表练习题(含详细答案解析)1.如图是元素周期表的一部分,表中所列字母分别代表一种元素。
根据表中所列元素回答下列问题:(1)元素d在元素周期表中的位置是________,元素h与f的原子序数相差_____。
(2)元素b、c、f形成的简单离子中半径最小的是______(填离子符号),原子半径最小的是______(填元素符号)。
(3)表中第三周期所列元素的非金属性最强的是______(填元素符号),e、f、g三种元素的简单氢化物中最不稳定的是______(填化学式)。
(4)元素g与元素b的最高价氧化物对应水化物反应的化学方程式为______。
(5)铅(Pb)、锡(Sn)、锗(Ge)与碳(C)、硅(Si)属于同主族元素,常温下,在空气中,单质锡、锗均不反应而单质铅表面生成一层氧化铅;单质锗与盐酸不反应,而单质锡与盐酸反应。
由此可得出以下结论:①锗的原子序数为______;②铅(Pb)、锡(Sn)、锗(Ge)的+4价氢氧化物的碱性由强到弱的顺序为___________(用化学式表示)。
(6)最近,德国科学家实现了铷原子气体的超流体态与绝缘态的可逆转换,该成果将在量子计算机研究方面带来重大突破。
已知铷(Rb)是37号元素,相对原子质量是85.5,与钠同主族。
回答下列问题:①铷在元素周期表中的位置为__________________。
②同主族元素的同类化合物的性质相似,请写出AlCl3与RbOH过量反应的离子方程式:_____________________。
③现有铷和另一种碱金属形成的混合金属50 g,当它与足量水反应时,放出标准状况下的氢气22.4 L,另一种碱金属可能是__________。
(填序号)A.Li B.Na C.K D.Cs【答案】第三周期第ⅢA族 18 Mg2+ S Cl PH3 NaOH+HClO4=NaClO4+H2O 32Pb(OH)4>Sn(OH)4>Ge(OH)4第五周期第ⅠA族 Al3++4OH-=AlO2-+2H2O (或写为Al3++4OH-=[Al(OH)4]-) AB【解析】【分析】由元素在周期表的位置可知,a是N元素,b为Na元素,C为Mg元素,d为Al元素,e 为P元素,f为S元素,g为Cl元素,h为Se元素,然后根据元素周期律分析解答。

长沙高考化学培优(含解析)之原子结构与元素周期表一、原子结构与元素周期表练习题(含详细答案解析)1.下表是元素周期表的一部分,针对表中用字母标出的元素,回答下列问题:(除特别注明外,其它一律用化学式表示)(1)由E形成的物质中硬度最大的是___(填名称),属于___(填“晶体类型”)。
(2)最高价氧化物水化物中碱性最强的化合物的电子式是___,该碱溶液与D的最高价氧化物反应的离子方程式___。
(3)常用作光导纤维的是___。
(4)G、H、I形成的气态氢化物稳定性由强到弱的顺序___。
(5)H、J、K的最高价氧化物对应水化物的酸性由强到弱的顺序___。
(6)I、J、K三种元素形成的离子,离子半径由大到小的顺序是___。
(7)元素I的氢化物的结构式为___;该氢化物常温下和元素K的单质反应的化学方程式为___。
【答案】金刚石原子晶体 2OH-+Al2O3=2AlO2-+H2O SiO2 H2O>NH3>PH3 HClO4>H2SO4>H3PO4 S2->Cl->O2- H—O—H Cl2+H2O ƒ HClO+HCl【解析】【分析】根据元素周期表可知,A为氢元素,B为钠元素,C为镁元素,D为铝元素,E为碳元素,F 为硅元素,G为氮元素,H为磷元素,I为氧元素,J为硫元素,K为氯元素,L为氩元素。
【详解】(1)E为碳元素,形成的物质中硬度最大的是金刚石,属于原子晶体,故答案为:金刚石;原子晶体;(2)同周期元素从左到右,金属性逐渐减弱,同主族元素,从上到下,金属性逐渐增强,可知钠金属性最强,对应的碱为氢氧化钠,其电子式为,D为铝元素,其最高价氧化物为氧化铝,氧化铝有两性,与氢氧化钠反应的离子反应方程式为2OH-+Al2O3=2AlO2-+H2O,故答案为:;2OH-+Al2O3=2AlO2-+H2O;(3)二氧化硅常用作光导纤维,故答案为:SiO2;(4)同周期元素从左到右非金属性逐渐增强,同主族元素从上到下非金属性逐渐减弱,则非金属性O>N>P,非金属性强的元素对应的氢化物越稳定,则稳定性H2O>NH3>PH3,故答案为:H2O>NH3>PH3;(5)同周期元素从左到右非金属性逐渐增强,则非金属性Cl>S>P,非金属性强的元素对应的最高价含氧酸的酸性强,则酸性HClO4>H2SO4>H3PO4,故答案为:HClO4>H2SO4>H 3PO 4;(6)S 2-、Cl -均有三个电子层,核外电子排布相同,则核电荷数小的离子半径大,即S 2->Cl -,O 2- 有两个电子层,比S 2-、Cl -的离子半径都小,则S 2->Cl ->O 2-,故答案为:S 2->Cl ->O 2-;(7)元素I 的氢化物为水,结构式为H —O —H ,水在常温下和氯气反应的化学方程式为Cl 2+H 2O ƒ HClO +HCl ,故答案为:H —O —H ;Cl 2+H 2O ƒ HClO +HCl 。
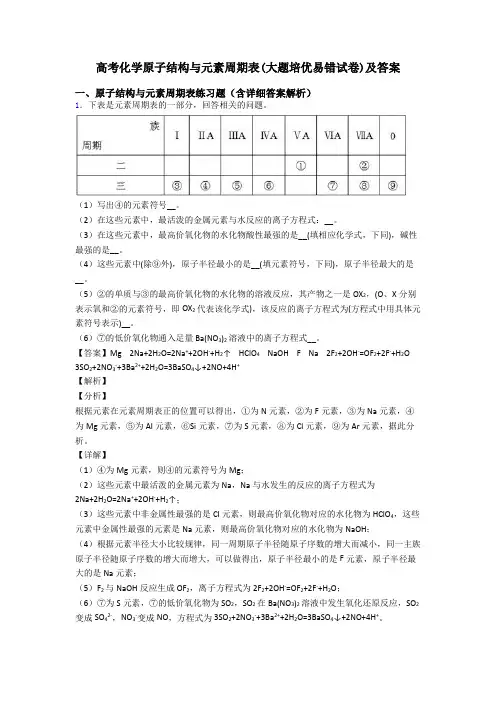
高考化学原子结构与元素周期表(大题培优易错试卷)及答案一、原子结构与元素周期表练习题(含详细答案解析)1.下表是元素周期表的一部分,回答相关的问题。
(1)写出④的元素符号__。
(2)在这些元素中,最活泼的金属元素与水反应的离子方程式:__。
(3)在这些元素中,最高价氧化物的水化物酸性最强的是__(填相应化学式,下同),碱性最强的是__。
(4)这些元素中(除⑨外),原子半径最小的是__(填元素符号,下同),原子半径最大的是__。
(5)②的单质与③的最高价氧化物的水化物的溶液反应,其产物之一是OX2,(O、X分别表示氧和②的元素符号,即OX2代表该化学式),该反应的离子方程式为(方程式中用具体元素符号表示)__。
(6)⑦的低价氧化物通入足量Ba(NO3)2溶液中的离子方程式__。
【答案】Mg 2Na+2H2O=2Na++2OH-+H2↑ HClO4 NaOH F Na 2F2+2OH-=OF2+2F-+H2O 3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+【解析】【分析】根据元素在元素周期表正的位置可以得出,①为N元素,②为F元素,③为Na元素,④为Mg元素,⑤为Al元素,⑥Si元素,⑦为S元素,⑧为Cl元素,⑨为Ar元素,据此分析。
【详解】(1)④为Mg元素,则④的元素符号为Mg;(2)这些元素中最活泼的金属元素为Na,Na与水发生的反应的离子方程式为2Na+2H2O=2Na++2OH-+H2↑;(3)这些元素中非金属性最强的是Cl元素,则最高价氧化物对应的水化物为HClO4,这些元素中金属性最强的元素是Na元素,则最高价氧化物对应的水化物为NaOH;(4)根据元素半径大小比较规律,同一周期原子半径随原子序数的增大而减小,同一主族原子半径随原子序数的增大而增大,可以做得出,原子半径最小的是F元素,原子半径最大的是Na元素;(5)F2与NaOH反应生成OF2,离子方程式为2F2+2OH-=OF2+2F-+H2O;(6)⑦为S元素,⑦的低价氧化物为SO2,SO2在Ba(NO3)2溶液中发生氧化还原反应,SO2变成SO42-,NO3-变成NO,方程式为3SO2+2NO3-+3Ba2++2H2O=3BaSO4↓+2NO+4H+。
化学 原子结构与元素周期表的专项 培优练习题及答案一、原子结构与元素周期表练习题(含详细答案解析)1.锌在工业中有重要作用,也是人体必需的微量元素。
回答下列问题:(1)Zn 原子核外电子排布式为__________洪特规则内容_____________泡利不相容原理内容______________________(2)黄铜是人类最早使用的合金之一,主要由Zn 和Cu 组成。
第一电离能I 1(Zn)__________I 1(Cu)(填“大于”或“小于”)。
原因是__________(3)ZnF 2具有较高的熔点(872℃ ),其化学键类型是__________;ZnF 2不溶于有机溶剂而ZnCl 2、ZnBr 2、ZnI 2能够溶于乙醇、乙醚等有机溶剂,原因是__________(4)金属Zn 晶体中的原子堆积方式如图所示,这种堆积方式称为__________,配位数为____六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为N A ,Zn 的密度为__________g·cm -3(列出计算式)。
【答案】1s 22s 22p 63s 23p 63d 104s 2或[Ar ]3d 104s 2 原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低 每个原子轨道上最多只能容纳两个自旋状态不同的电子 大于 Zn 核外电子排布为全满稳定结构,较难失电子 离子键 ZnF 2为离子化合物,ZnCl 2、ZnBr 2、ZnI 2的化学键以共价键为主、极性较小 六方最密堆积(A 3型2A 3N 6a c ⨯⨯⨯ 【解析】【分析】【详解】(1)Zn 原子核外有30个电子,分别分布在1s 、2s 、2p 、3s 、3p 、3d 、4s 能级上,其核外电子排布式为1s 22s 22p 63s 23p 63d 104s 2或[Ar]3d 104s 2,洪特规则是指原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低,而泡利原理是指每个原子轨道上最多只能容纳两个自旋状态不同的电子,故答案为:1s 22s 22p 63s 23p 63d 104s 2或[Ar]3d 104s 2;原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低;每个原子轨道上最多只能容纳两个自旋状态不同的电子;(2)轨道中电子处于全满、全空、半满时较稳定,失去电子需要的能量较大,Zn 原子轨道中电子处于全满状态,Cu 失去一个电子内层电子达到全充满稳定状态,所以Cu 较Zn 易失电子,则第一电离能Cu<Zn,故答案为:大于;Zn核外电子排布为全满稳定结构,较难失电子;(3)离子晶体熔沸点较高,熔沸点较高ZnF2,为离子晶体,离子晶体中含有离子键;根据相似相溶原理知,极性分子的溶质易溶于极性分子的溶剂,ZnF2属于离子化合物而ZnCl2、ZnBr2、ZnI2为共价化合物,ZnCl2、ZnBr2、ZnI2分子极性较小,乙醇、乙醚等有机溶剂属于分子晶体极性较小,所以互溶,故答案为:离子键;ZnF2为离子化合物,ZnCl2、ZnBr2、ZnI2的化学键以共价键为主,极性较小;(4)金属锌的这种堆积方式称为六方最密堆积,Zn原子的配位数为12,该晶胞中Zn原子个数=12×16+2×12+3=6,六棱柱底边边长为acm,高为ccm,六棱柱体积=[(6×23a)×3×c]cm3,晶胞密度=2AmV3N6a c=⨯⨯⨯,故答案为:六方最密堆积(A3型);12;2A3N6a c⨯⨯⨯。
专项集训6 原子结构与元素周期表一、选择题1.下列说法不正确的是( )A.人类对原子结构的认识经历了1803年道尔顿模型→1904年汤姆孙原子模型→1911年卢瑟福原子模型→1913年玻尔原子模型→1926~1935年电子云模型B.人类对原子结构的认识过程,启示了微观结构也要根据科学猜想和分析,并通过实验验证C.在原子中电子的分层排布中,M 层(第三层)容纳的电子数最多为18,最少为8D.在化学反应过程中,原子核不发生变化,但原子最外层电子可能发生变化2.(2020浙江丽水四校期中)下列叙述中,正确的是( )A .614C 中含有14个中子B .816O 、818O 是同一种核素C .11H 2和 12H 2互为同位素 D.C 60、C 70互为同素异形体3.R n +有m 个电子,它的质量数为A ,则原子核内的中子数为( )A.m+nB.A-m+nC.A-m-nD.A+m-n4.2017年,中国公布113号、115号、117号和118号四种元素的中文名称。
其中118号元素的原子符号为 118294Og,中文名称为“”。
下列说法不正确的是( )A.质子数为118B.中子数为176C.核外电子数为118D.质量数为4125.(2020浙江杭州校级期中)联合国大会将2019年指定为“化学元素周期表国际年”,来纪念元素周期表这一伟大的发现,下面有关元素周期表的内容,描述正确的是( )A.元素周期表是俄国科学家门捷列夫发现的B.元素周期表一共有7行16列C.左边的第一列的元素都是活泼的金属元素D.S 元素在元素周期表中的位置是第三周期Ⅵ族6.下列各组粒子中,核外电子总数相等的是( )A.CO 、H 2OB.H 2O 、HClC.CO 2、N 2OD.Na +、Cl -7.下列原子中,与氧元素原子的化学性质相似的是( )8.(2020~2021浙江温州高一检测)下列说法正确的是( )A.核素的种类比元素种类少B.H 2、D 2、T 2互为同位素,因为它们核内质子数相同,中子数不同C.通常人们所说的C-12原子是指质子数和中子数都是6的碳原子D .612C 与 614C 互为同位素,两者的化学性质不同9.下列离子中,所带电荷数与该离子的核外电子层数相等的是( )A.Al 3+B.Mg 2+C.Be 2+D.H +10.在离子R O 3n -中共有x 个核外电子,R 原子的质量数为A ,则R 原子核内含中子的数目为( )A.A+n+48+xB.A-n-24-xC.A-n+24-xD.A+n+24-x11.核外电子分层排布的主要原因是( )A.电子的质量不同B.电子的能量不同C.电子的数量不同D.电子的大小不同12.(2020浙江杭州八校联盟期中联考)医学上通过研究并实现了利用含放射性元素 1532P 的“纸贴”治疗疤痕,下列有关 1532P 、1531P 的叙述正确的是( )A .1532P 、1531P 属于同一种核素B .1532P 的原子中所含的质子数为16C .1531P 的中子数为16D .1532P 的摩尔质量为32 13.已知A 为第ⅡA 族元素,B 为第ⅢA 族元素,它们的原子序数分别为m 和n ,且A 、B 为同一周期元素。
高考化学原子结构与元素周期表(大题培优)一、原子结构与元素周期表练习题(含详细答案解析)1.电气石是一种具有保健作用的天然石材,其中含有的主要元素为B、Si、Al、Mg、Na、O等元素。
(1)上述元素中,原子半径最小的是_________(用元素符号表示),在元素周期表中处于金属和非金属分界线附近的元素是_____________(用元素符号表示);(2)表示原子结构的化学用语有:原子结构示意图、核外电子排布式、轨道表示式,从中选择最详尽描述核外电子运动状态的方式,来表示氧元素原子核外电子的运动状态______________;(3)B与最活泼的非金属元素F形成化合物BF3,检测发现BF3分子中三根B—F键的键长相等,三根键的键角相等,能否仅仅依据此数据此判断BF3分子的极性____________;(4)SiO2晶体的熔点比BF3晶体________(选填“高”、“低”)。
【答案】O B、Si、Al 非极性高【解析】【分析】(1)同周期自左而右原子半径减小,电子层越多原子半径越大;在元素周期表中处于金属和非金属分界线附近的元素是B、Si、Al;(2)最详尽描述核外电子运动状态的方式为核外电子轨道排布式,根据核外电子排布规律画出;处于不同能级的电子,能量不同,处于同一能级不同轨道的电子能量相同;(3)BF3分子中三根B﹣F键的键长相等且键角也相等,为平面正三角形结构,正负电荷重心重合;根据晶体类型判断熔点高低,一般熔点:原子晶体>离子晶体>分子晶体;(4)BF3是分子晶体,SiO2是原子晶体。
【详解】(1)同周期自左而右原子半径减小,电子层越多原子半径越大,故原子半径Na>Mg>Al>Si >B>O,在元素周期表中处于金属和非金属分界线附近的元素是B、Si、Al;(2)最详尽描述核外电子运动状态的方式为核外电子轨道排布式,氧元素原子核外电子轨道排布式为:;(3)BF3分子中三根B﹣F键的键长相等且键角也相等,为平面正三角形结构,正负电荷重心重合,为非极性分子;(4)BF3是分子晶体,SiO2是原子晶体,故SiO2晶体的熔点比BF3晶体高。
高考化学压轴题之原子结构与元素周期表(高考题型整理,突破提升)附详细答案一、原子结构与元素周期表练习题(含详细答案解析)1.南京理工教授制出了一种新的全氮阴离子盐—AgN5,目前已经合成出钠、锰、铁、钴、镍、镁等几种金属的全氮阴离子盐。
(1)基态Mn2+的价电子排布式为____;银与铜位于同一族,银元素位于元素周期表的___区。
(2)[Mg(H2O)6]2+[(N5)2(H2O)4]2-的晶体的部分结构如图1所示:N、O、Mg元素的前3级电离能如下表所示:元素I1/kJ∙mol-1I2/kJ∙mol-1I3/kJ∙mol-1X737.71450.77732.7Y1313.93388.35300.5Z1402.32856.04578.1①X、Y、Z中为N元素的是____,判断理由是__________。
②从作用力类型看,Mg2+与H2O之间是________、N5与H2O之间是________。
③N5-为平面正五边形,N原子的杂化类型是_______。
科学家预测将来还会制出含N4-、N6-表示,其中m代表等平面环状结构离子的盐,这一类离子中都存在大π键,可用符号πnm参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为π66),则N4-中的大π键应表示为_________。
(3)AgN5的立方晶胞结构如图2所示,Ag+周围距离最近的Ag+有_______个。
若晶体中紧邻的N5-与Ag+的平均距离为a nm,N A表示阿伏加德罗常数的值,则AgN5的密度可表示为_____g∙cm-3(用含a、N A的代数式表示)。
【答案】3d5 ds Z X最外层为2个电子,X为镁;N的2p轨道处于半充满的稳定状态,其失去第一个电子较难,I1较大,则Z为氮元素配位键氢键 sp254π 12223A8.910 N a⨯⨯【解析】【分析】(1)根据构造原理书写出25号Mn元素的原子核外电子排布式,Mn原子失去最外层2个电子得到Mn2+;根据原子结构与元素在周期表的位置确定Ag在周期表所属区域;(2)①根据元素的电离能大小结合原子结构确定X、Y、Z三种元素,然后判断哪种元素是N 元素;②根据图示,判断晶体中阳离子、阴离子中含有的作用力类型;③结合N5-为平面正五边形结构,结合原子杂化类型与微粒构型关系分析判断,结合微粒的原子结构分析大π键的形成;(3)根据晶胞中离子的相对位置判断Ag+的配位数,利用均摊方法计算1个晶胞中含有的AgN5的个数,结合ρ=mV计算密度大小。
高考化学原子结构与元素周期表综合练习题及答案一、原子结构与元素周期表练习题(含详细答案解析)1.锌在工业中有重要作用,也是人体必需的微量元素。
回答下列问题:(1)Zn 原子核外电子排布式为__________洪特规则内容_____________泡利不相容原理内容______________________(2)黄铜是人类最早使用的合金之一,主要由Zn 和Cu 组成。
第一电离能I 1(Zn)__________I 1(Cu)(填“大于”或“小于”)。
原因是__________(3)ZnF 2具有较高的熔点(872℃ ),其化学键类型是__________;ZnF 2不溶于有机溶剂而ZnCl 2、ZnBr 2、ZnI 2能够溶于乙醇、乙醚等有机溶剂,原因是__________(4)金属Zn 晶体中的原子堆积方式如图所示,这种堆积方式称为__________,配位数为____六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为N A ,Zn 的密度为__________g·cm -3(列出计算式)。
【答案】1s 22s 22p 63s 23p 63d 104s 2或[Ar ]3d 104s 2 原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低 每个原子轨道上最多只能容纳两个自旋状态不同的电子 大于 Zn 核外电子排布为全满稳定结构,较难失电子 离子键 ZnF 2为离子化合物,ZnCl 2、ZnBr 2、ZnI 2的化学键以共价键为主、极性较小 六方最密堆积(A 3型2A 3N 6a c ⨯⨯⨯ 【解析】【分析】【详解】(1)Zn 原子核外有30个电子,分别分布在1s 、2s 、2p 、3s 、3p 、3d 、4s 能级上,其核外电子排布式为1s 22s 22p 63s 23p 63d 104s 2或[Ar]3d 104s 2,洪特规则是指原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低,而泡利原理是指每个原子轨道上最多只能容纳两个自旋状态不同的电子,故答案为:1s 22s 22p 63s 23p 63d 104s 2或[Ar]3d 104s 2;原子核外电子在能量相同的各个轨道上排布时,电子尽可能分占不同的原子轨道,且自旋状态相同,这样整个原子的能量最低;每个原子轨道上最多只能容纳两个自旋状态不同的电子;(2)轨道中电子处于全满、全空、半满时较稳定,失去电子需要的能量较大,Zn 原子轨道中电子处于全满状态,Cu 失去一个电子内层电子达到全充满稳定状态,所以Cu 较Zn 易失电子,则第一电离能Cu <Zn ,故答案为:大于;Zn 核外电子排布为全满稳定结构,较难失电子;(3)离子晶体熔沸点较高,熔沸点较高ZnF 2,为离子晶体,离子晶体中含有离子键;根据相似相溶原理知,极性分子的溶质易溶于极性分子的溶剂,ZnF 2属于离子化合物而ZnCl 2、ZnBr 2、ZnI 2为共价化合物,ZnCl 2、ZnBr 2、ZnI 2分子极性较小,乙醇、乙醚等有机溶剂属于分子晶体极性较小,所以互溶,故答案为:离子键;ZnF 2为离子化合物,ZnCl 2、ZnBr 2、ZnI 2的化学键以共价键为主,极性较小;(4)金属锌的这种堆积方式称为六方最密堆积,Zn 原子的配位数为12,该晶胞中Zn 原子个数=12×16+2×12+3=6,六棱柱底边边长为acm ,高为ccm ,六棱柱体积=[(6×23a )×3×c]cm 3,晶胞密度=2A m V 3N 6a c =⨯⨯⨯,故答案为:六方最密堆积(A 3型);12;2A 3N 6a c ⨯⨯⨯。
原子结构示意图和元素周期表专项训练类型一原子结构示意图1. (2015)两种微粒的结构示意图是Na 和Na+,其中相同的是( )A. 电子数B. 质子数C. 电子层数D. 所带电荷数2. (2015)Cl的原子结构示意图为,下列关于Cl的说法错误的是()A. 电子层数是3B. 核质子数是17C. 最外层电子数是7D. 在化学反应中易失电子3. (2015)以下是四种微粒的结构示意图,下列有关各微粒的说法中,错误的是( )第3题图A. ①的化学性质比较稳定B. ③④属于同种元素C. ④是一种阴离子D. ②容易得到电子4. (2015眉山)元素周期表中某些元素的原子结构示意图如下:第4题图(1)上述结构图中的X=_______。
(2)硅原子的结构示意图为,上图中与其化学性质相似的元素是_______(填元素符号)。
(3)根据图示信息,确定一个水分子中所含电子总数为________。
类型二元素周期表1. (2015模拟)砷化镓(GaAs)是一种“LED”绿色节能光源材料。
根据镓元素的相关信息图得到有关镓元素的说法错误的是()A. 原子的核电荷数是31B. 元素符号是GaC. 属于金属元素D. 相对原子质量为69.72 g 第1题图2. (2015模拟)如图是元素周期表中硫元素的信息示意图,其中A表示_____________;B表示___________。
第2题图第3题图3. (2015聊城)规书写是我们学习中必须遵循的原则。
小明在元素周期表中查找到如图所示的一格后,明白了不能把一氧化碳写成“Co”的原因。
(1)“Co”表示________元素(填名称)。
(2)“CO”是由_________两种元素(填名称)组成的_________(填“单质”或“化合物”)。
4. (2015)元素周期表是学习和研究化学的重要工具。
A、B、C为周期表1-18号中的元素,在周期表中的位置如图所示。
已知A的核电荷数为8,三种元素的核电荷数之和为34。
(1)B的名称为_____。
(2)C的单质化学式为______。
(3)用H2A2制取A2的化学方程式为_____________________________。
第4题图5. (2015模拟)在元素周期表中,铝元素的信息如图所示,铝原子的结构示意图为_______,铝原子在化学变化中容易失去_____个电子;某酸(HR)与盐酸具有相似的化学性质,写出HR与铝的应反化学方程式_____________________。
第5题图类型三原子结构示意图和元素周期表相结合1. (2015)据媒体报道,锶品格钟是一种新型原子钟,其准确度高得惊人,它能在50亿年间不慢一秒也不快一秒。
如图为锶元素的相关信息。
下列说确的是( )第1题图A. 原子核中子数为87B. 该元素的原子序数为38C. 锶离子Sr2+中有38个电子D. 锶属于非金属元素,位于第五周期2. (2015呼和浩特)如图是某元素的原子结构示意图和该元素在元素周期表中的单元格,下列说法不正确的是( )A. 该元素属于金属元素B. 该原子在化学变化中容易失去电子C. 该原子的大小主要决定于核外电子的运动空间D. 该原子的质量由构成其原子的质子和电子决定第2题图的是( )3. (2015)结合如图分析,下列说法错误..A. 氧原子的核电荷数为8B. 硅元素属于金属元素C. 铝原子在化学反应中易失去电子形成Al3+D. 铁的相对原子质量为55.85 第3题图4. (2015模拟)如图是X原子的结构示意图和X元素在元素周期表中的信息。
下列关于X的说确的是()A. y等于x-10B. X属于非金属元素C. 相对原子质量为24.31 gD. X原子失去电子后形成的离子是阴离子第4题图5. (2015黔西南州)如图中①、②为氧元素、铝元素在元素周期表中的信息示意图,A、B、C、D是四种粒子的结构示意图。
第5题图(1)氧元素属于______元素(填“金属”或“非金属”);铝元素的质子数是______。
(2)C粒子属于______(填“原子”、“阴离子”或“阳离子”);若D为原子,则X=______。
(3)A、B、C、D中属于同种元素的是______(填序号)。
(4)A粒子的化学性质与B、C、D中哪一种粒子的化学性质相似____ (填序号)。
6. (2015)下表是元素周期表中的部分元素的一些信息,请据表回答问题:第6题图第6题图(1)氯原子的质子数是______,它属于______ (填“金属”或“非金属”)元素。
(2)原子序数为3的元素与第三周期中的______ (填名称)元素具有相似的化学性质,在化学反应中都比较容易______ (填“得到”或“失去”)电子。
(3)写出原子序数为3的元素形成的氧化物的化学式______。
【答案】类型一1. B 【解析】根据圆圈表示原子核、圆圈的数字表示核电荷数(即质子数)、弧线表示电子层、弧线上的数字表示该层电子数可知:两种微粒核外电子数分别为11、10,A错误;两种微粒质子数相同,均是11,B正确;两种微粒电子层数分别为3、2,C错误;钠原子不带电、钠离子带1个单位的正电荷,D错误。
2. D 【解析】由氯原子结构示意图可知,氯原子有三个电子层,最外层有7个电子,核质子数是17,最外层电子数大于4,所以在化学反应中易得电子,故D错误。
3. C 【解析】①的最外层电子数为8,具有相对稳定结构,A正确;③和④的质子数相等,所以这两种粒子属于同一元素,B正确;④的质子数为11,核外电子数为2+8=10,质子数>核外电子数,所以该粒子是阳离子,C错误;②的最外层有7个电子,在化学反应中易得到1个电子,D正确。
4. (1)5 (2)C (3)10【解析】(1)根据原子中质子数=核外电子数,可知X=5。
(2)化学性质相似的元素是指最外层电子数相同。
硅原子最外层电子数为4,与其化学性质相似的是6号元素,也就是C 元素。
(3)水的化学式为H2O,电子总数为1×2+8=10。
类型二1. D 【解析】从元素周期表中的信息可以看出镓的原子序数是31,根据在原子中质子数=原子序数=核电荷数=核外电子数,A正确;在元素周期表中汉字右上方表示元素的符号,B正确;“镓”是“钅”字旁,属于金属元素,C正确;镓的相对原子质量为69.72,其单位是“1”,通常省略不写,D错误。
2. 原子序数(或核电荷数或质子数)元素名称【解析】根据元素周期表中一格的信息可知,左上角的数字为原子序数=核电荷数=核质子数,右上角的符号表示该元素的元素符号,中间的汉字为该元素的名称,正下方的数字表示相对原子质量。
3. (1)钴(2)碳、氧(或氧、碳)化合物【解析】(1)Co表示钴元素或1个钴原子或钴这种物质;(2)CO表示一氧化碳,由碳、氧两种元素组成,属于化合物。
【图解】4. (1)氟(2)Cl2(3)2H2O22H2O+O2↑【解析】(1)B的核电核数为9,故B是氟元素;(2)C是氯元素形成的单质,该单质由分子直接构成,其化学式为Cl2;(3)H2A2的化学式为H2O2,过氧化氢在二氧化锰作催化剂的条件下分解生成水和氧气,反应的化学方程式为2H2O22H2O+O2↑。
5. 3 6HR+2Al2AlR3+3H2↑类型三1. B 【解析】A ×在原子中,中子数≈相对原子质量-质子数,所以中子数≈87.62-38≈49B √原子序数=质子数=38C ×锶原子核外最外层有2个电子,易失去2个电子形成Sr2+,所以Sr2+中有36个电子D ×锶元素属于金属元素,原子核外有5个电子层,所以锶位于第五周期2. D【解析】根据元素周期表中一格的信息可知,该元素名称为“钛”,偏旁为“钅”字旁,或由原子结构示意图可知该原子最外层电子数为2(小于4),故属于金属元素,A正确;根据钛原子的结构示意图可知,原子最外层电子数为2,在化学反应中容易失去电子,B正确;原子中原子核的体积很小,原子核外有很大的空间,电子在这个空间里作高速运动,2MnO2MnO因此原子的大小主要决定于核外电子的运动空间,C正确;原子由原子核和核外电子构成,原子核由质子和中子构成,原子的质量主要集中在原子核上,即原子的质量由质子和中子决定,D错误。
3. B【解析】从图中可知氧的核电荷数是8,铝最外层有3个电子,容易失去最外层电子形成铝离子(Al3+),铁的相对原子质量是55.85,硅是石字旁,属于非金属元素。
4. A【解析】根据X元素在元素周期表中的信息可知,该元素为12号元素,即镁元素,每个原子中有12个质子,故x=12,则y=2,即12-10=2,镁元素为金属元素;相对原子质量不能带质量单位;原子失去电子后形成的是阳离子。
5. (1)非金属13 (2)阴离子8 (3)BC (4)B【解析】(1)氧元素原子最外层有6个电子,属于非金属元素,在元素周期表中,原子序数=质子数,所以铝元素的质子数为13;(2)由于C中质子数<核外电子数,所以C为阴离子,若D为原子,则质子数=核外电子数,即18=2+8+X,X=8;(3)质子数决定元素的种类,B和C的质子数相同,所以B、C属于同种元素;(4)最外层电子数决定元素的化学性质,原子最外层电子数相同的,其化学性质相似,A、B粒子最外层都有6个电子,所以B与其化学性质相似。
6. (1)17 非金属(2)钠失去(3)Li2O【解析】(1)氯元素为17号元素,故有17个质子,名称中没有“钅”字旁,属于非金属元素;(2)原子的最外层电子数相同,化学性质相似,3号元素的最外层有一个电子,故与第三周期的11号元素钠元素具有相似的化学性质;最外层电子数小于4,在化学反应中易失去电子;(3)3号元素与其他元素化合时,易失去一个电子而显+1价,氧显-2价,故氧化物的1个分子中含有2个锂原子和1个氧原子。